赖鉴添1,2, 杨婷2, 史发超2, 和锐敏2,3, 王鑫2,3, 邵丹青2,3, 何琴1,2, 卢颖林2, 胡黎明1, 安玉兴2


1. 仲恺农业工程学院资源与环境学院, 广东 广州 510225;
2. 广东省科学院生物工程研究所, 广东省药肥工程技术研究中心, 广东 广州 510316;
3. 华南农业大学农学院, 广东 广州 510642
收稿日期:2019-12-31;修回日期:2020-03-11;网络出版日期:2020-10-10
基金项目:广东省重点领域研发计划(2018B020205003);国家重点研发计划(2018YFD0201100);广东省科技计划(2016A020221018);现代农业产业技术体系建设专项资金(CARS-170306)
*通信作者:安玉兴, Tel/Fax:+86-20-84168114;E-mail:yanxing888@126.com.
摘要:[目的] 从甘蔗叶堆肥中分离筛选具有高效溶磷及促生功能的菌株,为微生物肥料制备提供一种可利用的菌种资源。[方法] 以Ca3(PO4)2和Zn3(PO4)2为磷源,进行平板溶磷筛选实验;采用形态学特征和ITS rDNA序列分析法进行菌种鉴定;采用液体摇瓶培养测定菌株的溶磷能力;将溶磷菌接种至辣椒幼苗根部分析其促生效应。[结果] 从堆肥中筛选得到1株高效溶磷真菌DC30-2-P1,经鉴定为泡盛曲霉(Aspergillus awamori),菌株在Ca3(PO4)2和Zn3(PO4)2培养基的菌落直径(d)分别为55.33 mm和45.00 mm,透明圈直径(D)分别为65.33 mm和67.67 mm,(D/d)分别为1.16和1.50,菌株溶磷效果明显;在以Ca3(PO4)2(5 g/L)为磷源的液体培养基培养至96 h,有效磷含量达到2973.85 mg/L。盆栽试验结果表明接种DC30-2-P1对辣椒生长具有明显促进作用,与无添加溶磷菌处理组比较,其地上部鲜重和干重分别增加了18.6%和43.5%,地下部鲜重和干重分别增加了30.2%和25%,株高增加了13.6%,叶绿素含量增加了44.9%,植物全磷含量和土壤有效磷含量均提高了80%以上。[结论] 筛选到的菌株DC30-2-P1在溶解难溶性磷化合物、促进作物对磷的吸收和生长有良好效应,为微生物制剂的开发提供菌株资源。
关键词:溶磷真菌泡盛曲霉溶磷作用促生作用
A phosphorus-dissolving Aspergillus awamori strain from sugarcane leaf compost for growth promotion of pepper
Jiantian Lai1,2, Ting Yang2, Fachao Shi2, Ruimin He2,3, Xin Wang2,3, Danqing Shao2,3, Qin He1,2, Yinglin Lu2, Liming Hu1, Yuxing An2


1. College of Resources and Environment, Zhongkai University of Agriculture and Engineering, Guangzhou 510225, Guangdong Province, China;
2. Guangdong Province Pharmaceutical Fertilizer Engineering Technology Research Center, Institute of Bioengineering, Guangdong Academy of Sciences, Guangzhou 510316, Guangdong Province, China;
3. College of Agriculture, South China Agricultural University, Guangzhou 510642, Guangdong Province, China
Received: 31 December 2019; Revised: 11 March 2020; Published online: 10 October 2020
*Corresponding author: Yuxing An, Tel/Fax:+86-20-84168114;E-mail:yanxing888@126.com.
Foundation item: Supported by the Key R & D Program of Guangdong Province (2018B020205003), by the National Key R & D Program of China (2018YFD0201100), by the Science and Technology Planning Project of Guangdong Province (2016A020221018) and by the China Agriculture Reasearch System (CARS-170306)
Abstract: [Objective] Isolation of strains with high-efficiency of phosphorus-dissolving and growth-promoting functions from sugarcane leaf compost has provided available microbial resources for bio-fertilizers production. [Methods] Phosphorus-dissolving strains were screened from insoluble inorganic phosphorus media containing Ca3(PO4)2 or Zn3(PO4)2, and identified by morphological characteristics and ITS rDNA sequence analysis. The phosphorus-dissolving ability of the strains was determined by the halo zone and molybdenum antimony colorimetric methods, and the growth-promoting ability of the strain was analyzed by pot experiment of pepper. [Results] Strain DC30-2-P1 was screened from the compost and identified as Aspergillus awamori. The diameter of the colony of the strains (d) was 55.33 mm and 45.00 mm, the halo zone (D) was 65.33 mm and 67.67 mm, and the D/d value was 1.16 and 1.50 on the medium with Ca3(PO4)2 and Zn3(PO4)2, respectively. After 96 hours of cultivation in a liquid medium with Ca3(PO4)2 as the phosphorus source, the available phosphorus content reached 2974 mg/L. The results indicated that strain DC30-2-P1 had a significant effect on dissolving phosphorus. The results of the pot experiment show that the inoculation of DC30-2-P1 promoted the growth of pepper. Compared with the treatment group without phosphate solubilizing fungi, the above-ground fresh and dry weight increased by 18.6% and 43.5%, the under-ground fresh and dry weight increased by 30.2% and 25%, plant height increased by 13.6%, and chlorophyll content increased by 44.9%, both plant total phosphorus content and soil available phosphorus content increased by more than 80%. [Conclusion] Strain DC30-2-P1 from sugarcane leaf compost has a high efficiency on dissolving insoluble phosphorus compounds, promoting the absorption of phosphorus and improving crop yield.
Keywords: phosphate-solubilizing fungusAspergillus awamoriphosphate-dissolving effectgrowth-promoting effect
我国耕地土壤磷素含量丰富,然而土壤中供植物直接吸收利用的有效磷含量较少。自上个世纪以来,我国农业生产发展迅速,为提高作物产量,化肥使用量不断增加,但当季作物化肥利用率不到40%[1],其中每年约800万t磷肥被投入农田,按磷素利用率10%–25%计算,大部分磷素以磷酸根形式与钙、镁和铝等离子结合形成难溶性磷酸盐存在于土壤中,不能够被植物吸收利用[2-3]。土壤中有效磷含量是表征土壤肥力的重要因子之一[4],提高土壤有效磷含量是目前减肥增效工作的重要内容。
随着近年来农药化肥两减政策的实施,环境友好型微生物菌剂的研发和微生物有机肥的应用得到快速发展。利用溶磷微生物溶解土壤中难以被植物直接利用的磷素,对于减少磷肥施用量、促进土壤磷素循环和世界绿色粮食可持续生产具有重要的研究价值[5-7]。如何高效利用土壤中的难溶性磷化合物并提高磷肥利用率,成为当前化肥行业研究的重要工作。溶磷促生菌在土壤磷素循环和植物生长方面扮演着重要的角色,一方面将难溶性磷转化成供植物吸收利用的有效磷形态,另一方面促进植物对营养元素的吸收利用,间接改善植株生长发育状态并提高产量[8-10]。因此,挖掘自然界中潜在的溶磷菌对于保护农业生态平衡和可持续发展、植物健康及提高资源利用价值具有重要意义。
自报道第一株溶磷菌至今,已从不同材料中分离筛选获得不同种类的溶磷菌株[11],如从活性污泥分离的伯克氏菌(Burkholderia sp.)[12],从农业废弃物堆肥分离的毕赤酵母(Pichia farinosa)[13],从干旱土壤分离到的泡盛曲霉(A. awamori)[14],从玉米地土壤分离到的草酸青霉(Penicillium oxalicum)和枯草芽孢杆菌(Bacillus subtilis)[15],从甘蔗根际土样中分离出的肠杆菌属(Enterobacter spp.)[2],从作物根围土壤分离到的黑曲霉(A. niger)和塔宾曲霉(A. tubingensis)[16]。
功能微生物是近年来的研究热点,微生物的多功能特性也相继被报道,许多研究者发现溶磷菌具有促进植物生长并起到有增产的效果,史发超[17]从高产农田土壤样品中筛选获得的高效溶磷微生物,包括斜卧青霉(P. decumbens)、黑曲霉(A. niger)和草酸青霉(P. oxalicum),盆栽试验结果表明接种溶磷菌的植株与对照相比,生物量和产量均有所提高;张云霞等[18]从磷矿土壤中筛选到的枯草芽孢杆菌(B. subtilis)对小麦产量也有所提高,且磷肥利用率也提高了;詹寿等[19]从42株芒萁内生真菌中筛选得到2株具有高效溶磷、解钾功能且能分泌IAA的泡盛曲霉(A. awamori)和黑曲霉(A. niger),并表明这两株真菌均能有效提高玉米叶绿素含量,间接起到了促生作用。
从不同材料或环境中分离获得溶磷菌株的种类及其能力不尽相同[20-21]。溶磷微生物的应用需以高效、稳定的溶磷效果为前提,并对作物生长起到促进作用。农业废弃物本身含有大量的氮、磷等元素,经过发酵作用将无机化合物转化成有机物供植物吸收利用,在这过程中微生物发挥了重要的作用[22-23]。目前关于泡盛曲霉在溶磷作用方面的研究鲜有报道,且农业废弃物蔗叶堆肥溶磷菌筛选及对植物促生效应的研究未见报道,挖掘其中高效稳定的溶磷菌,对于加快土壤中难溶性磷化合物转化为有效态磷具有重要意义。
本研究从蔗叶堆肥中筛选出溶磷真菌,测定其溶解无机磷的能力,并通过盆栽试验探究其对作物生长的影响,目的为开发高效稳定的溶磷菌和微生物制剂提供基础资料,不断提高我国化肥利用率并推动微生物肥料在绿色农业生产中的广泛应用。
1 材料和方法 1.1 供试材料
1.1.1 堆肥材料来源: 堆肥样品采集于广州市南沙区东涌镇,以蔗叶、蔗梢为原料进行田间堆沤腐熟,样品采集于堆肥的第20天,分别采集表层(0–15 cm)、中层(16–30 cm)和深层(31–50 cm)蔗叶堆肥样品,4 ℃低温保存,用于溶磷菌株的分离筛选。
1.1.2 培养基: (1) 难溶无机磷培养基(g/L):葡萄糖10,(NH4)2SO4 0.5,KCl 0.3,NaCl 0.3,MgSO4·7H2O 0.3,FeSO4 0.03,MnSO4 0.03,难溶性磷源Ca3(PO4)2 10,固体培养基加琼脂15–20,加蒸馏水至1 L,pH 7.0–7.5,分装于锥形瓶,121 ℃灭菌30 min,备用。(2) PDB培养基:称取马铃薯葡萄糖水24 g,加入蒸馏水1 L,搅拌加入煮沸至完全溶解,分装于锥形瓶,121 ℃灭菌20 min备用。
1.1.3 供试磷源: (1) 分析纯磷酸三钙[Ca3(PO4)2 (P2O5 45.78%)]、分析纯磷酸锌[Zn3(PO4)2 (P2O5 36.80%)],购于天津市科密欧化学试剂有限公司。(2)钼锑抗比色法测定有效磷含量(P2O5 0.37%)。
1.1.4 草炭土: 购于广州大观农业科技有限公司,成分含量为全氮0.3%,全磷0.1%,有机质93.2%,其中有效磷含量为2.991 g/kg。
1.1.5 主要试剂和仪器: 真菌DNA提取试剂盒、植物总磷含量测定试剂盒均购于北京索莱宝科技有限公司;引物ITS 5和ITS 4由生工生物工程(上海)股份有限公司合成;培养箱为DHP-9162,购于上海一恒科技有限公司;PCR仪为846-x-070-280,购于德国耶拿分析仪器股份公司;紫外分光光度计为752N,购于上海仪电分析仪器有限公司;叶绿素检测仪为DX14413。
1.2 溶磷菌株的分离筛选 称取10 g样品加入装有90 mL无菌水的锥形瓶中,180 r/min恒温振荡30 min,用无菌水梯度稀释成10–3、10–4、10–5、10–6倍,分别吸取0.1 mL的稀释菌液涂布于磷酸钙无机磷固体培养基平板上,每个浓度重复3次,恒温28 ℃倒置培养3 d,观察菌落生长情况。挑取周围具有明显透明圈的单菌落接种至PDA培养基,纯化,观察其生长状态,并在显微镜下进行形态特征描述,用15%甘油保存于–80 ℃冰箱。
1.3 菌株的鉴定 参照Zhang[24]的热裂解法提取菌株的DNA,以此为模板用引物ITS4 (5′-TCCTCCGCTTATT GATATGC-3′)和ITS5 (5′-GGAAGTAAAAGTCG TAACAAGG-3′)进行ITS片段扩增,PCR产物由生工生物工程(上海)股份有限公司测序。将得到的序列与NCBI数据库里的序列进行比对,并以相近序列作为参考,利用MEGA 7构建基于ITS序列的系统发育树。
1.4 平板解磷试验 以Ca3(PO4)2和Zn3(PO4)2为磷源进行平板溶磷试验,分别配制含有Ca3(PO4)2和Zn3(PO4)2的培养基,添加量为5 g/L,高温灭菌后倒培养基,冷却至室温,备用。挑取新鲜溶磷菌株菌落接种于培养基中央,以PDA培养基为生长对照,每个处理5个重复,恒温25 ℃倒置培养7 d,测定透明圈直径(D)及菌落直径(d),计算D/d的比值,其大小可表明菌株溶解无机磷的能力,比值越大菌株溶磷能力越强。
1.5 溶磷真菌DC30-2-P1生长曲线的绘制 用含有0.1% Tween-80的无菌水配制孢子悬浮液,接种至150mL的PDB液体培养基,终浓度为1.0×105spores/mL,25 ℃、180 r/min恒温振荡培养10 d,每24 h随机取3瓶培养液过滤收集菌丝,烘干并称重,绘制生长曲线。
1.6 溶磷真菌对难溶性无机磷的溶解能力测定 参照鲁如坤[25]的钼锑抗比色法测定有效磷含量,分别配制浓度为0.2、0.6、1.0、1.4、1.8 mg/L磷含量的标准液,用分光光度计测定其在660 nm处的吸光值并绘制磷含量标准曲线。在装有100 mL液体难溶无机磷培养基的250 mL锥形瓶中接入待测真菌孢子液至终浓度为1.5×105 spores/mL,空白对照组仅加入150 mL液体难溶无机磷培养基,每个处理3–5个重复,25 ℃、180 r/min恒温振荡培养96 h,分别于0、24、48、72、96、120、144、168 h吸取发酵液,离心后取上清液,反应后测定660 nm处吸光值,根据标准曲线计算有效磷含量,同时记录pH的变化。
1.7 溶磷真菌促生试验 试验采用溶磷菌液体摇培发酵液处理植株,试验前将溶磷真菌接种至PDB培养基,25 ℃、180 r/min恒温振荡培养5 d获得菌液,盆栽试验分别设置以下4个处理,空白对照组A为草炭土;处理组B为草炭土+1% Ca3(PO4)2;处理组C为草炭土+1% Ca3(PO4)2+5% PDB培养基(V/W);处理组D为草炭土+1% Ca3(PO4)2+5%摇培菌液(V/W),充分混匀后分装于经2%次氯酸钠溶液浸泡过的花盆中,每盆200 g,备用。供试辣椒选用贵族朝天椒品种,种子用2%次氯酸钠浸泡20 min表面消毒,无菌水冲洗3次。经过催芽、播种至两片真叶长出,选取长势一致的辣椒苗移栽至不同处理的花盆中,每个处理4个重复,每盆2株,温度为28 ℃,周期为光照16 h、黑暗8 h条件下培养33 d后分别测定辣椒地上、地下部分的鲜重和干重,叶绿素含量,植株全磷含量和土壤有效磷含量。
1.8 数据分析 采用Excel和SPSS 23.0 (IBM,Armonk,NY USA)数据处理软件对试验中不同处理的数据进行统计和单因素方差分析(Fisher’s LSD test)。
2 结果和分析 2.1 溶磷真菌的分离筛选 通过观察菌株在无机磷培养基培养过程中有无透明圈可初步判定是否具有溶磷作用。在对蔗叶堆肥材料中的微生物分离实验中,从无机磷固体培养基筛选到一株编号为DC30-2-P1的真菌,其产生的溶磷圈较大,具有良好的溶磷效果,且经多次传代后仍具有稳定的溶磷效果。
2.2 溶磷真菌的鉴定
2.2.1 形态特征: 真菌DC30-2-P1在PDA培养基上28 ℃培养,菌落生长迅速,肉眼可观察到菌丝体,菌丝呈白色,反面为浅黄色,培养3 d菌落直径达到24 mm,随着培养时间出现黑褐色分生孢子,颜色逐渐变深。在显微镜下分生孢子梗细长且壁光滑,直径6–8 μm;分生孢子头易脱落,分生孢子球形,直径3–4μm (图 1)。
 |
| 图 1 菌株DC30-2-P1的菌落形态和显微观察 Figure 1 Morphological observation on the strain DC30-2-P1. |
| 图选项 |
2.2.2 序列分析: 通过ITS扩增测序,将获得的序列(No. MT953924)在NCBI数据库中模式菌株序列进行比对,其与曲霉属(Aspergillus)各种具有较高的相似度,且与A. awamori模式菌株的ITS序列(No. NR077143)相似度最高,达到99.18%。同时,以曲霉属相近种的序列作为参考,
以青霉属的P. ornatum (No. NR138306)的ITS序列为参考外群,采用邻接法(Neighbor-Joining,NJ)构建系统发育树,结果表明,菌株DC30-2-P1与A. awamori种菌株CBS 139.52的序列(No. MH856964)以较高的支持率(80)形成了一个独立分支(图 2)。综上,菌株DC30-2-P1经鉴定为泡盛曲霉(Aspergillus awamori Nakaz.)。
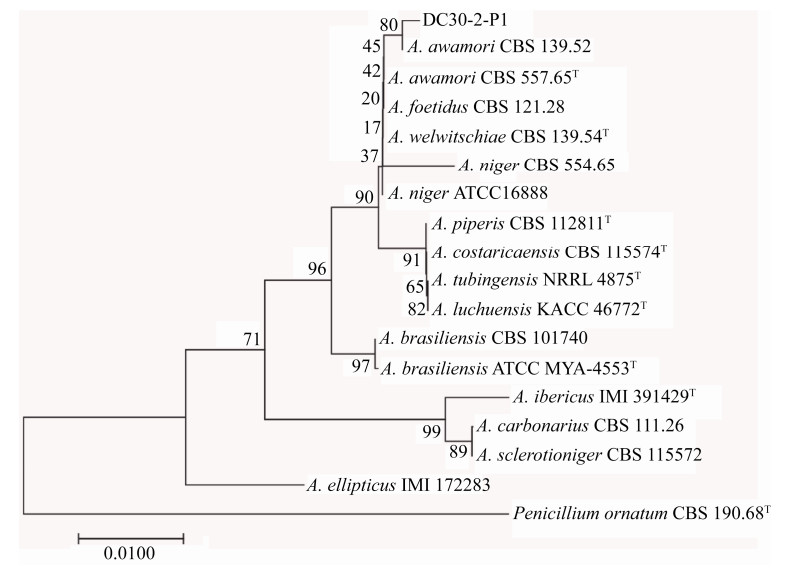 |
| 图 2 基于ITS序列的Neighbor-Joining系统发育树 Figure 2 Neighbor-Joining phylogenetic tree of strain DC30-2-P1and reference Aspergillus awamori species. Evolutionary distances showed in Figure 1 were calculated by MEGA7; Bootstrap=1000. Bar, 0.0100 substitution per nucleotide. Numbers in prentheses represent the sequences accession number in GenBank. The number at each branch points is the percentage supported by bootstrap. T: Type strain. |
| 图选项 |
2.3 溶磷菌DC30-2-P1生长曲线的绘制 溶磷菌DC30-2-P1在PDB液体培养基振荡培养7 d,菌丝干重变化随着时间出现先上升后下降的趋势。从24 h开始菌丝生长速度最快,24–96 h为菌株的对数生长期,培养至120 h菌丝干重达到最大值,为1059.9 mg,继续培养菌丝干重逐渐下降(图 3)。
 |
| 图 3 菌株DC30-2-P1的生长曲线 Figure 3 Growth curve of the strain DC30-2-P1. |
| 图选项 |
2.4 溶磷圈法测定菌株DC30-2-P1的溶磷能力 将菌株DC30-2-P1接种至难溶性无机磷培养基平板上,25 ℃恒温培养7 d,与PDA对照相比,接种于Ca3(PO4)2难溶磷培养基中的菌落生长状况和生长直径没有差异,Zn3(PO4)2难溶磷培养基中的菌落生长较慢,且有少量黄色色素产生(图 4)。Ca3(PO4)2和Zn3(PO4)2难溶磷培养基中菌落周围均有明显的透明圈,平均透明圈直径分别达到了65.33 mm和67.67 mm,Zn3(PO4)2培养基中菌株的D/d值(1.50)大于Ca3(PO4)2培养基(1.16) (表 1),表明菌株DC30-2-P1对无机磷Zn3(PO4)2的溶解能力大于对Ca3(PO4)2的溶解能力。
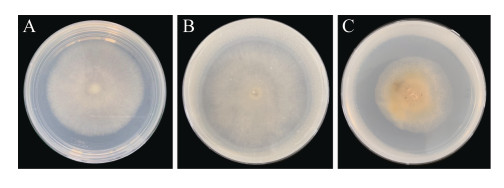 |
| 图 4 菌株DC30-2-P1在不同培养基上的菌落形态及溶磷作用 Figure 4 Colony morphology and phosphate dissolution of the strain DC30-2-P1 in different solid mediums. A: PDA; B: Ca3(PO4)2; C: Zn3(PO4)2. |
| 图选项 |
表 1. 菌株DC30-2-P1在培养皿上的溶磷效果(7 d) Table 1. Phosphate solubilization in culture medium by strain DC30-2-P1 (7 d)
| Medium | d | D | D/d |
| PDA | 58.67±1.15 a | ? | ? |
| Ca3(PO4)2 | 55.33±1.53 a | 65.33±2.08 a | 1.18 a |
| Zn3(PO4)2 | 45.00±2.65 b | 67.67±2.31 a | 1.50 a |
| d: diameter of the colony (mm); D: diameter of the halo zone (mm). The letters indicate the significant difference at 5% level. | |||
表选项
2.5 DC30-2-P1在Ca3(PO4)2液体培养基中的溶磷效果测定
2.5.1 磷含量标准曲线: 以不同浓度标准磷溶液在660 nm波长的吸光度值为横坐标,以有效磷含量为纵坐标绘制标准曲线,得到的磷标准曲线方程为Y=4.9267X–0.0108(R2=0.9997)。
2.5.2 DC30-2-P1溶磷效果测定: 在培养时间的第0、24、48、72、96、120、144、168 h吸取离心后的培养液上清液,在660 nm处测定吸光值,并根据标准曲线计算有效磷含量。结果显示,空白对照组随着摇培时间增加,有效磷含量没有明显变化,且与处理组0 h没有明显差异,处理组有效磷含量随着培养时间有效磷含量呈先上升后下降的趋势,其中在0–96 h,液体培养基中有效磷含量从74.28 mg/L增加至最大值2973.85 mg/L,96 h后培养液有效磷含量开始下降;空白对照组培养液pH波动范围为7.0±0.7,处理组从0 h (pH=7.01)下降到120 h (pH=1.86),120 h后培养液pH稍有上升(图 5)。
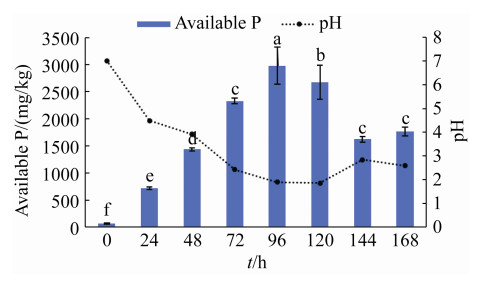 |
| 图 5 菌株DC30-2-P1发酵液可溶性磷含量及pH的变化 Figure 5 Soluble phosphorus content and pH in the fermentation broth of the strain DC30-2-P1. Different lowercase letters above the bars represent significant difference (P < 0.05). |
| 图选项 |
2.6 DC30-2-P1发酵液灌根对辣椒生长的影响 将不同处理在同样稳定条件下培养33 d后,结果发现,添加溶磷菌处理的辣椒生长状况更佳,DC30-2-P1发酵液灌根对辣椒有促生作用,处理组D [草炭土+1% Ca3(PO4)2+5%摇培菌液(V/W)]辣椒长势明显优于其他处理组,未添加DC30-2-P1发酵液的辣椒长势相对弱小且叶片有发黄现象(图 6)。
 |
| 图 6 溶磷真菌DC30-2-P1对辣椒的促生效果 Figure 6 Effect on growth promoting in pepper by phosphate solubilizing fungi DC30-2-P1. A: Peat soil; B: Peat soil+1% Ca3(PO4)2; C: Peat soil+1% Ca3(PO4)2+ 5% PDB medium (V/W); D: Peat soil+1% Ca3(PO4)2+ 5% shaking culture liquid (V/W). |
| 图选项 |
添加菌液的处理组,无论植株的鲜重、干重、株高以及叶绿素含量,均较不添加菌液的处理组有不同程度的提高(表 2)。处理组D与空白对照组A相比,辣椒地上部鲜重和干重分别增加了75.9%和120%,地下部鲜重和干重分别增加了92.9%和100%,株高增加了23.4%,叶绿素含量增加了33.9%;处理组D与B相比,地上部鲜重和干重分别增加了18.6%和43.5%,地下部鲜重和干重分别增加了30.2%和25%,株高增加了13.6%,叶绿素含量增加了44.9%;处理组D与C相比,从整体看无明显差异,排除了培养基的影响;处理组A、B与C两两比较,辣椒的各个生长指标均无明显差异。
表 2. 溶磷真菌DC30-2-P1对辣椒生物量的影响 Table 2. Effect on biomass of pepper by phosphate solubilizing fungi DC30-2-P1
| Treatment | Above ground | Under ground | Plant height/mm | Chlorophyll content/(mg/g) | |||
| Fresh weight/g | Dry weight/g | Fresh weight/g | Dry weight/g | ||||
| A | 1.16±0.49 b | 0.15±0.08 b | 0.85±0.35 b | 0.10±0.02 b | 114.13±15.10 b | 14.03±1.60 b | |
| B | 1.72±0.22 ab | 0.23±0.11 ab | 1.26±0.47 ab | 0.16±0.02 ab | 124.00±21.61 ab | 12.97±1.71 b | |
| C | 1.60±0.25 ab | 0.23±0.06 ab | 1.12±0.58 ab | 0.15±0.03 ab | 125.50±23.24 ab | 13.74±3.09 b | |
| D | 2.04±0.07 a | 0.33±0.05 a | 1.64±0.39 a | 0.20±0.02 a | 140.86±10.24 a | 18.79±3.65 a | |
| The different lowercase letters indicate the significant difference at 5% level. | |||||||
表选项
盆栽条件下,添加溶磷菌DC30-2-P1的处理组,植物全磷含量和土壤有效磷含量均较不添加溶磷菌的处理组有所提高,且差异显著(P < 0.05) (图 7、图 8)。处理组D与A、B、C相比,植物全磷含量分别提高了303.0%、90.9%和80.5%,土壤有效磷含量分别提高了631.1%、182.0%和84.8%,说明Ca3(PO4)2在没有溶磷菌的情况下难以被植物吸收利用。
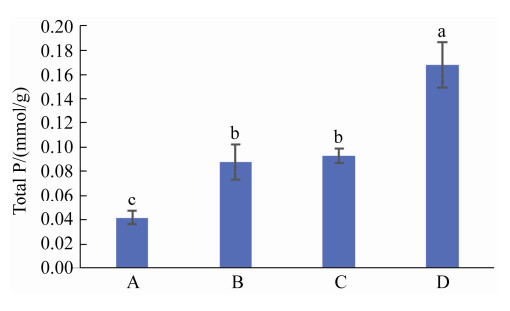 |
| 图 7 溶磷真菌DC30-2-P1对辣椒的磷吸收含量影响 Figure 7 Effect of phosphate solubilizing fungi DC30-2-P1 on phosphorus absorption of pepper. |
| 图选项 |
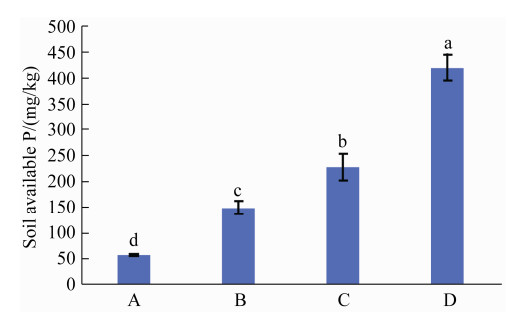 |
| 图 8 溶磷真菌DC30-2-P1对收获后土壤有效磷含量的影响 Figure 8 Effect of phosphate solubilizing fungi DC30-2-P1 on soil available P after harvest of pepper. |
| 图选项 |
3 讨论 自然界中存在大量能够溶解无机磷酸盐的微生物,现已报道的溶磷菌株多数分离自不同类型土壤、植物根际等材料,而这类微生物可能存在对环境适应能力差别较大或在土壤中生存是否占优势等问题[26-27],有研究者从盐碱地、沙漠地土壤等逆境中筛选到溶磷菌,比如从盐碱地分离到的芽孢杆菌SKDJP-1[28]、从沙漠分离到的溶磷细菌XY2J64[29],并表明这类溶磷菌具备较高的耐受性,对环境适应能力强。蔗叶中含有大量的磷素,但很难被植物直接利用,通过堆肥发酵作用降解类微生物可对其中的无机物、有机物等进行分解,在整个堆肥发酵过程中微生物发挥着重要作用[23]。农业废弃物堆肥是一种潜在的功能微生物种质资源库,发掘前景良好,本研究以蔗叶堆肥为材料从中分离筛选到了1株溶磷真菌DC30-2-P1,经鉴定为泡盛曲霉(A. awamori)。
目前,实验室通过测定菌株在平板的溶磷效果可初步判定该菌株的溶磷能力大小。刘玉凤等[30]研究假单胞菌属(Pseudomonas) RC01在无机磷培养基28 ℃培养7 d,测定菌落直径为30 mm,溶磷圈直径为40 mm,D/d为1.33;Ithipon等[31]研究的几种曲霉在无机磷培养基上的D/d范围在1.14至1.40;在相同条件下,史发超等[32]测定菌株P83的菌落直径为36 mm,D/d为1.38;杨顺等[16]筛选到的黑曲霉P1-1和塔宾曲霉P2-2,在无机磷培养基培养5 d,D/d均超过了1.50;而赵龙飞等[33]筛选到的(Enterobacter cloacae) DD284和(Pseudomonas putida) DD291表现出更强的溶磷能力,菌落直径仅为4.70 mm和4.20 mm,溶磷圈直径却达到了39.30 mm和39.70 mm;本研究筛选到的溶磷菌DC30-2-P1在无机磷培养基28 ℃培养7 d,测定菌落直径分别为55.33 mm [Ca3(PO4)2]、45.00 mm [Zn3(PO4)2],溶磷圈直径达到了65.33 mm [Ca3(PO4)2]、67.67 mm [Zn3(PO4)2],与上述研究的溶磷菌相比,表现出较好的溶磷能力;(D/d)分别为1.18 [Ca3(PO4)2]和1.50 [Zn3(PO4)2],表明菌株DC30-2-P1对无机磷Zn3(PO4)2的溶解能力大于对Ca3(PO4)2的溶解能力,与史发超等[32]研究的P83和张美荣[34]研究的EF1、EF5结果一致,与蒋国彪[35]研究的JG-22结果相反,对Ca3(PO4)2的溶解能力大于Zn3(PO4)2,(D/d)分别为5.40和1.67,可能原因在于不同类型的溶磷菌对磷源利用能力有差异。
此外,通过研究溶磷菌在发酵液中有效磷的含量也可表征其溶磷能力的大小,但从不同材料分离到的菌株溶磷能力存在较大差异,王彩霞[36]测定接种草酸青霉(P. oxalicum) QM-6和QM-10两个菌株的发酵液中有效磷含量分别为1239.21 mg/L和1386.93 mg/L,张建峰等[11]从盐碱地筛选到的绳状青霉(P. funiculosum),摇瓶培养测得发酵液中溶磷量也达到了1064.21 mg/L,马卫等[37]研究的黑曲霉(A. niger) MEM07的溶磷量为1242.49 mg/L;而一些溶磷菌的溶磷能力相对较弱,许昌超等[38]研究的黑曲霉(A. niger) M1,最大溶磷量仅为75.40 mg/L;薛应钰等[39]筛选到一株草酸青霉(P. oxalicum),对Ca3(PO4)2的溶磷量为557.00 mg/L,而李海云等[40]从猪粪堆肥分离到的产黄青霉(P. chrysogenum)对Ca3(PO4)2的溶解量仅达到138.36 mg/L。部分研究表明泡盛曲霉具有溶磷促生等功能,菌株泡盛曲霉(A. awamori) MQ013的最大溶磷量仅在260 mg/L左右[19],菌株S29对Ca3(PO4)2的溶解量为1110 mg/L[14],而本研究中泡盛曲霉DC30-2-P1在含有Ca3(PO4)2液体培养基中摇培至96 h,溶磷量达到2973.85 mg/L,与上述研究中的溶磷菌相比具有较大的优势,也说明了菌株的溶磷能力与溶磷圈法判定的能力大小之间相关性不大,这与李蓉等[41]研究得出的结论一致。对培养液进行pH测定发现pH的变化基本与溶磷量浓度成反比,这与许多研究者得到的结论一致。
溶磷菌对土壤中难溶性磷酸盐的溶解作用对植株生长有较大影响,不同种类的溶磷菌对植株各生理指标的影响不同,进而表现促生能力的差异性。菌株在土培试验中表现的溶磷能力也存在较大差距。添加外源溶磷菌可能改善了作物的营养结构,促进了作物对N、P、K营养元素的吸收,提高作物的光合作用并积累养分[42],表现为植株生物量的增加[39]。张中峰等[43]从石漠化地区植物根际筛选到一株假单胞菌(Pseudomonas),它对顶果木(Acrocarpus fraxinifolius)生长和养分吸收具有显著促进作用,植株地上生物量比对照增加14.5%–30.5%,根系生物量比对照增加27.6%–45.7%。本研究表明从蔗叶堆肥中分离到的泡盛曲霉(A. awamori),接种其发酵液可显著提高辣椒(Capsicum annuum L.)生物量及叶绿素含量,具有明显的促生作用,与魏伟等[44]从马尾松根际土样中分离筛选出的具有溶磷作用的泡盛曲霉(A. awamori) JP-NJ1研究结果一致。Rachana等[14]发现接种泡盛曲霉S29可显著促进植株的生长和总磷的吸收,与未添加S29的处理相比,总磷吸收含量提高了50%以上;Lee等[45]研究表明与空白对照比较,溶磷菌GAK2处理的水稻磷含量提高了36.6%;Yin等[46]研究的棘孢曲霉(Aspergillus aculeatus) P93和Silitonga等[47]研究的嗜松篮状菌(Talaromyces Pinophilus) M1、土曲霉(Aspergilus terreus) M2及其混合剂对于提高植物磷含量最高仅为12%。在本研究中,添加泡盛曲霉(A. awamori) DC30-2-P1的处理组对提高植物全磷含量和土壤有效磷含量达到了80.5%和84.8%,与上述研究的曲霉属比较表现出更强的提高植物磷利用率作用。
综合以上结果,泡盛曲霉(A. awamori)DC30-2-P1的溶磷促生机制可能与以下几方面有关:第一,溶磷菌代谢产生一些有机酸,降低了土壤pH,对难溶性磷酸盐起到溶解的作用[48],进而植株能够吸收利用其中的可溶性磷维持生长发育;第二,溶磷菌可能改善了植株的营养结构及微生物群落结构[49],保证良好的生长环境,促进光合作用并积累养分,提高了植株的抵抗能力;第三,溶磷菌代谢产物中可能具有促进作物生长的物质,如生长素、吲哚乙酸等,已有文献表明溶磷菌发酵液对玉米种子发芽率有提高作用[50],植物根系的发育与溶磷菌代谢产生的生长素也有一定关系[51]。
微生物菌剂的研发和应用需要确保功能菌株具有性能稳定、活性高等特点,筛选到的溶磷菌应具备较强的环境适应能力以及在土壤中更高的定殖能力。研究表明通过溶磷菌与其他功能菌复配成复合菌剂,施入土壤后能够显著提高作物生物量[52],同时能够提高其在土壤中的稳定性,改善磷土壤微生物群落结构[49],体现了复合菌群的环境友好性和可持续性,也改变了单一菌株的不稳定性、易失活等不良效应[53]。针对这些问题,本研究工作在后续研究中,将对泡盛曲霉(A. awamori) DC30-2-P1的产生活性物质能力、对环境适应能力、在土壤中的定殖能力进行测定,并探究与其他功能菌株互作对植物产生的效应,深入探索其溶磷促生机制,为将来开发的微生物制剂广泛应用奠定理论和实践基础。
4 结论 本研究以“绿色农业”为理念,从农田废弃物蔗叶堆肥材料中进行溶磷真菌的筛选、鉴定、溶磷效果及促生作用研究,得到了以下结论。(1)从蔗叶堆肥材料筛选到一株高效溶磷真菌DC30-2-P1,鉴定为泡盛曲霉(A. awamori)。(2)将DC30-2-P1接种在含有Ca3(PO4)2和Zn3(PO4)2的PAD培养基上,透明圈与菌落直径之比(D/d)分别为1.16和1.50,表明该菌株表现出良好的溶解无机磷酸盐的作用。(3)在液体摇瓶培养试验中,DC30-2-P1能够将Ca3(PO4)2高效转化成有效磷,培养至96 h有效磷含量达到2973.85 mg/L。(4)接种DC30-2-P1发酵液可显著提高辣椒的生物量、叶绿素含量、植物全磷含量和土壤有效磷含量,起到促生作用。本研究筛选获得的泡盛曲霉(A. awamori)丰富了溶磷微生物的种质资源,并具有应用于微生物肥料开发的潜质。
References
| [1] | Li WH, Cheng SK, Mei XR, Liu MC, Hong CC. Study on strategies for the sustainable development of China's agricultural resources and environment. Engineering Sciences, 2016, 18(1): 56-64. (in Chinese) 李文华, 成升魁, 梅旭荣, 刘某承, 洪传春. 中国农业资源与环境可持续发展战略研究. 中国工程科学, 2016, 18(1): 56-64. |
| [2] | Chen X, Lin XH. Screening of phosphorus-solubilizing bacteria in sugarcane rhizosphere soil and the optimization of culture conditions. Chinese Journal of Tropical Agriculture, 2017, 37(12): 61-69. (in Chinese) 陈炫, 林希昊. 甘蔗根际土壤解磷细菌的筛选及培养条件优化. 热带农业科学, 2017, 37(12): 61-69. |
| [3] | Qin LJ, Yang YZ, Yang XY. Advances in mechanisms of soil phosphorus solubilization and dissolution by phosphate solubilizing microorganisms. Life Science Research, 2019, 23(1): 59-64, 86. (in Chinese) 秦利均, 杨永柱, 杨星勇. 土壤溶磷微生物溶磷、解磷机制研究进展. 生命科学研究, 2019, 23(1): 59-64, 86. |
| [4] | Shi XK, Ma JJ, Liu LJ. Effects of phosphate-solubilizing bacteria application on soil phosphorus availability in coal mining subsidence area in Shanxi. Journal of Plant Interactions, 2017, 12(1): 137-142. DOI:10.1080/17429145.2017.1308567 |
| [5] | Parmar N, Singh A. Geomicrobiology and biogeochemistry. Berlin: Springer, 2014. |
| [6] | Alori ET, Glick BR, Babalola OO. Microbial phosphorus solubilization and its potential for use in sustainable agriculture. Frontiers in Microbiology, 2017, 8: 971. DOI:10.3389/fmicb.2017.00971 |
| [7] | Coutinho FP, Felix WP, Yano-Mel AM. Solubilization of phosphates in vitro by Aspergillus spp.. Ecological Engineering, 2012, 42: 85-89. DOI:10.1016/j.ecoleng.2012.02.002 |
| [8] | Sahoo HR, Gupta N. Phosphate-solubilizing fungi: impact on growth and development of economically important plants//Khan M, Zaidi A, Musarrat J. Phosphate Solubilizing Microorganisms. Switzerland: Springer, 2014: 87-111. |
| [9] | Mitra D, An?elkovi? S, Panneerselvam P, Senapati A, Vasi? T, Ganeshamurthy AN, Chauhan M, Uniyal N, Mahakur B, Radha TK. Phosphate-solubilizing microbes and biocontrol agent for plant nutrition and protection:current perspective. Communications in Soil Science and Plant Analysis, 2020, 51(5): 645-657. DOI:10.1080/00103624.2020.1729379 |
| [10] | Feng ZY, Chen SS, Wang WC, Yang H, Deng ZL, Li Z, Wang SM, Xu YC. Screening and identification of several phosphate-solubilizing bacteria and effect of their P-solubility. Journal of Nanjing Agricultural University, 2017, 40(5): 842-849. (in Chinese) 冯哲叶, 陈莎莎, 王文超, 杨华, 邓照亮, 李真, 王世梅, 徐阳春. 几株溶磷细菌的筛选和鉴定及其溶磷效果. 南京农业大学学报, 2017, 40(5): 842-849. |
| [11] | Zhang JF, Miao TY, Zhang JX, Zhang JJ, Jiang Y, Chen G. Screening, identification and phosphate solubilizing properties of a fungi strain isolated from saline-alkali land. Journal of Northwest A & F University (Natural Science Edition), 2017, 45(12): 121-128. (in Chinese) 张建峰, 苗天瑶, 张嘉旭, 张洁婧, 姜云, 陈光. 1株溶磷真菌的分离鉴定及溶磷特性分析. 西北农林科技大学学报(自然科学版), 2017, 45(12): 121-128. |
| [12] | Qu JH, Zhang LJ, Fu YH, Li HF, Tian HL. Isolation, identification and phosphorus-dissolving capacity of an efficient phosphate-solubilizing bacterium. Journal of Henan Agricultural Sciences, 2018, 47(3): 55-58, 91. (in Chinese) 屈建航, 张璐洁, 符运会, 李海峰, 田海龙. 1株高效溶磷细菌的分离、鉴定和溶磷能力研究. 河南农业科学, 2018, 47(3): 55-58, 91. |
| [13] | 符玲.一株解磷酵母菌的筛选及其特性研究.天津大学硕士学位论文, 2010. |
| [14] | Jain R, Saxena J, Sharma V. Effect of phosphate- solubilizing fungi Aspergillus awamori S29 on mungbean (Vigna radiata cv. RMG 492) growth. Folia Microbiologica, 2012, 57(6): 533-541. DOI:10.1007/s12223-012-0167-9 |
| [15] | Wang YY, Li PS, Zhang BX, Wang YP, Meng J, Gao YF, He XM, Hu XM. Identification of phosphate-solubilizing microorganisms and determination of their phosphate-solubilizing activity and growth-promoting capability. BioResources, 2020, 15(2): 2560-2578. |
| [16] | Yang S, Yang T, Lin B, Liu XZ, Xiang MC. Isolation and evaluation of two phosphate-dissolving fungi. Acta Microbiologica Sinica, 2018, 58(2): 264-273. (in Chinese) 杨顺, 杨婷, 林斌, 刘杏忠, 向梅春. 两株溶磷真菌的筛选、鉴定及溶磷效果的评价. 微生物学报, 2018, 58(2): 264-273. |
| [17] | 史发超.高效溶磷真菌的筛选鉴定及溶磷促生效果研究.中国农业科学院硕士学位论文, 2014. |
| [18] | Zhang YX, Lei P, Xu ZQ, Feng XH, Xu H, Xu XJ. Screening of a high-efficiency phosphate solubilizing bacterium Bacillus subtilis JT-1 and its effects on soil microecology and wheat growth. Jiangsu Journal of Agricultural Sciences, 2016, 32(5): 1073-1080. (in Chinese) 张云霞, 雷鹏, 许宗奇, 冯小海, 徐虹, 许仙菊. 一株高效解磷菌Bacillus subtilis JT-1的筛选及其对土壤微生态和小麦生长的影响. 江苏农业学报, 2016, 32(5): 1073-1080. DOI:10.3969/j.issn.1000-4440.2016.05.019 |
| [19] | Zhan SF, Lu DN, Mao HY, Xiong RL, Huang D, Chen Y. Isolation of two phosphate/potaaium-solubilizing and IAA-producing strains of endophytic fungi and their plant growth promoting function. Soils and Fertilizers Sciences in China, 2017(3): 142-151. (in Chinese) 詹寿发, 卢丹妮, 毛花英, 熊蓉露, 黄丹, 陈晔. 2株溶磷、解钾与产IAA的内生真菌菌株的筛选、鉴定及促生作用研究. 中国土壤与肥料, 2017(3): 142-151. |
| [20] | Fu XP, Wu FZ, Wu X, Liu D. Advances in the mechanism of improving crop mineral nutrients in intercropping and relay intercropping systems. Journal of Plant Nutrition and Fertilizers, 2016, 22(2): 525-535. (in Chinese) 付学鹏, 吴凤芝, 吴瑕, 刘丹. 间套作改善作物矿质营养的机理研究进展. 植物营养与肥料学报, 2016, 22(2): 525-535. |
| [21] | Yi YM, Huang WY. Distribution of phosphate-solubilizing microbes in soils of different ecological zones and its affecting factors. Journal of Ecology and Rural Environment, 2010, 26(5): 448-453. (in Chinese) 易艳梅, 黄为一. 不同生态区土壤溶磷微生物的分布特征及影响因子. 生态与农村环境学报, 2010, 26(5): 448-453. DOI:10.3969/j.issn.1673-4831.2010.05.009 |
| [22] | 耿凤展.番茄秸秆高温堆肥基质对番茄生长影响的研究.西北农林科技大学硕士学位论文, 2015. |
| [23] | Huang JZ, Hu GP, Yu YF, Du XM, Shi XP, Wang JW. Research progress of microbe in agricultural waste composting. Guangdong Agricultural Sciences, 2019, 46(1): 64-70. (in Chinese) 黄金枝, 胡桂萍, 俞燕芳, 杜贤明, 石旭平, 王军文. 微生物在农业废弃物堆肥应用中的研究进展. 广东农业科学, 2019, 46(1): 64-70. |
| [24] | Zhang YJ, Zhang S, Liu XZ, Wen HA, Wang M. A simple method of genomic DNA extraction suitable for analysis of bulk fungal strains. Letters in Applied Microbiology, 2010, 51(1): 114-118. |
| [25] | 鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 2000. |
| [26] | Zhang SY. Research progress of phosphate solubilizing microbes in soil. Inner Mongolia Forestry Science and Technology, 2015, 41(1): 39-41, 52. (in Chinese) 张淑云. 土壤解磷微生物研究进展. 内蒙古林业科技, 2015, 41(1): 39-41, 52. DOI:10.3969/j.issn.1007-4066.2015.01.010 |
| [27] | Schisler DA, Khan NI, Boehm MJ, Slininger PJ. Greenhouse and field evaluation of biological control of fusarium head blight on durum wheat. Plant Disease, 2002, 86(12): 1350-1356. |
| [28] | Lu HS, Wang YS, Wang HW, Zhao XS. Study on isolation and identification of phosphate-solubilizing bacteria from saline-alkali soil. Journal of Northeast Agricultural University, 2014, 45(2): 77-82. (in Chinese) 陆洪省, 王亚舒, 王厚伟, 赵晓舒. 盐碱地中解磷菌的分离鉴定及其解磷能力研究. 东北农业大学学报, 2014, 45(2): 77-82. |
| [29] | 李旭东.羽毛针禾共生菌的分离鉴定及其植株表型多样性的研究.石河子大学硕士学位论文, 2019. |
| [30] | Liu YF, Ma LJ, Zhang TT, Ma L. Identification and culture conditions optimization of phosphate-solubilizing bacteria in rhizosphere of Carthamus tinctorius L.. Jiangsu Agricultural Sciences, 2019, 47(18): 287-291. (in Chinese) 刘玉凤, 马丽娟, 张婷婷, 马磊. 红花根际溶磷菌的筛选与培养条件优化. 江苏农业科学, 2019, 47(18): 287-291. |
| [31] | Ithipon C, Saithong K, Chaninun P. Identification and screening of phosphate solubilizing Aspergillus species isolated from soil in the three southern border provinces of Thailand. Princess of Naradhiwas University Journal, 2019, 12(1): 163-172. |
| [32] | Shi FC, Yin ZW, Jiang HM, Fan BQ. Screening, identification of P-dissolving fungus P83 strain and its effects on phosphate solubilization and plant growth promotion. Acta Microbiologica Sinica, 2014, 54(11): 1333-1343. (in Chinese) 史发超, 殷中伟, 江红梅, 范丙全. 一株溶磷真菌筛选鉴定及其溶磷促生效果. 微生物学报, 2014, 54(11): 1333-1343. |
| [33] | Zhao LF, Xu YJ, Cao DJ, Li Y, Li JJ, Lü JM, Zhu ZY, Qin SS, He XL. Screening, resistance, phylogeny and growth promoting of phosphorus solubilizing bacteria isolated from soybean root nodules. Acta Ecologica Sinica, 2015, 35(13): 4425-4435. (in Chinese) 赵龙飞, 徐亚军, 曹冬建, 李源, 厉静杰, 吕佳萌, 朱自亿, 秦珊珊, 贺学礼. 溶磷性大豆根瘤内生菌的筛选、抗性及系统发育和促生. 生态学报, 2015, 35(13): 4425-4435. |
| [34] | 张美荣.蒙古韭(Allium mongolicum Regel)根际可培养微生物的分离及PGPR菌株的筛选.内蒙古大学硕士学位论文, 2019. |
| [35] | 蒋国彪.小麦溶磷内生菌的筛选鉴定及其溶磷特性的初步研究.四川师范大学硕士学位论文, 2012. |
| [36] | 王彩霞.高效解磷青霉菌菌株的筛选及解磷促生复合菌剂的研制.山东农业大学硕士学位论文, 2016. |
| [37] | Ma W, Liu C, Shao C, Chen L, Ni H. Screening and identification of a highly efficient phosphate-dissolving fungus MEM07 and optimization of its phosphate-dissolving conditions. Journal of Green Science and Technology, 2017(20): 193-195. (in Chinese) 马卫, 刘诚, 邵闯, 陈玲, 倪红. 一株高效溶磷真菌MEM07的筛选鉴定及其溶磷条件优化. 绿色科技, 2017(20): 193-195. |
| [38] | Xu CC, Zheng FH, Li T, Ye SP, Zhang JT. Isolation and solubilization capacity characterization of a phosphate- solubilizing strain derived from soil. Journal of Anhui University (Natural Science Edition), 2019, 43(5): 103-108. (in Chinese) 许昌超, 郑富海, 李铤, 叶少萍, 张俊涛. 土壤中一株溶磷菌的筛选和溶磷能力初探. 安徽大学学报(自然科学版), 2019, 43(5): 103-108. |
| [39] | Xue YY, Ye W, Yang S, Li P, Xu BL. Isolation and identification of P-dissolving fungi strain and its effects on phosphate-solubilizing and plant growth promotion. Agricultural Research in the Arid Areas, 2019, 37(4): 253-262. (in Chinese) 薛应钰, 叶巍, 杨树, 李培, 徐秉良. 一株溶磷菌的分离鉴定及溶磷促生作用. 干旱地区农业研究, 2019, 37(4): 253-262. |
| [40] | Li HY, Niu SQ, Kong WB, Da WY, Geng H, Han CH, Yan WR. Screening and identification of a phosphate solubilizing strain isolated from pig manure compost and determination of its phosphate solubilizing capacity. Acta Scientiae Circumstantiae, 2015, 35(5): 1464-1470. (in Chinese) 李海云, 牛世全, 孔维宝, 达文燕, 耿晖, 韩彩虹, 阎薇如. 猪粪堆肥中一株溶磷菌的筛选鉴定及溶磷能力初步测定. 环境科学学报, 2015, 35(5): 1464-1470. |
| [41] | Li R, Zhou DM, Wu Y, Zhou GY, Huang PF, Deng XJ. Selection and characteristics of phosphate-solubilizing bacteria in rhizosphere of Cunninghaimia lanceolata. Journal of Central South University of Forestry and Technology, 2012, 32(4): 95-99. (in Chinese) 李蓉, 周德明, 吴毅, 周国英, 黄鹏飞, 邓小军. 杉木根际溶磷菌筛选及其部分特性的初步研究. 中南林业科技大学学报, 2012, 32(4): 95-99. |
| [42] | 刘晶晶.外源溶磷菌对大豆生理性状和根际土壤微生态的影响.吉林农业大学硕士学位论文, 2016. |
| [43] | Zhang ZF, Zhou LW, Xu GP, Zhang JC. Screening of phosphate solubilizing bacteria and growth promoting effect in rhizosphere soil of karst area in Guangxi. Guangxi Sciences, 2018, 25(5): 590-598. (in Chinese) 张中峰, 周龙武, 徐广平, 张金池. 广西喀斯特地区植物根际土壤解磷菌筛选及促生效应研究. 广西科学, 2018, 25(5): 590-598. |
| [44] | Wei W, Wu XQ, Qiao H. Screening and identification of phosphate-solubilizing fungi of Pinus massoniana rhizosphere and its application. Scientia Silvae Sinicae, 2014, 50(9): 82-88. (in Chinese) 魏伟, 吴小芹, 乔欢. 马尾松根际高效解磷真菌的筛选鉴定及其促生效应. 林业科学, 2014, 50(9): 82-88. |
| [45] | Lee KE, Adhikari A, Kang SM, You YH, Joo GJ, Kim JH, Kim SJ, Lee IJ. Isolation and characterization of the high silicate and phosphate solubilizing novel strain Enterobacter ludwigii GAK2 that promotes growth in rice plants. Agronomy, 2019, 9(3): 144. |
| [46] | Yin ZW, Fan BQ, Roberts DP, Chen SF, Shi FC, Buyer JS, Jiang HM. Enhancement of maize growth and alteration of the rhizosphere microbial community by phosphate- solubilizing fungus Aspergillus aculeatus P93. Journal of Agriculture Biotechnology, 2019, 2(2): 1-10. |
| [47] | Silitonga N, Sembiring M, Marbun P, Rosneli. Application of phosphate solubilizing fungi and various sources of P-fertilizers toward P-available and P nutrient content of soybean (Glycine max L. Merrill) in andisol soil. IOP Conference Series:Earth and Environmental Science, 2019, 260: 012159. |
| [48] | Li Z, Bai TS, Dai LT, Wang FW, Tao JJ, Meng ST, Hu YX, Wang SW, Hu SJ. A study of organic acid production in contrasts between two phosphate solubilizing fungi:Penicillium oxalicum and Aspergillus niger. Scientific Reports, 2016, 6(1): 25313. |
| [49] | Liu J, Qi WY, Li Q, Wang SG, Song C, Yuan XZ. Exogenous phosphorus?solubilizing bacteria changed the rhizosphere microbial community indirectly. 3 Biotech, 2020, 10: 164. |
| [50] | 胡晓峰.溶磷菌的筛选、溶磷条件优化及对玉米的促生作用研究.南京农业大学硕士学位论文, 2010. |
| [51] | Shu JH, Wang PC, Li XG, Wang XL, Li XD. Isolation and screening of inorganic phosphate-solubilizing bacteria and their effect on the growth of Bromus cartharticus. Acta Prataculturae Sinica, 2017, 26(5): 173-180. (in Chinese) 舒健虹, 王普昶, 李显刚, 王小利, 李小冬. 无机磷溶解菌的分离筛选及其对扁穗雀麦生长的影响. 草业学报, 2017, 26(5): 173-180. |
| [52] | Zhao DQ, Yao T, Liu QH, Ma WB, Li JH. Effect of mixture of phosphate solubilizing bacteria and nodule bacteria on Alfafa seedling growth. Chinese Journal of Grassland, 2015, 37(5): 57-61. (in Chinese) 赵冬青, 姚拓, 刘青海, 马文彬, 李建宏. 溶磷菌和根瘤菌混合菌剂对苜蓿苗期生长的影响. 中国草地学报, 2015, 37(5): 57-61. |
| [53] | 曾令涛.蚯蚓堆肥与益生菌互作对西瓜/茄子生长及土壤性质的影响.南京农业大学硕士学位论文, 2016. |
