吴涓

 , 刘俊, 陈婕
, 刘俊, 陈婕 安徽大学资源与环境工程学院, 安徽 合肥 230601
收稿日期:2019-06-10;修回日期:2019-10-11;网络出版日期:2020-03-09
基金项目:安徽省教育厅重点科研项目(KJ2017A035);国家自然科学基金(31970100)
作者简介:吴涓, 2006年获中国科学技术大学化学院理学博士, 现就职于安徽大学资源与环境工程学院, 副教授。科研方向是应用微生物及水污染控制。近年来, 以环境污染物的生物治理以及污染物的资源化为主题, 开展了多项研究, 主要包括以生物吸附法去除废水中的重金属, 高效降解菌的筛选和培育, 以及有机污染物的生物降解和生物转化等。参与国家自然科学基金项目、省"十五"科技公关项目以及省部级研究课题等10余项, 主持省部级项目5项, 发表学术论文近30篇.
*通信作者:吴涓, Tel:+86-551-63861441;Fax:+86-551-63861724;E-mail:wujuan@ustc.edu.
摘要:[目的] 针对菲、蒽、荧蒽多环芳烃(PAHs)污染物,利用乳白耙齿菌F17,研究单一和复合PAHs污染物的生物降解规律。[方法] 采用气相色谱-质谱法(GC-MS)分析降解过程中PAHs的浓度,并采用准一级反应动力学模型对降解结果进行拟合。[结果] 对于单一PAHs,第15天时菲、蒽、荧蒽的降解率由高到低依次为菲(97.8%)>蒽(89.3%)>荧蒽(81.5%)。菲、蒽和荧蒽的降解过程具有准一级反应动力学特征,菲的生物降解速率最快,其次是蒽,荧蒽的降解速率最慢。与单一PAHs的降解相比,在复合PAHs的降解过程中,乳白耙齿菌F17的生长和锰过氧化物酶的合成均表现出不同的特征。此外,水溶性极可能是复合污染物降解的重要控制因子,三者水溶性为:菲>荧蒽>蒽。因此,在菲或荧蒽加入条件下,微生物能优先降解这些污染物,抑制了污染物蒽的降解;同时,蒽或菲的存在对荧蒽的降解也有抑制作用;然而外源加入水溶性较差的蒽和荧蒽,则对菲的生物降解无显著影响。[结论] 复合PAHs的生物降解主要表现为相互竞争的特点,通过GC-MS分析了PAHs的生物降解途径。
关键词:乳白耙齿菌F17单一多环芳烃复合多环芳烃生物降解动力学
Degradation of single and mixed PAHs by Irpex lacteus F17
Juan Wu

 , Jun Liu, Jie Chen
, Jun Liu, Jie Chen School of Resources and Environmental Engineering, Anhui University, Hefei 230601, Anhui Province, China
Received: 10 June 2019; Revised: 11 October 2019; Published online: 9 March 2020
*Corresponding author: Juan Wu, Tel: +86-551-63861441; Fax: +86-551-63861724; E-mail: wujuan@ustc.edu.
Foundation item: Supported by the Key Research Projects of Education Department of Anhui Province (KJ2017A035) and by the National Natural Science Foundation of China (31970100)
Abstract: [Objective] Here we studied the biodegradation characteristics of single and mixed polycyclic aromatic hydrocarbons (PAHs) pollutants by Irpex lacteus F17 using phenanthrene, anthracene, and fluoranthene. [Methods] We determined the concentration of PAHs during biodegradation using gas chromatography-mass spectrometer (GC-MS). We used pseudo first order reaction kinetics model to fit the biodegradation results of PAHs. [Results] After 15 days of degradation, the biodegradation rate was phenanthrene (97.8%) > anthracene(89.3%) > fluoranthene (81.5%). The degradation process of phenanthrene, anthracene and fluoranthene had the characteristics of pseudo first order reaction kinetics. The biodegradation rate of phenanthrene was the fastest, followed by anthracene, and fluoranthene was the slowest. Compared with the degradation of single PAHs, mixed PAHs showed different characteristics on the growth and manganese peroxidase synthesis of Irpex lacteus F17. In addition, water solubility was likely to be an important control factor for the biodegradation of mixed pollutants. The water solubility was in the following order:phenanthrene > fluoranthene > anthracene. Therefore, when we added phenanthrene or fluoranthene into anthracene degradation system, microorganisms may preferentially degrade these pollutants and inhibit the degradation of anthracene. The addition of anthracene or phenanthrene could also inhibit the biodegradation of fluoranthene. However, the addition of anthracene or fluoranthene with poor water solubility had no significant effect on the biodegradation of phenanthrene. [Conclusion] The competition role was the main characteristic for the biodegradation of mixed PAHs.
Keywords: Irpex lacteus F17single PAHsmixed PAHsbiodegradationkinetics
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是广泛存在于环境中的一大类持久性有毒有机污染物,主要来源于石油、煤炭、天然气、木材、工业废气等不完全燃烧过程以及还原状态下的热分解过程[1]。多环芳烃具有高稳定性和强疏水性,较难降解,并可通过生物积累和食物链进行传递,由于其“三致”作用而对人类健康和生态环境具有很大的危害性[2]。环境中的PAHs能够通过光降解、化学氧化、土壤吸附以及微生物降解等多种途径去除[3-4],然而大量研究表明,PAHs的微生物降解方法具有成本低、效率高、二次污染少的特点,成为去除环境中PAHs的最具潜力的途径之一。
目前国内外对PAHs生物降解的研究主要集中在降解菌的筛选、降解途径、降解产物以及降解酶和降解基因等方面[5-6]。目前已发现一些厌氧和好氧微生物能够通过多种代谢途径将PAHs降解甚至矿化。常见的好氧微生物有假单胞菌属[7-8]、鞘氨醇单胞菌属[9-10]、分支杆菌属[11-12]、红球菌属[13]、克雷伯氏菌属[14-15]等,而有关PAHs的厌氧微生物降解的研究不太多见[16]。
与细菌相比,真菌对自然环境中PAHs污染的修复有其独特的作用[17-18],特别是白腐真菌。白腐真菌是一种丝状真菌,由于其可以合成木质素降解酶系,因而对一些难降解有机污染物具有良好的降解效果[19-20]。白腐真菌种类繁多,本文所用的乳白耙齿菌F17 (Irpex lacteus F17)是一类典型的白腐真菌,与所有的白腐担子菌纲一样,I. lacteus F17主要通过分泌一系列胞外氧化酶,如锰过氧化物酶(MnP)、木质素过氧化物酶(LiP)以及漆酶(Lac)等,参与含木质素结构的有机化合物的降解[21]。陈金媛等[22]研究了白腐真菌Ganoderma Sinense对蒽的去除能力,当蒽的浓度为10–30 mg/L时,去除率可达到18.3%–33.3%。但是目前关于I. lacteus F17降解水相中PAHs的研究鲜有报道。
近年来针对PAHs的研究主要是以单一PAHs为对象,但是环境中PAHs污染的特点是多种PAHs共存,因而对复合PAHs的生物降解特性和多种PAHs之间的相互作用展开研究具有更重要的意义。本文主要是对低环的复合PAHs的生物降解展开研究,故选用菲、蒽、荧蒽为研究对象,考察在单一PAHs及复合PAHs体系中I. lacteus F17的生长特征及降解性能和锰过氧化物酶活力。同时,对单一PAHs的降解过程采用适宜的反应动力学模型加以拟合。通过本研究以期为复合PAHs中低环PAHs的生物降解以及PAHs污染地区的微生物修复提供理论依据和技术参考。
1 材料和方法 1.1 实验菌种 选用Irpex lacteus F17为PAHs降解菌,由安徽大学生命科学学院提供,该菌种是从长有白色菌丝的腐败树皮上分离得到[23]。前期研究已表明该菌对三环多环芳烃——蒽具有较强的降解能力[24]。
1.2 培养基 CPDA培养基(g/L):葡萄糖20.0,KH2PO4 3.0,MgSO4·7H2O 1.5,马铃薯汁0.2 L,pH 6.0。
无机盐培养基(g/L):NH4NO3 3.0,K2HPO4·3H2O 0.5,KH2PO4 0.5,无机盐溶液0.002 L,pH 5.0。
无机盐溶液(g/L):MnSO4·H2O 1.0,FeSO4·7H2O 1.0,CuSO4·5H2O 1.0,CaCl2·2H2O 1.0,MgSO4·7H2O 4.0。
1.3 单一PAHs的降解实验 将I. lacteus F17接入CPDA培养基中,于30 ℃、120 r/min培养3 d后,将含有菌丝球的培养液制成匀浆液待用。在已灭菌的20 mL无机盐培养基中加入一定量的PAHs (单一PAHs)的二氯甲烷溶液,使单一PAHs的初始浓度为10 mg/L。待二氯甲烷挥发后,加入1 mL匀浆液,于30 ℃、pH 5.0、120 r/min条件下恒温振荡培养(避光)。每组实验设7个平行,每个平行设3个重复的降解体系,空白对照是含单一PAHs但不接种I. lacteus F17的无机盐培养基。从接种微生物后的第3天开始,每2 d取样1次,测定体系中残留PAHs的浓度,直到第15天降解结束。
1.4 复合PAHs的降解实验 将I. lacteus F17接入CPDA液体培养基中,培养3 d后,将含有菌丝球的培养液制成匀浆液待用。在已灭菌的20 mL无机盐培养基中依次加入不同PAHs的二氯甲烷溶液,使培养基中每种PAHs的初始浓度均为10 mg/L。待二氯甲烷挥发后,加入1 mL匀浆液,于30 ℃、pH 5.0、120 r/min条件下恒温振荡培养(避光)。每组实验设7个平行,每个平行设3个重复的降解体系,空白对照是含复合PAHs但不接种I. lacteus F17的无机盐培养基。从接种微生物后的第3天开始,每2 d取样1次,测定体系中残留PAHs的浓度,直到第15天降解结束。
为考察菲、蒽和荧蒽三种多环芳烃在降解过程中的相互影响,采用了如表 1所示的实验方案。其中,实验1组是菲、蒽、荧蒽各自单独的降解,实验2组是不同共存体系中菲的降解,实验3组是不同共存体系中蒽的降解,实验4组是不同共存体系中荧蒽的降解。
表 1. PAHs的不同降解体系 Table 1. The different biodegradation systems of PAHs
| Experiment group | Degradation systems |
| 1 | Phenanthrene |
| 2 | Phenanthrene |
| 3 | Anthracene |
| 4 | Fluoranthene |
| 5 | Anthracene |
| 6 | Phenanthrene+Anthracene |
| 7 | Anthracene+Phenanthrene |
| 8 | Fluoranthene+Phenanthrene |
| 9 | Fluoranthene |
| 10 | Phenanthrene+Fluoranthene |
| 11 | Anthracene+Fluoranthene |
| 12 | Fluoranthene+Anthracene |
表选项
1.5 PAHs的提取与分析 将20 mL培养液转移至125 mL的分液漏斗中,加入等体积的二氯甲烷进行萃取。分离有机相并经无水硫酸钠脱水;对水相重复上述操作,对2次萃取的有机相进行合并,在40 ℃条件下进行减压蒸发,然后将旋转蒸发仪收集瓶内壁上的黏附物用甲醇洗下,再用甲醇定容至10 mL。将此溶液用0.22 μm的滤膜过滤,采用气相色谱-质谱仪对PAHs浓度进行测定。采用外标法,依据峰面积和保留时间计算PAHs的浓度。
Agilent7890A/5975C型气相色谱-质谱仪的分析条件如下:采用DB-5MS毛细管柱(0.25 mm× 30 m,0.25 μm,J&K Scientific,USA);载气是纯度为99.999%的高纯氦气,流速为1.0 mL/min;进样口温度为250 ℃,传输线温度为280 ℃,离子源温度为240 ℃;进样量是1 μL。气相色谱按如下程序升温:80 ℃,保留2 min;以15 ℃/min的速率升到215 ℃,保留1 min;以6 ℃/min的速率升到280 ℃,保留1 min;以10 ℃/min的速率升到300 ℃,保留5 min。
1.6 I. lacteus F17生长曲线的测定 生长曲线的测定采用测菌体干重的方法。在上述单一或复合PAHs降解体系中,在30 ℃、pH 5.0、120 r/min的条件下培养I. lacteus F17,定时取样,过滤得到菌丝球,于80 ℃下烘干至恒重。以生物量对时间作图即为生长曲线。
1.7 锰过氧化物酶(MnP)活力的测定 在预实验中分别测定了I. lacteus F17所合成的木质素过氧化物酶(LiP)、锰过氧化物酶(MnP)和漆酶(Lac)的活力,实验表明MnP是蒽、菲和荧蒽生物降解过程中的关键酶。因此实验着重考察了单一和复合PAHs降解过程中的MnP活力的变化情况。
MnP酶活测定方法:3.7 mL的0.11 mol/L乳酸钠缓冲液(pH 4.5),0.1 mL的粗酶液,0.1 mL的40 mmol/L MnSO4溶液,用0.1 mL的4 mmol/L的H2O2启动反应。25 ℃下水浴5 min后终止反应,在240 nm下测定吸光度,对照组用0.l mL缓冲液代替MnSO4溶液。定义每分钟氧化1 μmol Mn2+成为Mn3+所需的酶量为一个酶活力单位(U)。
2 结果和分析 2.1 单一PAHs的微生物降解
2.1.1 单一PAHs的降解性能比较: 由于PAHs的结构和毒性因其种类而异,因此微生物对不同PAHs降解的难易程度也会表现出差异性。本实验分别以10 mg/L的菲、蒽、荧蒽作为碳源,在pH 5.0、30 ℃及120 r/min的避光条件下进行降解实验,以含单一PAHs而不接种微生物的无机盐培养基为空白对照,图中数据是扣除空白对照后的数据。降解结果如图 1-A、图 1-B所示。
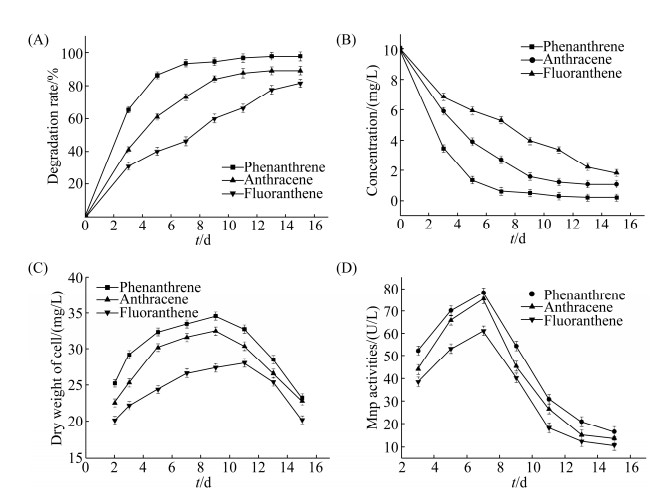 |
| 图 1 单一PAHs降解体系 Figure 1 The single PAHs degradation systems. A: the degradation rate of single PAHs; B: the concentration of single PAHs; C: the growth curve of I. lacteus F17; D: the activity of MnP. |
| 图选项 |
图 1-A表明,第3天时菲、蒽、荧蒽的降解率分别是65.2%、41.0%和30.7%,初期降解速率顺序为菲 > 蒽 > 荧蒽。在15 d的降解过程中,I. lacteus F17对3种PAHs的降解难度按照菲 < 蒽 < 荧蒽的顺序递增,降解率在第15天时分别达到97.8%、89.3%和81.5%。该实验结论和多数研究者的结果是一致的。
2.1.2 单一PAHs的微生物降解动力学特征: 白腐真菌通过分泌漆酶、锰过氧化物酶和木质素过氧化物酶等降解酶类来启动PAHs的生物降解[25]。在均相反应体系中,有机底物(PAHs)和酶之间的酶促反应大多遵循Monod方程。Monod方程是描述化合物作为唯一碳源进行生物降解时的动力学模型。若底物浓度很小而微生物浓度几乎不变,则Monod方程可简化为准一级动力学方程(方程1、2)。
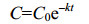 | 方程(1) |
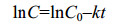 | 方程(2) |
本实验利用单一PAHs的微生物降解结果(图 1-B),分别分析了菲、蒽和荧蒽的降解动力学过程。随降解过程的进行,单一PAHs的浓度均呈现降低的趋势。蒽和荧蒽的浓度分别在第9天和第13天之后才稳定下来;然而菲在前5 d降解很快,第5天之后浓度变化不明显,表明菲的降解速率比蒽和荧蒽要快一些。
采用准一级动力学模型对图 1-B中的数据进行拟合,菲、蒽和荧蒽的降解动力学方程、降解速率常数及相关系数见表 2。表 2中的拟合结果显示,降解速率常数按照菲 > 蒽 > 荧蒽的顺序递减,这一结果表明,菲的降解最快,其次是蒽,荧蒽的降解最慢,这与前述实验中的结论是非常一致的。
表 2. 菲、蒽、荧蒽的生物降解动力学参数(30 ℃) Table 2. The biodegradation kinetic parameters of phenanthrene, anthracene and fluoranthene (30 ℃)
| PAHs | Initial concentration/(mg/L) | Dynamic equation lnC=–kt+lnC0 | Degradation rate constant/(d–1) | R2 |
| Phenanthrene | 10 | lnC=–0.2927t+2.0175 | 0.2927 | 0.9542 |
| Anthracene | 10 | lnC=–0.1823t+2.2759 | 0.1823 | 0.9806 |
| Fluoranthene | 10 | lnC=–0.1069t+2.313 | 0.1069 | 0.9687 |
表选项
2.1.3 单一PAHs降解体系中I. lacteus F17生长特征的分析: 在30 ℃、pH 5.0、120 r/min的条件下,分别测定了单一PAHs降解体系中I. lacteus F17的生长曲线。如图 1-C所示,在单一PAHs降解体系中该菌株在前3 d生长量比较少,从第3天至第11天生长量较大,随后生物量迅速下降。在含有菲和含有蒽的单一PAHs降解体系中,生物量均在第9天达到最大值,分别为34.6 mg/L和32.5 mg/L。然而,在含有荧蒽的降解体系中,生物量在第11天达到最大值,最大生物量为27.3 mg/L。在菲、蒽和荧蒽三者之中,菲的水溶性最好,最易被微生物利用,荧蒽比菲和蒽多一个苯环,增加了被氧化代谢的难度,生物可利用性随之降低。因而在相同条件下荧蒽的生物量最小。多环芳烃的生物降解是一个酶促降解过程,I. lacteus F17合成的MnP是次生代谢产物,而图 1-B中的实验结果也显示出菲、蒽和荧蒽的浓度是从第3天之后才开始逐渐减小的。
2.1.4 单一PAHs降解体系中锰过氧化物酶(MnP)活力的分析: 由图 1-D可以看出,在单一PAHs降解体系中,在相同的降解条件下,含有菲的单一体系中MnP活力最大,为78.3 U/L;含有荧蒽的单一体系中MnP活力最小,为61.2 U/L;含有蒽的单一体系中MnP活力为75.5 U/L。三个降解体系的共同特点是,MnP活力在第3–7天均呈上升趋势,并在第7天达到峰值,随后便迅速下降。
2.2 复合PAHs的微生物降解
2.2.1 复合PAHs降解体系中的降解规律: 环境中发生复合PAHs污染是很普遍的现象,因此与单一PAHs相比,对I. lacteus F17降解复合PAHs的特性进行研究更具有科学价值。实验包含了3组不同的复合PAHs降解体系,在pH 5.0的无机盐培养基、30 ℃及120 r/min条件下避光进行降解,每种PAHs的初始浓度均为10 mg/L,以含PAHs而不接种微生物的无机盐培养基为空白对照,图中数据是扣除空白对照后的数据。降解结果如图 2-A、图 2-B及图 2-C所示。
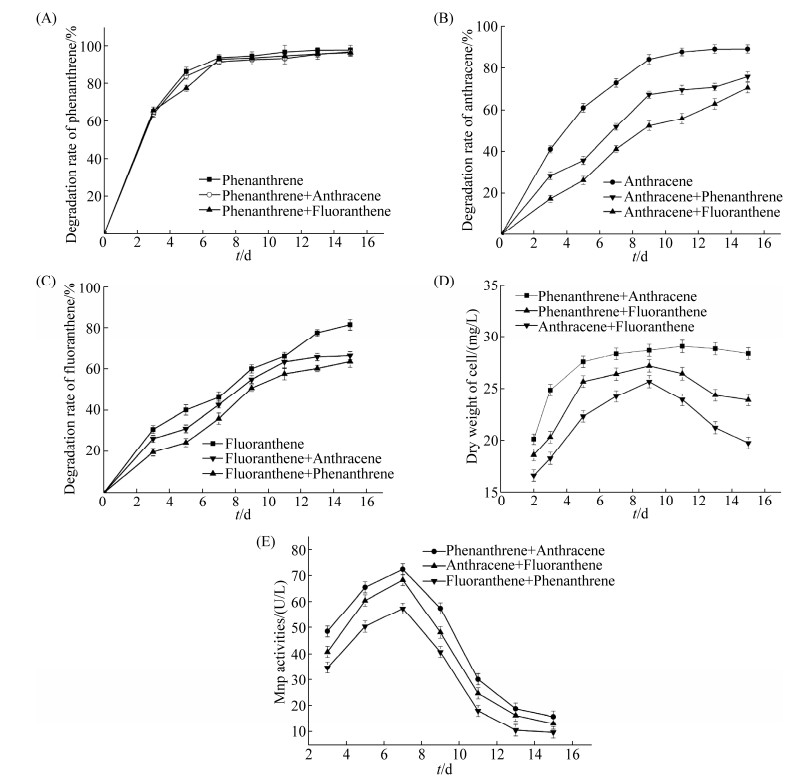 |
| 图 2 复合PAHs降解体系 Figure 2 The mixed PAHs degradation systems. A: degradation rate of phenanthrene; B: degradation rate of anthracene; C: degradation rate of fluoranthene; D: growth curve of I. lacteus F17; E: MnP activity. |
| 图选项 |
根据图 2-A、图 2-B和图 2-C中的数据对降解过程中菲、蒽、荧蒽之间的相互作用进行分析,结果如表 3和表 4所示。图 2-A和表 3均表明,单一体系和复合体系中的菲在降解效果上没有表现出明显的差别,第15天时(蒽+菲)和(荧蒽+菲)中的菲降解率分别为96.0%、96.5%,稍低于单一的菲降解率97.8%,说明蒽和荧蒽的存在对菲的降解无显著影响。究其原因可能是因为与蒽和荧蒽相比,菲更容易被I. lacteus F17所利用,因此当外源加入蒽或荧蒽时菲的降解基本不受影响。
表 3. 不同降解体系中PAHs的降解率(%) Table 3. Degradation rate of PAHs in different degradation systems (%)
| PAHs | Anthracene | Anthracene+phenanthrene | Phenanthrene | Fluoranthene+phenanthrene | Fuoranthene | Fluoranthene+anthracene |
| Phenanthrene | 96.0 | 97.8 | 96.5 | |||
| Anthracene | 89.3 | 75.9 | 70.6 | |||
| Fluoranthene | 63.5 | 81.5 | 66.4 |
表选项
表 4. 共存体系中菲、蒽、荧蒽的相互作用 Table 4. Interactions among phenanthrene, anthracene and fluoranthene in co-existence systems
| PAHs | Phenanthrene | Anthracene | Fluoranthene |
| Phenanthrene→ | + | ++ | |
| Anthracene→ | – | + | |
| Fluoranthene→ | – | ++ | |
| +: little effect on degradation, ++: great effect on degradation, –: no or very weak effect on degradation. | |||
表选项
由图 2-B和表 3中可以看出,蒽在单一体系和复合体系中的降解效果有明显的差异。蒽在菲和蒽共存体系、荧蒽和蒽共存体系中第15天时的降解率分别是75.9%和70.6%,而单一体系中蒽的降解率则为89.3%,明显高于共存体系中蒽的降解率,这表明菲或荧蒽的加入显著抑制了I. lacteus F17对蒽的降解。这可能是因为I. lacteus F17所产降解酶的广谱降解作用,导致了共存体系中菲或荧蒽与蒽的竞争降解。另外,荧蒽对蒽的抑制作用表现得更明显,因为荧蒽和蒽共存体系中蒽的降解率比单一体系中蒽的降解率下降了18.7%,而菲和蒽共存体系中蒽的降解率比单一体系中蒽的降解率下降了13.4%。造成这一现象的原因是,虽然荧蒽比菲多一个苯环且难降解而竞争力较弱,然而荧蒽的生物毒性会对微生物的活性产生一定的抑制作用,导致菲对蒽生物降解的抑制作用比荧蒽对蒽的抑制效果要弱一些。
如图 2-C和表 3所示,荧蒽在单一体系和复合体系中的降解率也有一定的差别。单一体系中荧蒽的降解率为81.5%,菲和荧蒽共存体系、蒽和荧蒽共存体系中的荧蒽在第15天时的降解率分别是63.5%和66.4%,明显低于单一体系中荧蒽的降解率,显然菲或蒽的加入显著抑制了I. lacteus F17对荧蒽的降解。造成共存PAHs的降解表现出竞争抑制的原因可能还是I. lacteus F17合成的降解酶的广谱性。实验结果还显示,菲和荧蒽共存体系中荧蒽的降解率比单一体系中荧蒽的降解率下降了18.0%,而蒽和荧蒽共存体系中荧蒽的降解率比单一体系中荧蒽的降解率下降了15.1%,表明菲对荧蒽降解的抑制作用表现得比蒽更显著,这是因为菲比蒽更容易降解而在共存体系中表现出较强的竞争力。
2.2.2 复合PAHs降解体系中I. lacteus F17生长特征的分析: 在复合PAHs降解体系中I. lacteus F17的生长特征稍有不同。从图 2-D中可以发现,首先,复合PAHs降解体系中的生物量均小于单一PAHs降解体系中的生物量。其次,对于菲和蒽共存的体系,生物量在第2–5天逐渐增大,并在第5–15天基本保持不变。对于菲和荧蒽共存的体系以及蒽和荧蒽共存的体系,生物量均在第2–9天逐渐增大,并在第9天之后逐渐减小。与单一PAHs降解体系相比,复合PAHs降解体系中碳源的增加导致了微生物可在较长时间内保持较大的生物量。
2.2.3 复合PAHs降解体系中锰过氧化物酶(MnP)活力的分析: 由图 2-E可知,菲+蒽的体系中MnP活力最大,为72.2 U/L;菲+荧蒽的体系中MnP活力最小,为57.4 U/L;蒽+荧蒽的体系中MnP活力为68.2 U/L。与单一PAHs降解体系相比,复合PAHs降解体系中MnP活力均有所下降,但MnP活力依然是在3–7 d均呈上升趋势,并在第7天达到峰值,在第9天后迅速下降。
2.3 生物降解过程中代谢途径的分析 通过对I. lacteus F17降解PAHs中间产物的GC-MS分析发现,在菲的降解过程中产生了大量的2-(3-羧基-3-氧代-1-丙烯基)苯甲酸(图 3-A)和4-(2-羟基-苯基)-2-氧代-3-丁烯酸(图 3-B)。在蒽的降解过程中出现了较多的中间产物9, 10蒽醌(图 3-C)和邻苯二甲酸(图 3-D)。而对荧蒽的降解,其质谱分析表明较多的1-苯基萘(图 3-E)和对苯二甲酸(图 3-F)出现在降解过程中。
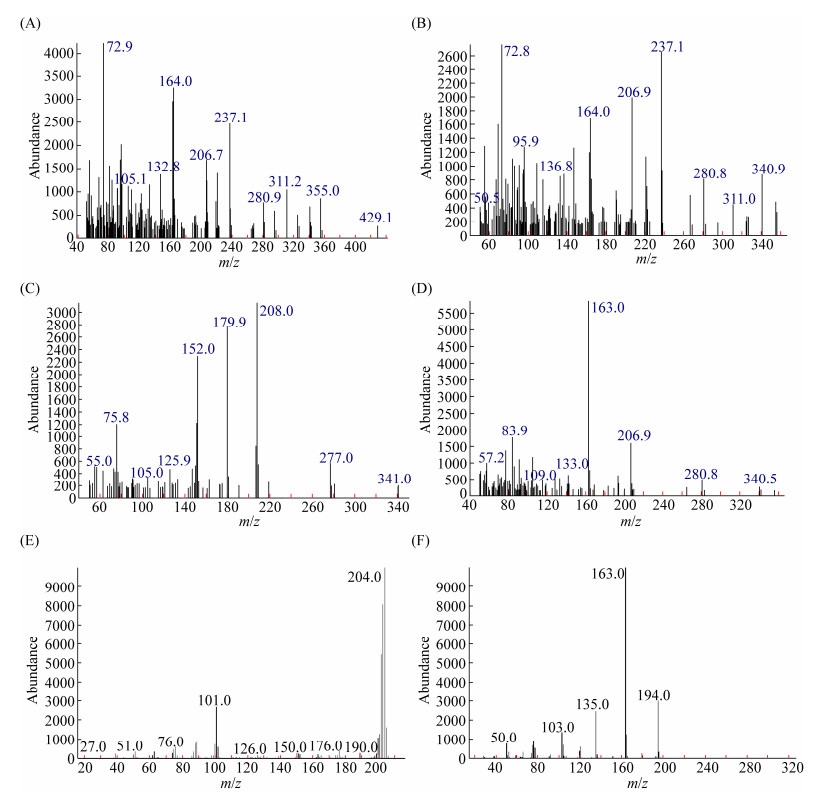 |
| 图 3 菲、蒽、荧蒽的代谢产物图谱 Figure 3 Mass spectrogram of metabolic production of phenanthrene, anthracene and fluoranthene. A: 2-(3-carboxy-3-oxo-propenyl)-benzoic acid; B: 4-(2-hydroxy-phenyl)-2-oxo-3-crotonic acid; C: 9, 10-anthraquinone; D: phthalic acid; E: 1-phenylnaphthalene; F: 1, 4-dicarboxybenzene. |
| 图选项 |
根据质谱图推测,菲首先在双加氧酶的催化作用下生成1, 2-菲二酚,然后转化成1-羟基-2-萘甲酸,接着按照不同的途径进行降解。途径一是经过2-(3-羧基-3-氧代-1-丙烯基)苯甲酸转化为邻苯二甲酸,然后进入TCA循环进行下一步转化;途径二是经过4-(2-羟基-苯基)-2-氧代-3-丁烯酸转化为邻苯二酚,然后进入TCA循环进行下一步转化(图 4-A)。蒽首先在9, 10位氧化为双氢二醇,然后9, 10位经脱氢酶作用氧化为双羟基蒽,进一步转化成9, 10蒽醌,经多次酶促反应之后9, 10蒽醌转化为邻苯二甲酸,后者进入TCA循环进行下一步转化(图 4-B)。荧蒽通过一系列的酶促反应,首先通过环裂解依次生成1-苯基萘和对苯二甲酸,然后对苯二甲酸进入TCA循环进行下一步转化(图 4-C)。
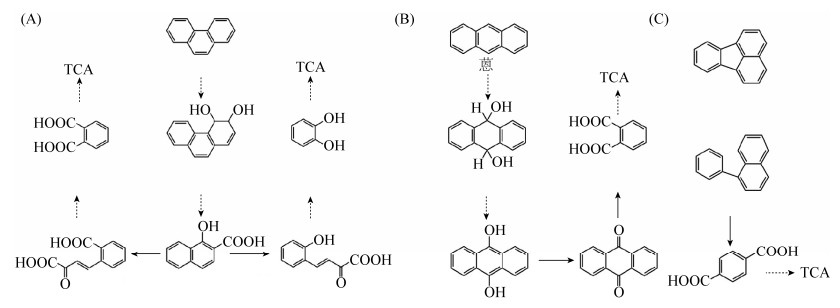 |
| 图 4 PAHs的降解途径 Figure 4 Metabolic pathways of PAHs. A: metabolic pathways of phenanthrene; B: metabolic pathways of anthracene; C: metabolic pathways of fluoranthene. |
| 图选项 |
3 讨论 单一PAHs的研究结果表明,PAHs的降解效果与PAHs的分子结构有着密切的关系,PAHs的水溶性以及生物毒性等因素对PAHs的生物降解也有一定的影响。蒽和菲均为含3个芳环的稠环化合物,蒽的结构特点是3个环并列在一条直线上,是呈线性结构的无极性分子,而菲的3个苯环“弯”并,是有极性的非线性分子。通常角性分子比线性分子在水中的溶解性要好,比如菲在水中的溶解度是蒽的溶解度的20倍[26]。由于水溶性较好的多环芳烃更容易被微生物所利用,其氧化代谢的速率也越快,因此PAHs的水溶性很可能是复合污染物降解的重要限制因子。三种PAHs的水溶性大小为:菲 > 荧蒽 > 蒽,因此当菲和蒽或荧蒽共存时,微生物优先降解菲。有研究表明[27],随着PAHs结构中苯环数目的增加,PAHs的毒性和疏水性也随之增强,而微生物对其降解能力则随之降低。荧蒽比菲和蒽多一个苯环,因此在相同条件下荧蒽更难被微生物代谢转化,在三者中其降解率最低。杜丽娜等[26]对青顶拟多孔菌降解蒽、菲、芘的特性进行了研究,实验结果表明该菌对菲的降解作用最强,其次是蒽,最后是毒性较强的四环化合物芘。但也有研究结果显示[18],在一定条件下,PAHs生物降解的难易程度为蒽 > 菲 > 荧蒽,这可能与降解条件和生物转化环境有关。
对PAHs的降解动力学研究结果显示,菲的降解速率最快,其次是蒽,最慢的是荧蒽。巩春娟等[28]研究发现,1株耐冷高山被孢霉对土壤中的菲、芘和苯并芘的降解速率从大到小的顺序为菲 > 芘 > 苯并芘,表明水溶性好的PAHs降解得快,低环PAHs比高环PAHs降解得更快,与本实验得出的结论是一致的。由于降解酶大多是水溶性的,因此水溶性好的PAHs更容易被微生物优先代谢转化。然而如果PAHs疏水性较强,那么底物的水溶性及其分子结构的复杂性均会对其降解性能起决定性作用。同时,由于PAHs的生物降解过程是逐步进行的,因此环数越多开环降解所需时间越长,反应速率越慢。
本研究发现,I. lacteus F17对复合PAHs的降解比单一PAHs的降解更为复杂,不同的PAHs分子之间在生物降解过程中表现出了竞争的特点。对(菲+蒽)和(菲+荧蒽)这两个体系,由于菲的水溶性和极性较大而表现出了较强的竞争力,因而蒽或荧蒽的加入并不会对菲的生物降解产生显著影响。在(荧蒽+蒽)体系中,虽然蒽和荧蒽的水溶性均较差,但蒽比荧蒽少一个苯环,微生物更易于对其进行转化。研究共存体系中的生物降解,对PAHs的分子大小、水溶性以及生物毒性需加以综合考虑。此外,由于I. lacteus F17是一类典型的白腐真菌,所分泌的胞外氧化酶对木质素以及多种芳香化合物具有广谱的降解作用,表现出了良好的非特异性[29-30],而在一定条件下I. lacteus F17所分泌的降解酶的量是一定的,这可能是造成复合PAHs降解过程中竞争现象的原因之一。刘芳等[31]在研究降解菌LD29同时降解菲、荧蒽、芘的过程中发现,蒽在共存体系中的降解率比单一体系时的降解率降低约57.0%,与本研究的结论相同。刘芳等还发现,低分子量的蒽促进了高分子量的荧蒽的生物降解,但由于所用菌种以及降解条件不同,在本研究中未观察到此现象。
MnP和LiP是木质素降解酶系中两种主要的过氧化物酶,依靠氧化还原反应对有机污染物进行降解和矿化。研究表明,I. lacteus F17在染料脱色降解体系中的产酶以MnP为主,只有少量的LiP,而不分泌Lac[23, 32]。本文的研究表明,I. lacteus F17在PAHs降解体系中的产酶也是以MnP为主,只有少量的LiP和Lac。对于单一PAHs和复合PAHs降解体系而言,MnP活力均在第3–7天呈上升趋势,并在第7天达到峰值,但与单一PAHs降解体系相比,复合PAHs降解体系的MnP活力均有所下降。MnP是在白腐真菌次生代谢过程中合成的,而分析不同降解体系中I. lacteus F17的生长特征发现,复合PAHs降解体系中的生物量均小于单一PAHs降解体系中的生物量,表明复合降解体系中PAHs总量的增大对微生物的生长产生了不利影响,进而影响了降解酶的合成。综合I. lacteus F17在不同降解体系中的生长特征和MnP的合成情况,不难发现,当I. lacteus F17生物量和MnP活力均处于较高水平时,PAHs的降解率或达到最高,或开始迅速增大。
通过对菲、蒽和荧蒽代谢产物及代谢途径的分析,证实了3种PAHs在I. lacteus F17的作用下均发生了生物降解,同时也表明,PAHs分子结构及特性的不同导致了降解途径的不同。
4 结论 在单一PAHs体系中,当菲、蒽、荧蒽初始浓度为10 mg/L时,在第15天时I. lacteus F17对3种PAHs的降解率分别达到97.8%、89.3%和81.5%,表明该白腐真菌对菲的生物降解能力最强,其次是蒽,对含有4个苯环的荧蒽降解能力最弱。动力学拟合的结果表明,菲、蒽和荧蒽的生物降解过程表现出了准一级反应动力学的特征,降解速率从大到小的顺序为菲 > 蒽 > 荧蒽。
在单一PAHs和复合PAHs的降解过程中,I. lacteus F17的生长和MnP的合成均表现出不同的特征,而这两方面是决定PAHs降解效果的主要因素。在不同的复合PAHs体系中,I. lacteus F17对共存PAHs的降解表现出不同的特点。蒽和荧蒽的存在对菲的降解无显著影响,然而菲或荧蒽的存在对蒽的降解则产生抑制效应,而且由于荧蒽的生物毒性,其对蒽的抑制作用表现得更显著。菲或蒽的存在对荧蒽的降解也有抑制作用,而且由于菲比蒽更容易被微生物利用,其对荧蒽的抑制作用表现得更显著。GC-MS分析表明,I. lacteus F17对菲、蒽和荧蒽具有降解作用,而且由于分子结构及特性的不同而具有不同的中间产物以及降解途径。
References
| [1] | Miao Y, Kong XS, Li CX. Distribution, sources, and toxicity assessment of polycyclic aromatic hydrocarbons in surface soils of a heavy industrial city, Liuzhou, China. Environmental Monitoring and Assessment, 2018, 190(3): 164-174. |
| [2] | Wu B, Zhang Y, Zhang XX, Cheng SP. Health risk assessment of polycyclic aromatic hydrocarbons in the source water and drinking water of China:quantitative analysis based on published monitoring data. Science of the Total Environment, 2011, 410-411: 112-118. DOI:10.1016/j.scitotenv.2011.09.046 |
| [3] | Vela N, Martínez-Menchón M, Navarro G, Pérez-Lucas G, Navarro S. Removal of polycyclic aromatic hydrocarbons (PAHs) from groundwater by heterogeneous photocatalysis under natural sunlight. Journal of Photochemistry and Photobiology A:Chemistry, 2012, 232: 32-40. DOI:10.1016/j.jphotochem.2012.02.003 |
| [4] | Dutta K, Shityakov S, Das PP, Ghosh C. Enhanced biodegradation of mixed PAHs by mutated naphthalene 1, 2-dioxygenase encoded by Pseudomonas putida strain KD6 isolated from petroleum refinery waste. 3 Biotech, 2017, 7(6): 365-375. DOI:10.1007/s13205-017-0940-1 |
| [5] | Meena SS, Sharma RS, Gupta P, Karmakar S, Aggarwal KK. Isolation and identification of Bacillus megaterium YB3 from an effluent contaminated site efficiently degrades pyrene. Journal of Basic Microbiology, 2016, 56(4): 369-378. DOI:10.1002/jobm.201500533 |
| [6] | Li JB, Zhang DY, Song MK, Jiang LF, Wang YJ, Luo CL, Zhang G. Novel bacteria capable of degrading phenanthrene in activated sludge revealed by stable-isotope probing coupled with high-throughput sequencing. Biodegradation, 2017, 28(5/6): 423-436. |
| [7] | Li X, Zhang XY, Zhou J, Song J, Wang JG, Yong XY, Jia HH. Degradation characteristics and metabolic pathway of a pyrene-degrading Pseudomonas aeruginosa strain. Environmental Science, 2018, 39(4): 1794-1803. (in Chinese) 李想, 张雪英, 周俊, 宋军, 王建刚, 雍晓雨, 贾红华. 1株铜绿假单胞菌对芘的降解特性及代谢途径. 环境科学, 2018, 39(4): 1794-1803. |
| [8] | Lin M, Hu XK, Chen WW, Wang H, Wang CY. Biodegradation of phenanthrene by Pseudomonas sp. BZ-3, isolated from crude oil contaminated soil. International Biodeterioration & Biodegradation, 2014, 94: 176-181. |
| [9] | Zhong Y, Luan TG, Lin L, Liu H, Tam NFY. Production of metabolites in the biodegradation of phenanthrene, fluoranthene and pyrene by the mixed culture of Mycobacterium sp. and Sphingomonas sp.. Bioresource Technology, 2011, 102(3): 2965-2972. DOI:10.1016/j.biortech.2010.09.113 |
| [10] | Roy M, Khara P, Dutta TK. meta-Cleavage of hydroxynaphthoic acids in the degradation of phenanthrene by Sphingobium sp. strain PNB. Microbiology, 2012, 158(3): 685-695. DOI:10.1099/mic.0.053363-0 |
| [11] | Li QX, Fan BQ, Gong MB, Yang H. Isolation, identification of a pyrene-degrading strain Mycobacterium sp. M11 and its degrading Characteristics. Environmental Science, 2008, 29(3): 763-768. (in Chinese) 李全霞, 范丙全, 龚明波, 杨惠. 降解芘的分枝杆菌M11的分离鉴定和降解特性. 环境科学, 2008, 29(3): 763-768. |
| [12] | Cheung PY, Kinkle BK. Mycobacterium diversity and pyrene mineralization in petroleum-contaminated soils. Applied and Environmental Microbiology, 2001, 67(5): 2222-2229. DOI:10.1128/AEM.67.5.2222-2229.2001 |
| [13] | Goswami L, Manikandan NA, Pakshirajan K, Pugazhenthi G. Simultaneous heavy metal removal and anthracene biodegradation by the oleaginous bacteria Rhodococcus opacus. 3 Biotech, 2017, 7(1): 37-45. |
| [14] | Ping LF, Zhang CR, Zhang CP, Zhu YH, He HM, Wu M, Tang T, Li Z, Zhao H. Isolation and characterization of pyrene and benzo. Applied Microbiology and Biotechnology, 2014, 98(8): 3819-3828. DOI:10.1007/s00253-013-5469-6 |
| [15] | Li CH, Ye C, Hou XP, Chen MH, Zheng XY, Cai XY. Isolation and characterization of polycyclic aromatic hydrocarbon-degrading bacteria with tolerance to hypoxic environments. Journal of Environmental Science and Health, Part A, 2017, 52(7): 581-589. DOI:10.1080/10934529.2017.1293991 |
| [16] | Liang L, Song XH, Kong J, Shen CH, Huang TW, Hu Z. Anaerobic biodegradation of high-molecular-weight polycyclic aromatic hydrocarbons by a facultative anaerobe Pseudomonas sp. JP1. Biodegradation, 2014, 25(6): 825-833. DOI:10.1007/s10532-014-9702-5 |
| [17] | Sun SS, Wei R, Ni JZ, Zhang H, Qian W, Yang LM. Sorption and biodegradation characteristics of pyrene by a PAH degradation fungus Fusarium solani. Acta Scientiae Circumstantiae, 2016, 36(7): 2408-2414. (in Chinese) 孙姗姗, 魏然, 倪进治, 张红, 钱伟, 杨柳明. 多环芳烃降解真菌Fusarium solani对芘的吸收存储和降解特性研究. 环境科学学报, 2016, 36(7): 2408-2414. |
| [18] | Birolli WG, De A Santos D, Alvarenga N, Garcia ACFS, Rom?o LPC, Porto ALM. Biodegradation of anthracene and several PAHs by the marine-derived fungus Cladosporium sp. CBMAI 1237. Marine Pollution Bulletin, 2018, 129(2): 525-533. DOI:10.1016/j.marpolbul.2017.10.023 |
| [19] | Faraco V, Pezzella C, Miele A, Giardina P, Sannia G. Bio-remediation of colored industrial wastewaters by the white-rot fungi Phanerochaete chrysosporium and Pleurotus ostreatus and their enzymes. Biodegradation, 2009, 20(2): 209-220. DOI:10.1007/s10532-008-9214-2 |
| [20] | Chen AW, Zeng GM, Chen GQ, Fan JQ, Zou ZJ, Li H, Hu XJ, Long F. Simultaneous cadmium removal and 2, 4-dichlorophenol degradation from aqueous solutions by Phanerochaete chrysosporium. Applied Microbiology and Biotechnology, 2011, 91(3): 811-821. |
| [21] | Zhao XS, Huang XJ, Yao JT, Zhou Y, Jia R. Fungal growth and manganese peroxidase production in a deep tray solid-state bioreactor, and in vitro decolorization of poly R-478 by MnP. Journal of Microbiology and Biotechnology, 2015, 25(6): 803-813. DOI:10.4014/jmb.1410.10054 |
| [22] | Chen JY, Shen YY, Li XZ. Removal of cadmium and anthracene by white rot fungi Ganoderma sinensis. Chinese Journal of Environmental Engineering, 2016, 10(2): 787-791. (in Chinese) 陈金媛, 沈洋洋, 李烜桢. 白腐真菌Ganoderma sinense对镉和蒽的去除能力. 环境工程学报, 2016, 10(2): 787-791. |
| [23] | Chen WT, Zheng LL, Jia R, Wang N. Cloning and expression of a new manganese peroxidase from Irpex lacteus F17 and its application in decolorization of reactive black 5. Process Biochemistry, 2015, 50(11): 1748-1759. DOI:10.1016/j.procbio.2015.07.009 |
| [24] | Wu J, Zuo SS. Characteristics of glycolipids biosurfactant and its enhancement role in the biodegradation of anthracene by white rot fungi. Microbiology China, 2017, 44(6): 1286-1294. (in Chinese) 吴涓, 左珊珊. 糖脂类生物表面活性剂的特性及其对白腐真菌降解蒽的强化作用. 微生物学通报, 2017, 44(6): 1286-1294. |
| [25] | Hadibarata T, Khudhair AB, Salim MR. Breakdown products in the metabolic pathway of anthracene degradation by a ligninolytic fungus Polyporus sp. S133. Water, Air, & Soil Pollution, 2012, 223(5): 2201-2208. |
| [26] | Du LN, Gao DW. Degradation characteristics of single and mixed PAHs by Polyporellus picipes. China Environmental Science, 2011, 31(2): 277-282. (in Chinese) 杜丽娜, 高大文. 青顶拟多孔菌对单一和复合多环芳烃的降解特性. 中国环境科学, 2011, 31(2): 277-282. |
| [27] | Gupta S, Pathak B, Fulekar MH. Molecular approaches for biodegradation of polycyclic aromatic hydrocarbon compounds:a review. Reviews in Environmental Science and Bio/Technology, 2015, 14(2): 241-269. DOI:10.1007/s11157-014-9353-3 |
| [28] | Gong CJ, Su D, Pu Y, Wang X. Degradation and kinetics of PAHs in contaminated soil by microbial consortia tolerant to low temperature. Environmental Engineering, 2018, 36(S1): 752-756. (in Chinese) 巩春娟, 苏丹, 普聿, 王鑫. 耐低温混合菌对土壤中PAHs的降解及其动力学. 环境工程, 2018, 36(S1): 752-756. |
| [29] | Baborová P, M?der M, Baldrian P, Cajthamlová K, Cajthaml T. Purification of a new manganese peroxidase of the white-rot fungus Irpex lacteus, and degradation of polycyclic aromatic hydrocarbons by the enzyme. Research in Microbiology, 2006, 157(3): 248-253. DOI:10.1016/j.resmic.2005.09.001 |
| [30] | Mohammadi A, Nasernejad B. Enzymatic degradation of anthracene by the white rot fungus Phanerochaete chrysosporium immobilized on sugarcane bagasse. Journal of Hazardous Materials, 2009, 161(1): 534-537. DOI:10.1016/j.jhazmat.2008.03.132 |
| [31] | Liu F, Liang JS, Sun Y, Guo YB, Li QX, Li J. Isolation and degradation characteristics of a HMW PAHs-degrading strain LD29. Environmental Science, 2011, 32(6): 1799-1804. (in Chinese) 刘芳, 梁金松, 孙英, 郭岩彬, 李庆孝, 李季. 高分子量多环芳烃降解菌LD29的筛选及降解特性研究. 环境科学, 2011, 32(6): 1799-1804. |
| [32] | Yang XT, Zheng JZ, Lu YM, Jia R. Degradation and detoxification of the triphenylmethane dye malachite green catalyzed by crude manganese peroxidase from Irpex lacteus F17. Environmental Science and Pollution Research, 2016, 23(10): 9585-9597. DOI:10.1007/s11356-016-6164-9 |
