姜顺, 郝少华, 向腊, 宋俐, 周玉玲, 蒋思婧

 , 张桂敏
, 张桂敏

湖北大学生命科学学院, 湖北省生物资源绿色转化协同创新中心, 省部共建生物催化与酶工程国家重点实验室, 湖北 武汉 430062
收稿日期:2019-03-09;修回日期:2019-05-13;网络出版日期:2017-10-17
基金项目:国家重点研发计划(2017YFD0501506);湖北省技术创新专项重大项目子课题(2018ABA113);2016武汉黄鹤英才人才项目
*通信作者:蒋思婧, Tel:+86-27-88663882, E-mail:jiangsijing@hubu.edu.cn;
张桂敏, Tel:+86-27-88663882, E-mail:zhangguimin@hubu.edu.cn, zhangguimin6@hotmail.com.
摘要:β-N-乙酰氨基葡萄糖苷酶作用于肽聚糖或几丁质,从其非还原末端水解产生β-D-N-乙酰氨基葡萄糖单体,该酶在细胞壁代谢过程中起重要作用,在医药和生物技术领域也有广泛的应用。[目的] 克隆表达来源于兼性嗜碱菌Bacillus pseudofirmus 703的β-N-乙酰葡糖胺糖苷酶NagZ703,为获得乙酰氨基葡萄糖单体奠定基础。[方法] 以B.pseudofirmus 703基因组DNA为模板,克隆得到了β-N-乙酰氨基葡萄糖苷酶基因NagZ703,通过构建pET28a-nagZ703表达载体,在大肠杆菌BL21(DE3)中诱导表达NagZ703,利用镍柱纯化得到NagZ703纯蛋白,并对其酶学和生化性质进行分析。[结果] NagZ703与其同源蛋白多序列比对分析结果表明,NagZ703属于糖苷水解酶3家族(GH3),由2个结构域构成,催化活性中心由位于N端结构域的Arg232-His234-Arg318组成,和研究最多的Bacillus subtilis 168来源的BsNagZ氨基酸的序列相似性为37%。酶学性质分析表明,以对硝基酚-β-乙酰氨基葡萄糖苷(pNP-β-GlcNAc)为底物,NagZ703的最适反应温度和pH分别为60℃和pH 6.5,比酶活为10.79 U/mg,其Km和Vmax分别为0.276 mmol/L和0.612 mmol/(mg·min)。该酶具有较好的稳定性,在50℃处理30 min,或在pH 6.0-10.5条件下,4℃保存12 h后,仍保留80%以上的酶活力。EDTA不影响该酶的活性,推测其为非金属依赖酶,且Hg2+可完全抑制酶活性。[结论] 本研究将兼性嗜碱菌Bacillus pseudofirmus 703来源的β-N-乙酰葡糖胺糖苷酶NagZ703在大肠杆菌中成功表达和纯化,并分析了其酶学性质;NagZ703的最适pH为6.5,没有表现出耐盐嗜碱的特征;NagZ703能水解胶体几丁质产生GlcNAc,为酶解生产GlcNAc提供了一条可行的思路。
关键词:β-N-乙酰氨基葡萄糖苷酶多序列比对异源表达酶学性质分析乙酰氨基葡萄糖
A new N-acetylglucosaminidase from facultative alkaliphilic Bacillus pseudofirmus 703
Shun Jiang, Shaohua Hao, La Xiang, Li Song, Yuling Zhou, Sijing Jiang

 , Guimin Zhang
, Guimin Zhang

State Key Laboratory of Biocatalysis and Enzyme Engineering, Hubei Collaborative Innovation Center for Green Transformation of Bio-Resources, School of Life Sciences, Hubei University, Wuhan 430062, Hubei Province, China
Received: 9 March 2019; Revised: 13 May 2019; Published online: 17 October 2017
*Corresponding author: Sijing Jiang, Tel: +86-27-88663882, E-mail: jiangsijing@hubu.edu.cn;
Guimin Zhang, Tel: +86-27-88663882, E-mail: zhangguimin@hubu.edu.cn, zhangguimin6@hotmail.com.
Foundation item: Supported by the National Key R & D Program (2017YFD0501506), by the Technical Innovation Program of Hubei Province (2018ABA113) and by the 2016 Wuhan Yellow Crane Talents (Science) Program
Abstract: β-N-acetylglucosaminidases (NAGases) participate in the removal of N-acetylglucosamine (GlcNAc) from the non-reducing end of peptidoglycan or chitin, and are important for many biological functions and industrial applications. [Objective] A new NAGase encoding gene NagZ703 was cloned from a facultative alkaliphilic Bacillus pseudofirmus and expressed in Escherichia coli, for the enzymatic production of GlcNAc. [Methods] The gene NagZ703 was cloned into the expression vector pET28a to get the recombinant plasmid pET28a-NagZ703. The recombinant NagZ703 was induced for expression in E. coli BL21 (DE3) and purified through His-Trap column. Then the purified NagZ703 was characterized. [Results] The multiple sequence alignments showed that NagZ703 belonged to GH 3 NAGase with 2 domains, and the catalytic active sites were composed of 3 conserved residues (Arg232, His234 and Arg318) at the N-terminal domain. NagZ703 shared only 37% identity with the most studied BsNagZ from B. subtilis. The purified NagZ703 exhibited optimal activity at 60℃ and pH 6.5, the specific activity was 10.79 U/mg, and the Km and Vmax of NagZ703 were 0.276 mmol/L and 0.612 mmol/(mg·min) toward p-nitrophenyl β-N-acetylglucosaminide, respectively. NagZ703 retained more than 80% residual activity after pre-incubation at 50℃ for 30 min, or at pH 6.0-10.5 for 12 h. NagZ703 was a non-metalloenzyme because EDTA could not affect its activity, whereas Hg2+ completely inhibited its activity. NagZ703 hydrolyzed colloidal chitin to produce GlcNAc in vitro. [Conclusion] A NAGaseNagZ703 from facultative alkaliphilic Bacillus pseudofirmus was characterized carefully. The ability of NagZ703 to produce GlcNAc from colloidal chitin provided a promising approach for the production of GlcNAc by enzymatic hydrolysis.
Keywords: β-N-acetylglucosaminidasesmultiple sequence alignmentheterologous expressionenzymatic assayGlcNAc
几丁质是由N-乙酰-β-D氨基葡萄糖(GlcNAc)单体通过β-1, 4糖苷键连接而成的聚合物,是地球上仅次于木质纤维素的第二大类可再生多糖资源,在虾、蟹和昆虫壳体、真菌以及藻类中含量特别丰富[1],每年海产品产生的几丁质就超过了8万t[2]。氨基葡萄糖(GlcN)和乙酰氨基葡萄糖(GlcNAc)是形成软骨细胞的重要营养素,是健康关节软骨的天然组织成分;能促进人体粘多糖的合成、提高关节滑液的粘性、改善关节软骨,并能刺激软骨细胞的生长,因此它被广泛用于治疗风湿性关节炎、骨质增生和半月板损伤等病症;它还具有促进抗生素注射效能的作用,可供糖尿病者作营养补助剂;GlcNAc能替代皮质醇治疗肠炎,对黑色素瘤、肺癌、肾癌等也有一定的疗效;可以添加于化妆品、饲料和食品中[3]。目前一般是通过酸水解几丁质来制备乙酰氨基葡萄糖单体,这种工艺酸碱用量大,对设备的腐蚀比较严重,副产物多,产品得率低,且废水排放量大,环境污染严重[4]。因此,迫切需要发展条件温和、产品纯度高和环境友好的酶法生物转化工艺。酶法水解几丁质制备GlcNAc需要内切几丁质酶(endochitinases,C 3.2.1.14)和N-乙酰-β-D-氨基葡萄糖苷酶(N-acetyl-β-D-glucosaminidase,C 3.2.1.30)[5]的协同作用。
内切几丁质酶随机水解几丁质内部的糖苷键,产生几丁寡糖,N-乙酰-β-D-氨基葡萄糖苷酶(NAGase)能从非还原端水解几丁寡糖、几丁二糖和胞壁肽等寡糖的O-糖苷键,产生N-乙酰氨基葡萄糖单体(GlcNAc)单体[6],因此,这两类酶组合可以用于GlcNAc的酶法生产。因为几丁质酶还可以用于医药、植物病害防治等方面,因此几丁质酶基因克隆表达获得几丁质酶的研究很多。是NAGase的研究主要集中在其胞内生理功能研究上,体外表达和表征的研究也越来越受到关注。
NAGases广泛存在于动植物和微生物中,在细胞中承担重要的生理功能,如参与细胞壁的代谢循环[7]。自上世纪70年代枯草芽孢杆菌来源的NAGases NagZ首次被分离纯化以来[8],从不同微生物体内均发现了NAGases,一系列细菌(如E. coli、Enterobacter sp.、Pseudomonas fluorescens、Streptomyces thermoviolaceus等)和真菌(如Rhizomucor miehei、Talaromyces emersonii等)来源的NAGases陆续被分离纯化,并对这些不同来源NAGases的酶学性质、底物特异性和催化机制都进行了研究,相应的编码基因也被克隆并进行异源表达[7, 9-10],积累了很多NAGases的基因和蛋白质序列信息,并对酶的蛋白质结构进行了表征[11]。氨基酸序列的同源比较分析显示,目前已发现的NAGases分别属于糖苷水解酶GH 3、20、73和84这4个家族(http://www.cazy.org/),其中,GH 3家族的NAGases成员最多。基因组测序的广泛使用提供了大量新的NAGases基因信息,这些NAGases的分子和生化性质尚需进一步通过实验来解析。
本课题组从湖北省天门市的水稻田土壤中分离得到的一株嗜碱菌假强芽孢杆菌Bacillus pseudofirmus 703[12],它与Bacillus pseudofirmus OF4的16S rDNA序列相似性为100%;而B. pseudofirmus OF4菌株的全基因组测序已完成,其基因组测序数据已上传至NCBI的基因组数据库中。全基因组的基因功能注释揭示了该基因组中有一个GH3的NAGase,目前关于B. pseudofirmus来源的NAGase还未见报道。因此,本研究以B. pseudofirmus 703为模板,得到NagZ703基因,实现了NagZ703在大肠杆菌细胞内的可溶性表达,并对纯化的重组酶NagZ703进行生化分析。
1 材料和方法 1.1 菌株和试剂
1.1.1 菌株: Escherichia coli XL10-Gold克隆菌株和BL21(DE3)表达菌株购自Transgene公司,B. pseudofirmus 703由本实验室筛选并保存。
1.1.2 质粒: pET28a购自Stratagene公司。
1.1.3 培养基: LB液体培养基:0.5%酵母提取物,1%蛋白胨,0.5% NaCl;LB固体培养基是在LB液体培养基的基础上添加1.5%琼脂。Horikoshi-I液体培养基:1%葡萄糖,0.5%酵母提取物,0.5%蛋白胨,0.1% K2HPO4,0.02% Mg2SO4?7H2O,1% Na2CO3。
1.1.4 酶: BamH I、Sal I等限制性内切酶、Solution I、Ex Taq酶均购自TaKaRa公司;
1.1.5 生化试剂: IPTG、对硝基酚-β-乙酰氨基葡萄糖苷(pNP-β-GlcNAc)购自Sigma公司,His Bind Kits购自Novagen公司,卡那霉素、质粒DNA抽提试剂盒、DNA凝胶回收试剂盒、Quick Start Bradford、标准牛血清白蛋白、SDS-PAGE检测试剂等其他常规试剂采用进口分装或国产分析纯产品。
1.2 引物 根据B. pseudofirmus OF4的β-N-乙酰葡糖胺糖苷酶的基因序列(GenBank收录号ADC51622.1)设计并合成一对扩增NagZ703的引物(表 1)。
表 1. 扩增NagZ703的引物序列 Table 1. Primer sequence used to amplify NagZ703
| Primer name | Primer sequence (5′→3′) | Size/bp |
| NagZ703 F | CGCGGATCCGATAACTCGCTTAAAGATCTTGTC (BamH I was underlined) | 33 |
| NagZ703 R | ACGCGTCGACTTAATAGTTCAAATAGTGGCCAA (Sal I was underlined) | 33 |
表选项
1.3 序列分析 用ClustalX软件,按默认参数进行多序列比对分析,分析结果用Espript导出[12],用SignalP 4.1Server(http://www.cbs.dtu.dk/services/SignalP)分析NagZ703有无信号肽序列。
1.4 NagZ703基因的获得 将B. pseudofirmus 703接入Horikoshi-I液体培养基中,37 ℃培养过夜,然后收集菌体,从中抽提出基因组DNA;以基因组DNA为模板、NagZ703 F/R为引物进行PCR扩增(反应条件为:94 ℃ 5 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 2 min 10 s,循环35次;72 ℃ 10 min),得到一个约2 kb的NagZ703基因片段;经琼脂糖凝胶电泳后,用DNA凝胶回收试剂盒回收该基因片段。
1.5 重组表达质体构建 将扩增得到的NagZ703片段分别用BamH I和Sal I进行酶切后,与经这两种酶消化的质粒载体pET28a连接;连接混合物转化E. coli XL 10-Gold后,涂布于添加了卡那霉素(终浓度50 μg/mL)的LB平板上,37 ℃培养12–16 h;挑取转化平板上的单菌落于3 mL添加了卡那霉素(终浓度50 μg/mL)的LB液体培养基中,37 ℃培养过夜,然后收集菌体,从中抽提质粒;经琼脂糖凝胶电泳筛选出比pET28a大的质粒,再用BamH I和Sal I对质粒进行酶切,琼脂糖凝胶电泳检测,产生了大小分别为2 kb和5.4 kb两个DNA片段的质粒初步判定为重组质粒pET28a-NagZ703,将该质粒送至公司测序分析。
1.6 NagZ703在大肠杆菌中的表达和纯化 将pET28a-NagZ703转入E. coli BL21 (DE3),获得了表达NAGase的E. coli工程菌;将该菌接入添加了卡那霉素的LB液体培养基中,37 ℃、200 r/min摇瓶培养至OD600为0.6时,加入IPTG (终浓度0.5 mmol/L),18 ℃诱导培养12 h。离心收集菌体,用PBS buffer重悬细胞后,超声波破碎细胞,然后离心收集细胞破碎上清液;用His Bind Kits纯化得到带His标签的NagZ703,用Amicon Ultracentricon超滤浓缩,随后对该酶进行脱盐处理,去除咪唑;整个纯化过程都在4 ℃进行。以牛血清白蛋白(BSA)作为标准品,采用Bradford法测定纯化过程中每步蛋白质的浓度。
1.7 酶活力和酶学性质分析 NAGase的酶活力以该酶水解对硝基酚-β-乙酰氨基葡萄糖苷(pNP-β-GlcNAc)底物后释放的4-硝基苯(pNP)的量来计算[13]。酶活力测定方法:取10 μL酶液,加入90 μL 0.5 mol/L的pNP-β-GlcNAc底物,在合适的条件下反应10 min,然后加入200 μL 0.2 mol/L Na2CO3终止反应,在405 nm检测反应物的吸光度。酶活力单位(1U)定义为:在适宜条件下,每分钟水解底物产生1 μmol的pNP所需的酶量。
最适温度和热稳定性的测定:在35–85 ℃的温度范围内、pH 6.0 (50 mmol/L的Na2HPO4- NaH2PO4缓冲液)条件下,测定NagZ703的酶活力,找出酶的最适反应温度;将NagZ703分别在45、50、55、60 ℃处理10、20、30、40 min,然后在最适条件下测定酶的残余活性,未处理NagZ703酶活力设定为100%。
最适pH和pH稳定性的测定:在pH 4.0–9.0 (50 mmol/L HAc-NaAc缓冲液,pH 4.0–5.5;50 mmol/L Na2HPO4-NaH2PO4缓冲液,pH 5.0–8.0;100 mmol/L的Tris-HCl,pH 8.0–9.5)范围内、60 ℃反应温度下,测定NagZ703的酶活力,找到最适反应pH。将NagZ703用不同的pH缓冲液(pH 4.0–5.5,50 mmol/L HAc-NaAc缓冲液;pH 5.0–8.0,50 mmol/L Na2HPO4-NaH2PO4缓冲液;pH 8.0–9.0,100 mmol/L的Tris-HCl;pH 9.5–10.5,50 mmol/L Glysine-NaOH)稀释后在4 ℃放置16 h,然后在最适条件下测定酶的残余活性,未处理NagZ703酶活力设定为100%。
1.8 金属离子对酶活性的影响 在酶解反应体系中分别加入终浓度为5 mmol/L不同的金属离子溶液,在最适反应条件下水解pNP-β-GlcNAc底物,然后测NagZ703的酶活力,以不加金属离子测得的酶活力为100%对照。
1.9 酶动力学参数的测定 以浓度分别为1、2、3、4、5、6、7、8 mmol/L的pNP-β-GlcNA为底物,酶浓度为0.36 mg/mL,在60 ℃、pH 6.5条件下反应,用酶标仪每隔15 s连续在OD405处测样品的吸光值;计算每个底物浓度下酶反应的初速度,然后用双倒数法作图。
1.10 胶体几丁质的酶解及产物检测 胶体几丁质的制备按照Hsu等的方法[14]进行,以胶体几丁质作为底物进行水解实验,250 μL 3%的胶体几丁质中加入150 μL NagZ703酶液(7 U/mL),在pH 6.5、温度50 ℃条件下水解2 h。
NagZ703联合几丁质酶来水解胶体几丁质:1 mL 2%的胶体几丁质溶液中,加入20 μL几丁质酶,在pH 6.0、温度37 ℃条件下水解1 h后,再加入100 μL NagZ703酶液(3 U/mL),50 ℃条件下继续水解1 h。
将酶解过后的样品高速离心,取上清进行HPLC(安捷伦高效液相色谱站)检测,样品进样量为20 μL,流动相为70%乙腈(乙腈:水=70:30,V/V),检测流速为0.5 mL/min,检测温度为30 ℃,检测波长为190 nm。
2 结果和分析 2.1 NagZ703保守结构域和催化活性中心的分析 序列分析显示NagZ703属于糖苷水解酶3家族的水解酶,N端含有29个氨基酸组成的信号肽;为了预测其保守的结构域和催化活性中心,NagZ703与一致性较高、大小比较相似且已经分析了生化性质的4个NAGase (来源于B. subtilis 168、Cellulomonas fimi、Streptomyces thermoviolaceus、Alteromonas sp. strain O-7,GenBank收录号分别为CAB11942.1、AF478460.1、AB00877.1、D17399.1,一致性分别为36.97%、20.64%、28.45%、25.46%)进行多序列氨基酸同源比对(图 1)。并以解析了三维结构的B. subtilis NagZ (BsNagZ)为模板,分析这4个不同来源的NAGase的结构特征,结果发现4个酶所含α螺旋和β折叠的数量和位置极为类似,这表明NagZ703与糖苷水解酶3家族乙酰葡萄糖胺酶亚家族的结构相似,有2个独立的结构域,N端由(β/α)8形成桶状催化结构域,C端结构域是由αβα形成的三明治结构;N端具有高度保守的KH(F/I)PG(H/L)GX(4)D(S/T)H的序列,识别底物的乙酰氨基基团,而其中第232位的天冬氨酸(D)和第234位的组氨酸(H)构成催化二联体,这2个位点和318位天冬氨酸(D)构成酶的催化活性中心,这是β-N-乙酰葡糖胺糖苷酶典型特征。
 |
| 图 1 NagZ703与GH3家族的β-N-乙酰葡糖胺糖苷酶的氨基酸序列比对分析 Figure 1 Multiple sequences alignments of NagZ703 with GH3 GlcNAcases. Secondary structure elements are presented on top: α helices with squiggles, β strands with arrows, η strands with random coil. Strictly conserved residues are indicated in white letters on a black background. The conserved regions are shown in black boxes. The residues equivalent to the putative catalytic dyad are indicated by a solid triangle, which constitute the catalytic active site with the third residue marked by a hollow triangle. These residues are believed to play a vitally important role in the reaction of NagZ703 with its substrates. |
| 图选项 |
2.2 NagZ703基因的克隆和重组质粒的构建 通过PCR,从B. pseudofirmus 703基因组中扩增得到去除了信号肽序列、长2013 bp的β-N-乙酰葡糖胺糖苷酶基因NagZ703,将该基因克隆至表达载体pET28a的BamH I和Sal I位点之间,得到重组质粒pET28a-NagZ703;测序结果表明NagZ基因和表达载体上N端的HIS标签正确融合。
2.3 NagZ703在大肠杆菌中的表达及纯化 将pET28a-NagZ703质粒转化E. coli BL21 (DE3),获得了重组表达菌株E. coli BL21(DE3)/ pET28a-NagZ703,用0.5 mmol/L的IPTG诱导,实现了NagZ703在大肠杆菌细胞内可溶性表达;超声波破碎细胞后,细胞裂解液经Ni柱纯化,得到纯的NagZ703,然后对纯化的酶进行脱盐处理。SDS-PAGE分析显示纯化的蛋白质是大约73 kDa单一分子(图 2),与预测的分子量大小一致;对纯化过程每一步得到的NagZ703的酶活力也进行了分析,结果表明酶在纯化过程中是稳定的(表 2)。
 |
| 图 2 表达和纯化的NagZ703的SDS-PAGE分析 Figure 2 SDS-PAGE analysis of the recombinant NagZ703 at each purification step. Samples were resolved on a 12% polyacrylamide gel and then stained with Coomassie Blue R-250. M: Protein marker; 1: Lysate supernatant of of induced E. coli BL21(DE3)/ pET28a-NagZ703 cells; 2: Purification of NagZ703 on Ni–NTA affinity column; 3: Purification of NagZ703 on desalting column. |
| 图选项 |
表 2. 重组NagZ703蛋白纯化表 Table 2. Purification of recombinant NagZ703
| Purification | Total protein/mg | Total activity/U | Specific activity/(U/mg) | Purified fold | Recovery rate/% |
| Crude enzyme | 36.03 | 150.56 | 4.18 | 1.00 | 100.00 |
| Ni-column | 12.13 | 121.96 | 10.05 | 2.40 | 81.00 |
| Desalting column | 9.51 | 102.60 | 10.79 | 2.58 | 68.15 |
表选项
2.4 NagZ703酶学性质的研究
2.4.1 温度对NagZ703活性及稳定性的影响: 在30–85 ℃的温度范围内,测定NagZ703对底物pNP-β-GlcNAc的活性,结果显示,酶的最适作用温度是60 ℃ (图 3-A),在50–65 ℃温度范围内,NagZ703能表现出80%以上的相对活性,当反应温度高于70 ℃时酶活性迅速下降。NagZ703的热稳定性分析结果显示,在50 ℃下处理30 min后,NagZ703仍保留了接近80%的残余酶活力,而在55 ℃处理30 min后,残余酶活力降至40%以下(图 3-B)。
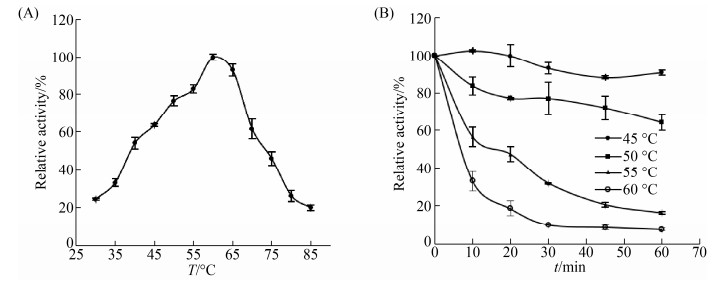 |
| 图 3 反应温度对NagZ703酶活性和稳定性的影响 Figure 3 Effects of temperature on the activity and stability of NagZ703. A: Effects of temperature on the activity of NagZ703. To determine the optimal temperature of NagZ703, the reaction was conducted from 30 ℃ to 85 ℃ in 50 mmol/L Na2HPO4-NaH2PO4 (pH 6.0). B: Effect of temperature on the stability of NagZ703. The thermal stability of NagZ703 was determined at the indicated temperature in 50 mmol/L Na2HPO4-NaH2PO4 (pH 6.0) for 10, 20, 30 and 40 min. After pre-incubation, the residual activity of NagZ703 was measured at pH 6.0 and 60 ℃. Each value of the assay was the arithmetic mean of triplicate measurements. |
| 图选项 |
2.4.2 pH对NagZ703活性及稳定性的影响: 不同pH值的缓冲液对NagZ703的活性有很大的影响,其最适反应pH为6.5,在pH 5.5–7.0展现出50%以上相对活性(图 4-A),当pH低于5.5或高于7.5时,酶活力迅速下降。pH稳定性分析表明:NagZ703在pH 6.0–10.5内都很稳定,在此pH范围内,4 ℃保存12 h后,该酶仍保持80%以上的残余活力;当pH降到5以下时,该酶丧失大部分活性(图 4-B)。
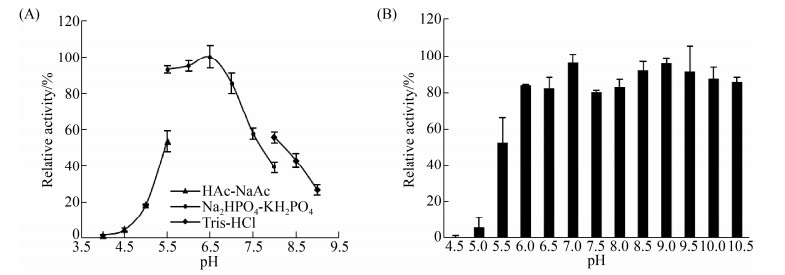 |
| 图 4 pH对NagZ703酶活性和稳定性的影响 Figure 4 Effects of pH values on the activity and stability of NagZ703. A: Effects of pH on the activity of NagZ703. The reaction was conducted at 60 ℃ in different buffers: HAc-NaAc (pH 4.0–5.5), Na2HPO4-NaH2PO4 (pH 5.0–8.0), Tris-HCl (pH 8.0–9.5). B: Effects of pH on the stability of NagZ703. The stability of NagZ703 was determined at different pH values ranging from 4.0 to 10.5 (pH 4.0–5.5, HAc-NaAc; pH 5.0–8.0, Na2HPO4-NaH2PO4; pH 8.0–9.0, Tris-HCl; pH 9.5–10.5, Glysine-NaOH) at 4 ℃ for 12 h. After pre-incubation, the residual activity was measured at pH 6.5 and 60 ℃. Each value of the assay was the arithmetic mean of triplicate measurements. |
| 图选项 |
2.4.3 金属离子对NagZ703活性的影响: β-N-乙酰葡糖胺糖苷酶是非金属依赖酶,EDTA对酶活性没有明显的影响;不同金属离子对重组酶NagZ活性的影响见表 3,除Mg2+外,很多二价金属离子对酶活性都有抑制,其中Cu2+、Zn2+和Ni2+均使酶丧失了80%以上的活性,而Hg2+完全抑制了NagZ703的酶活力;甲醛也使NagZ703几乎完全丧失了酶活力(表 3)。
表 3. 金属离子和化学试剂对NagZ703活性的影响 Table 3. Effects of metal ions and chemical reagents on the activity of NagZ703
| Metal ions or chemical reagents | Concentration/(mmol/L) | Relative activity/% |
| No addition | 0 | 100±2.16 |
| Li+ (LiCl) | 5 | 105.13±8.50 |
| Na+ (NaCl) | 5 | 101.14±2.00 |
| K+ (KCl) | 5 | 100.30±3.19 |
| Mg2+ (MgCl2) | 5 | 91.86±0.73 |
| Ca2+ (CaCl2) | 5 | 54.22±0.35 |
| Mn2+(Mn2SO4) | 5 | 75.76±3.49 |
| Cu2+ (Cu2SO4) | 5 | 9.69±4.72 |
| Co2+ (CoCl2) | 5 | 56.03±3.10 |
| Hg2+ (HgCl2) | 5 | 0.05±2.2 |
| Ni2+ (Ni2SO4) | 5 | 7.06±0.47 |
| Zn2+ (ZnCl2) | 5 | 18.4±3.77 |
| Fe3+ (FeCl3) | 5 | 61.08±4.86 |
| EDTA | 5 | 102.52±11.17 |
| Methanol | 5 | 75.72±3.35 |
| Alcohol | 5 | 73.81±2.84 |
| Glycerine | 5 | 66.52±2.50 |
| Formaldehyde | 5 | 4.09±0.22 |
| DMSO | 5 | 102.94±2.10 |
| Acetone | 5 | 82.04±3.64 |
表选项
2.4.4 NagZ703的酶动力学: 控制pNP-β-GlcNA底物浓度分别为1、2、3、4、5、6、7、8 mmol/L,测定不同底物浓度下酶反应的初速度,采用双倒数法作图(图 5),并计算得到Km和Vmax的值分别为0.276 mmol/L和0.612 mmol/(mg·min)。
 |
| 图 5 NagZ703的酶动力学参数 Figure 5 Kinetic parameters of recombinant NagZ703. |
| 图选项 |
2.5 NagZ703水解胶体几丁质产生GlcNAc 酶解胶体几丁质后,通过HPLC分析酶解产物(图 6),以N-乙酰氨基葡萄糖(GlcNAc)和N-N′-乙酰氨基壳二糖(GlcNAc2)作为标准品(图 6-A),发现酶解有少量的GlcNAc产生(图 6-B)。这说明NagZ703确实可以从胶体几丁质末端水解其糖苷键,生成单糖;由于β-N-乙酰氨基葡萄糖苷酶只能从非还原端逐次切下单糖单元,而且底物的乙酰程度会影响酶反应,因此仅用β-N-乙酰葡糖胺糖苷酶水解几丁质的水解效率十分低下。
为了提高水解效率,我们先用本实验室表达的几丁质二糖酶ChiA3来水解胶体几丁质,然后再加入NagZ703继续酶解。HPLC分析水解产物后发现,几丁质酶可以先将胶体几丁质水解成GlcNAc2 (图 6-C),然后在NagZ703的作用下,GlcNAc2逐渐被水解成GlcNAc单糖,随着水解时间增加,单糖的产量也逐步提高,1 h后,二糖被完全水解成单糖(图 6-D–F),这表明NagZ703的确具有β-N-乙酰氨基葡萄糖苷酶活性。
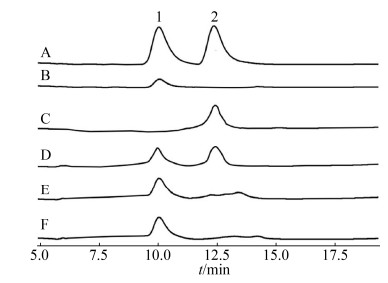 |
| 图 6 NagZ703的水解产物分析 Figure 6 Enzymatic production of GlcNAc by NagZ703. A: Standard of GlcNAc (peak 1) and N, N′-Diacetylchitobiose (peak 2). B: The hydrolysis product of colloidal chitin by recombinant NagZ703. C: The hydrolysis product of colloidal chitin by ChiA3 for 1 h. D–F: The hydrolysis product of colloidal chitin by ChiA3 for 1 h and then recombinant NagZ703 for 20, 40, 60 min. |
| 图选项 |
3 讨论 近些年,因为能适应特殊环境,耐盐碱的酶受到了广泛的关注。本实验室从分离得到的一株嗜碱芽孢杆菌B. pseudofirmus 703中获得了一种碱性淀粉酶Amy703,该酶在pH 9.0时表现出最佳反应活性[12],这个性质使得它在纺织业有良好的应用前景。芽孢杆菌属的细菌能产生多种多糖水解酶,是否该菌株产生的多糖水解酶都具有耐碱性的特点呢?我们分析了NCBI基因组数据库中公布的B. pseudofirmus OF4菌株的全基因组序列,发现了一个假定的GH3家族的β-N-乙酰氨基葡萄糖苷酶的编码基因NagZ703,其编码的蛋白NagZ703与枯草芽孢杆菌来源的BsNagZ序列相似性为37%。GH3家族的β-N-乙酰氨基葡萄糖苷酶有两类,一类比较小,只有一个结构域——N端结构域,而另一类比较大,除了N端结构域外,还有一个C端结构域,这两类酶的N端结构域均有能识别底物中乙酰氨基基团的保守序列[11]。利用BLAST将该基因编码的蛋白质与已解析过结构的β-N-乙酰氨基葡萄糖苷酶BsNagZ进行氨基酸序列比对,比对结果显示,虽然氨基酸序列一致性不高,但NagZ703与BsNagZ一样,有2个结构域,其N端有保守的乙酰氨基基团的底物识别序列KH(F)PG(H)GX(4)D(S)H (图 1),该序列中精氨酸D和组氨酸H能组成催化二联体,而318位也存在一个精氨酸D,这3个氨基酸形成了一个典型的β-N-乙酰氨基葡萄糖苷酶的“D-H-D”催化活性中心,这也是NagZ703被判断为β-N-乙酰氨基葡萄糖苷酶编码基因的依据。因此,本研究克隆了B. pseudofirmus 703来源的这个NagZ703基因,并在大肠杆菌中实现了可溶性表达NagZ703。
由于NagZ703与枯草芽孢杆菌来源的BsNagZ的一致性不高(37%),而且B. pseudofirmus 703是一株嗜碱芽孢杆菌,因此我们系统研究了重组NagZ703的酶学特征,其结果如下。
(1) 纯化的NagZ703具有外切β-N-乙酰氨基葡萄糖苷酶的活性,能水解pNP-β-GlcNAc和胶体几丁质,水解胶体几丁质后能得到GlcNAc,也能将几丁质二糖酶ChiA3酶解胶体几丁质后得到的二糖GlcNAc2水解成单糖。以pNP-β-GlcNAc为底物时,其Km为0.276 mmol/L,而BsNagZ的Km值为0.15 mmol/L[9],这表明NagZ703对pNP-β- GlcNAc的亲和性低于BsNagZ,这也是NagZ703的比酶活比BsNagZ低的原因之一。
(2) 与BsNagZ一样,NagZ703在60 ℃表现出最佳反应活性,55 ℃保温20 min后,该酶丧失了50%的活力,同样条件下,BsNagZ还保留了80%以上的活力,因此NagZ703的热稳定性不如BsNagZ。
(3) NagZ703是一个中性外切β-N-乙酰氨基葡萄糖苷酶,其最适pH为6.5,略高于枯草芽孢杆菌的NagZ (最适pH 6.0)[15]。通过pH稳定性研究发现,NagZ703在pH 6.0–10.5范围内比较稳定;而BsNagZ则是在pH 4.0–8.0范围内比较稳定,表明NagZ703比BsNagZ更耐碱。
通过金属离子对酶活性影响的分析,我们没有发现对酶活性有明显促进作用的金属离子,因而NagZ703与BsNagZ一样,是一个非金属依赖酶,而EDTA对酶活性没有抑制作用,这进一步证实了该酶的非金属依赖性。几种常见的二价金属离子均对NagZ703的活性产生抑制作用,其中Hg2+、Ni2+、Cu2+和Zn2+表现出强烈的抑制。5 mmol/L Hg2+使该酶完全丧失了活性,5 mmol/L Zn2+使酶的活性丧失了80%以上,这与Hg2+和Zn2+对BsNagZ的抑制效果是相似的[16],Kim等在研究Thermotoga neapolitana来源的β-N-乙酰氨基葡萄糖苷酶CbsA时,发现它也受ZnCl2的强烈抑制[16]。
通过性质分析,我们发现嗜碱菌B. pseudofirmus 703来源的β-N-乙酰氨基葡萄糖苷酶NagZ703与枯草芽孢杆菌来源的BsNagZ的性质比较相似,其最适反应温度是一样的,热稳定比BsNagZ略差一点;最适pH比BsNagZ略高一点(pH 6.5对6.0),它pH稳定性范围与BsNagZ相比并未扩大,只是都增加了2,向pH碱性范围偏移,这可能是与B. pseudofirmus 703这个嗜碱芽孢杆菌的生长环境相适应的一个变化;在1 mmol/L NaCl溶液的环境中NagZ703的活性也下降了80%,没有嗜盐的倾向。为什么NagZ703和BsNagZ氨基酸序列的一致性这么低,而且这两个酶的产生菌性质差异这么大,但它们的酶学性质差异却并不大呢?我们分析,微生物产生的β-N-乙酰氨基葡萄糖苷酶主要是参与细胞壁的代谢,它的功能是保守的,而这两个菌都是芽孢杆菌属,亲缘关系近,所以性质比较相似。此外,本课题组曾从嗜碱菌B. pseudofirmus 703分离到了一种淀粉酶Amy703,它表现出很明显的耐盐嗜碱的特性,而NagZ703虽然耐碱但是并不耐盐。序列分析显示NagZ703带有信号肽序列,与Amy703一样,是分泌蛋白。同样的,BsNagZ也是分泌蛋白,Litzinger等[11]用实验证实了BsNagZ参与细胞壁代谢,从胞壁肽的非还原端切除GlcNAc;而且他们还发现BsNagZ从细胞内分泌出去后,与细胞壁结合在一起。因此我们推测NagZ703的作用机理可能与BsNagZ相似,也是在细胞内合成后,通过分泌通道来到细胞表面,和胞壁肽结合在一起,参与细胞壁的主要成分胞壁肽的营救,并没有在细胞外的盐碱环境下进行酶反应,所以NagZ703是中性酶,在中性条件下活性最高。
References
| [1] | Patil NS, Waghmare SR, Jadhav JP. Purification and characterization of an extracellular antifungal chitinase from Penicillium ochrochloron MTCC 517 and its application in protoplast formation. Process Biochemistry, 2013, 48(1): 176-183. DOI:10.1016/j.procbio.2012.11.017 |
| [2] | Zhou JP, Song ZF, Zhang R, Chen CH, Wu Q, Li JJ, Tang XH, Xu B, Ding JM, Han NY, Huang ZX. A Shinella β-N-acetylglucosaminidase of glycoside hydrolase family 20 displays novel biochemical and molecular characteristics. Extremophiles, 2017, 21(4): 699-709. DOI:10.1007/s00792-017-0935-1 |
| [3] | Chen JK, Shen CR, Liu CL. N-acetylglucosamine:production and applications. Marine Drugs, 2010, 8(9): 2493-2516. DOI:10.3390/md8092493 |
| [4] | Gohel V, Singh A, Vimal M, Ashwini P, Chhatpar HS. Bioprospecting and antifungal potential of chitinolytic microorganisms. African Journal of Biotechnology, 2006, 5(2): 54-72. |
| [5] | Dahiya N, Tewari R, Hoondal GS. Biotechnological aspects of chitinolytic enzymes:a review. Applied Microbiology and Biotechnology, 2006, 71(6): 773-782. DOI:10.1007/s00253-005-0183-7 |
| [6] | Cohen-Kupiec R, Chet I. The molecular biology of chitin digestion. Current Opinion in Biotechnology, 1998, 9(3): 270-277. DOI:10.1016/S0958-1669(98)80058-X |
| [7] | Cheng QM, Li HS, Merdek K, Park JT. Molecular characterization of the β-N-acetylglucosaminidase of Escherichia coli and its role in cell wall recycling. Journal of Bacteriology, 2000, 182(17): 4836-4840. DOI:10.1128/JB.182.17.4836-4840.2000 |
| [8] | Ortiz JM, Gillespie JB, Berkeley RCW. An exo-β-acetylglucosaminidase from Bacillus subtilis B:extraction and purification. Biochimica et Biophysica Acta (BBA)-Enzymology, 1972, 289(1): 174-186. DOI:10.1016/0005-2744(72)90120-9 |
| [9] | Litzinger S, Duckworth A, Nitzsche K, Risinger C, Wittmann V, Mayer C. Muropeptide rescue in Bacillus subtilis involves sequential hydrolysis by β-N-acetylglucosaminidase and N-acetylmuramyl-L-alanine amidase. Journal of Bacteriology, 2010, 192(12): 3132-3143. DOI:10.1128/JB.01256-09 |
| [10] | Huang YW, Hu RM, Lin CW, Chung TC, Yang TC. NagZ-dependent and NagZ-independent mechanisms for β-lactamase expression in Stenotrophomonas maltophilia. Antimicrobial Agents and Chemotherapy, 2012, 56(4): 1936-1941. DOI:10.1128/AAC.05645-11 |
| [11] | Litzinger S, Fischer S, Polzer P, Diederichs K, Welte W, Mayer C. Structural and kinetic analysis of Bacillus subtilis N-acetylglucosaminidase reveals a unique Asp-His dyad mechanism. The Journal of Biological Chemistry, 2010, 255(46): 35675-35684. |
| [12] | Lu ZH, Tian CG, Li AY, Zhang GM, Ma YH. Identification and characterization of a novel alkaline α-amylase Amy703 belonging to a new clade from Bacillus pseudofirmus. Journal of Industrial Microbiology & Biotechnology, 2014, 41(5): 783-793. |
| [13] | Yem DW, Wu HC. Purification and properties of β-N-acetylglucosaminidase from Escherichia coli. Journal of Bacteriology, 1976, 125(1): 324-331. DOI:10.1128/JB.125.1.324-331.1976 |
| [14] | Chen JK, Shen CR, Yeh CH, Fang BS, Huang TL, Liu CL. N-acetyl glucose mine obtained from chitin by chitin degrading factors in Chitinbacter tainanesis. International Journal of Molecular Sciences, 2011, 12(2): 1187-1195. DOI:10.3390/ijms12021187 |
| [15] | Berkeley RCW, Brewer SJ, Ortiz JM, Gillespie JB. An exo-β-N-acetylglucosaminidase from Bacillus subtilis B; characterization. Biochimica et Biophysica Acta (BBA)-Enzymology, 1973, 309(1): 157-168. DOI:10.1016/0005-2744(73)90327-6 |
| [16] | Kim JS, Yoon BY, Ahn J, Cha J, Ha NC. Crystal structure of β-N-acetylglucosaminidase CbsA from Thermotoga neapolitana. Biochemical and Biophysical Research Communications, 2015, 464(3): 869-874. DOI:10.1016/j.bbrc.2015.07.053 |
