马良军1, 王佳媚1,2, 黄明明1, 章建浩1

 , 严文静1
, 严文静1

1. 南京农业大学食品科学技术学院, 江苏省肉类生产与加工质量安全控制协同创新中心, 国家肉品质量安全控制工程技术研究中心, 江苏 南京 210095;
2. 海南大学食品学院, 海南 海口 570228
收稿日期:2018-10-07;修回日期:2018-12-12;网络出版日期:2019-03-13
基金项目:江苏省农业创新资金[CX(18)3041];南京市农业科技攻关项目(201805038);国家青年科学基金(31601565)
*通信作者:章建浩, Tel:+86-25-84399096, E-mail:nau_zjh@njau.edu.cn;
严文静, E-mail:yanwenjing0317@126.com.
摘要:[目的] 研究不同处理条件下介质阻挡放电低温等离子体对单增李斯特菌和肠炎沙门氏菌的杀菌效果,以及抑菌活性物质含量随处理时间的变化。[方法] 以单增李斯特菌和肠炎沙门氏菌为对象,研究不同电压、时间及氧气浓度对介质阻挡放电低温等离子体杀菌效果的影响,通过气态活性物质测定管测定O3和NO2浓度随处理时间的变化,利用荧光强度表征菌液中产生的活性物质浓度,采用荧光分光光度法测定·OH、H2O2和1O2随处理时间的变化。[结果] 采用70 kV、150 s或80 kV、120 s能够完全杀灭肠炎沙门氏菌,而单增李斯特菌只在80 kV、120 s条件下才能被完全杀死。采用50% O2+50% N2的混合气体能够在90 s内完全杀死细菌。随处理时间的增加,两种菌体细胞内活性氧物质含量呈逐渐增加趋势。[结论] 电压、时间及氧气浓度均能显著增强等离子体的杀菌效果,其杀菌作用主要与H2O2、·OH、1O2等活性氧物质的含量有关,其中·OH和H2O2是介质阻挡放电等离子体杀菌的主要物质。
关键词:介质阻挡放电低温等离子体活性氧物质单增李斯特菌肠炎沙门氏菌杀菌
Sterilization by dielectric barrier discharge low temperature plasma under different treatment conditions
Liangjun Ma1, Jiamei Wang1,2, Mingming Huang1, Jianhao Zhang1

 , Wenjing Yan1
, Wenjing Yan1

1. Jiangsu Collaborative Innovation Center of Meat Production and Processing, National Center of Meat Quality and Safety Control, College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, Jiangsu Province, China;
2. College of Food Science and Technology, Hainan University, Haikou 570228, Hainan Province, China
Received: 7 October 2018; Revised: 12 December 2018; Published online: 13 March 2019
*Corresponding author: Zhang Jianhao, Tel: +86-25-84399096, E-mail:nau_zjh@njau.edu.cn;
Yan Wenjing, E-mail:yanwenjing0317@126.com.
Foundation item: Supported by the Jiangsu Agricultural Science Technology Innovation Fund [CX(18)3041], by the Nanjing Agricultural Science and Technology Research Project (201805038) and by the National Youth Science Fund Project (31601565)
Abstract: [Objective] To study the bactericidal effect of dielectric barrier discharge low temperature plasma on Listeria monocytogenes and Salmonella Enteritidis under different treatment conditions and the content of antibacterial active substances with treatment time. [Methods] Listeria monocytogenes and Salmonella enteritidis were used as research objects to determine the total number of colonies after treatment with different voltage, time and oxygen concentration. The concentration of O3 and NO2 was determined by gas-active substance determination tube with treatment time and fluorescence intensity was utilized. The concentration of free radicals generated in the bacterial liquid was characterized and the changes of·OH, H2O2 and 1O2 with the treatment time were determined by fluorescence spectrophotometry. [Results] Using 70 kV, 150 s or 80 kV, 120 s could completely kill Salmonella Enteritidis, whereas Listeria monocytogenes could be completely killed only at 80 kV, 120 s. A mixture of 50% O2+50% N2 could completely kill the bacteria in 90 s. With the increase of treatment time, The content of intracellular ROS in two bacteria gradually increased. [Conclusion] The voltage, time and oxygen concentration could significantly enhance the bactericidal effect of plasma. Active oxygen radicals such as H2O2 and·OH could promote the bactericidal effect on Listeria monocytogenes and Salmonella enteritidis. Moreover, the bactericidal effect of·OH and H2O2 was better than that of 1O2.
Keywords: dielectric barrier dischargelow temperature plasmareactive oxygen speciesListeria monocytogenesSalmonella enteritidissterilization
非热杀菌是近年来兴起的一种新型杀菌技术。与传统热杀菌技术相比,非热杀菌能够很好地维持食品自身的生物化学特性,保证风味物质及成分不受杀菌过程的干扰而发生损失,对于温度升高引起的食品体系中酶活性的变化能够更加合理地规避,从而在一定程度上延长食品的保质期,达到保鲜杀菌的效果[1-3]。目前常见的非热杀菌方式主要有紫外线杀菌、超高压杀菌、辐照杀菌、高压电场低温等离子体杀菌等,其中高压电场低温等离子体杀菌因其操作简单、设备成本较低、可在常温常压下进行、先包装再杀菌能够很好避免包装过程中产生的二次污染等特点[4-5],该技术目前被广泛用于材料表面改性、空气净化、土壤修复、育种、农产品保鲜等领域[6-7]。其中,在农产品的保鲜防腐方面,国际上已经进行了深入的研究。Ziuzina等[8]分别用等离子体对西红柿上接种的沙门氏菌、大肠杆菌和李斯特菌处理10 s、60 s和120 s以后,可以将这3种致病菌全部杀灭。经过5 min体处理的草莓,在24 h内表面菌落数降低了2个数量级,且硬度和呼吸速率均不产生明显的变化[9]。Misra等[5]利用等离子体处理圣女果,其表面菌落数明显降低,颜色和呼吸速率无剧烈变化,货架期得到明显延长。Bursa? Kovacěvi?等[10]研究发现经低温等离子体处理后,石榴汁中花青素含量明显升高。介质阻挡放电(dielectric barrier discharge,DBD)低温等离子体杀菌主要是通过电离空气产生的紫外光子、离子、分子以及各种形式的活性物质与微生物表面接触,对细胞造成氧化损伤,最终导致细菌细胞死亡[11]。影响高压电场低温等离子体杀菌效率的因素主要有处理时间、电压、包装体系内的气体组分、温度、湿度等,通过这些因素的变化,会使体系中产生的臭氧、过氧化氢及羟基自由基等活性氧(reactive oxygen species,ROS)成分的含量发生变化,而这些活性物质正是起到杀菌作用的关键。
近年来,关于低温等离子体在农产品杀菌保鲜方面的研究已经在国外广泛开展,而国内关于这方面的研究相对较少。本实验室采用的低温等离子体杀菌装置为介质阻挡放电(dielectric barrier discharge,DBD),在2个铝电极板之间放置样品,电极与样品之间放入介质板,防止处理过程中产生电弧放电,整个装置如图 1所示。单增李斯特菌(Listeria monocytogenes)和肠炎沙门氏菌(Salmonella enteritidis)是生鲜肉品中出现最多的阳性和阴性致病菌,对于这两种致病菌的抑制具有重要的意义。本文主要研究在不同的处理条件(处理时间,处理电压以及包装体系内的气体组成)下,DBD低温等离子体对单增李斯特菌(革兰氏阳性菌)和肠炎沙门氏菌(革兰氏阴性菌)的杀菌效果,测定处理后部分气态活性成分和液体环境中活性氧物质和活性氮物质含量的变化情况,研究处理过程中活性物质与杀菌率之间相关性关系,初步探究不同活性物质对细菌的杀菌机理,为后续研究提供理论依据。
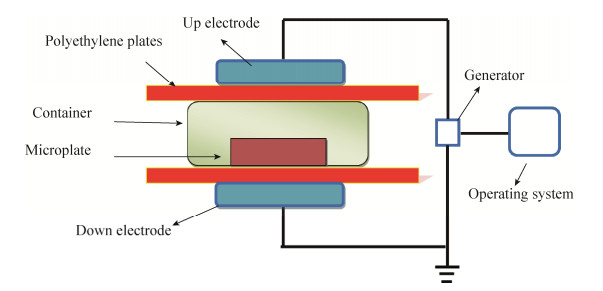 |
| 图 1 DBD低温等离子体杀菌装置示意图 Figure 1 Schematic diagram of DBD low temperature plasma sterilization device. |
| 图选项 |
1 材料和方法 1.1 材料
1.1.1 菌种和试剂: 单增李斯特菌(Listeria monocytogenes CICC21532),肠炎沙门氏菌(Salmonella enteritidis CICC24119),购自中国工业微生物菌种保藏管理中心;平板计数培养基(PCA),LB营养肉汤,购自青岛海博生物技术有限公司;Singlet Oxygen Sensor Green,Amplex? UltraRed Reagent,HPF (Hydroxyl Radical and Peroxynitrite Sensor),辣根过氧化物酶(HRP),购自赛默飞世尔科技(中国)有限公司。
1.1.2 主要仪器: MAP-H360型复合气调包装机(配有气体比例检测装置),苏州森瑞保鲜设备有限公司;低温等离子体发生器(配有电压调控箱,可控电压0-90 kV),美国Phoenix公司;SJ-CJ-1D型超净工作台,苏洁净化仪器设备有限公司;SMIC型电热灭菌锅,上海申安医用仪器厂;电热恒温培养箱,上海一恒科学仪器有限公司;AUY120型电子天平,UV-2600紫外-可见分光光度计,日本岛津公司;Multiskan MK3酶标仪,美国赛默飞世尔科技(中国)有限公司。
1.2 菌悬浮液的制备 从-40 ℃冰箱中取出传代培养3次的菌种保藏管,加入到100 mL的LB营养肉汤中,37℃、200 r/min培养18 h,取培养好的菌液离心(7000×g,4℃,7 min),去上清,加入0.85%生理盐水清洗2-3次,调节菌液浓度为108 CFU/mL,保存备用。
1.3 不同处理条件下杀菌效率的研究 将菌悬液混匀,加入到灭菌后的96孔板中备用。
1.3.1 不同处理时间及电压对杀菌效率的影响: 对96孔板进行包装,气氛条件为空气。选取不同处理电压和不同处理时间对两种菌悬液处理,随后立刻打开包装盒进行微生物计数实验。采用平板涂布法进行菌落总数测定,以未做处理的菌悬液作为空白对照。将涂布好的培养基置于37℃恒温培养箱中培养3 d,每天定时进行菌落计数。每个样品做3次平行。
1.3.2 不同氧气浓度对杀菌效率的影响: 选取处理电压为75 kV,不同氧气含量点对菌悬液进行等离子体处理,随后立刻打开包装盒进行微生物计数实验,计数方法与1.3.1相同。
1.4 等离子处理产生的活性成分研究 选取处理时间的变化对杀菌效果影响,处理电压为75 kV,探究不同处理时间产生的活性氧物质的变化情况,研究活性氧物质与杀菌率之间的相关性。
1.4.1 细胞内整体ROS含量测定: 调整菌液浓度至106-107 CFU/mL,经等离子体处理后,加入H2DCFDA染料至终浓度为1 mmol/L,37℃、5% CO2培养箱静置0.5 h,PBS溶液洗涤细胞3次,去除未进入细胞内的H2DCF-DA。在激发光/发射光为485/528 nm波长条件下读取数值。空白对照组(CK组)为未处理细胞+H2DCF-DA。每个样品做3次平行。
1.4.2 不同时间条件下产生的气态活性氧(氮)物质含量研究: 等离子体处理后,气体环境中主要的活性成分是O3和NO2。因此,主要检测这两种成分。O3及NO2浓度测量使用drager臭氧检测器管[德尔格(中国)安全设备有限公司]测量密封包装内的O3以及NO2浓度[12]。抽取10 mL处理后包装盒内气体,适当稀释后经检测管,通过检测管内颜色变化对应管壁上的刻度,读取相应数值,最后乘稀释倍数,得到最终包装盒内O3及NO2浓度。
1.4.3 不同处理时间菌液中产生的活性氧物质浓度变化研究: 选取3种最主要的活性氧物质进行测定,分别是·OH、H2O2和1O2。1O2测定:将一支Singlet Oxygen Sensor Green试剂与33 μL甲醇混合,加入33 mL PBS溶液,配置成5 mol/L的工作储备液,避光保存待用。经等离子体处理的菌液加入Singlet Oxygen Sensor Green工作液在37℃下避光孵化15 min,在激发光/发射光为485/530 nm条件下测定荧光强度。H2O2测定:将1瓶Amplex? UltraRed Reagent与340 μL DMSO混合,记为Ⅰ,再将辣根过氧化物酶用PB配成1 U/mL的溶液,记为Ⅱ,取50 μLⅠ和100 μL Ⅱ混合后加入50 mmol/L的PBS (pH 7.4) 4.85 mL一起混合成工作液避光保存待用。经等离子体处理菌液加入混合工作液后在37℃下避光孵化15 min,在激发光/发射光为530/590 nm条件下测定荧光强度。·OH测定:30 μL HPF (hydroxyl radical and peroxynitrite sensor)和30 mL PBS混合。未处理的菌液与工作液1︰1混合,在37℃孵化20 min,离心去除多余的荧光染色剂,加入相同体积的PBS溶液,经等离子体处理后,激发光/发射光为490/515 nm条件下测定荧光强度。以不加菌液的作为CK组。
1.5 数据分析 本文相关实验结果均采用平行测定3次所取的平均值。采用Oringin 8.0绘图。显著性分析采用SAS分析软件中的单因素方差分析。
2 结果和分析 2.1 处理时间和电压对杀菌效率的影响 研究不同处理电压及时间对单增李斯特菌(革兰氏阳性菌,G+)和肠炎沙门氏菌(革兰氏阴性菌,G-)杀菌效果。初始菌落数为8 log时,等离子体处理电压越高、处理时间越长,其杀菌率越高(图 2和图 3)。等离子体处理80 kV、120 s时能够完全杀灭单增李斯特菌(图 2)。而肠炎沙门氏菌在处理电压70 kV时,处理150 s或80 kV、120 s时可完全杀死细菌。
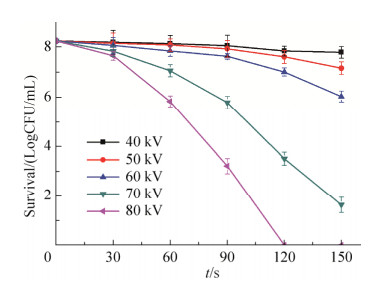 |
| 图 2 不同处理时间和电压对单增李斯特菌杀菌效果的影响 Figure 2 Effect of different treatment time and voltage on the sterilization effect of Listeria monocytogenes. |
| 图选项 |
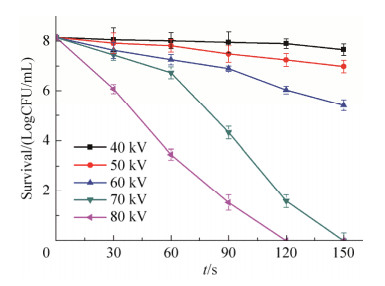 |
| 图 3 不同处理时间和电压对肠炎沙门氏菌杀菌效果的影响 Figure 3 Effect of different treatment time and voltage on the sterilization effect of Salmonella enteritidis. |
| 图选项 |
2.2 不同氧气浓度对杀菌效率的影响 当使用不同的O2和N2比例作为介质气体处理菌悬液,如图 4和图 5所示。氧气含量在20%以上时,随处理时间增加,菌落数逐渐降低。当氧气浓度在20%、30%、40%和50%时,单增李斯特菌分别在150、120、120、90 s以内达到完全杀灭的效果。当氧气浓度在20%、30%、40%和50%时,肠炎沙门氏菌分别在150、90、90、90 s以内达到完全杀灭的效果。且氧气浓度越高,杀菌速率越快。对比图 2和图 3,当利用相同的处理条件处理两种菌悬液时,单增李斯特菌的存活数量明显多于肠炎沙门氏菌。
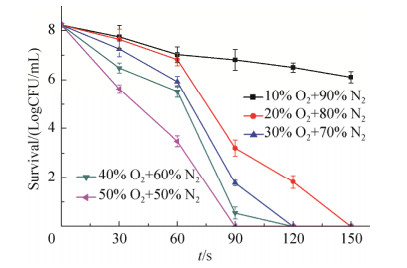 |
| 图 4 不同氧气浓度对单增李斯特菌杀菌效果的影响 Figure 4 Effect of different O2 concentration on the sterilization effect of Listeria monocytogenes. |
| 图选项 |
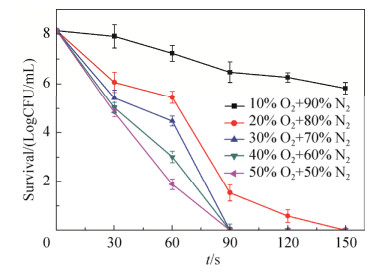 |
| 图 5 不同氧气浓度对肠炎沙门氏菌杀菌效果的影响 Figure 5 Effect of different O2 concentration on the sterilization effect of Salmonella enteritidis. |
| 图选项 |
等离子体杀菌主要是通过产生各种ROS对菌体细胞形成氧化作用,并最终导致其死亡的过程。活性氧和活性氮成分中的一些物质,如H2O2,由于其具有较高的氧化作用,被认为是主要的杀菌成分。其中,含氧活性成分在杀菌过程中起主要作用[13]。氧气含量较低时,生成的含氧活性成分(O3、NO2、1O2、H2O2、·OH等)含量低,杀菌效果不显著。当氧气含量达到一定浓度时,能够激发产生的含氧活性物质是有限的,即达到饱和状态,此时如果处理条件不变,即使提高氧气浓度,也不会产生显著的变化。
2.3 细胞内整体ROS含量随处理时间的变化情况 经等离子体处理的菌悬液,细胞内ROS水平明显升高,且随着处理时间增加,两种菌体内的ROS水平均逐渐升高。对于同一处理时间,单增李斯特菌菌体细胞内ROS水平明显高于肠炎沙门氏菌。肠炎沙门氏菌在60 s时荧光强度产生明显的上升,说明菌体内ROS水平产生了明显的增加,随后缓慢升高,趋于平稳。单增李斯特菌在30 s时荧光强度就处于较高水平,且之后随处理时间增加,荧光强度缓慢增加(图 6)。这是因为对于革兰氏阴性菌主要是通过ROS破坏外部组分,而对于革兰氏阳性菌,主要是通过ROS进入细胞内,与细胞内的大分子物质结合,造成核酸和蛋白质的氧化损伤[14]。
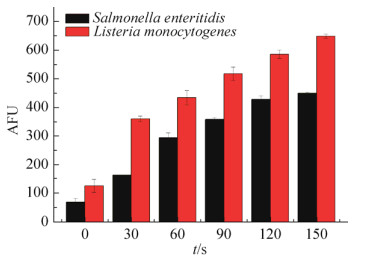 |
| 图 6 不同处理时间两种菌体细胞内ROS含量变化情况 Figure 6 Changes of intracellular ROS content in two kinds of cells at different treatment time. |
| 图选项 |
2.4 O3和NO2含量随处理时间的变化 随处理时间的增加,O3和NO2浓度逐渐增加,且O3浓度显著高于NO2。O3浓度在0 s到90 s时增长率逐渐变缓,90 s到120 s时增长率变大,在120 s到150 s时,O3浓度出现缓慢下降,可能是由于在较高浓度的O3条件下,部分O3会和水反应生成强氧化性的HO2。NO2在整个实验范围内,几乎呈线性增长。从图 7可知,O3浓度在任何时间点都显著高于NO2,相差一个数量级,说明O3是整个处理过程中产生的主要活性物质,并且从氧气浓度对杀菌效率关系中也可以看出,O3在细菌抑制过程中起到至关重要的作用[15]。NO2可以和H2O反应,最终形成NO2-和NO3-,使溶液酸化,参与杀菌反应。
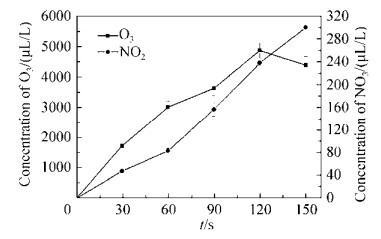 |
| 图 7 O3和NO2含量随处理时间的变化情况 Figure 7 Changes of O3 and NO2 content at different treatment time. |
| 图选项 |
2.5 菌液中ROS含量随处理时间的变化 单线态氧含量变化如图 8所示,利用荧光强度高低来间接表示含量变化。所有实验组1O2水平呈现出先增加后降低,最后达到稳定的趋势。任意处理时间点,CK组1O2含量均高于两种菌,当处理时间为120 s和150 s时,CK组和菌液处理组含量基本相同,且维持在同一水平线上。1O2半衰期较短,不易与菌体发生充分的反应,因此在短时处理时,与CK组相比,荧光强度有所降低,说明短时处理,1O2可以起到一定的作用,当处理时间延长时,1O2不再是主要的活性抑菌物质[16],且1O2只能与菌体内的少数物质发生反应。
 |
| 图 8 1O2含量随处理时间的变化情况 Figure 8 1O2 content at different treatment time. |
| 图选项 |
H2O2含量变化如图 9所示,随处理时间增加,两种细菌内部荧光强度均出现先增加后稳定的趋势,在前120 s处理时间范围内,单增李斯特菌菌体内H2O2的含量显著低于CK组和肠炎沙门氏菌,这是由于在单增李斯特菌体内含有大量的过氧化氢酶,能够很好地降解H2O2达到保护菌体的作用。当杀菌时间达到150 s时,两种菌液所含有的H2O2含量与空白对照组基本一致,这是由于高电压长时间处理,造成了菌体内酶活力降低,无法对产生的H2O2有效降解[17-18]。此外,当细胞内存在Cu+/Fe2+时,可以与H2O2发生芬顿反应生成·OH[19]。NO2-也可以与H2O2反应生成ONOOH,ONOOH或ONOO-均能够氧化脂质和蛋白质[20]。H2O2转化后的这些物质均能够对菌体造成不同程度的破坏,最终导致菌体死亡。
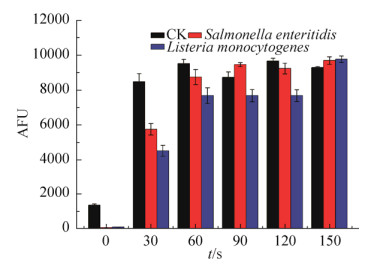 |
| 图 9 H2O2含量随处理时间的变化情况 Figure 9 H2O2 content at different treatment time. |
| 图选项 |
·OH含量变化如图 10所示,在整个处理过程中,单增李斯特菌和肠炎沙门氏菌的荧光强度显著低于CK组,并且随着时间增加,两种菌内的·OH含量无显著变化。·OH是一种氧化性极强的自由基,可以与生物体内的任何物质发生快速反应从而被消耗,被氧化的生物体蛋白质等发生变形导致生物功能降低或失活,达到杀灭微生物的效果。·OH具有很高的氧化电势,能够破坏微生物的通透性屏障,穿过细胞外层结构,进入细胞内对蛋白质、酶以及核酸造成破坏,并最终导致细菌体死亡[21-23]。
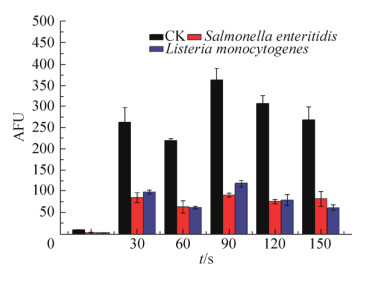 |
| 图 10 ·OH含量随处理时间的变化情况 Figure 10 ·OH content at different treatment time. |
| 图选项 |
采用皮尔逊相关系数方法研究3种活性氧成分对肠炎沙门氏菌和单增李斯特菌杀菌效率的相关性。由表 1可以看出,对于不同的处理时间,1O2、H2O2和·OH三种活性氧成分对肠炎沙门氏菌杀菌效率影响的相关系数绝对值分别为0.1226、0.8909和0.8117,即对于肠炎沙门氏菌抑菌效果由好到差依次为H2O2 > ·OH > 1O2。由表 2可知,对于单增李斯特菌,1O2、H2O2和·OH三种活性氧成分对其杀菌效率影响的相关系数绝对值分别为0.3164、0.8257和0.8941,即对于肠炎沙门氏菌抑菌效果由好到差依次为·OH > H2O2 > 1O2。
表 1. 不同活性氧物质对肠炎沙门氏菌杀菌效果的相关性分析 Table 1. Correlation analysis of different reactive oxygen species on the bactericidal effect of S. enteritidis
| Species | S. enteritidis | 1O2 | H2O2 | ·OH |
| S. enteritidis | 1 | |||
| 1O2 | 0.1226 | 1 | ||
| H2O2 | -0.8909 | 0.2096 | 1 | |
| ·OH | -0.8117 | -0.5412 | 0.2083 | 1 |
表选项
表 2. 不同活性氧物质对单增李斯特菌杀菌效果的相关性分析 Table 2. Correlation analysis of different reactive oxygen species on the bactericidal effect of L. monocytogenes
| Species | L. monocytogenes | 1O2 | H2O2 | ·OH |
| L. monocytogenes | 1 | |||
| 1O2 | -0.3164 | 1 | ||
| H2O2 | -0.8257 | 0.6593 | 1 | |
| ·OH | 0.8941 | -0.0997 | -0.7866 | 1 |
表选项
3 讨论 当处理电压较低或者处理时间较短时,起到杀菌作用的活性氧(ROS)及活性氮(RNS)很难被激发产生,或产生的量较少,不能对菌体形成有效的杀菌作用。随处理电压或处理时间增加,能够电离产生的活性氧物质的量逐渐增加,表现在杀菌效果上即菌落数越来越少,杀菌效果越来越好。但当处理电压较低,即使处理较长时间,体系中生成的活性氧物质含量较少,因此也不会产生较好的杀菌效果。对比图 2和图 3,在相同的处理条件下,同样初始浓度的肠炎沙门氏菌(G-)比单增李斯特菌(G+)更能容易杀死,这主要与两种细菌的细胞结构有关。革兰氏阴性菌细胞壁较薄而疏松,革兰氏阳性菌有较厚的细胞壁(15-18 nm)[24]、厚而致密的肽聚糖层及大量特殊组分磷壁酸[14],这使得活性氧成分很难穿透。因此,本文研究结果表明,肠炎沙门氏菌(G-)比单增李斯特菌(G+)更容易被杀灭。随处理时间及电压的升高,体系中整体活性氧(ROS)含量逐渐升高,而ROS在等离子体杀菌过程中起到重要作用,其含量直接决定杀菌效果[8, 25],因此,在低电压、处理时间较短时产生的ROS无法完全杀灭细菌体。此外,处理功率对杀菌效果的影响比处理时间对杀菌效果的影响高,即处理电压的变化对杀菌效果影响更大[26]。氧气浓度对杀菌效果产生明显的影响,低氧浓度时,含氧活性物质浓度较低,尤其是产生的O3浓度低,不利于有效灭菌。相对于处理过程中产生的1O2和O2-,O3具有更长的半衰期(取决于温度和湿度),能够起到较好的抑菌作用[27-28]。NO2并无杀菌作用,其主要是通过形成NO2-和NO3-起到杀菌作用。
1O2可以将不饱和脂肪酸氧化成过氧化脂[29],由于其较短的半衰期,仅仅在处理初期起到部分抑菌作用,当处理较长时间以后,1O2已经不再对菌体形成抑制和杀灭。而H2O2由于其较强的氧化能力、性质稳定、半衰期长,对细胞表面的脂质、膜蛋白产生氧化作用,形成对应的过氧化物,同时,其还可以渗透生物膜,对细胞内的核酸和蛋白质等遗传物质发生氧化作用。此外,芬顿反应可以使H2O2转化成·OH和OH-,实现了自由基之间有效的相互转化[30]。·OH则可以和生物大分子发生强氧化反应,所以相比其他活性氧成分,其能够对生物系统造成更强的破坏力[31]。因此,不论是单增李斯特菌(G+)还是肠炎沙门氏菌(G-),·OH都是占据主导地位的杀菌活性成分,对杀菌效果起主要作用。
综上所述,电压、时间及氧气浓度的变化均能对杀菌效果产生不同程度的影响,且电压比处理时间对杀菌效果的影响更大。在几种活性氧成分的测定中,O3、·OH和H2O2在杀菌活性成分中起主要作用。在同一条件下,由于革兰氏阳性菌和阴性菌细胞结构的差异性,DBD低温等离子体对肠炎沙门氏菌的杀菌效果优于单增李斯特菌。
References
| [1] | Lu HX, Huang XM, Zhu JL. Effect of ultra high pressure on cell membrane destruction and death of Listeria monocytogenes. Acta Microbiologica Sinica, 2014, 54(7): 746-753. (in Chinese) 陆海霞, 黄小鸣, 朱军莉. 超高压对单增李斯特菌细胞膜的损伤和致死机理. 微生物学报, 2014, 54(7): 746-753. |
| [2] | Li YQ, Zhou GH, Xu XL. Application of four non-thermal sterilization technology on meat products. Science and Technology of Food Industry, 2013, 34(17): 354-359. (in Chinese) 李影球, 周光宏, 徐幸莲. 四种非热杀菌技术在肉类中的应用. 食品工业科技, 2013, 34(17): 354-359. |
| [3] | Ma Y, Zhang GJ, Shi XM, Xu GM, Yang Y. Bacteria inactivation mechanisms by dielectric barrier discharge. High Voltage Engineering, 2008, 34(2): 363-367. (in Chinese) 马跃, 张冠军, 石兴民, 许桂敏, 杨芸. 介质阻挡放电用于细菌灭活的机理研究. 高电压技术, 2008, 34(2): 363-367. |
| [4] | Maeda K, Toyokawa Y, Shimizu N, Imanishi Y, Sakudo A. Inactivation of Salmonella by nitrogen gas plasma generated by a static induction thyristor as a pulsed power supply. Food Control, 2015, 52: 54-59. DOI:10.1016/j.foodcont.2014.12.012 |
| [5] | Misra NN, Keener KM, Bourke P, Mosnier JP, Cullen PJ. In-package atmospheric pressure cold plasma treatment of cherry tomatoes. Journal of Bioscience and Bioengineering, 2014, 118(2): 177-182. DOI:10.1016/j.jbiosc.2014.02.005 |
| [6] | Bae SC, Park SY, Choe W, Ha SD. Inactivation of murine norovirus-1 and hepatitis A virus on fresh meats by atmospheric pressure plasma jets. Food Research International, 2015, 76: 342-347. DOI:10.1016/j.foodres.2015.06.039 |
| [7] | Pankaj SK, Bueno-Ferrer C, Misra NN, O'Neill L, Tiwari BK, Bourke P, Cullen PJ. Characterization of dielectric barrier discharge atmospheric air cold plasma treated gelatin films. Food Packaging and Shelf Life, 2015, 6: 61-67. DOI:10.1016/j.fpsl.2015.09.002 |
| [8] | Ziuzina D, Patil S, Cullen PJ, Keener KM, Bourke P. Atmospheric cold plasma inactivation of Escherichia coli, Salmonella enterica serovar Typhimurium and Listeria monocytogenes inoculated on fresh produce. Food Microbiology, 2014, 42: 109-116. DOI:10.1016/j.fm.2014.02.007 |
| [9] | Misra NN, Patil S, Moiseev T, Bourke P, Mosnier JP, Keener KM, Cullen PJ. In-package atmospheric pressure cold plasma treatment of strawberries. Journal of Food Engineering, 2014, 125: 131-138. DOI:10.1016/j.jfoodeng.2013.10.023 |
| [10] | Bursa? Kova?evi? D, Putnik P, Dragovi?-Uzelac V, Pedisi? S, Re?ek Jambrak A, Herceg Z. Effects of cold atmospheric gas phase plasma on anthocyanins and color in pomegranate juice. Food Chemistry, 2016, 190: 317-323. DOI:10.1016/j.foodchem.2015.05.099 |
| [11] | Huang MM, Qiao WW, Zhang JH, Wang JM. Effects of cold plasma cold sterilization on major spoilage bacteria and biogenic amines in beef. Journal of Food Science and Technology, 2018, 36(4): 17-23. (in Chinese) 黄明明, 乔维维, 章建浩, 王佳媚. 低温等离子体冷杀菌对生鲜牛肉主要腐败菌及生物胺抑制效应研究. 食品科学技术学报, 2018, 36(4): 17-23. |
| [12] | Wan ZF, Chen Y, Pankaj SK, Keener KM. High voltage atmospheric cold plasma treatment of refrigerated chicken eggs for control of Salmonella enteritidis contamination on egg shell. LWT-Food Science and Technology, 2017, 76: 124-130. DOI:10.1016/j.lwt.2016.10.051 |
| [13] | Van Acker H, Coenye T. The role of reactive oxygen species in antibiotic-mediated killing of bacteria. Trends in Microbiology, 2017, 25(6): 456-466. DOI:10.1016/j.tim.2016.12.008 |
| [14] | Han L, Patil S, Boehm D, Milosavljevi? V, Cullen PJ, Bourke P. Mechanisms of inactivation by high-voltage atmospheric cold plasma differ for Escherichia coli and Staphylococcus aureus. Applied and Environmental Microbiology, 2016, 82(2): 450-458. DOI:10.1128/AEM.02660-15 |
| [15] | Patil S, Moiseev T, Misra NN, Cullen PJ, Mosnier JP, Keener KM, Bourke P. Influence of high voltage atmospheric cold plasma process parameters and role of relative humidity on inactivation of Bacillus atrophaeus spores inside a sealed package. Journal of Hospital Infection, 2014, 88(3): 162-169. DOI:10.1016/j.jhin.2014.08.009 |
| [16] | Edge R, Truscott TG. Singlet oxygen and free radical reactions of retinoids and carotenoids—a review. Antioxidants, 2018, 7(1): 5. DOI:10.3390/antiox7010005 |
| [17] | Davies KJ, Lin SW, Pacifici RE. Protein damage and degradation by oxygen radicals. Ⅳ. Degradation of denatured protein. Journal of Biological Chemistry, 1987, 262(20): 9914-9920. |
| [18] | Ali A, Ashraf Z, Kumar N, Rafiq M, Jabeen F, Park JH, Choi KH, Lee S, Seo SY, Choi EH. Influence of plasma-activated compounds on melanogenesis and tyrosinase activity. Scientific Reports, 2016, 6: 21779. DOI:10.1038/srep21779 |
| [19] | Nordberg J, Arnér ESJ. Reactive oxygen species, antioxidants, and the mammalian thioredoxin system. Free Radical Biology and Medicine, 2001, 31(11): 1287-1312. DOI:10.1016/S0891-5849(01)00724-9 |
| [20] | Daiber A, Ullrich V. Nitric oxide, superoxide and peroxynitrite - a radical chemistry in organism. Chemie in Unserer Zeit, 2002, 36(6): 366-375. DOI:10.1002/1521-3781(200212)36:6<366::AID-CIUZ366>3.0.CO;2-B |
| [21] | Imlay JA. Diagnosing oxidative stress in bacteria: not as easy as you might think. Current Opinion in Microbiology, 2015, 24: 124-131. DOI:10.1016/j.mib.2015.01.004 |
| [22] | Zhao XL, Drlica K. Reactive oxygen species and the bacterial response to lethal stress. Current Opinion in Microbiology, 2014, 21: 1-6. DOI:10.1016/j.mib.2014.06.008 |
| [23] | Kottur J, Nair DT. Reactive oxygen species play an important role in the bactericidal activity of quinolone antibiotics. Angewandte Chemie International Edition, 2016, 55(7): 2397-2400. DOI:10.1002/anie.201509340 |
| [24] | Gaunt LF, Beggs CB, Georghiou GE. Bactericidal action of the reactive species produced by gas-discharge nonthermal plasma at atmospheric pressure: a review. IEEE Transactions on Plasma Science, 2006, 34(4): 1257-1269. DOI:10.1109/TPS.2006.878381 |
| [25] | Uhm HS, Choi EH, Cho GS, Hwang DH. Influence of reactive oxygen species on the sterilization of microbes. Current Applied Physics, 2013, 13(S1): S30-S35. |
| [26] | Song HP, Kim B, Choe JH, Jung S, Moon SY, Choe W, Jo C. Evaluation of atmospheric pressure plasma to improve the safety of sliced cheese and ham inoculated by 3-strain cocktail Listeria monocytogenes. Food Microbiology, 2009, 26(4): 432-436. DOI:10.1016/j.fm.2009.02.010 |
| [27] | Young SB, Setlow P. Mechanisms of Bacillus subtilis spore resistance to and killing by aqueous ozone. Journal of Applied Microbiology, 2010, 96(5): 1133-1142. |
| [28] | Mahfoudh A, Barbeau J, Moisan M, Leduc A, Séguin J. Biocidal action of ozone-treated polystyrene surfaces on vegetative and sporulated bacteria. Applied Surface Science, 2010, 256(10): 3063-3072. DOI:10.1016/j.apsusc.2009.11.074 |
| [29] | Guo JS, Pan J, Zhang Q, Wu S, Liang YD, Wang J. Composition analysis of non-thermal atmospheric pressure plasma micro jet and a study of its sterilization effects. Acta Scientiarum Naturalium Universitatis Pekinensis, 2012, 48(4): 533-537. (in Chinese) 国晋菘, 潘洁, 张茜, 吴杉, 梁永栋, 王静. 大气压低温等离子体的活性氧成分分析及其杀菌效应研究. 北京大学学报(自然科学版), 2012, 48(4): 533-537. |
| [30] | Cabiscol E, Tamarit J, Ros J. Oxidative stress in bacteria and protein damage by reactive oxygen species. International Microbiology: the Official Journal of the Spanish Society for Microbiology, 2000, 3(1): 3-8. |
| [31] | Betteridge DJ. What is oxidative stress?. Metabolism, 2000, 49(2 Suppl. 1): 3-8. |
