张琪文1,2,3,4, 蔡普默1,2,3,4, 张贺贺1,2,3,4, 花若晗1,2,3,4, 季清娥1,2,3,4

 , 陈家骅1,2,3,4
, 陈家骅1,2,3,4 1.联合国(中国)实蝇防控研究中心, 福建 福州 350002;
2.福建农林大学植物保护学院益虫研究所, 福建 福州 350002;
3.闽台作物有害生物生态防控国家重点实验室, 福建 福州 350002;
4.生物农药与化学教育部重点实验室, 福建 福州 350002
收稿日期:2018-03-28;修回日期:2018-06-15;网络出版日期:2018-07-30
基金项目:国家重点研发计划项目(2017YFD0202000)
*通信作者:季清娥, E-mail:jiqinge@yeah.net
摘要:[目的] 为研究137Cs辐照前后橘小实蝇雄虫肠道菌群多样性和丰度的变化及其肠道菌群在不同分类阶元上的显著差异物种。[方法] 本研究利用Illumina HiSeq高通量测序技术对辐照组和对照组共6个样品进行测序分析。[结果] 变形菌门和厚壁菌门分别以60.38%、24.33%的比例作为橘小实蝇肠道中的优势菌门和次优势菌门,肠杆菌科和肠球菌科分别以60.38%和15.69%作为优势菌科和次优势菌科。米勒氏菌属(Moellerella)、摩根氏菌属(Morganella)、Cosenzaea属、链球菌科未知属和酸热菌属(Acidothermus)是组间显著差异的菌属。[结论] 本研究发现橘小实蝇在辐照后的肠道菌群多样性和丰度均有显著性降低,并在目至属等3个分类阶元上找到辐照后具有显著差异的物种,为后期利用差异菌群来改善辐照对橘小实蝇的消极影响及修复辐照损伤提供理论基础。
关键词:橘小实蝇肠道菌群辐照Illumina HiSeq高通量测序
Effects of 137Cs radiation on the diversity of bacterial communities in male Bactrocera dorsalis (Hendel)
Qiwen Zhang1,2,3,4, Pumo Cai1,2,3,4, Hehe Zhang1,2,3,4, Hua Ruohan1,2,3,4, Qing'e Ji1,2,3,4

 , Jiahua Chen1,2,3,4
, Jiahua Chen1,2,3,4 1.UN(China) Center for Fruit Fly Prevention and Treatment, Fuzhou 350002, Fujian Province, China;
2.Institute of Beneficial Insects, College of Plant Protection, Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian Province, China;
3.State Key Laboratory of Ecological Pest Control for Fujian and Taiwan Crops, Fuzhou 350002, Fujian Province, China;
4.Key Lab of Biopesticide and Chemical Biology, Ministry of Education, Fuzhou 350002, Fujian Province, China
Received 28 March 2018; Revised 15 June 2018; Published online 30 July 2018
*Corresponding author: Qing'e Ji, E-mail:jiqinge@yeah.net
Supported by the National Key Research and Development Program of China (2017YFD0202000)
Abstract: [Objective] The aim of this research was to analyze the change of diversity and species abundance of bacterial communities in male Bactrocera dorsalis (Hendel) after 137Cs radiation treatment. [Methods] We used Illumina HiSeq high-throughput sequencing technology to sequence 6 intestinal samples of Bactrocera dorsalis. [Results] Proteobacteria (60.38%) and Firmicutes (24.33%) were the dominant phylum and subdominant phylum in the intestinal microflora of Bactrocera dorsalis respectively, and Enterobacteriaceae (60.38%) and Enterococcaceae (15.69%) were the dominant family and subdominant family. Moellerella, Morganella, Cosenzaea, unidentified-Streptococcaceae and Acidothermus have significant difference after irradiation. [Conclusion] Irradiation treatment significantly reduced the diversity and abundance of intestinal microflora in Bactrocera dorsalis. And we found significant differential species in different taxonomic level. This result provides a theoretical basis to improve the irradiated-induced damage to Bactrocera dorsalis.
Keywords: Bactrocera dorsalisintestinal microflorairradiationIllumina HiSeq
橘小实蝇Bactrocera dorsalis (Hendel),属双翅目Diptera,实蝇科Tetriphitidae,果实蝇属Bactrocera,又名东方果实蝇,俗称果蛆,是一种非常重要的钻蛀性害虫,能危害约46科270余种果蔬和花卉[1]。对于经济水果,该害虫主要以幼虫钻蛀为害,雌虫将卵产在果实内部,孵化后的幼虫取食果肉,被蛀食的果实会出现未熟先黄、脱落和腐烂的症状,严重影响经济作物的产量和质量[2-4]。目前实蝇的综合防治方法(integrated pest management, IPM)主要包括田园清理、蛋白饵剂诱杀、性诱灭雄、昆虫不育技术(sterile insect technique, SIT)和释放天敌寄生蜂等[5-6]。因雄性不育技术对害虫防治具有专一性且无公害,该技术已经成功广泛应用于实蝇科害虫的防治中,并成功防治包括橘小实蝇在内的多种实蝇[7-9]。
昆虫体内的微生物在昆虫生长、繁殖、适应环境及进化的过程中起重要作用[10]。Yao等[11]利用瓜实蝇Bactrocera cucurbitae肠道优势菌肠杆菌属来强化幼虫饲料并喂食瓜实蝇,增强了瓜实蝇健康适合度,以此改善辐照对瓜实蝇的消极影响。另外,王洪秀[12]发现数种橘小实蝇肠道优势菌发酵液对橘小实蝇具有显著的引诱作用。但是,有研究表明实验室大量饲养的不育雄虫在存活率、健康和交配竞争力方面都不如野生雄虫,这使得SIT防治效果大打折扣,这可能与辐照损伤或长期饲养在实验室等相关[13-14]。另有研究表明辐照会对实蝇雄虫造成一定的影响,例如破坏地中海实蝇Ceratitis capitata (Wiedemann)和墨西哥按实蝇Anastrepha ludens (Loew)雄虫的中肠组织、肠道微生物以及中肠蛋白酶等[15]。目前,国内外尚无关于辐照对橘小实蝇肠道微生物的影响的研究。因此,本研究从肠道菌的角度研究辐照对昆虫的影响,利用Illumina HiSeq高通量测序技术分析辐照前后橘小实蝇雄虫肠道菌群的多样性和丰度的变化,并通过T-test检验寻找目(Order)、科(Family)、属(Genus)各个分类阶元下,辐照后有显著差异菌群,以期为进一步研究橘小实蝇辐照损伤机理提供理论依据,为应用SIT防控橘小实蝇改善不育雄虫的质量打下基础。
1 材料和方法 1.1 供试虫源 供试橘小实蝇为福建农林大学益虫研究所人工饲养敏感品系。饲养条件:室温25 ℃±2 ℃,相对湿度65%±5%,光周期L:D=12 h:12 h。
1.2 蛹期橘小实蝇辐照 有研究结果表明,用于橘小实蝇雄虫不育技术的雄蛹最适宜蛹龄为羽化前2 d,最佳辐照剂量为100 Gy。因此,本研究取适量羽化前2 d橘小实蝇蛹,以100 Gy的137Cs进行辐照,辐照剂量率为1.00 Gy/min。辐照源由浙江省农业科学院作物与核技术利用研究所提供。同时选取同日龄的橘小实蝇蛹作为对照,但不进行辐照,将辐照及未辐照的蛹置于养虫室。羽化后的成虫饲喂无菌饲料(蔗糖3:酵母1)及无菌水至性成熟,饲养条件同1.1。
1.3 橘小实蝇成虫肠道解剖及高通量测序 待辐照后的橘小实蝇蛹和未辐照蛹正常羽化后,然后分别选取12日龄(性成熟)的雄虫各90头,分为辐照组YI1、YI2、YI3和正常对照组NI1、NI2、NI3,每组各30头雄虫,3个重复。在灭菌的超净工作台上进行肠道解剖操作。用75%酒精进行体表消毒处理2-3 min,然后在灭菌PBS (pH 7.4)中漂洗3次,再用无菌水冲洗3-5次。最后一次漂洗完的无菌水通过涂布法检测,以保证实蝇体表达到完全灭菌的效果。将消毒后的虫体放在含有1 mL无菌水的培养皿中,在体视显微镜(SMZ-B4,重庆奥特光学仪器有限公司)下解剖,取出完整肠道置于1.5 mL EP试管中。以上解剖操作中所用实验器具、仪器等均已提前做好灭菌处理。将样品封存于干冰中,送往北京诺禾致源科技股份有限公司利用Illumina HiSeq高通量测序平台对辐照组和对照组各3个重复一共6个肠道样品(表 1)进行16S rDNA V3-V4区多样性测序分析。
表 1. 橘小实蝇肠道解剖样品信息表 Table 1. Information of dissected intestinal samples from Bactrocera dorsalis
| Code | Irradiation/Non-irradiation |
| NI1 | Non-irradiation |
| NI2 | Non-irradiation |
| NI3 | Non-irradiation |
| YI1 | Irradiation |
| YI2 | Irradiation |
| YI3 | Irradiation |
表选项
1.4 辐照对橘小实蝇肠道菌群多样性的影响分析 基于Illumina HiSeq测序,根据所扩增的16S区域特点,利用双末端测序(Paired-End)的方法,构建小片段文库进行双末端测序。利用Uparse (Uparse v7.0.1001)软件[16]对6个样品的全部高质量序列进行聚类,默认以97%的一致性将序列聚类成为OTUs,同时选取OTUs的代表性序列,依据相应的算法原则,以OTUs中出现频数最高的序列作为OTUs的代表序列,并对OTUs代表序列进行物种注释。
利用Qiime软件(Version 1.7.0)计算Chao1、Shannon、Simpson等指数,指数值的高低可反映6个样品群落内的复杂度大小。Chao1指数高说明肠道菌群丰富度高,Shannnon和Simpson指数高说明肠道菌群多样性高。对OTUs进行Alpha多样性计算,以物种多样性曲线图展示,以得到样品内物种丰富度和均匀度信息[17]。筛选辐照组和对照组中最大相对丰度前10的属,进行物种分类树统计,利用分类树状图展示两组样品中不同分类阶元上的优势物种。
通过beta多样性分析,比较辐照组(YI)和对照组(NI)样品间的物种群落结构差异。通过PCoA主坐标分析(principal co-ordinates analysis),进行物种组成结构相似性检测。PCoA分析使用R软件的WGCNA、stats和ggplot2软件包。PCoA分析图可以二维方式展示这种群落结构的差异,以图中不同组样品之间的分散聚合情况来评价两组样品间群落结构的差异程度。选用T-test统计分析方法对两组物种组成和群落结构进行差异显著性检验。从目、科、属不同层级分别做两组间物种差异显著性分析,寻找不同分类阶元上辐照后具有差异显著的菌群。
2 结果和分析 2.1 橘小实蝇肠道共生菌群16S rDNA基因测序数据分析 利用Illumina HiSeq测序和16S rDNA V3-V4可变区基因扩增技术对辐照组和对照组肠道样品进行测序分析,一共得到493617条原始序列,其中可用于后续分析的高质量序列一共256182条,平均每条序列的碱基对长度为370 bp。据表 2中辐照组和对照组橘小实蝇肠道样品的Shannon指数对比可知,辐照组Shannon多样性指数均低于对照组。同样,辐照组的Simpson优势度指数和Chao1丰富度指数均低于对照组。初步说明在辐照后,橘小实蝇的肠道菌多样性及优势度和丰富度均有所降低。
表 2. 辐照组和对照组橘小实蝇肠道菌群16S rDNA基因文库测序信息 Table 2. 16S rDNA gene libraries information of intestinal samples from Bactrocera dorsalis
| Simple ID | Raw tags | Effective tags | Avlength/bp | Shannon index | Simpson index | Chao1 index |
| NI1 | 75158 | 35440 | 366 | 3.522 | 0.854 | 186.043 |
| NI2 | 88872 | 46619 | 373 | 3.654 | 0.843 | 218.903 |
| NI3 | 82998 | 44627 | 365 | 3.444 | 0.815 | 206.034 |
| YI1 | 84798 | 44481 | 372 | 2.794 | 0.769 | 167.714 |
| YI2 | 85156 | 46173 | 375 | 3.387 | 0.840 | 195.125 |
| YI3 | 76635 | 38842 | 370 | 2.984 | 0.789 | 157.086 |
| Total | 493617 | 256182 | ---- | ---- | ---- | ---- |
表选项
2.2 物种多样性曲线 稀释曲线(rarefaction curve)和等级丰度曲线(rank abundance)是常用于描述微生物种群组内样品多样性的曲线。其中稀释曲线可直接反映测序数据量的合理性,同时间接反映了样品中物种的丰富度。以97%相似形水平以上的序列聚类成为一个OTU的序列,并绘制OTUs稀释曲线(图 1)。从图 1可以看出,随着测序深度的增加,辐照组和对照组的稀释曲线的斜率逐渐减小并趋近平缓,但并未到达平缓期。这说明继续增加测序数量也可能只会产生少量的OTUs,因此测序数据量渐进合理。而且从图中曲线间接证明了辐照组橘小实蝇肠道样品丰度明显低于对照组。进一步证明了辐照影响了橘小实蝇肠道菌群多样性。
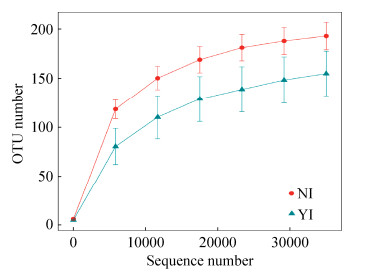 |
| 图 1 辐照组与对照组肠道样品菌群的稀释性曲线 Figure 1 The rarefaction curve of bacterial communities in NI and YI gut samples. |
| 图选项 |
等级丰度曲线(图 2)可直观反映辐照组和对照组橘小实蝇肠道样品中菌群的丰富度和均匀度。在水平方向上,等级曲线的宽度反映了样品中菌群的丰富度,曲线在水平方向的跨度越大,则说明菌群的丰富度越高;在垂直方向上,等级曲线的平滑程度反映了样品中菌群的均匀程度,曲线越平滑,则说明菌群分布越均匀。图 2中,在水平方向上可以看出,辐照组的橘小实蝇肠道样品丰富度明显低于对照组。而在垂直水平上可以看出,辐照组的橘小实蝇肠道菌均匀度同样低于对照组。
 |
| 图 2 辐照组与对照组肠道样品菌群的等级丰度曲线 Figure 2 The rank abundance of bacterial communities in NI and YI gut samples. |
| 图选项 |
2.3 不同分类阶元的优势菌种分析 从辐照组和对照组橘小实蝇肠道样品中共检测到9个菌门,包括变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、疣微菌门(Verrucomicrobia)和两个未能确定其分类地位的门。选择最大相对丰度前10的属为标准进行物种分类树统计并制作树状图(图 3)。由图 3可知变形菌门和厚壁菌门所有样品中所占比例分别为60.38%、24.33%,可见变形菌门和厚壁菌门分别是橘小实蝇肠道中的优势菌门和次优势菌门。肠杆菌科(Enterobacteriaceae)和肠球菌科(Enterococcaceae)分别以60.38%和15.69%作为优势菌科和次优势菌科,肠杆菌属(Enterobacter)和漫游球菌属(Vagococcus)分别以33.84%和12.53%作为优势菌属和次优势菌属。其中对照组中乳杆菌科(Lactobacillaceae)、乳酸菌属(Lactobacillus)占比远远高于辐照组。
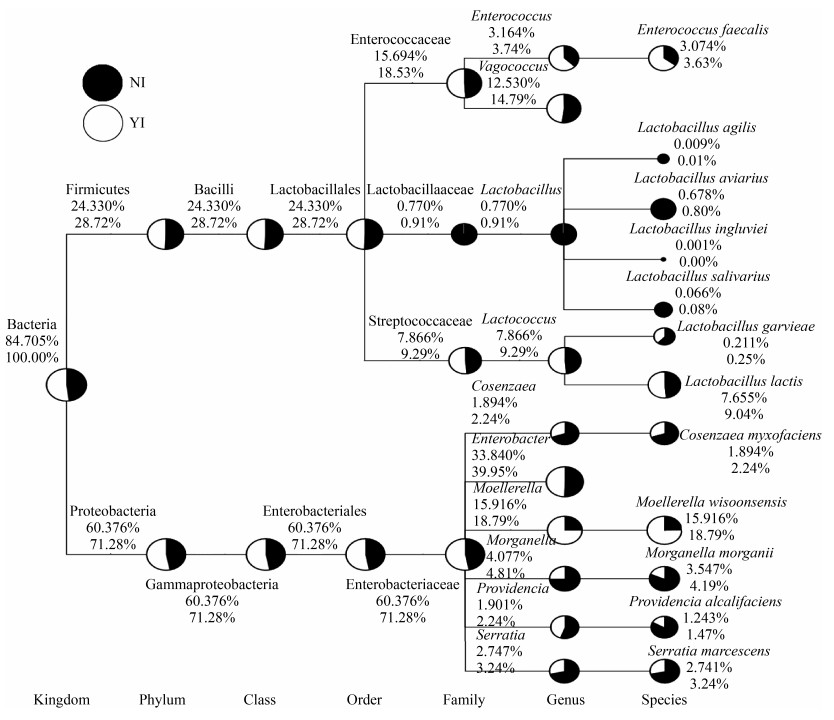 |
| 图 3 各分类阶元的优势菌种占比树状图 Figure 3 The tree map of dominant bacterial communities in different level. |
| 图选项 |
2.4 辐照前后橘小实蝇在不同分类阶元的种群丰度和多样性的变化
2.4.1 群落差异性分析: 基于Unweighted Unifrac距离来进行PCoA分析,选取贡献率最大的主坐标组合并使用R软件绘制PCoA图。若是图中样品之间距离越接近,则表示物种组成结构越相似,因此群落结构相似度高的样品倾向于聚集在一起,群落差异很大的样品则会远远分开。从图 4可以看出,辐照组和对照组之间的菌群都存在不同程度的差异性。从图中可知辐照组和对照组样品中肠道菌群的种类产生最大两大主成分是PC1 (60.13%)和PC2 (15.87%),并且辐照组样品的分布范围远大于对照组。两组样品中的OTU都均匀分布,完全分离,但相对含量存在差异,这说明,辐照显著影响橘小实蝇肠道菌OTU的多样性和丰度。
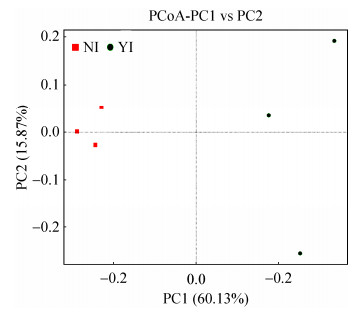 |
| 图 4 辐照对橘小实蝇肠道菌群多样性和结构的影响 Figure 4 Effect of irradiation on symbiotic bacterial diversity and structure component of Bactrocera dorsalis. The PC1 and PC2 respectively represents two different principal component, The percentage represents the contribution of the principal component to the sample difference. |
| 图选项 |
2.4.2 组间不同分类阶元上显著差异物种分析: 辐照后橘小实蝇肠道菌群的物种多样性曲线图、测序样品OTU数量和肠道菌群PCoA分析等,皆证明了辐照对橘小实蝇肠道菌群的丰富度和多样性产生了影响,因此,为寻找橘小实蝇辐照后其肠道菌在目、科、属水平下组间的差异物种,进行了组间T-test检验,以P值< 0.05为显著差异标准。测序数据表明,辐照前后橘小实蝇肠道菌群在门水平没有显著差异。从目一级水平开始,科、属水平上皆有显著差异的物种。图 5-A-C分别为目、科、属3个分类阶元上显著差异物种T-test分析图。
 |
| 图 5 不同分类阶元中T test组间菌群差异分析图 Figure 5 Analysis diagram of symbiotic bacterial differences on two treatments in different level using T test (order level, family level and genus level). The left figures presents that the abundance of differential species among different treatments, and the bar means that the mean of bacterial species that have significant difference in abundance; The right figures means that 95% confidence intervals among different treatment, and the left and right point of circle means that the lower bound and upper bound of mean difference mean in 95% confidence intervals. The color of circle means that the group in this color has highest value. The numbers in right edge means that the P-value of significance test. A: in order level, B: in family level, C: in genus level. |
| 图选项 |
在目一级水平上,Frankiales目在组间具有显著差异(P=0.028),辐照后,该菌目菌群丰度显著降低(图 5-A)。在科一级水平上,DA111科(P=0.039)和酸热菌科(Acidothermaceae) (P=0.028)是组间具有显著差异的菌科。同样在辐照后,其菌群丰度均显著降低(图 5-B)。在属一级水平上,米勒氏菌属(Moellerella) (P=0.023)、摩根氏菌属(Morganella) (P=0.016)、Cosenzaea属(P=0.032)、链球菌科(Streptococcaceae)未知属(P=0.016)和酸热菌属(Acidothermus) (P=0.028)是组间显著差异的菌属。其中米勒氏菌属和链球菌科未知属在辐照后的丰度均高于对照组;而摩根氏菌属、Cosenzaea属和酸热菌属在辐照后的丰度均低于对照组(图 5-C)。
3 讨论 本研究利用Illumina HiSeq测序分析辐照后橘小实蝇肠道菌群的多样性变化和在不同分类阶元上的显著差异物种。结果表明:以97%相似性水平以上的序列聚类成为一个OTU的序列,辐照后的肠道菌群的全部OTUs和特有OTUs均少于对照组,且辐照组橘小实蝇肠道样品的Shannon指数、Simpson指数和Chao1指数都低于对照组,这说明辐照降低了橘小实蝇肠道菌的多样性和丰富度。姚明燕[18]等研究发现,辐照同样降低了瓜实蝇肠道微生物的多样性和优势菌的丰度。
在辐照组和对照组所有样品中,变形菌门和厚壁菌门分别以60.376%、24.330%的比例作为橘小实蝇肠道中的优势菌门和次优势菌门,肠杆菌科和肠球菌科分别以60.376%和15.694%作为优势菌科和次优势菌科,肠杆菌属和漫游球菌属分别以33.840%和12.530%作为优势菌属和次优势菌属。在实蝇科的其他几种实蝇肠道中,如地中海实蝇[19]、南亚实蝇Bactrocera tau (walker)[20]、番石榴果实蝇Bactrocera correcta (Bezzi)[21]、柑橘大实蝇Bactrocera minax[22]等,肠杆菌科同样为优势菌群。本研究对橘小实蝇肠道优势菌分析结果与王洪秀[23]等研究的橘小实蝇成虫肠道可培养细菌群落的分析结果有所不同,他们的研究结果表明,在实验室种群(lab-reared LR)中,放线菌纲(Actinobacteria)为次优势菌群,而在野生种群(field-collected FC)中,厚壁菌门同为次优势菌群。这可能与实验选用不同品系的橘小实蝇有关,该试验所用橘小实蝇来自于湖北武汉武昌区橘园,而本实验所用橘小实蝇来源于福建漳洲番石榴果园,且不同的饲养条件对橘小实蝇肠道菌的影响也有很大关系[24-25]。
昆虫的肠道微生物能够维持昆虫的生长发育和生理平衡、昆虫的行为调节、影响昆虫对病原菌和寄生虫的免疫和抵抗力以及影响昆虫的种群动态等[26-28]。值得一提的是,昆虫的一些肠道菌还具有潜在的引诱活性以及增强宿主健康的作用。如骆米娟[29]对南亚实蝇性成熟的雌、雄成虫肠道共同的13株细菌进行室内外引诱效果测定,结果表明所选细菌发酵液和高压灭菌的发酵上清液对南亚实蝇均有一定的引诱作用。Ami等[30]喂食地中海实蝇添加产酸克雷伯菌(Klebsiella oxytoca)的饲料后,能显著地增加辐照的地中海实蝇的交配竞争力。Behar等[13]在饲料中分别加入杓兰果胶杆菌(Pectobacterium cypripedii)、弗氏柠檬酸杆菌(Citrobacter freundii)、肠杆菌属、产酸克雷伯菌、成团泛菌属(Pantoea)任一种肠杆菌科细菌时,地中海实蝇的寿命明显延长。洪静芳[31]等研究发现,辐照显著影响到橘小实蝇成虫飞出率、羽化率,且赵菊鹏[32]发现辐照后的橘小实蝇雄虫的竞争交配能力低于正常雄虫。本研究结果表明,在属一级水平上,米勒氏菌属(Moellerella)、摩根氏菌属(Morganella)、Cosenzaea属、链球菌科(Streptococcaceae)未知属和酸热菌属(Acidothermus)是组间显著差异的菌属。且米勒氏菌属和链球菌科未知属在辐照后的丰度均高于对照组。目前对于米勒氏菌属对橘小实蝇生长发育等方面的影响鲜见报道。因此,本研究中,对于辐照前后具有显著差异的菌群与橘小实蝇雄虫生理功能之间的关系需进一步深入探索。
本研究利用Illumina HiSeq高通测序技术分析了辐照前后橘小实蝇雄虫肠道菌群的多样性及丰度变化。分析结果表明,辐照导致橘小实蝇雄虫肠道菌群的多样性和丰度显著降低。并在目至属3个分类阶元上寻找到辐照后具有显著差异的菌群,对于显著差异物种与橘小实蝇交配竞争力、寿命等之间的关系有待进一步研究讨论,以期为改善辐照对橘小实蝇的消极影响及修复辐照损伤提供研究方向。
References
| [1] | Ji QE, Bi K, Chen JH. Response of egg-pupal parasitoid Fopius arisanus (Sonan) to infochemicals from the host eggs' surface of Bactrocera dorsalis (Hendel). Journal of Asia-Pacific Entomology, 2016, 19(4): 1151-1157. DOI:10.1016/j.aspen.2016.10.005 |
| [2] | Yang J, Xiao LY. Technical control of Bactroceradorsalis by sex pheromone in citrus orchard. Chinese Horticulture Abstracts, 2017(5): 207-208. (in Chinese) 杨杰, 肖灵亚. 柑橘园橘小实蝇性诱剂防治技术. 中国园艺文摘, 2017(5): 207-208. DOI:10.3969/j.issn.1672-0873.2017.05.086 |
| [3] | Wang T, Ren YL, He SY, Zhang RZ, Yang MF. The potencial geographical distribution of Bactrocera dorsalis based on CLIMEX and ArcGIS in Guizhou. Journal of Environmental Entomology, 2015, 37(3): 534-542. (in Chinese) 王涛, 任艳玲, 何善勇, 张润志, 杨茂发. 基于CLIMEX和ArcGIS的桔小实蝇在贵州适生性研究. 环境昆虫学报, 2015, 37(3): 534-542. |
| [4] | Yuan JL, Liang GW, Lu YY, Zeng L. Economic thresholds of Bactrocera dorsalis (Hendel) in guava orchard. Journal of Environmental Entomology, 2015, 37(1): 116-121. (in Chinese) 袁家龙, 梁广文, 陆永跃, 曾玲. 桔小实蝇在番石榴上的防治指标研究. 环境昆虫学报, 2015, 37(1): 116-121. |
| [5] | Cai PM, Hong JF, Wang C, Yang YC, Yi CD, Chen JH, Ji QE. Effects of Co-60 radiation on the activities of three main antioxidant enzymes in Bactrocera dorsalis (Hendel) (Diptera: Tephritidae). Journal of Asia-Pacific Entomology, 2018, 21(1): 345-351. DOI:10.1016/j.aspen.2018.01.006 |
| [6] | Wang JT, Dong YC, Li ZK, Li SB, Niu CY. Overview of the use of the sterile insect technique to control the Chinese citrus fruit fly. Chinese Journal of Applied Entomology, 2013, 50(3): 848-852. (in Chinese) 王金涛, 董永成, 李宗锴, 黎少波, 牛长缨. 昆虫不育技术防治柑橘大实蝇研究概况. 应用昆虫学报, 2013, 50(3): 848-852. |
| [7] | Ji QE, Hou WR, Chen JH. Sterile insect technique of oriental fruit fly, Bactrocera dorsalis (Hendel)——optimal pupal age and dose of irradiation treatment for male pupae. Journal of Nuclear Agricultural Sciences, 2007, 21(5): 523-526. (in Chinese) 季清娥, 侯伟荣, 陈家骅. 橘小实蝇雄性不育技术——雄蛹辐照最佳时期和剂量. 核农学报, 2007, 21(5): 523-526. DOI:10.3969/j.issn.1000-8551.2007.05.022 |
| [8] | Robinson AS. Genetic sexing strains in medfly, Ceratitis capitata, sterile insect technique programmes. Genetica, 2002, 116(1): 5-13. DOI:10.1023/A:1020951407069 |
| [9] | Ito Y, Kakinohana H, Yamagishi M, Kohama T. Eradication of the melon fly, Bactrocera cucurbitae, from Okinawa, Japan, by means of the sterile insect technique, with special emphasis on the role of basic studies. Journal of Asia-Pacific Entomology, 2003, 6(2): 119-129. DOI:10.1016/S1226-8615(08)60177-6 |
| [10] | Huang X, Huang YS, Zhang JY, Jiang MX. Interactions of various microbes in insects: a review. Chinese Journal of Biological Control, 2015, 31(6): 936-945. (in Chinese) 黄旭, 黄韵姗, 张静宇, 蒋明星. 昆虫体内不同微生物间互作关系的研究进展. 中国生物防治学报, 2015, 31(6): 936-945. |
| [11] | Yao MY, Zhang HH, Cai PM, Gu XH, Wang D, Ji QE. Enhanced fitness of a Bactrocera cucurbitae genetic sexing strain based on the addition of gut-isolated probiotics (Enterobacter spec.) to the larval diet. Entomologia Experimentalis et Applicata, 2017, 162(2): 197-203. DOI:10.1111/eea.2017.162.issue-2 |
| [12] | 王洪秀.橘小实蝇成虫肠道细菌分子多态性分析及其功能研究.华中农业大学博士学位论文, 2011. |
| [13] | Behar A, Jurkevitch E, Yuval B. Bringing back the fruit into fruit fly-bacteria interactions. Molecular Ecology, 2008, 17(5): 1375-1386. DOI:10.1111/mec.2008.17.issue-5 |
| [14] | Ben-Yosef M, Aharon Y, Jurkevitch E, Yuval B. Give us the tools and we will do the job: symbiotic bacteria affect olive fly fitness in a diet-dependent fashion. Proceedings of the Royal Society B: Biological Sciences, 2010, 277(1687): 1545-1552. DOI:10.1098/rspb.2009.2102 |
| [15] | Lauzon CR, Potter SE. Description of the irradiated and nonirradiated midgut of Ceratitis capitata Wiedemann (Diptera: Tephritidae) and Anastrepha ludens Loew (Diptera: Tephritidae) used for sterile insect technique. Journal of Pest Science, 2012, 85(2): 217-226. DOI:10.1007/s10340-011-0410-1 |
| [16] | Edgar RC. UPARSE: highly accurate OTU sequences from microbial amplicon reads. Nature Methods, 2013, 10(10): 996-998. DOI:10.1038/nmeth.2604 |
| [17] | Li B, Zhang XX, Guo F, Wu WM, Zhang T. Characterization of tetracycline resistant bacterial community in saline activated sludge using batch stress incubation with high-throughput sequencing analysis. Water Research, 2013, 47(13): 4207-4216. DOI:10.1016/j.watres.2013.04.021 |
| [18] | Yao MY, Zhang HH, Xiang HJ, Ji QE, Chen JH. Effect of irradiation on bacterial communities in the gut of adult Bactrocera cucurbitae from the genetic sexing strain (Diptera: Tephritidae). Journal of Nuclear Agricultural Sciences, 2017, 31(6): 1145-1152. (in Chinese) 姚明燕, 张贺贺, 向候君, 季清娥, 陈家骅. 辐照对瓜实蝇遗传区性品系成虫肠道微生物的影响. 核农学报, 2017, 31(6): 1145-1152. |
| [19] | Aharon Y, Pasternak Z, Ben Yosef M, Behar A, Lauzon C, Yuval B, Jurkevitch E. Phylogenetic, metabolic, and taxonomic diversities shape mediterranean fruit fly microbiotas during ontogeny. Applied and Environmental Microbiology, 2013, 79(1): 303-313. DOI:10.1128/AEM.02761-12 |
| [20] | Luo MJ, Zhang HH, Chen JH, Du YG, He LY, Ji QE. Isolation and identification of bacteria in the intestinal tract of adult Bactrocera tau (Walker) (Diptera:Tephritidae). Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2016, 45(1): 8-13. (in Chinese) 骆米娟, 张贺贺, 陈家骅, 杜迎刚, 何龙艳, 季清娥. 南亚实蝇成虫肠道细菌的分离与鉴定. 福建农林大学学报(自然科学版), 2016, 45(1): 8-13. |
| [21] | Dai Y, Li ZH, Liu LJ, Wu JJ, Deng YL. Composition of symbiotic bacteria associated with Bactrocera correcta analyzed by 16S rDNA libraries. Plant Protection, 2012, 38(2): 60-65. (in Chinese) 戴阳, 李志红, 柳丽君, 吴佳教, 邓裕亮. 16S rDNA文库法分析番石榴果实蝇共生菌组成. 植物保护, 2012, 38(2): 60-65. DOI:10.3969/j.issn.0529-1542.2012.02.012 |
| [22] | 万伦.柑橘大实蝇肠道细菌分子多态性分析及其生理作用研究.华中农业大学硕士学位论文, 2013. |
| [23] | Wang HX, Jin L, Chen QL, Wei YH, Ma JP, Yao J, Chen LM, Zhong GX. The community structure of the intestine cultivable bacteria of Bactrocera dorsalis adults. Microbiology China, 2015, 42(12): 2351-2365. (in Chinese) 王洪秀, 靳亮, 陈庆隆, 魏云辉, 马吉平, 姚健, 陈柳萌, 钟国祥. 橘小实蝇成虫肠道可培养细菌群落结构分析. 微生物学通报, 2015, 42(12): 2351-2365. |
| [24] | Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. An obesity-associated gut microbiome with increased capacity for energy harvest. Nature, 2006, 444(7122): 1027-1031. DOI:10.1038/nature05414 |
| [25] | B?ckhed F, Ding H, Wang T, Hooper LV, Koh GY, Nagy A, Semenkovich CF, Gordon JI. The gut microbiota as an environmental factor that regulates fat storage. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(44): 15718-15723. DOI:10.1073/pnas.0407076101 |
| [26] | Guo J, Wu J, Deng XY, Lin LB, Liu S, Li JL. Advances in research on insect gut microbiota and their functions. Chinese Journal of Applied Entomology, 2015, 52(6): 1345-1352. (in Chinese) 郭军, 吴杰, 邓先余, 林连兵, 刘珊, 李继莲. 昆虫肠道菌群的功能研究进展. 应用昆虫学报, 2015, 52(6): 1345-1352. |
| [27] | Rao Q, Wu HM. Advances in insect obligate endosymbionts and their genomes-a review. Acta Microbiologica Sinica, 2014, 54(7): 728-736. (in Chinese) 饶琼, 吴慧明. 昆虫专性内共生细菌及其基因组研究进展. 微生物学报, 2014, 54(7): 728-736. |
| [28] | Wang SB, Qu S. Insect symbionts and their potential application in pest and vector-borne disease control. Bulletin of Chinese Academy of Sciences, 2017, 32(8): 863-872. (in Chinese) 王四宝, 曲爽. 昆虫共生菌及其在病虫害防控中的应用前景. 中国科学院院刊, 2017, 32(8): 863-872. |
| [29] | 骆米娟.南亚实蝇成虫肠道微生物分子多样性分析及引诱效果.福建农林大学硕士学位论文, 2016. |
| [30] | Ami EB, Yuval B, Jurkevitch E. Manipulation of the microbiota of mass-reared Mediterranean fruit flies Ceratitis capitata (Diptera: Tephritidae) improves sterile male sexual performance. The ISME Journal, 2010, 4(1): 28-37. DOI:10.1038/ismej.2009.82 |
| [31] | Hong JF, Ji QE, Chen JH. Effects of irradiated eggs on development and reproduction of Bactrocera dorsalis (Hendel). Journal of Nuclear Agricultural Sciences, 2014, 28(3): 418-422. (in Chinese) 洪静芳, 季清娥, 陈家骅. 卵期辐照对橘小实蝇生长发育繁殖的影响. 核农学报, 2014, 28(3): 418-422. |
| [32] | 赵菊鹏.[32]辐照对桔小实蝇检疫除害及酶活性影响的研究.华南农业大学博士学位论文, 2011. |
