袁远1#, 张佩2#, 何鹏飞1, 唐萍1, 范黎明1, 吴毅歆2,3

 , 何月秋2,3
, 何月秋2,3

1.云南农业大学植物保护学院, 云南 昆明 650201;
2.云南农业大学农学与技术学院, 云南 昆明 650201;
3.微生物菌种筛选与应用国家地方联合工程研究中心, 云南 昆明 650217
收稿日期:2018-05-21;修回日期:2018-07-11;网络出版日期:2018-08-14
基金项目:云南省教育厅项目(2018JS269);云南省玉米产业体系项目(2017KJTX002)
*通信作者:吴毅歆, Tel/Fax:+86-871-65228532, E-mail:535045733@qq.com
何月秋, E-mail:ynfh2007@163.com
#共同第一作者
摘要:[目的] 本研究分离筛选出一株对黄曲霉既有抑制作用又能降解其毒素的拮抗细菌菌株,并将其应用于玉米中的黄曲霉污染防治研究。[方法] 试验通过平板筛选法结合玉米活体筛选法对黄曲霉毒素B1(AFB1)的拮抗细菌进行初筛,以AFB1的降解率和抑制率为指标进行复筛。[结果] 分离到的菌株对黄曲霉菌的抑制率为79.20%,对1 μg/mL的黄曲霉毒素B1的降解率为68.39%。贮藏期玉米含水量在15%-30%时,该菌株对黄曲霉污染的抑制率与玉米含水量成反比,即玉米含水量在15%时其抑制率达92.46%,玉米含水量在30%时其抑制率为19.41%。玉米含水量在28%时,菌株对黄曲霉污染玉米的防治效果达到36.39%。[结论] 筛选出的拮抗菌株为枯草芽孢杆菌,该菌株不仅对黄曲霉菌有抑制作用,而且能减少AFB1对玉米的污染。
关键词:黄曲霉玉米拮抗细菌分离鉴定
Screening and application of an antagonistic bacterium against Aspergillus flavus
Yuan Yuan1#, Pei Zhang2#, Pengfei He1, Ping Tang1, Liming Fan1, Yixin Wu2,3

 , Yueqiu He2,3
, Yueqiu He2,3

1.Faculty of Plant Protection, Yunnan Agricultural University, Kunming 650201, Yunnan Province, China;
2.Faculty of Agronomy and Biotechnology, Yunnan Agricultural University, Kunming 650201, Yunnan Province, China;
3.National and Local Joint Engineering Research Center for Screening and Application of Microbial Strains, Kunming 650217, Yunnan Province, China
Received 21 May 2018; Revised 11 July 2018; Published online 14 August 2018
*Corresponding author: Yixin Wu, Tel/ Fax: +86-871-65228532; E-mail: 535045733@qq.com
Yueqiu He, E-mail: ynfh2007@163.com
Supported by the Scientific Research Foundation of Yunnan Provincial Education Department (2018JS269) and by the Research Program of Yunnan Maize Production System (2017KJTX002)
#Those authors contributed equally to this work
Abstract: [Objective] We isolated bacterial strain that can antagonize the aflatoxin B1 (AFB1) producing fungus Aspergillus flavus in maize seed. [Methods] The plate method and in vivo screening were performed for samples from various sources. The positive bacterial strains were screened by their ability to degrade AFB1 in culture media. [Results] The inhibitory rate of bacterial strain to Aspergillus flavus was 79.2% and its degradation rate was 68.39% in 1 μg/mL AFB1. During storage period, the inhibition rate of the bacterial strain to Aspergillus flavus was inversely proportional to the water content of maize. When the water content in the maize was 15%, 92.46% inhibition rate was recorded, while the inhibition rate of 19.41% was noted with 30% water content in maize. When the maize water content was 28%, the control effect on Aspergillus flavus was 36.39%. [Conclusion] An AFB1-degrading strain not only could inhibit the growth of Aspergillus flavus, but also may control the contamination of AFB1 to maize.
Keywords: Aspergillus flavusmaizeantagonistic bacteriacharacteristics
黄曲霉(Aspergillus flavus)是广泛存在于自然界的一种腐生丝状真菌,寄生于粮食、食品[1]和饲料[2]中生长繁殖,并在此过程中产生黄曲霉毒素(Aflatoxins)。黄曲霉毒素是目前发现的致癌毒性最强的真菌毒素,对人及动物的生长发育、消化功能、造血功能、生殖功能、代谢功能以及免疫功能造成影响,严重危害人类和动物健康[3-7]。据世界粮农组织(FAO)报道,全球每年约有25%的农作物受真菌毒素污染而不能食用,其中AFT污染最为严重[8],其中玉米及其制品,主要为黄曲霉毒素B1 (Aflatoxin B1,AFB1)污染。由于AFB1热稳定,即使烹饪加热也不易降解而威胁人类健康。我国规定玉米、花生中AFB1的最大限量为20 μg/kg,其他农副产品和食品中AFB1含量不得超过5.0-10.0 μg/kg[9]。如何解决AFB1对粮食、食品和饲料的污染已经成为世界性难题。
防止黄曲霉对食品污染的方法主要有物理法、化学法和生物法。物理和化学去除法包括有机溶剂萃取法、吸附剂法、辐照法、高温法、挤压膨化法等。生物去除法[10]包括植物抗原物质去除法和微生物去除法。后者又叫生物脱毒,它是通过微生物细胞的吸附作用和微生物酶的降解作用将霉菌毒素降解为低度或者无毒的物质,不会破坏产品的品质。目前,已经报道降解黄曲霉的真菌有密环菌[11]、黑曲霉菌[12]。能降解黄曲霉的细菌有橙色黄杆菌、醋酸菌、乳酸菌、发酵乳酸杆菌、分支杆菌、红平红球菌、嗜麦芽窄食单胞菌、橙色黏球菌、解淀粉芽孢杆菌、巨大芽孢杆菌、枯草芽孢杆菌、地衣芽孢杆菌、施氏假单胞菌、萎缩芽孢杆菌、甲基营养型芽孢杆菌和蔬菜芽胞杆菌等[13-24]。总体来看,利用细菌减少或去除黄曲霉毒素污染是降解黄曲霉毒素的一条新策略。本研究旨在筛选出具有降解AFB1能力的拮抗细菌,来抑制真菌的生长与产毒,为防治和降低黄曲霉毒素的污染提供依据和技术支撑,为生物防治黄曲霉毒素的污染提供理论基础。
1 材料和方法 1.1 材料 材料为市场收集发霉玉米以及自育品种“云禾单1号”玉米粒。
1.1.1 供试菌株: 供试真菌为黄曲霉菌株HO8-B22,分离自霉变玉米[24];供试细菌为芽孢杆菌,由本实验室保存。
1.1.2 培养基: 试验中所用培养基有PDA培养基和LB培养基。
1.2 黄曲霉孢子悬浮液的制备 将黄曲霉菌株HOB-B22接种在PDA试管斜面,28 ℃培养7 d,用0.9%的生理盐水冲洗斜面制备孢子悬浮液。将孢子浓度调整为105 CFU/mL,于4 ℃条件下保存备用。
1.3 拮抗细菌筛选 取100 μL浓度为105 CFU/mL黄曲霉HO8-B22孢子悬浮液涂布于PDA平板,然后接种实验室保存的生防菌株,28 ℃培养5 d,观察平板中细菌的生长情况及抑菌圈的大小,挑出生长良好且有抑菌圈的细菌进行平板对峙培养,并按照公式(1)计算细菌对黄曲霉的抑制率。
 | 公式(1) |
 | 公式(2) |
将上述对AFB1的降解效果最好的拮抗细菌制备成菌悬液和上清液。菌悬液的制备:移取培养24 h的拮抗细菌发酵液4 mL于离心管中,10000 r/min离心10 min,倒去上清液加无菌生理盐水进行冲洗,10000 r/min离心10 min,如此重复3次,最后向菌体中加4 mL无菌生理盐水,振荡摇匀。
上清液的制备:移取培养24 h的拮抗细菌发酵液4 mL于5 mL离心管中,10000 r/min离心10 min,收集上清液去掉菌体,然后用0.22 μm微孔滤膜过滤得到上清液。然后采取上述降解方法,检测菌悬液和上清液对AFB1的降解效果(公式3)。
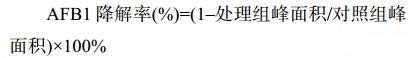 | 公式(3) |
1.6 储藏条件下拮抗细菌抑制黄曲霉生长的研究 采用浸种的方法调节玉米中的水分含量,然后取上述抑制效果较好的几个菌株,在不同水分含量下,观察拮抗细菌对玉米中黄曲霉的抑制效果。不同含水量(15%、20%、25%、30%)的玉米在1%的次氯酸钠溶液中浸泡2 min进行消毒,然后用无菌水冲洗3次,装入组培瓶,每瓶100 g玉米。在无菌条件下向其中分别加200 μL浓度为105 CFU/mL黄曲霉孢子悬浮液、200 μL浓度为109 CFU/mL拮抗细菌菌液作为处理组,对照组加200 μL无菌水,摇匀28 ℃培养7 d,观察各组玉米中黄曲霉的发病情况。然后准确称取5 g玉米样品加入含45 mL无菌水的三角瓶中,混匀,用血球计数板计数并计算黄曲霉孢子浓度(公式4)。
 | 公式(4) |
根据黄曲霉在玉米粒中的污染面积对其进行污染等级划分:0级,未发病;1级,1%-30%;3级,31%-60%;5级,>61%。按下列公式(公式5-6)计算防效。
 | 公式(5) |
 | 公式(6) |
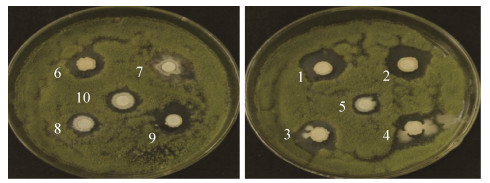 |
| 图 1 拮抗细菌在黄曲霉平板上的生长情况 Figure 1 Antagonistic growth of bacteria on Aspergillus flavus. 1-10 represent the antagonistic strains DJB5, W1, YN2009-65, DYB3, DJB7, GJB9, QJB7, YN2009-B-268, YN2009-B-260 and GJB15. |
| 图选项 |
再将上述10株拮抗细菌与黄曲霉进行平板对峙培养,通过测量菌落直径,得到拮抗细菌对黄曲霉的抑制率(图 2)。其中10株拮抗菌株的抑菌宽度均在5 mm以上,拮抗效果均在70%以上。菌株DJB5和W1对黄曲霉菌的抑制率最高,达79.20%。其次为菌株DYB3和YN2009-B-260,抑制率为77.24%。
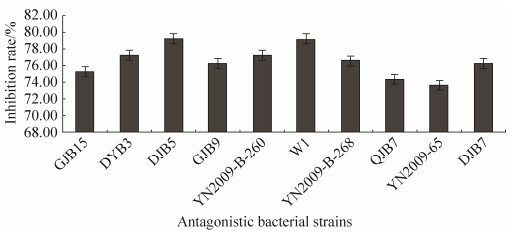 |
| 图 2 拮抗菌株对黄曲霉的抑制作用 Figure 2 Inhibitory effect of antagonistic strains on Aspergillus flavus (P < 0.05). |
| 图选项 |
2.2 黄曲霉拮抗细菌的活体筛选 将上述10株拮抗细菌和黄曲霉菌共培养在消毒过的玉米上,在培养2 d后,对照组长出黄曲霉的白色菌丝,随后菌丝覆盖面积不断扩大,且有黄绿色的黄曲霉孢子产生,随着培养时间的延长,黄曲霉的发病情况不断加重,培养7 d后玉米均被污染且产生大量黄曲霉孢子;处理组比对照组的发病时间晚1-2 d,且黄曲霉的感染率降低,培养7 d时玉米受到黄曲霉不同程度的污染,部分菌落产生黄曲霉孢子,但是黄曲霉孢子的数量较对照组明显减少(图 3)。菌株DJB5、260、DYB3、W1对黄曲霉的抑制率分别为91.15%、88.83%、87.12%、68.33%,表明拮抗细菌起到防治黄曲霉污染的作用(表 1)。
 |
| 图 3 拮抗细菌对黄曲霉污染玉米的抑制效果 Figure 3 Antagonistic effect of antagonistic bacteria on Aspergillus flavus on maize grains. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 and 11 were CK, DJB5, 260, DYB3, W1, YN2009-B-268, QJB7, YN2009-65, GJB15, GJB9 and DJB7. |
| 图选项 |
表 1. 拮抗细菌对黄曲霉的拮抗效果 Table 1. Antagonistic effects of antagonistic bacteria on Aspergillus flavus(x±s, P < 0.05)
| Strains | Aspergillus flavus spore concentration log/(CFU/mL) | Inhibition rate/% |
| CK | 8.09±0.22c | |
| YN2009-65 | 7.94±0.32bc | 23.27±0.34 |
| GJB15 | 7.89±0.33bc | 32.59±0.24 |
| W1 | 7.46±0.25ab | 68.33±0.23 |
| YN2009-B-260 | 7.03±0.37a | 88.83±0.09 |
| DYB3 | 7.16±0.29a | 87.12±0.07 |
| DJB5 | 7.02±0.19a | 91.15±0.03 |
| DJB7 | 7.52±0.34ac | 58.64±0.37 |
| QJB7 | 7.51±0.28ac | 62.76±0.30 |
| GJB9 | 7.55±0.26ac | 60.96±0.29 |
| YN2009-B-268 | 7.91±0.06bc | 30.39±0.28 |
| The values are means of five replicates and their standard deviations. Means with different letters are significantly different according to Duncan's Multiple Range Test (P < 0.05). | ||
表选项
2.3 降解黄曲霉毒素拮抗细菌的筛选 选取了综合效果较好的4株拮抗细菌DJB5、DYB3、W1和YN2009-B-260,在含1 μg/mL AFB1标准品的LB液体培养基中,培养3 d后,用高效液相色谱检测AFB1含量。结果表明这4株拮抗细菌对AFB1的降解率均在60%以上,达极显著水平(表 2),对AFB1均有一定程度的降解能力,其中拮抗细菌DJB5对AFB1的降解率最高,达68.39%。
表 2. 拮抗细菌对AFB1的降解效果 Table 2. Antagonistic effect of the bacteria on aflatoxin B1 (P < 0.05).
| Antagonistic strain | Peak area | Degradation rate/% |
| CK | 71.5a | |
| DJB5 | 22.6b | 68.39 |
| DYB3 | 27.5b | 61.54 |
| W1 | 26.5b | 62.94 |
| YN2009-B-260 | 28.4b | 60.28 |
| Means with different letters are significantly different according to Duncan's Multiple Range Test (P < 0.05). | ||
表选项
选取上述降解AFB1效果最好的拮抗菌株DJB5,再次比较发酵液、菌悬液和上清液降解AFB1的能力。结果表明,DJB5菌株发酵液、菌悬液、上清液各处理组的峰面积分别为71.5、22.6、29.1、59.8 (图 4),对AFB1的降解率分别为68.39%、59.30%、16.36%。其中发酵液和菌悬液对毒素的降解效果较好,上清液的降解效果最差。这说明该菌株发酵液中的抗菌物质也能抑制和降解毒素污染的发生。
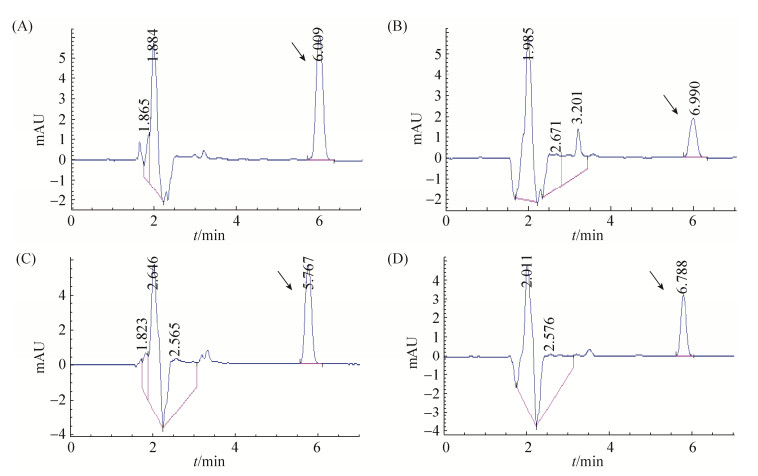 |
| 图 4 高效液相色谱检测图 Figure 4 High performance liquid chromatography. A: control group; B: DJB5 fermentation broth; C: DJB5 supernatant; D: DJB5 suspension. |
| 图选项 |
2.4 储藏条件下拮抗细菌抑制黄曲霉生长的研究 将不同水分含量(15%、20%、25%、30%)的玉米经过消毒处理后,接种拮抗细菌与黄曲霉菌在28 ℃培养7 d。结果发现,在培养2 d后,对照组玉米表面长出微量黄曲霉的白色菌丝,随后菌丝在玉米中的侵染面积不断扩大,且伴随黄绿色的黄曲霉孢子产生,随着培养时间的推移,黄曲霉的发病情况不断加重,培养7 d后玉米均被污染且产生大量黄曲霉孢子;处理组比对照组晚1-2 d发病,且黄曲霉的感染率降低,培养7 d时玉米受到黄曲霉不同程度的污染,部分菌落产生黄曲霉孢子,但是黄曲霉孢子的产量较对照组明显减少。对照组发病快,且发病严重。从图 5可知,4株拮抗细菌在玉米水分为15%时对黄曲霉的抑制率较高,DJB5抑制率最高,达92.46%,W1抑制率最低,达57.95%。但是随着玉米水分含量的升高,拮抗细菌对黄曲霉的抑制效果逐渐下降,当水分含量为30%时,拮抗细菌YN-2009-B-260、DYB3、DJB5、W1对黄曲霉的抑制率分别降至33.69%、22.30%、19.41%、13.6 3%。可见,玉米水分含量在15%-30%范围内,玉米水分含量越高越有利于黄曲霉的生长。低水分含量有利于拮抗细菌抑制黄曲霉的生长。在实际应用中降低粮食水分含量有利于拮抗细菌的抑制作用。
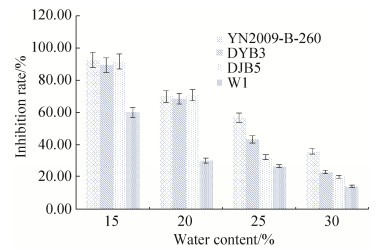 |
| 图 5 拮抗细菌YN-2009-B-260、DYB3、DJB5、W1在不同水分条件下对玉米中黄曲霉的抑制效果 Figure 5 Inhibitory effect of antagonistic bacteria YN-2009-B-260, DYB3, DJB5, W1 on Aspergillus flavus on maize with different water contents. |
| 图选项 |
2.5 拮抗菌株DJB5对黄曲霉毒素污染玉米的防治效果 在对黄曲霉污染玉米的防治研究中,结果表明对照组中的玉米发病较为严重,病情指数为61.44%;拮抗菌株DJB5处理组中的玉米发病较轻,病情指数39.04%;DJB5对黄曲霉污染玉米的防治效果达到36.39% (表 3)。通过各处理玉米样品中的AFB1检测结果发现,DJB5处理组中的AFB1含量低于对照组,对AFB1减少88.78% (表 3和图 6),可见拮抗菌株DJB5不仅对黄曲霉菌有抑制作用,而且能减少AFB1对玉米的污染。
表 3. DJB5对黄曲霉污染玉米的防治和AFB1降解率 Table 3. Control effect of DJB5 on contamination of Aspergillus flavus on maize seeds (x±s)
| Treatment | Disease index/% | Control effect/% | Peak area | Degradation/% |
| CK | 61.44±0.03a | 641.8a | ||
| DJB5 | 39.04±0.02b | 36.39±0.04 | 72.03±21.98b | 88.78±0.03 |
| Means with different letters are significantly different according to Duncan's Multiple Range Test (P < 0.05). | ||||
表选项
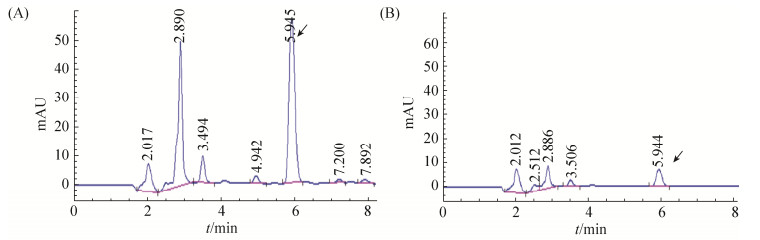 |
| 图 6 玉米粒上AFB1的高效液相色谱图 Figure 6 Profiles of aflatoxin B1 in contaminated maize grains with high performance liquid chromatography. A: control group; B: treatment group. |
| 图选项 |
3 讨论 生防细菌的筛选与利用在植物病害生防中发挥重要作用,有利于环境安全及人体健康,亦是近年来真菌毒素防治研究的热点。人们通常是在平板上进行分离和筛选工作,除了寄生、拮抗等作用机制外,许多通过其他机制起作用的菌株会被漏选。为了弥补平板筛选的局限性,本试验采用玉米活体筛选法对拮抗菌株的拮抗效果进行再验证。在拮抗细菌发酵液与黄曲霉孢子共培养时,黄曲霉孢子虽然萌发但生长显著慢于空白对照。表明拮抗细菌的菌体本身和发酵液均具抑菌作用。本实验通过筛选获得一株芽孢杆菌DJB5,培养7 d后对黄曲霉孢子的抑制率高达91.15%,明显高于王德培等[18]、饶胜其等[19]、韩愈杰等[20]和刘丁等[21]报道的菌株。
在分解黄曲霉毒素的实验中,分别用菌体的发酵液、菌悬液、上清液来对1 μg/mL的AFB1进行降解,发现发酵液对AFB1的降解作用要高于菌悬液、上清液对毒素的去除作用,且发酵液降解效果最好,处理3 d时达68.39%,菌悬液的效果接近发酵液为59.30%,其效果优于其他报道[14, 20, 22],但究竟是何种机制在起作用,还有待深入研究。
岳晓禹等[23-24]报道,当在相同水分含量下,黄曲霉的生长速率随着温度的升高而升高,当温度条件相同时,黄曲霉的生长速率与玉米中水分含量呈正相关,温度和湿度是影响贮藏玉米中黄曲霉生长的主要生态因子。研究发现,当玉米水分含量为28%、28 ℃培养、黄曲霉孢子浓度为102 CFU/mL时,该菌株对玉米中黄曲霉污染的防治效果达到36.9%,对AFB1的降解率达到88.78%。DJB5是球花石斛的内生菌,它既能抑制黄曲霉病原菌又能降解黄曲霉毒素,具有抑制和脱毒双重功能,具有防治黄曲霉污染的应用潜力,同时,它对石斛本身的药效是否也起到作用,以及它的耐热性、降解活性,相关的酶或其他活性物质,以及代谢产物,均有待进一步研究。
References
| [1] | Wang W, Li G, Wei YX. Research status of aflatoxin contamination in China. Journal of Anhui Agricultural Sciences, 2015, 43(18): 308-309. (in Chinese) 王雯, 李岗, 魏云潇. 我国食品中黄曲霉毒素污染现状的研究. 安徽农业科学, 2015, 43(18): 308-309. DOI:10.3969/j.issn.0517-6611.2015.18.107 |
| [2] | Liu FZ, Sun HM, Lian XH, Li CF, Cong QX, Zhang TT, Yin XL, Gu W. Analysis of contamination status of aflatoxin B1 in feed and feed ingredients in 2014. Guangdong Feed, 2015, 24(3): 45-46. (in Chinese) 刘凤芝, 孙合美, 廉新慧, 李春凤, 丛秋霞, 张甜甜, 尹训兰, 谷巍. 2014年饲料及饲料原料中黄曲霉毒素B1污染状况的分析. 广东饲料, 2015, 24(3): 45-46. DOI:10.3969/j.issn.1005-8613.2015.03.018 |
| [3] | Li M, Qin RF, Chen DH. The effect of aflatoxin on livestock and poultry and the method of detoxification. Henan Journal of Animal Husbandry and Veterinary Medicine, 2008, 29(3): 35-36. (in Chinese) 李敏, 秦锐峰, 陈岱辉. 黄曲霉毒素对畜禽的影响及去毒方法. 河南畜牧兽医, 2008, 29(3): 35-36. DOI:10.3969/j.issn.1004-5090.2008.03.025 |
| [4] | Farombi EO. Aflatoxin contamination of foods in developing countries:implications for hepatocellular carcinoma and chemopreventive strategies. African Journal of Biotechnology, 2006, 5(1): 1-14. |
| [5] | Gong YY, Hounsa A, Egal S, Turner PC, Sutcliffe AE, Hall AJ, Cardwell K, Wild CP. Postweaning exposure to aflatoxin results in impaired child growth:A longitudinal study in Benin, West Africa. Environmental Health Perspectives, 2004, 112(13): 1334-1338. DOI:10.1289/ehp.6954 |
| [6] | Zhen YZ, Liu GT. Research progress on carcinogenicity of mycotoxins in China. Acta Academiae Medicinae Henan, 1983(3): 72-74. (in Chinese) 甄应中, 刘桂亭. 国内真菌毒素致癌性的研究进展. 河南医学院学报, 1983(3): 72-74. |
| [7] | Li JX, Ouyang SZ, Wang XP. Injuries of aflatoxin to animals and protective functions of selenium. Journal of Henan Vocation-Technical Teachers College, 2003, 31(2): 50-54. (in Chinese) 李敬玺, 欧阳素贞, 王学平. 黄曲霉毒素对机体的损害与硒的保护作用. 河南职业技术师范学院学报, 2003, 31(2): 50-54. DOI:10.3969/j.issn.1673-6060-B.2003.02.015 |
| [8] | Wild CP, Gong YY. Mycotoxins and human disease:a largely ignored global health issue. Carcinogenesis, 2010, 31(1): 71-82. DOI:10.1093/carcin/bgp264 |
| [9] | 中华人民共和国卫生部.食品中真菌毒素限量.北京: 中国标准出版社, 2011. |
| [10] | Wang HL, Fan HT, Lu WY. Patent technology of aflatoxin detoxification method. Journal of Anhui Agricultural Sciences, 2015, 43(17): 291-293. (in Chinese) 王慧林, 樊海涛, 卢文英. 黄曲霉毒素脱毒方法专利技术综述. 安徽农业科学, 2015, 43(17): 291-293. DOI:10.3969/j.issn.0517-6611.2015.17.103 |
| [11] | Liu DL, Yao DS, Huang BH, Xie CF, Liang YQ, Ma L. Characterization of immobilized aflatoxin-detoxizyme. Chinese Journal of Biotechnology, 2003, 19(5): 603-607. (in Chinese) 刘大岭, 姚冬生, 黄炳贺, 谢春芳, 梁郁强, 马林. 黄曲霉毒素解毒酶的固定化及其性质的研究. 生物工程学报, 2003, 19(5): 603-607. DOI:10.3321/j.issn:1000-3061.2003.05.018 |
| [12] | Chen ZH, Xu X, Li ZY, Cheng BJ. Study on the effect factors of degradation of aflatoxin B1 by Aspergillus niger. Food Research and Development, 2015, 36(12): 110-113. (in Chinese) 陈志辉, 徐馨, 李仲玉, 程宝晶. 黑曲霉菌降解黄曲霉毒素B1的影响因素的研究. 食品研究与开发, 2015, 36(12): 110-113. DOI:10.3969/j.issn.1005-6521.2015.12.028 |
| [13] | Smiley RD, Draughon FA. Preliminary evidence that degradation of aflatoxin B1 Flavobacterium aurantiacum is enzymatic. Journal of Food Protection, 2000, 63(3): 415-418. DOI:10.4315/0362-028X-63.3.415 |
| [14] | Xu J, Ji R. The effect of lactic acid bacteria on the growth and production of fungi. Foreign Medical Hygienic Register, 2001, 28(4): 237-240. (in Chinese) 徐进, 计融. 乳酸菌对霉菌生长及产毒的影响. 国外医学(卫生学分册), 2001, 28(4): 237-240. |
| [15] | Teniola OD, Addo PA, Brost IM, F?rber P, Jany KD, Alberts JF, van Zyl WH, Steyn PS, Holzapfel WH. Degradation of aflatoxin B1 by cell-free extracts of Rhodococcus erythropolis and Mycobacterium fluoranthenivorans sp. nov. DSM44556T. International Journal of Food Microbiology, 2005, 105(2): 111-117. DOI:10.1016/j.ijfoodmicro.2005.05.004 |
| [16] | Zhai CP, Kong Q, Guan B, Lv ZL, You Y, Gao YY, Yang YY. Statistical experimental methods for optimizing the cultivating conditions for Rhodococcus erythropolis. African Journal of Biotechnology, 2011, 10(42): 8502-8510. DOI:10.5897/AJB |
| [17] | Li JX, Liang ZH, Guan S, Wang X, Wang N, Ji C, Niu TG. Screening and identification of aflatoxin B1 degradation strains. Scientia Agricultura Sinica, 2008, 41(5): 1459-1463. (in Chinese) 李俊霞, 梁志宏, 关舒, 汪晓, 王宁, 计成, 牛天贵. 黄曲霉毒素B1降解菌株的筛选及鉴定. 中国农业科学, 2008, 41(5): 1459-1463. DOI:10.3864/j.issn.0578-1752.2008.05.026 |
| [18] | Wang N, Ma QG, Ji C, Guan S, Niu TG. Screening of culture condition for aflatoxin B1 transformation enzyme from Myxococcus fulvus. Journal of China Agricultural University, 2009, 14(2): 27-31. (in Chinese) 王宁, 马秋刚, 计成, 关舒, 牛天贵. 黏细菌降解黄曲霉毒素B1的产酶条件优化. 中国农业大学学报, 2009, 14(2): 27-31. DOI:10.3321/j.issn:1007-4333.2009.02.006 |
| [19] | Wang DP, Meng H, Guan XL, Luo XG. Identification of bacillus amyloliquefaciens BI2 and its antagonistic activity against Aspergillus flavus. Journal of Tianjin University of Science & Technology, 2010, 25(6): 5-9. (in Chinese) 王德培, 孟慧, 管叙龙, 罗学刚. 解淀粉芽孢杆菌BI2的鉴定及其对黄曲霉的抑制作用. 天津科技大学学报, 2010, 25(6): 5-9. DOI:10.3969/j.issn.1672-6510.2010.06.002 |
| [20] | Rao SQ, Chen SY, Gao L, Yin YQ, Yang ZQ, Fang WM. Screening, identification, and antifungal properties of a bacterial strain F1 with antagonistic activities against Aspergillus flavus. Modern Food Science and Technology, 2015, 31(12): 99-105. (in Chinese) 饶胜其, 陈素雅, 高璐, 尹永祺, 杨振泉, 方维明. 一株黄曲霉拮抗细菌F1的筛选、鉴定及其抑菌特性. 现代食品科技, 2015, 31(12): 99-105. |
| [21] | Li CB, Li WM, Yang WH, Li HX, Liu XH, Cao YS. Isolation and characterisation of an aflatoxin B1-degrading bacterium. Acta Microbiologica Sinica, 2012, 52(9): 1129-1136. (in Chinese) 李超波, 李文明, 杨文华, 李海星, 刘晓华, 曹郁生. 黄曲霉毒素B1降解菌的分离鉴定及其降解特性. 微生物学报, 2012, 52(9): 1129-1136. |
| [22] | 韩愈杰.黄曲霉拮抗菌株的分离筛选及对黄曲霉毒素的降解效果.河北农业大学硕士学位论文, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10086-1015381925.htm |
| [23] | Yue XY, Li ZG, Hao XZ, Xu J, Liu XD, Niu TG. Simulation of effect of main ecological factors on radial growth of Aspergillus flavus during storage period of corn. Transactions of the Chinese Society of Agricultural Engineering, 2013, 29(18): 269-276. (in Chinese) 岳晓禹, 李自刚, 郝修振, 徐军, 刘相东, 牛天贵. 主要生态因子对贮藏玉米中黄曲霉生长影响的模拟. 农业工程学报, 2013, 29(18): 269-276. DOI:10.3969/j.issn.1002-6819.2013.18.032 |
| [24] | Zhang P, He PF, Li ZX. Isolation and characterisation of aflatoxigen strains in corn. Southwest China Journal of Agricultural Sciences, 2017(30): 146-150. (in Chinese) 张佩, 何鹏飞, 李智新. 玉米中产黄曲霉毒素菌株的分离与鉴定. 西南农业学报(增刊), 2017(30): 146-150. |
| [25] | Shi JY, Ning H, Xu R, Gao ZX, Yu Y, Liu B, Ke YP, Sun Q. Inhibitory effect on the growth and aflatoxin-production of Aspergillus flavus by ClO2 and its application in corn of high water content. China Measurement & Test, 2017, 43(10): 47-52. (in Chinese) 史健阳, 宁华, 徐冉, 高珍璇, 余洋, 刘保, 柯永培, 孙群. 二氧化氯抑制黄曲霉菌生长和产毒能力及其在高水分玉米中的应用. 中国测试, 2017, 43(10): 47-52. DOI:10.11857/j.issn.1674-5124.2017.10.010 |
