宁楚涵1,2, 李文彬1, 张晨1,2, 刘润进1,2


1. 青岛农业大学菌根生物技术研究所, 山东 青岛 266109;
2. 青岛农业大学植物医学学院, 山东 青岛 266109
收稿日期:2018-12-12;修回日期:2019-04-10;网络出版日期:2019-04-24
基金项目:国家自然科学基金(31470101);青岛市民生科技计划(17-3-3-57-nsh)
*通信作者:刘润进, Tel:+86-532-88030113, E-mail:liurjsswl@126.com.
摘要:[目的] 旨在分离、筛选并鉴定体外具抑菌促生作用的定殖于植物根内和根围的放线菌,以期丰富放线菌种质资源,为研制植物病害生防菌剂提供技术依据。[方法] 采用稀释涂布平板法分离盐碱地、湿地、工业污染土壤中优势植物根内及其根围中的放线菌;通过平板对峙试验筛选具有抑菌效应的菌株,进而采用Salkowski比色法、CAS平板检测法和无氮源培养法进一步检测抑菌菌株的促生作用;通过形态观测、生理生化特性检测及16S rRNA基因序列分析鉴定菌种。[结果] 共分离到链霉菌属(Streptomyces)、诺卡氏菌属(Nocardia)和小单孢菌属(Micromonospora)3属共283株定殖于植物根内和根围的放线菌,3个采样地中湿地数量最多,均为根围土>根内;其中链霉菌属占总数的77%,可分为10个类群。经筛选获得7株抑菌活性和促生效应较强的菌株,其中菌株H6-1抑菌效应最大,其无菌发酵液对尖孢镰刀菌(Fusarium oxysporum)、禾谷镰刀菌(Fusarium graminearum)、灰葡萄孢菌(Botrytis cinerea)、立枯丝核菌(Rhizoctonia solani)、轮纹大茎点霉(Macrophoma kawatsukai)和瓜类炭疽菌(Colletotrichum orbiculare)的抑制率分别为32.3%、42.6%、48%、72.2%、58.1%和60.5%;而D11-4菌株的促生作用最强,能产吲哚乙酸(22.3 mg/L)、产铁载体(晕圈直径25.2 mm)和固氮。经鉴定这7株放线菌是吸水链霉菌变种(Streptomyces angustmyceticus)H4-6、娄彻氏链霉菌(Streptomyces rochei)S2-2、浑圆链霉菌(Streptomyces globosus)H6-1、(Streptomyces iakyrus)GD8-4、波卓链霉菌(Streptomyces bottropensis)GH8-6、(Streptomyces paradoxus)H8-2和(Streptomyces coralus)D11-4。[结论] 三个生境中定殖于植物根内和根围的放线菌类群丰富且所筛选获得的7株放线菌具有生防潜力,值得进一步研发。
关键词:根内根围放线菌抑菌活性促生作用生物防治
Isolation and identification of antagonizing and growth-promoting actinobacteria colonized in plant roots and rhizosphere
Chuhan Ning1,2, Wenbin Li1, Chen Zhang1,2, Runjin Liu1,2


1. Institute of Mycorrhizal Biotechnology, Agricultural University of Qingdao, Qingdao 266109, Shandong Province, China;
2. Plant Medical College, Agricultural University of Qingdao, Qingdao 266109, Shandong Province, China
Received: 12 December 2018; Revised: 10 April 2019; Published online: 24 April 2019
*Corresponding author: Runjin Liu, Tel:+86-532-88030113, E-mail:liurjsswl@126.com.
Foundation item: Supported by the National Natural Science Foundation of China (31470101), by the Qingdao People's Livelihood Science and Technology Project (17-3-3-57-nsh)
Abstract: [Objective] The aim of this study was to enrich species resources of actinobacteria colonized in plant roots and rhizosphere through isolating, screening and identifying and to provide resources for the development of biocontrol agents via examining the effects of these actinobacteria on antagonizing plant pathogens and promoting plant growth. [Methods] Actinobacteria were isolated from roots and rhizosphere of dominant herbaceous plants grown in three habitats (saline-sodic, wet, and polluted land) using the dilution plate method. The antibacterial strains were screened by plate confrontation test. Then Salkowski colorimetry, Chrome Azurol S plate assay and nitrogen free culture were used to further detect their effect on promoting plant growth. The isolated strains were examined by the combined morphological, physiological and biochemical characteristics and 16S rRNA gene sequence analysis for taxonomical identification. [Results] A total of 283 isolates of actinobacteria colonized in plant roots and rhizosphere, belonging to genera Streptomyces, Nocardia and Micromonospora, were obtained. Among them, 77% belonged to 10 groups of the genus Streptomyces. Seven strains showed strong antagonizing activity and plant growth-promoting effects. Strain H6-1 gave the most significant antagonizing effect among the seven strains, and its fermentation broths inhibition ratio to pathogens Fusarium oxysporum, Fusarium, Botrytis cinerea, Rhizoctonia solani, Macrophoma kawatsukai, and Colletotrichum orbiculare were 32.3%, 42.6%, 48%, 72.2%, 58.1% and 60.5%, respectively. Strain D11-4 showed the strongest plant growth-promoting effect, which was found to be capable of producing IAA (22.3 mg/L), iron carrier (halo diameter 25.2 mm) and fixing nitrogen from air. The seven species of the actinobacteria were identified as Streptomyces angustmyceticus H4-6, Streptomyces rochei S2-2, Streptomyces globosus H6-1, Streptomyces iakyrus GD8-4, Streptomyces bottropensis GH8-6, Streptomyces paradoxus H8-2, and Streptomyces coralus D11-4. [Conclusion] The three habitats had abundant species of actinobacteria colonized in plant roots and rhizosphere, and the seven selected actinobacteria isolates were proven to possess biocontrol potential, which is worth of further research and development.
Keywords: plant rootsrhizosphereactinobacteriaantagonizing activitygrowth-promoting effectbiological control
放线菌(Actinobacteria)是重要的原核生物种质资源。近年来,人们更加重视对新型或独特的放线菌资源进行挖掘。除了定殖动物体表和体内的放线菌、海洋与极端生态环境中游离分布的放线菌外,还有一类定殖于植物根内和根围的放线菌,该类群的放线菌具有较丰富的物种多样性,对植物的生长、抗逆性以及生态系统的稳定与可持续发展具有不可替代的作用[1-3]。
研究表明,这些定殖植物根内和根围的放线菌能产生抗生素等次生代谢活性物质,抑制植物病原物,提高植物抗病性[4-5]。从土壤中筛选的放线菌菌株BZ45对玉米大斑病菌具有较强的拮抗作用[6]。定殖番茄植株体内的放线菌St24的提取物可抑制多种病原物,其中,对灰葡萄孢菌的抑制作用最强[7]。从刺五加中分离的链霉菌对苹果的5种病原真菌(尖孢镰刀菌、层出镰刀菌、串珠镰刀菌、腐皮镰刀菌和立枯丝核菌)具有拮抗效应[8]。放线菌AGRS8和SORS119可造成约80%-100%的致倦库蚊四龄幼虫死亡[9]。放线菌还能改善植物根围微环境,在保护植物根系和增强植物抗逆性等方面也发挥一定作用[10-11]。粗枝木麻黄与弗兰克氏菌共生提高了前者的抗盐性[12]。放线菌产生的耐热和抗干燥的孢子,可于逆境下长期存活;产生的菌丝体定殖植物的能力较强,这均有利于诱导寄主植物产生抗性[13]。
定殖植物根内和根围的放线菌还能以结瘤固氮、溶磷、分泌生长素、产生铁载体等作用机制促进寄主植物生长[14]。Goudjal等[15]从5种沙漠植物分离的放线菌可产生吲哚乙酸(IAA),促进番茄种子发芽和根的伸长。接种放线菌后产生的激素促进了大豆植株吸收和运转养分,以及柑橘幼苗的生长[16-17]。链霉菌属菌株GMKU3100能产生噬铁素,将其接种水稻和绿豆后,增加了植株铁元素的吸收[18]。薛冬等[19]从牡丹根围分离出具有较强溶磷能力的放线菌PSPSA1,接种处理的土壤有效磷含量比对照增加68%。链霉菌属放线菌WZS021能促进甘蔗根系吸收氮素,茎和根内N含量分别增加30%和36%[20]。
可见,该类群放线菌在植物保护、促进农林牧业生产以及生物农药研制等方面具有重要研究与应用价值。然而,由于其在分离培养基上不易生长、培养周期长和容易污染等方面的限制,自然生境中分布的诸多新种及其新功能尚未获得发掘。因此,对特殊生境中放线菌开展分离筛选工作,可望丰富中国的放线菌种质资源,并且可为进一步开发和利用提供技术依据。山东青岛环胶州湾地区分布有大面积滨海盐渍土,在海陆交互作用以及土壤水盐比例失调的环境中,可能存在独特功能的放线菌物种;被誉为“地球之肾”的湿地是陆地环境向水生环境的过渡,具有较高的生态多样性和物种多样性,蕴藏着丰富的微生物资源,值得进一步调查探究;而工业污染区重金属含量高,土壤贫瘠,是否分布着具有耐重金属毒性与增强植物抗逆性的放线菌资源,同样值得探索。本研究从盐碱地、湿地和工业污染区土壤中生长的优势草本植物根系及其根围采集样品,旨在分离鉴定和初步筛选具有抗菌活性与促生能力的放线菌菌株,以期丰富中国放线菌资源,为进一步开展植物病害绿色防控技术的研发提供依据和技术基础。
1 材料和方法 1.1 试验材料
1.1.1 样品采集: 2017年10月上旬自山东青岛市胶州湾盐碱地、胶州少海湿地公园和城阳区工业污染区(119°37′-120°20′E,36°00′-36°30′N)按5点取样法采集样地优势草本植物根系与根围土壤500 g (表 1)。记录采样时间、地点等,样品保存于4 ℃冰箱。
表 1. 样品采集地概况 Table 1. Environmental parameters of the sampling sites.
| Sampling sites | Dominant vegetation | Soil type | Soil texture | Organic matter/(g/kg) | Soil pH |
| Jiaozhou Bay saline-sodic land | Pennisetum alopecuroides Artemisia anethifolia | Saline-sodic soil | Loam | 7.82±0.6 | 8.5±0.5 |
| Jiaozhou Bay Wetland Park | Gladiolus gandavensis Phragmites australis Hemerocallis fulva | Brown earth | Clay soil | 12.47±2.1 | 7.3±0.3 |
| Chengyang industrial polluted land | Plantago depressa Portulaca oleraceal Taraxacum mongolicum | Brown earth | Sandy soil | 9.34±1.4 | 5.9±0.2 |
表选项
1.1.2 培养基: (1) 分离培养基:高氏1号培养基可溶性淀粉20 g、KNO3 1 g、K2HPO4 0.5 g、MgSO4 0.5 g、NaCl 0.5 g、FeSO4 0.01 g、琼脂20 g、pH 7.4-7.6和蒸馏水1000 mL。(2)发酵培养基:液体高氏1号培养基。(3)抑菌活性培养基:PDA培养基,马铃薯200 g、葡萄糖20 g、琼脂20 g和蒸馏水1000 mL。(4)促生作用培养基:吲哚乙酸鉴定培养基[21]、CAS检测培养基[22]和无氮固体培养基[23]。(5)生理生化特征培养基:按徐丽华等[24]描述的方法配制。
1.1.3 供试病原真菌: 尖孢镰刀菌黄瓜专化型(Fusarium oxysporum f.sp. cucumerinum,Foc)由中国农业科学院植物保护研究所提供;禾谷镰刀菌(Fusarium graminearum)、灰葡萄孢(Botrytis cinerea)、立枯丝核菌(Rhizoctonia solani)、轮纹大茎点霉(Macrophoma kawatsukai)和瓜类炭疽菌(Colletotrichum orbiculare)均由本校植物医学学院植物病理学研究室分离和保存。
1.2 放线菌的分离纯化 将植物根系洗净后依次用75%无水乙醇漂洗5 min、2%次氯酸钠漂洗3 min和无菌水冲洗3 min,将最后一次冲洗的无菌水取200 μL涂布于分离培养基置于28 ℃培养7 d,检测消毒结果。将彻底消毒后的根系置于研钵研磨均匀,采用稀释涂布平板法分离,取10-4稀释度根系组织悬液200 μL涂布于分离培养基,28 ℃培养5-7 d,挑取放线菌单菌落,采用平板划线法纯化2次,斜面保存4 ℃冰箱中。从植物根围土壤中的分离和纯化方法与上述相同。
1.3 抗菌活性菌株筛选 采用平板对峙培养法,筛选具有抗菌活性的放线菌。将病原菌和待测放线菌分别在PDA培养基和高氏1号培养基上活化5 d,将各病原菌用5 mm打孔器制成菌饼倒接于PDA平板中央,在病原菌左右两侧、距培养皿边缘2 cm处倒接放线菌菌饼5 mm,3次重复,设不接种放线菌菌饼为对照。28 ℃下培养5-7 d后观察抑菌带判断有无抗菌活性。
1.3.1 无菌发酵液抗菌活性检测: 发酵液制备,选取抗菌效应较大的放线菌,将其4块5 mm菌饼接种于100 mL高氏1号液体培养基中,28 ℃,160 r/min振荡培养7 d。培养结束后取发酵液于4000 r/min离心20 min,收集上清液,用0.22 μm微孔滤膜过滤除菌,将无菌发酵液于4 ℃保存备用。
将无菌发酵液以体积分数20%的比例与50 ℃左右PDA培养基迅速混匀,以加等量无菌水的处理为对照,每个培养皿倾倒30 mL。培养基凝固后挑取5 mm病原菌菌饼倒贴于平板中央,于28 ℃培养5-7 d,采用十字交叉法测量各病原菌菌落直径大小(公式1),并根据公式计算菌丝生长抑制率(公式2)。每个处理重复3次。
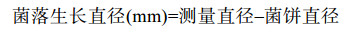 | 公式(1) |
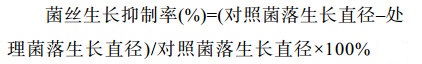 | 公式(2) |
1.3.2 产IAA活性定性定量检测: 采用Salkowski比色法对具有抗菌活性放线菌进行产IAA活性测定[25]。将放线菌接种于含色氨酸0.5 g/L的高氏1号液体培养基中,于28 ℃、150 r/min振荡培养14 d。发酵液经8000 r/min,离心10 min后取上清液10 mL,滴加2 mL Salkowski显色剂,室温避光显色30 min,变粉红色为阳性,表示有产IAA活性。定量测定时,显色后快速测定反应液530 nm吸光值,以不添加放线菌的培养基为对照,配制不同浓度IAA溶液为标样测定吸光度,绘制标准曲线计算IAA的含量(mg/L)。
1.3.3 产铁载体活性定性检测: 菌株产铁载体活性测定参照Milagres[26]的方法,制作通用CAS检测平板。挑取5 mm待测菌饼接于检测平板,28 ℃暗培养5-7 d。根据菌株周围能否产生橙黄色晕圈,判断菌株是否具有产铁载体活性。
1.3.4 固氮作用检测: 参照白娟娈[23]的方法将待测放线菌接种于无氮培养基中,28 ℃培养5-7 d,观察菌株在该检测培养基上的生长状况,将能够生长的菌株进行转接,若菌株转接5次后还能生长,则判定该菌株具有固氮的潜在活性。
1.3.5 放线菌的形态观测、生理生化特性测定及分子鉴定: 采用插片法观察描述具有抗菌促生效应的放线菌菌株的菌落形态特征,并参照《伯杰细菌鉴定手册》进行其生理生化特征鉴定[27]。依据Ming等[28]的方法提取待测菌株总DNA并进行PCR扩增。扩增引物为通用引物27 f和1492 r,反应条件:95 ℃ 5 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min 30 s;72 ℃ 7 min,35个循环。将扩增产物送至上海派森诺生物科技股份有限公司测序。将获得的序列提交到NCBI的GenBank数据库,BLAST搜索与之相近的菌株16S rRNA序列,用MEGA 5.0软件采用邻接法(Neighbor- Joining)构建系统发育树。通过生物信息学分析确定放线菌菌种。
2 结果和分析 2.1 放线菌的类群与分布特征 从3个样地草本植物根系和土壤中共分离到283株定殖于植物根内和根围的放线菌(表 2),湿地数量 > 盐碱地数量 > 工业污染区数量,根围土数量 > 根内数量;其中,链霉菌属(Streptomyces)占总数的77%,其次为小单孢菌属(Micromonospora)和诺卡氏菌属(Nocardia)的菌株。依据气丝、基丝及可溶性色素的特征链霉菌可初步分为10个类群(表 3)。所有样地均呈现土壤中链霉菌类群多于根内,其中湿地土壤及根内链霉菌类群数量都为最多,盐碱地次之,工业污染地最少;湿地以白孢、灰褐和灰红紫类群为主,吸水类群数量也显著多于其他样地;工业污染地以烬灰、白孢类群为主;盐碱地以黄色类群和灰褐类群为主。经去重复后,从中选取74株菌株进行下一步试验。
表 2. 分离所得283株定殖于植物根内和根围的放线菌分布情况 Table 2. Distribution of the 283 isolates of actinobacteria isolated from plant roots and rhizosphere
| Colonization distribution of isolates | Wetland | Industrial polluted land | Saline-sodic land |
| Numbers of isolates colonized in root | 44 | 15 | 33 |
| Numbers of isolates colonized in rhizosphere | 77 | 58 | 56 |
| Total | 121 | 73 | 89 |
表选项
表 3. 不同样地链霉菌类群分布情况 Table 3. Distribution of Streptomyces groups in different sampling sites
| Streptomyces groups | Wetland | Industrial polluted land | Saline-sodic land | |||||
| Numbers of isolates in root | Numbers of isolates in soil | Numbers of isolates in root | Numbers of isolates in soil | Numbers of isolates in root | Numbers of isolates in soil | |||
| Albosporus | 6 | 11 | 6 | 8 | 4 | 7 | ||
| Globisporus | 3 | 2 | 0 | 0 | 0 | 2 | ||
| Hygroscopicus | 2 | 9 | 0 | 1 | 0 | 0 | ||
| Griseofuscus | 7 | 8 | 2 | 3 | 7 | 8 | ||
| Cinereus | 2 | 5 | 5 | 10 | 2 | 4 | ||
| Lavendulae | 0 | 2 | 1 | 3 | 0 | 1 | ||
| Griseorubroviolaceus | 6 | 8 | 4 | 6 | 3 | 6 | ||
| Roseosporus | 1 | 2 | 0 | 2 | 2 | 3 | ||
| Flavus | 3 | 5 | 3 | 9 | 9 | 12 | ||
| Cyaneus | 0 | 1 | 0 | 0 | 1 | 1 | ||
| Total | 30 | 53 | 21 | 42 | 28 | 44 | ||
表选项
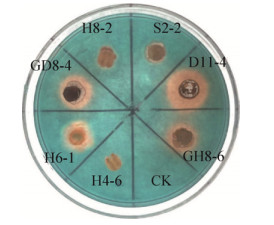
2.2 定殖植物根内和根围的放线菌体外拮抗病原真菌的效应 取74株放线菌分别与禾谷镰刀菌、尖孢镰刀菌或灰葡萄孢进行对峙培养。其中,18株具有抑制灰葡萄孢的效应,占总数的24%;12株能抑制禾谷镰刀菌,占16%;9株抑制尖孢镰刀菌占12%。S2-2、H6-1、GH8-6和H4-6对3种病原真菌均有明显抑菌带出现,表明具有较强的拮抗效果。GD8-4和H8-2对禾谷镰刀菌和灰葡萄孢、D11-4对尖孢镰刀菌和灰葡萄孢均具有明显抑制效应(图 1)。这7株放线菌中H6-1、H4-6和H8-2分离自湿地植物根围土,GH8-6分离自湿地植物根内,D11-4分离自盐碱地植物根围土,GD8-4分离自盐碱地植物根内,S2-2分离自工业污染区植物根围土。选取以上7株放线菌作为高效拮抗菌株继续进行无菌发酵液抑菌效果测定。
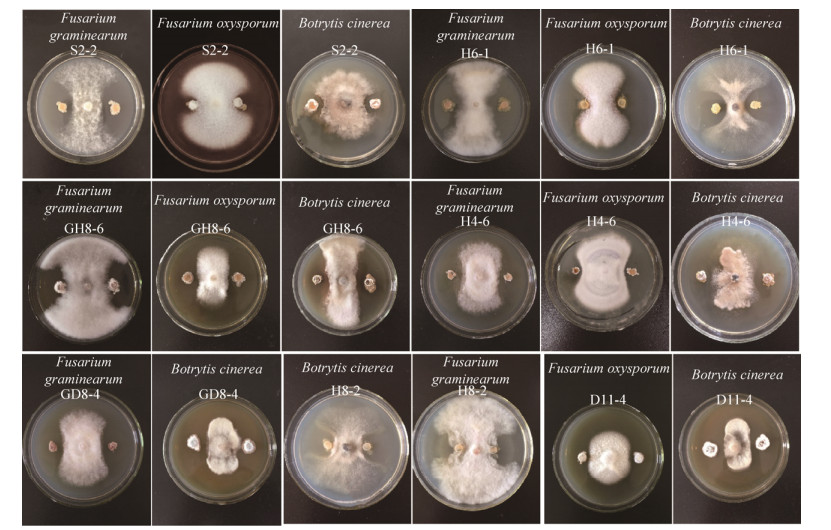 |
| 图 1 定殖于植物根内和根围的7株放线菌对3种病原真菌抑制效果 Figure 1 Inhibition effect of the 7 strains of actinobacteria colonized in plant roots and rhizosphere on 3 pathogenic fungi. The code number in the figure indicates the actinobacteria strain. |
| 图选项 |
2.3 定殖于植物根内和根围的放线菌无菌发酵液的抗菌活性 初筛得到了7株抗菌能力较强放线菌,经复筛发现其无菌发酵液对6种病原真菌皆有不同程度抑制作用;其中H6-1、S2-2和H4-6相较于其他菌株具有更强的抑菌效果。H6-1对禾谷镰刀菌、灰葡萄孢和轮纹大茎点霉抑制能力最强,抑菌率分别为48%、43%和58%,具有广谱抑菌性;S2-2对尖孢镰刀菌抑制效果最强,抑菌率为38%;H4-6对瓜类炭疽菌抑制效果最强,为62%;D11-4对立枯丝核菌抑制效果最强,为74%。放线菌无菌发酵液对立枯丝核菌、轮纹大茎点霉和瓜类炭疽菌的抑制作用较其他病原菌强,最高抑菌率均大于50% (图 2和表 4)。
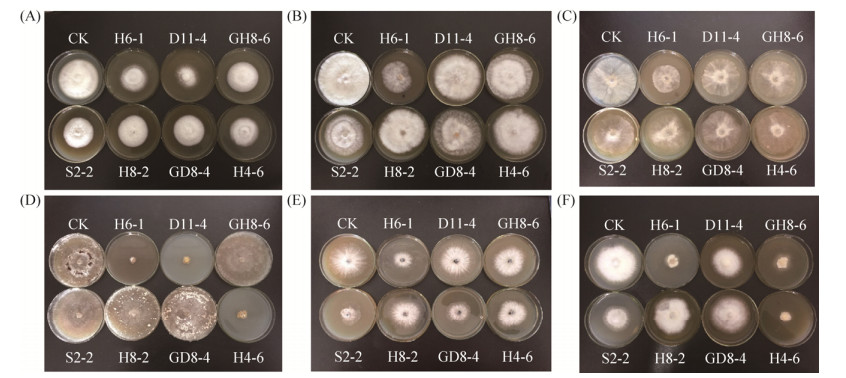 |
| 图 2 定殖于植物根内和根围的7株放线菌发酵液对6种病原真菌的抑制作用 Figure 2 Fermentation broth inhibitory effects of the 7 strains of actinobacteria colonized in plant roots and rhizosphere on 6 pathogenic fungi. A: Fusarium oxysporum; B: Fusarium graminearum; C: Botrytis cinerea; D: Rhizoctonia solani; E: Macrophoma kawatsukai; F: Colletotrichum orbiculare. The code number in the figure indicates the actinobacteria strain. |
| 图选项 |
表 4. 定殖于植物根内和根围的放线菌发酵液对病原真菌的抑制效果 Table 4. Fermentation broth antagonizing effects of the actinobacteria colonized in plant roots and rhizosphere on pathogenic fungi
| Strains | Fusarium oxysporum | Fusarium graminearum | Botrytis cinerea | Rhizoctonia solani | Macrophoma kawatsukai | Colletotrichum orbiculare | |||||||||||
| Colony diameter/ mm | Inhibition rate/% | Colony diameter/ mm | Inhibition rate/% | Colony diameter/ mm | Inhibition rate/% | Colony diameter /mm | Inhibition rate/% | Colony diameter /mm | Inhibition rate/% | Colony diameter /mm | Inhibition rate/% | ||||||
| CK | 6.9±0.4a | - | 8.2±0.4a | - | 8.1±0.4a | - | 8.6±0.3a | - | 7.5±0.4a | - | 7.2±0.4a | - | |||||
| H6-1 | 4.8±0.2de | 32.3±1.1b | 4.5±0.3f | 48.0±1.2a | 4.8±0.2e | 42.6±0.4a | 2.8±0.2e | 72.2±1.4b | 3.5±0.1f | 58.1±1.0a | 3.2±0.2e | 60.5±0.6a | |||||
| D11-4 | 5.0±0.2cd | 29.2±1.3bc | 7.5±0.3bc | 9.3±0.8e | 6.4±0.1d | 22.3±2.8b | 2.6±0.1e | 74.4±0.3a | 5.5±0.2c | 29.5±1.2e | 5.5±0.1c | 25.1±3.0c | |||||
| GH8-6 | 5.2±0.1bcd | 26.7±3.0c | 7.1±0.2cd | 14.8±1.8d | 6.6±0.2bcd | 18.9±1.7cd | 7.2±0.3b | 17.4±0.6f | 5.4±0.3c | 30.0±0.3e | 3.1±0.3e | 61.8±2.2a | |||||
| S2-2 | 4.4±0.2e | 38.1±0.5a | 6.0±0.1e | 28.4±2.4b | 6.8±0.2bcd | 16.4±1.8de | 6.7±0.1c | 23.4±1.6e | 4.5±0.2e | 43.0±0.4b | 4.3±0.2d | 42.9±0.4b | |||||
| H8-2 | 5.2±0.3bc | 25.6±0.1cd | 7.6±0.4b | 8.2±0.4e | 6.5±0.3cd | 20.0±0.3bc | 6.5±0.2c | 25.7±0.3d | 6.77±0.3b | 11.6±2.2f | 6.3±0.3b | 14.2±0.6d | |||||
| GD8-4 | 5.5±0.1b | 22.0±3.3d | 7.2±0.1bcd | 13.5±3.2d | 7.1±0.4b | 13.0±0.7f | 7.5±0.4b | 14.5±1.8g | 4.7±0.1e | 40.7±2.0c | 6.9±0.3a | 5.6±1.2e | |||||
| H4-6 | 4.9±0.1cd | 30.8±2.8b | 6.8±0.2d | 18.7±1.6c | 6.9±0.1bc | 15.4±3.2ef | 3.6±0.1d | 62.2±0.2c | 5.1±0.3d | 35.0±0.6d | 3.0±0.1e | 62.2±0.8a | |||||
| In each column, different lowercase letters after the data mean significant difference among treatments (P < 0.05). The same below. | |||||||||||||||||
表选项
2.4 定殖于植物根内和根围的放线菌的体外促生效果 结果表明,7株菌株均能产生IAA(图 3和表 5),其中D11-4、GH8-6和H6-1分泌的IAA含量较高,D11-4的含量可达22.3 mg/L;定性测试时GD8-4显色较深,但经检测IAA含量较低。菌株H6-1、GH8-6、D11-4和GD8-4均能产生明显橙黄色晕圈(图 4),其中,以D11-4晕圈直径最大(25.2 mm),表明其具备较强产铁载体能力。H6-1、S2-2、GH8-6、D11-4及GD8-4均能在无氮源培养基上长出菌落,转接5次后仍生长良好(图 5),表明其具备潜在的固氮能力,其中,菌株D11-4促生效应最大。
 |
| 图 3 7株放线菌产IAA效果 Figure 3 IAA production of the 7 strains of actinobacteria. The code number in the figure indicates the actinobacteria strain. |
| 图选项 |
表 5. 定殖于植物根内和根围的放线菌的体外促生效果 Table 5. The 7 strains of actinobacteria colonized in plant roots and rhizosphere growth-promoting effects in vitro
| Strains | IAA production/(mg/L) | Halo diameter of Fe carrier/mm | Nitrogen fixation |
| H6-1 | 12.79±0.4c | 16.7±0.3b | + |
| S2-2 | 7.72±0.2d | 0.0±0.0c | + |
| H8-2 | 4.01±0.1e | 1.4±0.1c | - |
| GH8-6 | 14.24±0.2b | 15.8±0.2b | + |
| D11-4 | 22.33±0.5a | 25.2±0.2a | ++ |
| H4-6 | 1.07±0.1f | 0.0±0.0c | - |
| GD8-4 | 7.31±0.2d | 19.3±0.4b | + |
| “+” indicates the degree of effectiveness; “-” means no effect. | |||
表选项
 |
| 图 4 7株放线菌产铁载体效应 Figure 4 Fe vector produced by the 7 strains of actinobacteria. The code number in the figure indicates the actinobacteria strain. |
| 图选项 |
 |
| 图 5 7株放线菌在无氮培养基上转接5次后的效果 Figure 5 Growth status of the 7 strains of actinobacteria on N free medium after 5 successive transfer culture. The code number in the figure indicates the actinobacteria strain. |
| 图选项 |
2.5 定殖于植物根内和根围的放线菌的生理生化特性 生理生化特性测定结果如表 6所示。
表 6. 定殖于植物根内和根围的放线菌生理生化特征测定结果 Table 6. Physiological and biochemical characteristics of the actinobacteria colonized in plant roots and rhizosphere
| Physiological and biochemical characteristics | Strains | |||||||
| H6-1 | D11-4 | GH8-6 | S2-2 | H8-2 | GD8-4 | H4-6 | ||
| Gelatin liquefaction | - | - | + | - | + | - | + | |
| Starch hydrolysis | + | + | + | - | + | - | + | |
| Cellulose utilization | - | - | - | - | - | - | + | |
| Melanin production | + | + | + | - | - | - | - | |
| H2S production | + | + | + | - | - | + | - | |
| Nitrate reduction | - | + | + | + | - | + | - | |
| C source utilization | No C source | + | + | + | + | - | - | + |
| Fructose | + | - | - | - | + | + | + | |
| Glucose | + | + | + | + | + | + | + | |
| Lactose | + | + | + | - | + | - | + | |
| Arabia sugar | + | + | - | - | + | + | - | |
| Sucrose | + | + | + | + | - | - | + | |
| Rhamnose | + | + | - | + | + | + | + | |
| Sodium citrate | + | - | + | + | + | - | - | |
| Inositol | + | + | - | + | + | + | + | |
| “+” means positive; “-” means negative. | ||||||||
表选项
2.6 定殖于植物根内和根围的放线菌形态观测及分子鉴定 本试验获得的放线菌菌株均具有典型链霉菌属特征(图 6)。高氏1号培养基上H6-1气丝淡粉色,基丝米白色,无可溶性色素,孢子丝螺旋状;H4-6气丝白色,基丝初为白色后呈乳白色,无可溶性色素,菌落圆形,孢子丝直形;D11-4气丝白色,基丝灰褐色,产生淡灰色色素,孢子丝波曲状;GH8-6气丝灰白色,基丝米白色,无可溶性色素,孢子丝波曲状;GD8-4气丝初为白色后呈淡紫灰色,基丝紫黑色,产生紫红色可溶性色素,菌落圆形,孢子丝波曲状;S2-2气丝灰白色,基丝灰色,无可溶性色素,孢子丝直形;H8-2气丝米白色,基丝白色,无可溶性色素,孢子丝直形。
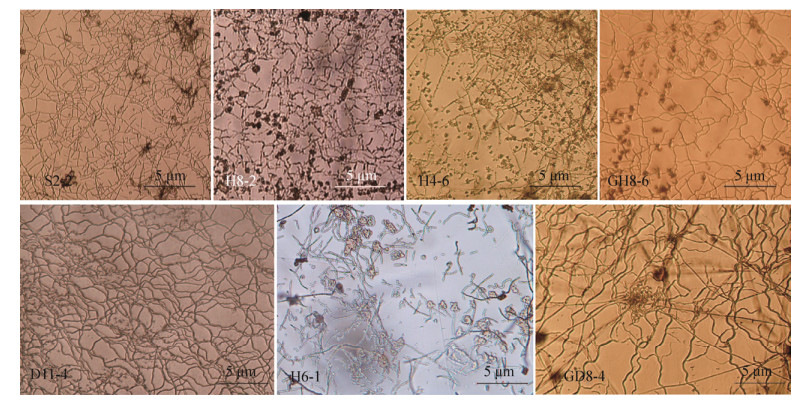 |
| 图 6 定殖于植物根内和根围的放线菌菌株的显微形态特征 Figure 6 Micromorphology of the actinobacteria colonized in plant roots and rhizosphere. The code number in the figure indicates the actinobacteria strain. |
| 图选项 |
结合形态观察、生理生化特性及16S rRNA基因序列分析,7株菌株亲缘关系较近的均为链霉菌属;H4-6为吸水链霉菌变种(Streptomyces angustmyceticus),S2-2为娄彻氏链霉菌(Streptomyces rochei),H6-1为浑圆链霉菌(Streptomyces globosus),GD8-4为Streptomyces iakyrus,GH8-6为波卓链霉菌(Streptomyces bottropensis),H8-2为Streptomyces paradoxus,D11-4为Streptomyces coralus;相似性皆为99.9% (图 7)。
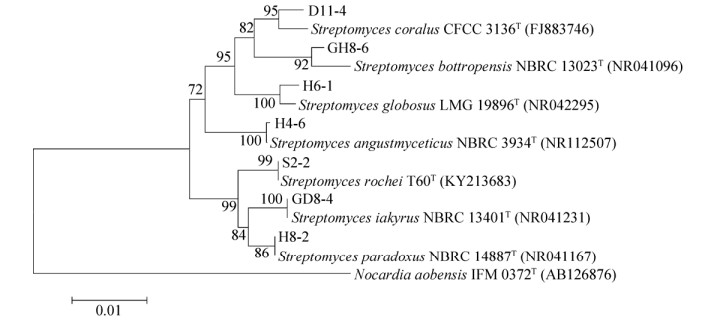 |
| 图 7 根据16S rRNA序列构建的系统发育树 Figure 7 Phylogenetic trees based on 16S rRNA sequences. Numbers at nodes are levels of bootstrap support for branch points (1000 resamplings); Bar indicates 1% sequence variance; Those in parentheses are GenBank accession number. |
| 图选项 |
3 讨论 业已证实,自然生境中分布的诸多放线菌具有防病促生作用,筛选高效放线菌,特别是定殖植物体内的放线菌已经成为生物共生与绿色生防领域热点之一。本调查开展的分离与鉴定定殖植物根内和根围的放线菌工作,不仅为放线菌领域增添了新的研究方向,而且为今后深入研究植物共生放线菌及推动植物共生微生物的研究提供了借鉴和思路。有研究报道,艾比湖湿地3种植物根围放线菌中具抑菌活性的占42%[29];攀枝花矿区糙野青茅根围分离的5株放线菌,不仅具有强耐铬性,还能促进玉米生长发育,其中菌株SCAU9006对6种病原菌都具有拮抗作用[30];胡磊等[31]从甘肃省河西走廊改良后的盐碱地分离得到两株链霉菌Ⅳ22-3-3和Ⅳ22-3-12对油菜菌核病菌的防效分别达64%和49%。相比而言,本试验选取了研究较少的华北滨海地区并且采样生境较为特殊。对盐碱地、湿地和工业污染地中的放线菌资源进行发掘与筛选,同样获得了具备抑菌促生效应的放线菌菌株,这为了解该地区的放线菌种质资源及其代谢产物的开发利用提供了参考价值。笔者发现不同生境中的放线菌,尤其是可培养的链霉菌,存在类群组成和数量上的差异。研究表明,土壤类型、土壤有机质和pH等对土壤微生物的分布有显著影响,肥力水平较高的土壤往往分布着更为丰富的土壤微生物类群;土壤有机质越丰富,放线菌数量和种属越多,许多放线菌喜好偏弱碱性的土壤环境,并且大多数土壤微生物以植物凋落物或根系分泌物为营养,植物群落多样性也影响着链霉菌的分布[32-33]。湿地环境的土壤有机质含量比污染土及盐碱地高,pH值呈中性,又存在着更为丰富的物种多样性和植被群落,可能因此链霉菌类群也更加丰富,这些均亟待今后进一步探究。
本试验通过体外筛选74株代表性放线菌,所得到的7株对常见植物病原真菌具有较强抑制作用,并且同时具有高效促生能力。例如,浑圆链霉菌体外和盆栽条件下均能抑制海枣黑焦病的病原菌(Thielaviopsis punctulata)的菌丝生长,而且能够防止病原物的传播[34];而我们又进一步发现该菌株具有最突出的高效广谱抗菌性,其无菌发酵液对本试验所供病原真菌抑制率皆达约50%。娄彻氏链霉菌不仅能产生抗生素borrelidin[35],还能促进茄子生长降低青枯病发病率和病情指数[36],增强鹰嘴豆的抗逆性,减轻核盘菌和NaCl对其的胁迫[37],防治魔芋软腐病[38]和苹果轮纹病[39]等;吸水链霉菌变种能产生具有植物细胞分裂素生物活性的狭霉素[40],本试验进一步印证了上述菌株部分促生防病能力。关于这些定殖植物体内和根围的放线菌促生防病的分子作用机制尚待深入探索。
业已表明,定殖植物体内的微生物往往通过合成植物激素、溶磷、固氮以及产生铁载体等途径促进植物生长[41]。菌株分泌IAA刺激细胞伸长和分裂从而直接促进植物生长,通过间接作用固氮,如将空气和土壤中的无机氮源转变成可被植物利用的有机氮源,为植物生长提供养分,还可以通过产铁载体螯合土壤中游离的铁使土壤中可用的铁降低至更为缺乏的程度,使病原真菌的繁衍和侵染能力大大下降从而间接促进植物生长[42]。本研究中7株放线菌均能产生IAA,4株能产生铁载体,5株有固氮潜在活性,其中菌株H6-1、GH8-6、GD8-4和D11-4均具备这3种促生能力,又以菌株D11-4 (S.coralus)最为高效,其各项促生指标最高,并且该菌株的促生作用国内外也鲜有报道,这对于今后的研发与应用具有重要意义。然而,本研究只进行了这7个菌株的部分体外试验,今后有待开展深入系统的盆栽试验及其相关研究。
References
| [1] | Bibi F, Yasir M, Song GC, Lee SY, Chung YR. Diversity and characterization of endophytic bacteria associated with tidal flat plants and their antagonistic effects on oomycetous plant pathogens. The Plant Pathology Journal, 2012, 28(1): 20-31. |
| [2] | Jin C. Endophytic actinomycetes in Acanthus ilicifolius. Microbiology, 2013, 40(9): 1742. (in Chinese) 金城. 老鼠簕内生放线菌. 微生物学通报, 2013, 40(9): 1742. |
| [3] | Kaur T, Sharma D, Kaur A, Manhas RK. Antagonistic and plant growth promoting activities of endophytic and soil actinomycetes. Archives of Phytopathology and Plant Protection, 2013, 46(14): 1756-1768. DOI:10.1080/03235408.2013.777169 |
| [4] | Lin L, Ge HM, Yan T, Qin YH, Tan RX. Thaxtomin A-deficient endophytic Streptomyces sp. enhances plant disease resistance to pathogenic Streptomyces scabies. Planta, 2012, 236(6): 1849-1861. DOI:10.1007/s00425-012-1741-8 |
| [5] | Genilloud O. Actinomycetes: still a source of novel antibiotics. Natural Product Reports, 2017, 34(10): 1203-1232. DOI:10.1039/C7NP00026J |
| [6] | Zhao SL, Ren FE, Liu JL, Qin JC, Pan HY. Screening, identification and optimization of fermentation conditions of an antagonistic actinomycetes strain to Setosphaeria turcica. Acta Microbiologica Sinica, 2012, 52(10): 1228-1236. (in Chinese) 赵淑莉, 任飞娥, 刘金亮, 秦建春, 潘洪玉. 玉米大斑病生防放线菌的筛选鉴定及发酵条件优化. 微生物学报, 2012, 52(10): 1228-1236. |
| [7] | Wang MQ, Ma L, Han JC, Liu HP, He YC. Identification of endophytic actinomycete St24 tomato plants from and its application in bio-control of gray mold disease. Chinese Journal of Applied Ecology, 2012, 23(9): 2529-2535. (in Chinese) 王美琴, 马林, 韩巨才, 刘慧平, 贺运春. 番茄内生菌St24的鉴定及其对灰霉病的生防作用. 应用生态学报, 2012, 23(9): 2529-2535. |
| [8] | Liu AH, Xu HY, Wang B, Wang W, Zhou B, Yuan LJ. Antagonism of endophytic actinomycetes isolated from Acanthopanax senticosus to five apple pathogenic fungi. Acta Agriculturae Boreali-occidentalis Sinica, 2017, 26(1): 94-100. (in Chinese) 刘爱华, 徐红艳, 王彬, 王卫, 周波, 袁丽杰. 刺五加内生放线菌对5种苹果病原真菌的拮抗作用初探. 西北农业学报, 2017, 26(1): 94-100. |
| [9] | Tanvir R, Sajid I, Hasnain S. Larvicidal potential of Asteraceae family endophytic actinomycetes against Culex quinquefasciatus mosquito larvae. Natural Product Research, 2014, 28(22): 2048-2052. DOI:10.1080/14786419.2014.919579 |
| [10] | Peng S, Yang R, Yan SZ, Chen SL. Control effect of the antinematode endophytic bacteria and rhizosphere actinomycetes to root-knot nematodes of tomato plant. Acta Phytophylacica Sinica, 2012, 39(1): 63-69. (in Chinese) 彭双, 杨茹, 闫淑珍, 陈双林. 杀线虫植物内生细菌和根际放线菌对根结线虫的防效. 植物保护学报, 2012, 39(1): 63-69. |
| [11] | Hakoyama T, Kobae Y, Umehara Y, Hata Y, Kouchi H, Suganuma N. Valuable functions in plant-microbe symbiosis: symbiotic nitrogen fixation and mycorrhizal symbiosis (Root nodule bacteria and its symbiosis-recent advances in molecular genetics). Regulation of Plant Growth & Development, 2011, 46(2): 103-111. |
| [12] | Duro N, Batista-Santos P, Da Costa M, Maia R, Castro IV, Ramos M, Ramalho JC, Pawlowski K, Máguas C, Ribeiro-Barros A. The impact of salinity on the symbiosis between Casuarina glauca Sieb. ex Spreng. and N2-fixing Frankia bacteria based on the analysis of nitrogen and carbon metabolism. Plant and Soil, 2016, 398(1/2): 327-337. |
| [13] | Li XL, Huang P, Wang Q, Xiao L, Liu MM, Bolla K, Zhang B, Zheng LY, Gan BC, Liu XT, Zhang LX, Zhang XP. Staurosporine from the endophytic Streptomyces sp. strain CNS-42 acts as a potential biocontrol agent and growth elicitor in cucumber. Antonie van Leeuwenhoek, 2014, 106(3): 515-525. DOI:10.1007/s10482-014-0220-6 |
| [14] | Du HJ, Su J, Yu LY, Zhang YQ. Isolation and physiological characteristics of endophytic actinobacteria from medicinal plants. Acta Microbiologica Sinica, 2013, 53(1): 15-23. (in Chinese) 杜慧竟, 苏静, 余利岩, 张玉琴. 药用植物内生放线菌的分离和生物学特性. 微生物学报, 2013, 53(1): 15-23. |
| [15] | Goudjal Y, Toumatia O, Sabaou N, Barakate M, Mathieu F, Zitouni A. Endophytic actinomycetes from spontaneous plants of Algerian Sahara: indole-3-acetic acid production and tomato plants growth promoting activity. World Journal of Microbiology and Biotechnology, 2013, 29(10): 1821-1829. DOI:10.1007/s11274-013-1344-y |
| [16] | Nimnoi P, Pongsilp N, Lumyong S. Co-inoculation of soybean (Glycine max) with actinomycetes and Bradyrhizobium japonicum enhances plant growth, nitrogenase activity and plant nutrition. Journal of Plant Nutrition, 2014, 37(3): 432-446. DOI:10.1080/01904167.2013.864308 |
| [17] | Shutsrirung A, Chromkaew Y, Pathom-Aree W, Choonluchanon S, Boonkerd N. Diversity of endophytic actinomycetes in mandarin grown in northern Thailand, their phytohormone production potential and plant growth promoting activity. Soil Science and Plant Nutrition, 2013, 59(3): 322-330. DOI:10.1080/00380768.2013.776935 |
| [18] | Rungin S, Indananda C, Suttiviriya P, Kruasuwan W, Jaemsaeng R, Thamchaipenet A. Plant growth enhancing effects by a siderophore-producing endophytic streptomycete isolated from a Thai jasmine rice plant (Oryza sativa L. cv. KDML105). Antonie van Leeuwenhoek, 2012, 102(3): 463-472. DOI:10.1007/s10482-012-9778-z |
| [19] | Xue D, Huang XD, Yang RX, Wang ZH. Screening and phosphate-solubilizing characteristics of phosphate-solubilizing actinomycetes in rhizosphere of tree peony. Chinese Journal of Applied Ecology, 2018, 29(5): 1645-1652. (in Chinese) 薛冬, 黄向东, 杨瑞先, 王祖华. 牡丹根际溶磷放线菌的筛选及其溶磷特性. 应用生态学报, 2018, 29(5): 1645-1652. |
| [20] | Wang Z, Solanki MK, Pang F, Singh RK, Yang LT, Li YR, Li HB, Zhu K, Xing YX. Identification and efficiency of a nitrogen-fixing endophytic actinobacterial strain from sugarcane. Sugar Tech, 2017, 19(5): 492-500. DOI:10.1007/s12355-016-0498-y |
| [21] | Glickmann E, Dessaux Y. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria. Applied and Environmental Microbiology, 1995, 61(2): 793-796. |
| [22] | Schwyn B, Neilands JB. Universal chemical assay for the detection and determination of siderophores. Analytical Biochemistry, 1987, 160(1): 47-56. DOI:10.1016/0003-2697(87)90612-9 |
| [23] | 白娟娈.苏北海岸带典型盐生植物根际放线菌多样性及其耐盐促生作用研究.江苏师范大学硕士学位论文, 2017. |
| [24] | 徐丽华, 李文均, 刘志恒, 姜成林. 放线菌系统学——原理、方法及实践. 北京: 科学出版社, 2007. |
| [25] | Godinho A, Ramesh R, Bhosle S. Bacteria from sand dunes of Goa promoting growth in eggplant. World Journal of Agricultural Sciences, 2010, 6(5): 555-564. |
| [26] | Milagres AMF, Machuca A, Napole? o D. Detection of siderophore production from several fungi and bacteria by a modification of chrome azurol S (CAS) agar plate assay. Journal of Microbiological Methods, 1999, 37(1): 1-6. DOI:10.1016/S0167-7012(99)00028-7 |
| [27] | R.E.布坎南, N.E.吉本斯.伯杰细菌鉴定手册.中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组, 译.第8版.北京: 科学出版社, 1984. |
| [28] | Ming N, Zhang XD, Wang JQ, Jiang LF, Yang J, Quan ZX, Cui XH, Fang CM, Li B. Rhizosphere effects on soil bacterial abundance and diversity in the Yellow River Deltaic ecosystem as influenced by petroleum contamination and soil salinization. Soil Biology and Biochemistry, 2009, 41(12): 2535-2542. DOI:10.1016/j.soilbio.2009.09.012 |
| [29] | 张晓红.艾比湖湿地不同植物根际放线菌多样性及多相分类研究.石河子大学硕士学位论文, 2015. |
| [30] | Li J, Cheng XF, Liao P, Shen ML, Zhao C, Li JN, Zhao K. Chromium-resistant rhizosphere actinomycetes from Deyeuxia scabrescens in Panzhihua mine area: isolation, screening and plant growth promoting. Acta Scientiae Circumstantiae, 2018, 38(3): 1197-1206. (in Chinese) 李静, 程雪芬, 廖萍, 申枚灵, 赵翀, 李久楠, 赵珂. 攀枝花矿区糙野青茅根际耐铬放线菌筛选及促生能力评价. 环境科学学报, 2018, 38(3): 1197-1206. |
| [31] | Hu L, Niu SQ, Jing CH, Da WY, Zhu XT, Han JS, Chen X, Zhang AM. Identification of Streptomyces antagonizing oilseed rape pathogen Sclerotinia sclerotiorum. Chinese Journal of Oil Crop Sciences, 2013, 35(1): 69-73. (in Chinese) 胡磊, 牛世全, 景彩虹, 达文燕, 朱学泰, 韩建山, 程晓, 张爱梅. 拮抗油菜菌核病菌的链霉菌分离筛选与鉴定. 中国油料作物学报, 2013, 35(1): 69-73. |
| [32] | 阮继生, 黄英. 放线菌快速鉴定与系统分类. 北京: 科学出版社, 2011. |
| [33] | Ghorbani-Nasrabadi R, Greiner R, Alikhani HA, Hamedi J, Yakhchali B. Distribution of actinomycetes in different soil ecosystems and effect of media composition on extracellular phosphatase activity. Journal of Soil Science and Plant Nutrition, 2013, 13(1): 223-236. |
| [34] | Saeed EE, Sham A, Salmin Z, Abdelmowla Y, Iratni R, El-Tarabily K, AbuQamar S. Streptomyces globosus UAE1, a potential effective biocontrol agent for black scorch disease in date palm plantations. Frontiers in Microbiology, 2017, 8: 1455. DOI:10.3389/fmicb.2017.01455 |
| [35] | Li Z, Zhao SY. Borrelidin production by Streptomycete rochei ATCC10739: optimization of fermentation, separation and purification conditions. Microbiology China, 2011, 38(7): 1051-1055. (in Chinese) 李周, 赵圣印. 娄彻氏链霉菌ATCC10739产抗生素Borrelidin发酵条件优化及其分离纯化. 微生物学通报, 2011, 38(7): 1051-1055. |
| [36] | Li W, Xiao XO, Li K, Gao XM, Lü LL. The antibiotic activity of fermentation broth produced from Streptomyces rochei XL-6 and its influence on bacterial wilt control and plant growth in eggplant seedling. Chinese Journal of Biological Control, 2017, 33(4): 531-536. (in Chinese) 李威, 肖熙鸥, 李可, 高晓敏, 吕玲玲. 娄彻氏链霉菌XL-6的抑菌活性及对茄子幼苗的防病促生效应. 中国生物防治学报, 2017, 33(4): 531-536. |
| [37] | Srivastava S, Patel JS, Singh HB, Sinha A, Sarma BK. Streptomyces rochei SM3 induces stress tolerance in chickpea against Sclerotinia sclerotiorum and NaCl. Journal of Phytopathology, 2015, 163(7/8): 583-592. |
| [38] | He F, Zhang ZL, Cui M, Xue QH, Wang DS. Disease prevention and growth promotion effects of actinomycete strain D74 on Amorphophallus konjac. Acta Horticulturae Sinica, 2015, 42(2): 367-376. (in Chinese) 何斐, 张忠良, 崔鸣, 薛泉宏, 王东胜. 放线菌'D74'对魔芋的防病促生作用. 园艺学报, 2015, 42(2): 367-376. |
| [39] | Zhang QM, Yong DJ, Zhang Y, Shi XP, Li BH, Li GF, Liang WX, Wang CX. Streptomyces rochei A-1 induces resistance and defense-related responses against Botryosphaeria dothidea in apple fruit during storage. Postharvest Biology and Technology, 2016, 115: 30-37. DOI:10.1016/j.postharvbio.2015.12.013 |
| [40] | Han Z, Chen RX, Xu HZ. Advances in angustmycins and their applications. Chinese Journal of Antibiotics, 2007, 32(6): 329-333. (in Chinese) 韩征, 陈汝贤, 许鸿章. 狭霉素及其应用研究的新进展. 中国抗生素杂志, 2007, 32(6): 329-333. DOI:10.3969/j.issn.1001-8689.2007.06.003 |
| [41] | Liang XR, Li NH, Zhou XG, Yang Y, Wu YQ, Wu FZ. Isolation and identification of tomato-associated endophytic actinomyces and their potential for plant growth promotion. Microbiology China, 2018, 45(6): 1314-1322. (in Chinese) 梁新冉, 李乃荟, 周新刚, 杨洋, 吴宇琪, 吴凤芝. 番茄根内促生放线菌的分离鉴定及其促生效果. 微生物学通报, 2018, 45(6): 1314-1322. |
| [42] | Qin S, Miao Q, Feng WW, Wang Y, Zhu X, Xing K, Jiang JH. Biodiversity and plant growth promoting traits of culturable endophytic actinobacteria associated with Jatropha curcas L. growing in Panxi dry-hot valley soil. Applied Soil Ecology, 2015, 93: 47-55. DOI:10.1016/j.apsoil.2015.04.004 |
