杨萍1,2, 刘蔷2, 蒋宇3, 孙兵兵3, 杨俊杰3, 李琦4, 杨晟3

 , 陈代杰5
, 陈代杰5

1. 复旦大学药学院, 上海 201203;
2. 上海医药工业研究院, 上海 201203;
3. 中国科学院上海生命科学研究院植物生理生态研究所, 上海 200032;
4. 四川师范大学生命科学学院, 四川 成都 610101;
5. 上海交通大学药学院, 上海 200240
收稿日期:2019-01-03;修回日期:2019-05-05;网络出版日期:2019-06-03
基金项目:国家自然科学基金(81573329,81872775,21825804);上海市自然科学基金(18ZR1446800,18ZR1446500)
*通信作者:杨晟, E-mail:syang@sibs.ac.cn;
陈代杰, E-mail:hccb001@163.com.
摘要:[目的] 耐甲氧西林金黄色葡萄球菌在苯唑西林作用下,其辅酶A二硫化物还原酶表达上调2.3倍。本文研究苯唑西林对该酶缺失的金黄色葡萄球菌的杀菌效应。[方法] 利用同源重组双交换技术对金黄色葡萄球菌进行基因敲除,并用质粒pOS1构建回补株;采用分光光度法检测菌株体外增殖能力;以时间-杀菌法考察苯唑西林对菌株杀菌效应;以2',7'-二氯荧光黄双乙酸盐为探针检测胞内活性氧水平。[结果] 辅酶A二硫化物还原酶基因敲除株较亲株生长缓慢(P<0.05);20倍MIC浓度苯唑西林下敲除株的时间-杀菌曲线及胞内活性氧水平与亲株无显著性差异,5倍MIC浓度下敲除株的致死速率及胞内活性氧水平均较亲株下降。[结论] 在较低浓度苯唑西林作用下,辅酶A二硫化物还原酶基因缺失降低胞内活性氧水平,减小杀菌速率,延缓次级损伤效应。
关键词:金黄色葡萄球菌基因编辑辅酶A二硫化物还原酶活性氧次级损伤
Deficiency of coenzyme A disulfide reductase in methicillin-resistant Staphylococcus aureus MRSA252 delays the secondary damage of oxacillin
Ping Yang1,2, Qiang Liu2, Yu Jiang3, Bingbing Sun3, Junjie Yang3, Qi Li4, Sheng Yang3

 , Daijie Chen5
, Daijie Chen5

1. School of Pharmacy, Fudan University, Shanghai 201203, China;
2. Shanghai Institute of Pharmaceutical Industry, Shanghai 201203, China;
3. Institute of Plant Physiology and Ecology, Shanghai Institutes for Biological Sciences, Chinese Academy of Sciences, Shanghai 200032, China;
4. College of Life Sciences, Sichuan Normal University, Chengdu 610101, Sichuan Province, China;
5. School of Pharmacy, Shanghai Jiao Tong University, Shanghai 200240, China
Received: 3 January 2019; Revised: 5 May 2019; Published online: 3 June 2019
*Corresponding author: Sheng Yang, E-mail:syang@sibs.ac.cn;
Daijie Chen, E-mail:hccb001@163.com.
Foundation item: Supported by the National Natural Science Foundation of China (81573329, 81872775, 21825804) and by the Shanghai Provincial Natural Science Foundation of China (18ZR1446800, 18ZR1446500)
Abstract: [Objective] The expression of coenzyme A disulfide reductase in methicillin-resistant Staphylococcus aureus was up-regulated by 2.3 folds when the strain was cultured with oxacillin. Here, the bactericidal effect of oxacillin on coenzyme A disulfide reductase deficient Staphylococcus aureus was studied. [Methods] Homologous recombination mediated double-exchange techniques were used to delete genes in Staphylococcus aureus, whereas pOS1 plasmid was used to construct the complemented strain. Spectrophotometry was used to detect the proliferation ability of the strains in vitro. The bactericidal effect of oxacillin on the strains was studied by time-kill method, and 2', 7'-dichlorodihydrofluorescein diacetate was used as a probe to detect intracellular reactive oxygen species levels. [Results] Coenzyme A disulfide reductase gene deleted strain grew more slowly than the parental strain (P < 0.05). Under the action of oxacillin, the time-kill curve and intracellular reactive oxygen species level of the knockout strains were slightly different from that of the parental strains at 20 times MIC concentration, and the lethal rate and intracellular reactive oxygen species level of coenzyme A disulfide reductase gene deleted strains were lower than that of the parental strains at 5 times MIC concentrations. [Conclusion] At lower concentrations of oxacillin, the deletion of coenzyme A disulfide reductase gene reduced intracellular ROS levels, and the bactericidal rate, meanwhile the secondary damage was delayed.
Keywords: Staphylococcus aureusgene editingcoenzyme A disulfide reductasereactive oxygen speciessecondary damage
金黄色葡萄球菌Staphylococcus aureus是引起临床皮肤或软组织感染的常见菌株,其中耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)的检出率高达35%以上[1]。在2017年,世界卫生组织列出的世界上最威胁人类健康的“超级细菌”中,耐甲氧西林金黄色葡萄球菌被归为“高度耐药性”菌株。目前,临床用于治疗金葡菌感染的首选药物依旧是β-内酰胺抗生素。β-内酰胺抗生素是一种杀菌性药物,对其作用机制的研究经历了“微生物形态学——生物化学(细胞壁结构)——分子生物学”过程[2],但这些机制研究还未成功探索到新的药物作用靶点,因此,我们怀疑已知的β-内酰胺抗生素杀菌机制依旧不够完善。前期我们对苯唑西林作用下MRSA菌株中蛋白组学进行了研究[2-4],比较1.0 h和0.5 h蛋白组学变化,其中辅酶A二硫化物还原酶(coenzyme A disulfide reductase,CoADR)均有不同程度上调(2.3倍和2.0倍)。猜测CoADR可能参与了β-内酰胺类抗生素杀菌过程。
CoADR由cdr编码,属于吡啶核苷酸-二硫化物氧化还原酶超家族[5],作为小分子二硫化物还原酶在NADPH辅酶作用下可以将1分子辅酶A二硫化物还原成2分子辅酶A硫醇和1分子NADP+[5-6],即维持小分子硫醇CoASH的还原状态。Eggers等及Boylan等[7-8]在伯氏疏螺旋体菌中发现cdr参与细菌的氧化应激反应,该基因的敲除能够增强细菌对叔丁基-氢过氧化物的敏感性,且辅酶A在体外对过氧化氢具有还原作用等。有研究[9]表明杀菌性抗生素通过诱导产生羟基自由基引起氧化应激,从而实现杀菌作用。因此,研究者[9]将抗生素杀菌作用总结为两种形式:一是初级损伤,由抗生素作用导致的直接损伤;二是次级损伤,是细菌对初级损伤应答比如氧化应激反应等引起的损伤。我们猜测CoADR可能通过影响氧化应激反应的次级损伤来参与β-内酰胺类抗生素杀菌过程。
对基因的功能研究需要依靠基因组编辑技术。目前已报道用于金黄色葡萄球菌基因组编辑工具有两种,一种是基于CRISPR-Cas的编辑技术[10-11],一种是传统的同源重组双交换技术[12]。本研究前期比较了这两种技术在MRSA菌株中的编辑效果,发现CRISPR-Cas系统在MRSA菌株敲除效果不理想,本研究利用同源重组双交换技术获得cdr基因敲除菌株。Luba等[13]通过体外比较野生型和氨基酸43位突变型的CoADR的功能,已证明CoADR 43位唯一的半胱氨酸是其活性位点;同时cdr基因开放阅读框架对应下游序列基因在GenBank数据显示为多拷贝,本实验综合考虑cdr基因功能及其上下游序列,敲除了MRSA252菌株cdr基因从起始密码子ATG开始的301 bp片段,实现破坏CoADR的功能。我们研究了cdr敲除株与亲株的生长状态及在苯唑西林杀菌作用下的表型差异,从而研究苯唑西林对CoADR缺失的金黄色葡萄球菌杀菌效应。
1 材料和方法 1.1 材料
1.1.1 菌株、噬菌体和质粒: 金黄色葡萄球菌MRSA252菌株和RN4220菌株、大肠杆菌DH5α感受态细胞购于诺唯赞生物科技有限公司;pKOR1质粒[12]、pOS1-hprk质粒和噬菌体Φ85由上海市仁济医院检验科李敏研究员提供。
1.1.2 主要试剂和培养基: 细菌基因组DNA提取试剂盒、质粒小抽试剂盒、胶回收试剂盒购于美国Axygene公司;Taq DNA聚合酶和限制性内切酶购于MBI公司;KOD FX DNA聚合酶购于日本TOYOBO公司;氯霉素购于MP Biomedicals公司;氨苄青霉素和溶菌酶购于AMRESCO公司;苯唑西林购于上海先锋药业公司;溶葡萄球菌素、T4 DNA聚合酶购于生工生物工程(上海)股份有限公司;活性氧检测试剂盒购于碧云天生物技术公司。
酵母粉、胰蛋白胨、胰蛋白胨大豆肉汤(Trypticase Soy Broth,TSB)培养基和脑心浸液肉汤(Brain Heart Infusion,BHI)培养基购自美国Oxoid公司;琼脂粉购于北京鼎国昌盛生物技术有限责任公司;牛肉浸膏购于浙江医药新昌制药厂;可溶性淀粉、NaCl购于国药集团化学试剂有限公司。
1.1.3 主要仪器: PCR仪、电转仪为美国BioRad生产;凝胶电泳仪、凝胶成像仪购于UVP公司;恒温摇床、恒温培养箱购于上海智诚分析仪器制造有限公司;离心机购于Eppendorf公司;核酸测定仪、紫外分光光度计由美国BECKMAN公司生产。
1.1.4 PCR引物: 引物的序列如表 1。
表 1. PCR引物序列 Table 1. The sequences of primers
| Primer names | Primer sequences (5′→3′)a |
| PKOR-LIC-F | ATTGGAAGTGGATAACGGTACCGGTTCCGAGGCTC |
| PKOR-LIC-R | ATTGGATTGGAAGTACGGGCCCGAGCTTAAGACTGG |
| cdrUPF | TACTTCCAATCCAATGGATTAAATCTTTAGGGTGGC |
| cdrUPR | ACAATAGGAGGTAAGTTACGAATTTGAAGAATCATACGATAAAC |
| cdrDNF | ATCGTATGATTCTTCAAATTCGTAACTTACCTCCTATTGT |
| cdrDNR | TTATCCACTTCCAATGAATGCCTCTTCCATCCATAT |
| PKOR-F | CACACAGGAAACAGCTATGAC |
| PKOR-R | GAACCGACTTCTCCTTTTTCG |
| cdrVF | GTATGGAATCTCCCGCTTATCT |
| cdrVR | GTCATATCAACTGTACATACGCC |
| cdr-SmaIF | GAGCCCGGGATGCCCAAAATAGTCGTAGT |
| cdr-BamHIR | GAGGGATCCTTATTTAGCTTTGTAACCAATC |
| POS1-F | AACTGAAGAACAACGTAACGGC |
| POS1-R | CACACAGGAAACAGCTATGACC |
| a Incorporated restriction sites are underlined. | |
表选项
1.2 质粒构建 根据NCBI上MRSA252基因组序列设计cdr (从起始密码子ATG开始301 bp)上下游引物(cdrUPF/cdrUPR和cdrDNF/cdrDNR),利用PCR方法获得上下游序列,并连接获得cdr同源臂片段,以PKOR-LIC-F/PKOR-LIC-R引物扩增pKOR1骨架片段,用T4 DNA聚合酶对割胶回收后的骨架和同源臂片段进行处理,再用T4连接酶连接处理后的片段[14],用PKOR-F/ PKOR-R验证,获得敲除质粒pKOR1cdr。
以MRSA252基因组为模板、cdr-SmaIF/cdr-BamHIR为引物PCR获得cdr基因完整开放阅读框(1317 bp)片段,用Sma I/BamH I限制性内切酶处理pOS1质粒及cdr片段,再跑胶回收,用T4连接酶连接回收后的载体和片段,用POS1-F/POS1-R PCR验证,获得回补质粒pOS1cdr。
1.3 cdr敲除株与回补株构建 将pKOR1cdr、pOS1cdr质粒电击转入金黄色葡萄球菌RN4220中,再将验证正确的RN4220转化子(PKOR-F/PKOR-R或POS1-F/POS1-R),直接噬菌体Φ85转化[15]至目标菌株MRSA252、MRSA252-Δcdr,涂布于含氯霉素TSA平板筛选,再进行PCR验证(PKOR-F/PKOR-R或POS1-F/ POS1-R),获得MRSA252(pKOR1cdr)菌株及回补株MRSA252-Δcdr(pOS1cdr)。将MRSA252(pKOR1cdr)菌株在含氯霉素的TSB中43 ℃孵育传代3次,再将10–4稀释的过夜孵育菌液涂布于含1 mg/mL的脱水四环素TSA平板30 ℃孵育2 d,将单菌落分别接种于含氯霉素和无抗生素TSA平板上,37 ℃孵育过夜,再将只在无抗板上长出的单菌落进行菌落PCR鉴定,获得成功敲除的菌株MRSA252-Δcdr。
1.4 体外增殖能力比较 挑单菌落至BHI中培养过夜,第2天将菌液1:100接入含25 mL BHI培养基的250 mL摇瓶中,在0、2、4、6、8、10、12、16、24 h时间点吸取1 mL菌液利用分光光度计测定其OD600,4 h时间点及之后均稀释10倍再测定。过夜孵育菌液梯度稀释(10–3、10–4、10–5、10–6、10–7),分别吸取5 μL至固体平板,放置37 ℃培养箱,孵育16 h拍照。
1.5 最小抑菌浓度及时间-杀菌曲线测定 参照美国临床和实验室标准化协会发布的微生物药敏实验检测方法[16]测定最低抑菌浓度(Minimum Inhibitory Concentration,MIC)。挑单菌落过夜孵育,第2天将菌液1:1000稀释至MH (Mueller Hinton)培养基中,用于MIC测定实验。在96孔板分别加入100 μL的MH培养基,加入梯度稀释的苯唑西林抗生素,最后加入100 μL前面稀释好的菌液(苯唑西林最终浓度梯度为1024、512、256、128、64、32 μg/mL)。放入恒温培养箱中培养16–18 h,观察细菌的生长情况,以无细菌生长的最低浓度为MIC值。
挑单菌落过夜孵育,第2天1:1000接至2 mL BHI试管中,并分别加入4个浓度梯度的苯唑西林钠(终浓度512、2560、5120、10240 μg/mL),此时记为0时刻,再分别在0、4、8、12、24 h取100 μL菌液,并用无菌生理盐水梯度稀释成合适浓度,取100 μL涂布于无抗平板,37 ℃孵育过夜,第3天记录菌落形成单位(colony-forming units,CFU);以时间为横轴,以log(CFU/mL)为纵轴,绘制时间-杀菌曲线。
1.6 细菌胞内活性氧测定 采用碧云天公司的活性氧(reactive oxygen species,ROS)检测试剂盒,结合说明书和文献[17]调整操作如下。将过夜孵育菌液,1:100接至含150 mL BHI培养基750 mL摇瓶中,37 ℃、220 r/min孵育2.5–3.0 h至OD600为0.6–0.8,均分至5个无菌250 mL摇瓶中,其中4组分别加入不同浓度的药物(苯唑西林终浓度为512、2560、5120、10240 μg/mL),一组不加药;继续于37 ℃、220 r/min培养14 h;然后5000 r/min离心10 min收集菌液,用预冷的磷酸缓冲盐溶液(phosphate buffered saline,PBS)洗涤2次后重悬,利用紫外分光光度仪调整至OD600一致;再以1 μL:1 mL的比例装载2’, 7’-二氯荧光黄双乙酸盐[2', 7'-dichlorodihydrofluorescein diacetate,DCFH-DA (10 mmol/L)]探针,37 ℃孵育30 min,5000 r/min离心10 min;再用预冷的PBS洗涤重悬2次,洗去未进入的探针;样品加入96孔板,每个样品设置3个复孔,使用荧光酶标仪测定样品的荧光值(488 nm激发波长,525 nm发射波长),实验重复1次。
1.7 数据分析 本文均采用Graphpad Prism 5.0统计软件进行统计分析,实验各结果间比较均采用t检验,P<0.05表示差异具有统计学意义。
2 结果和分析 2.1 cdr基因敲除株构建 将pKOR1cdr电转入感受态RN42200菌株,长出102以上个转化子,挑取15个转化子经鉴定均含有目标质粒,再通过噬菌体感染法转入MRSA252菌株,获得2个含pKOR1cdr的MRSA252菌株,在43 ℃氯霉素孵育条件下,只有一株菌株长浓,1 mg/mL脱水四环素诱导长出40个单菌落。利用PCR筛选敲除株,如图 1所示,cdr基因部分敲除株PCR片段长度为1.4 kb,而野生株(wild type,WT)片段长度约为1.7 kb,挑取31个鉴定,16个为阳性,敲除率为51.6%;表明cdr基因部分敲除菌株构建成功。
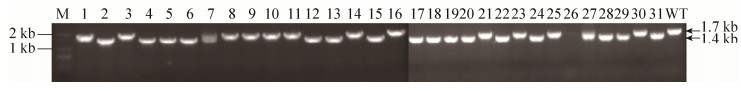 |
| 图 1 MRSA252-Δcdr基因敲除株构建 Figure 1 The construction of MRSA252-Δcdr mutant strain. M: DNA marker; 1–31: PCR amplification product of 31 single colonies of MRSA252 (pKOR1cdr) randomly selected; WT: PCR amplification product of MRSA252 wild strain. |
| 图选项 |
2.2 cdr基因回补株构建 为进一步验证cdr基因功能,我们构建了cdr基因回补株。我们将构建好的含有cdr完整开放阅读框的pOS1-cdr,电转入RN4220菌株,再通过噬菌体感染法转入MRSA252-Δcdr菌株,获得PCR验证正确菌株。验证结果如图 2所示,表明cdr基因回补株构建成功。
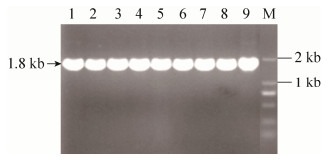 |
| 图 2 cdr基因回补株MRSA252-Δcdr(pOS1cdr)的构建 Figure 2 The construction of cdr complementation strains MRSA252-Δcdr(pOS1cdr). M: DNA marker; lane 1–9: PCR amplification product of 9 single colonies of MRSA252-Δcdr (pOS1cdr) randomly selected. |
| 图选项 |
2.3 cdr基因敲除对菌株体外增殖能力影响 在37 ℃,液体培养和固体平板培养cdr敲除株、回补株与亲株,结果如图所示(图 3),与MRSA252亲株相比,MRSA252 cdr基因部分敲除株在液体培养中生长速率低于野生株,且在相同孵育时间下平板孵育的菌落也小于野生菌;同时从生长曲线及菌落大小看,回补株MRSA252-Δcdr (pOS1cdr)恢复其生长速率,表明CoADR缺失使菌株生长缓慢,但不致死。
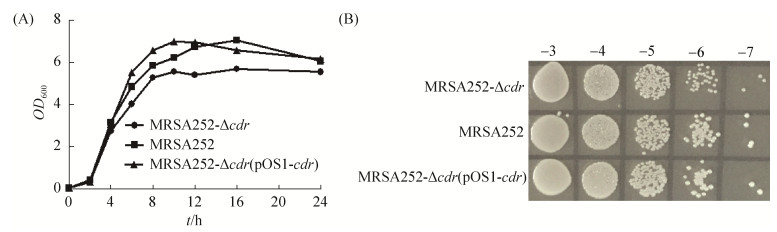 |
| 图 3 菌株MRSA252-Δcdr、MRSA252-Δcdr(pOS1cdr)与MRSA252的生长比较 Figure 3 Comparison of the growth of strains MRSA252-Δcdr, MRSA252-Δcdr(pOS1cdr) and MRSA252. |
| 图选项 |
2.4 苯唑西林作用于cdr基因敲除株、回补株与亲株的MIC及时间-杀菌曲线 为研究苯唑西林对CoADR缺失金黄色葡萄球菌的杀菌效应,我们测定了苯唑西林对cdr基因敲除菌株、回补株与亲株的MIC及时间-杀菌曲线。MIC测定结果,cdr基因敲除株、回补株与野生株一致,均是512 μg/mL,表明CoADR缺失不影响苯唑西林的对MRSA的抑菌活性。基于MIC,我们绘制了不同浓度苯唑西林作用的时间-杀菌曲线,如图 4所示,在1倍MIC苯唑西林作用下,cdr敲除株较亲株略耐药,差异较小;在5倍MIC苯唑西林作用下,两者差异增大,cdr敲除株杀菌速率较亲株低,之后随着苯唑西林浓度增大(10倍MIC、20倍MIC),cdr敲除株与野生株之间差异又减小;且cdr回补株菌落数在5倍MIC苯唑西林作用下表现出较快的下降。结果说明苯唑西林作用时,20倍MIC浓度下cdr敲除株的时间-杀菌曲线无显著性差异,而5倍MIC浓度下CoADR缺失菌株的致死速率显著下降。
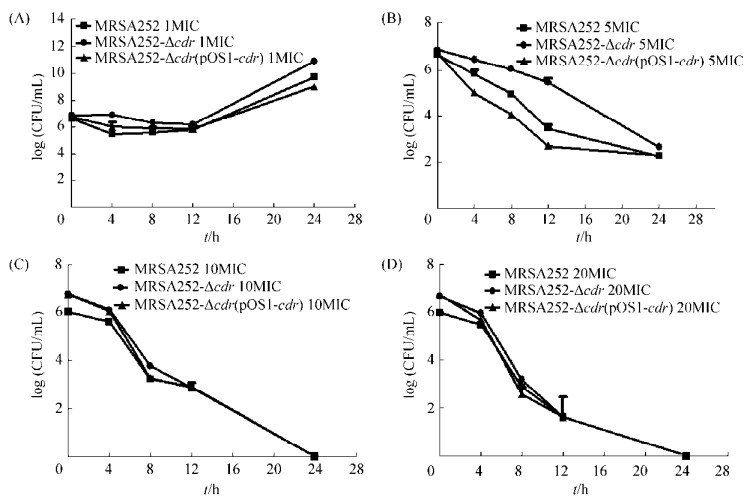 |
| 图 4 不同浓度苯唑西林作用MRSA252-Δcdr、MRSA252-Δcdr (pOS1cdr)与MRSA252时间-杀菌曲线 Figure 4 Time-kill curves of MRSA252-Δcdr, MRSA252-Δcdr(pOS1cdr) and MRSA252 in the presence of various concentrations of oxacillin. |
| 图选项 |
2.5 cdr基因敲除对在高浓度苯唑西林胁迫下胞内活性氧产生的影响 为验证CoADR是否参与了次级损伤中的氧化应激反应,我们采用DCFH-DA探针标记检测不同浓度苯唑西林作用后MRSA 252、cdr敲除株及回补株胞内ROS水平。结果如图 5所示,与时间杀菌曲线的趋势一致,亲株与敲除株胞内ROS差异先增大后减小;且在5倍MIC苯唑西林作用下,胞内ROS水平最大,cdr敲除株胞内ROS水平显著低于亲株及回补株,差异最大。结果表明CoADR缺失不影响20倍MIC苯唑西林作用时的胞内ROS水平,但显著影响5倍MIC苯唑西林作用时的ROS水平。
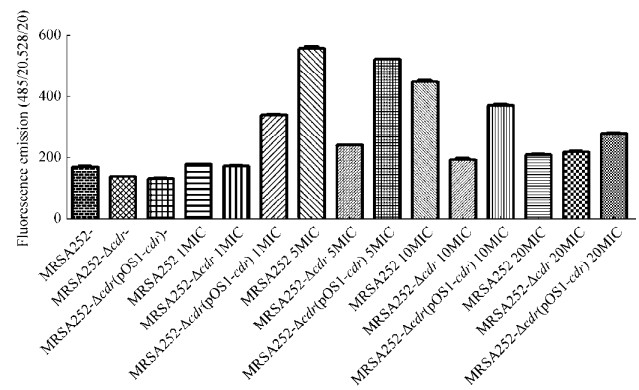 |
| 图 5 不同浓度苯唑西林作用后胞内ROS水平 Figure 5 Intracellular ROS levels of the MRSA strains after the action of oxacillin at different concentrations. |
| 图选项 |
3 讨论 本研究以临床分离的MRSA252为研究对象,通过传统同源重组双交换敲除方法获得cdr基因敲除并用质粒pOS1对敲除株进行回补,来研究cdr基因在苯唑西林杀死金黄色葡萄球菌过程中的作用。cdr基因功能研究早有一些报道,其中金黄色葡萄球菌中CoADR的体外纯化[7]为之后其体外合成及结构功能分析研究奠定基础[5-6, 13, 18]。Schneider等[19]通过差异荧光诱导NCTC8325 cdr基因突变,发现cdr基因突变将减弱菌株肾脓肿感染效力30倍以上。此外,在伯氏疏螺旋体菌Borrelia burgdorferi中[8],cdr基因缺失将减弱菌株快速生长能力及感染宿主的能力。有研究[20]根据基团特征设计的CoADR的抑制剂能够抑制金黄色葡萄球菌RN4220生长。体外增殖实验与已有研究报道结果一致,显示CoADR酶缺失能显著抑制MRSA252菌株生长,说明CoADR可能在细菌的快速生长中存在一定作用。辅酶A二硫化物还原酶维持小分子硫醇辅酶A还原态,小分子硫醇在大多数生物尤其是需氧生物中是重要的氧化还原缓冲剂,保护细胞免受环境或胞内的活性化合物带来的损伤,如ROS、活性氮、金属和抗生素等[6]。CoADR/CoA体系在许多细菌中被发现,能保护细菌硫醇蛋白不被氧化[21],在维持细菌硫醇-二硫化物的稳态中有一定作用[8];同时CoADR酶缺失破坏了CoASSCoA/CoASH稳态。因此,我们猜测细菌通过反馈抑制生长维持胞内还原态,从而CoADR酶缺失表现为菌株快速生长抑制现象。有文献表明[22],在金黄色葡萄球菌中,小分子硫醇除了辅酶A还存在芽胞杆菌硫醇(Bacillithiol,BSH)和半胱氨酸;在生理pH=7.7条件下,辅酶A的活性硫代产物含量较少只有0.7%,且辅酶A的pKa为9.83较BSH (pKa=7.97)的高,较难解离;表明在生理条件下,氧化应激反应时消除ROS及其引起的氧化损伤的小分子硫醇并不是辅酶A而是BSH。因此,CoADR酶是否通过影响氧化应激反应参与了苯唑西林杀菌过程是未知的。我们通过MIC、时间-杀菌曲线及胞内ROS水平来表征苯唑西林作用cdr敲除株与亲株的杀菌效应,结果表明cdr基因缺失不影响苯唑西林对MRSA的生长抑制作用,也并未使其ROS水平上升,敏感性增大,反而有所下降,证明了在MRSA252菌株中,辅酶A小分子硫醇在中和氧化应激产生的ROS作用较弱。
细菌致死过程中胞内ROS水平与细菌的代谢水平相关,当其代谢水平明显减弱时,我们主要考虑是初级损伤,此时胞内ROS水平没有明显变化或甚至减小;当其代谢水平较高时,胞内ROS水平将会增大[23]。我们结果显示,在5倍MIC苯唑西林作用时,胞内ROS水平最高,20倍MIC浓度时胞内ROS水平偏低;说明20倍MIC浓度下,杀菌作用主要考虑是初级损伤;而5倍MIC浓度下,主要考虑是次级损伤作用。考虑到在5倍MIC苯唑西林作用下,cdr敲除株与野生株时间-杀菌曲线及胞内ROS水平差异均是最大,证明了CoADR中断对初级损伤影响较小,但对次级损伤具有显著的延缓作用。在5倍MIC苯唑西林作用下,CoADR缺失株的胞内ROS水平较亲株有所下降,可能与CoADR缺失使细菌生长缓慢相关。
本研究利用传统同源重组双交换敲除技术获得cdr敲除MRSA菌株并以pOS1质粒形式获得回补株MRSA252-Δcdr (pOS1cdr),为我们之后进一步研究耐甲氧西林金黄色葡萄球菌CoADR或研究其他蛋白功能奠定了基础。
References
| [1] | Hu FP, Guo Y, Zhu DM, Wang F, Jiang XF, Xu YC, Zhang XJ, Zhang ZX, Ji P, Xie Y, Kang M, Wang CQ, Wang AM, Xu YH, Shen JL, Sun ZY, Chen ZJ, Ni YX, Sun JY, Chu YZ, Tian SF, Hu ZD, Li J, Yu YS, Lin J, Shan B, Du Y, Guo SF, Wei LH, Zou FM, Zhang H, Wang C, Hu YJ, Ai XM, Zhuo C, Su DH, Wang RZ, Fang H, Yu BX, Zhao Y, Gong P, Guo DW, Zhao JY, Liu WE, Li YM, Jin Y, Shao CH, Wen KZ, Zhang YR, Xu XS, Yan C, Yu H, Huang XN, Wang SM, Chu YF, Zhang LX, Ma J, Zhou SP, Zhou Y, Zhu L, Meng JH, Dong F, Zheng HY, Shen H, Zhou WQ, Jia W, Li G, Wu JS, Lu YM. Antimicrobial resistance profile of clinical isolates in hospitals across China: report from the CHINET Surveillance Program, 2017. Chinese Journal of Infection and Chemotherapy, 2018, 18(3): 241-251. (in Chinese) 胡付品, 郭燕, 朱德妹, 汪复, 蒋晓飞, 徐英春, 张小江, 张朝霞, 季萍, 谢轶, 康梅, 王传清, 王爱敏, 徐元宏, 沈继录, 孙自镛, 陈中举, 倪语星, 孙景勇, 褚云卓, 田素飞, 胡志东, 李金, 俞云松, 林洁, 单斌, 杜艳, 郭素芳, 魏莲花, 邹凤梅, 张泓, 王春, 胡云建, 艾效曼, 卓超, 苏丹虹, 汪瑞忠, 房华, 俞碧霞, 赵勇, 龚萍, 郭大文, 赵金英, 刘文恩, 李艳明, 金炎, 邵春红, 温开镇, 张贻荣, 徐雪松, 鄢超, 喻华, 黄湘宁, 王山梅, 楚亚菲, 张利侠, 马娟, 周树平, 周艳, 朱镭, 孟晋华, 董芳, 郑红艳, 沈瀚, 周万青, 贾伟, 李刚, 吴劲松, 卢月梅. 2017年CHINET中国细菌耐药性监测. 中国感染与化疗杂志, 2018, 18(3): 241-251. |
| [2] | Zhang T, Ni MX, Shao L, Chen DJ. Research progress in mechanism of β-lactam antibiotics. Chinese Journal of Antibiotics, 2015, 40(10): 785-790. (in Chinese) 张韬, 倪孟祥, 邵雷, 陈代杰. β-内酰胺抗生素作用机制的研究进展. 中国抗生素杂志, 2015, 40(10): 785-790. DOI:10.3969/j.issn.1001-8689.2015.10.014 |
| [3] | Liu XF, Hu YW, Pai PJ, Chen DJ, Lam H. Label-free quantitative proteomics analysis of antibiotic response in Staphylococcus aureus to oxacillin. Journal of Proteome Research, 2014, 13(3): 1223-1233. DOI:10.1021/pr400669d |
| [4] | Liu XF, Pai PJ, Zhang WP, Hu YW, Dong XJ, Qian PY, Chen DJ, Lam H. Proteomic response of methicillin-resistant S. aureus to a synergistic antibacterial drug combination: a novel erythromycin derivative and oxacillin. Scientific Reports, 2016, 6: 19841. DOI:10.1038/srep19841 |
| [5] | delCardayré SB, Davies JE. Staphylococcus aureus coenzyme a disulfide reductase, a new subfamily of pyridine nucleotide-disulfide oxidoreductase: sequence, expression, and analysis of cdr. The Journal of Biological Chemistry, 1998, 273(10): 5752-5757. DOI:10.1074/jbc.273.10.5752 |
| [6] | delCardayré SB, Stock KP, Newton GL, Fahey RC, Davies JE. Coenzyme A disulfide reductase, the primary low molecular weight disulfide reductase from Staphylococcus aureus: purification and characterization of the native enzyme. The Journal of Biological Chemistry, 1998, 273(10): 5744-5751. DOI:10.1074/jbc.273.10.5744 |
| [7] | Boylan JA, Hummel CS, Benoit S, Garcia-Lara J, Treglown-Downey J, Crane Ⅲ EJ, Gherardini FC. Borrelia burgdorferi bb0728 encodes a coenzyme A disulphide reductase whose function suggests a role in intracellular redox and the oxidative stress response. Molecular Microbiology, 2006, 59(2): 475-486. DOI:10.1111/j.1365-2958.2005.04963.x |
| [8] | Eggers CH, Caimano MJ, Malizia RA, Kariu T, Cusack B, Desrosiers DC, Hazlett KRO, Claiborne A, Pal U, Radolf JD. The coenzyme A disulphide reductase of Borrelia burgdorferi is important for rapid growth throughout the enzootic cycle and essential for infection of the mammalian host. Molecular Microbiology, 2011, 82(3): 679-697. DOI:10.1111/j.1365-2958.2011.07845.x |
| [9] | Zhao XL, Drlica K. Reactive oxygen species and the bacterial response to lethal stress. Current Opinion in Microbiology, 2014, 21: 1-6. DOI:10.1016/j.mib.2014.06.008 |
| [10] | Liu Q, Jiang Y, Shao L, Yang P, Sun BB, Yang S, Chen DJ. CRISPR/Cas9-based efficient genome editing in Staphylococcus aureus. Acta Biochimica et Biophysica SINICA, 2017, 49(9): 764-770. DOI:10.1093/abbs/gmx074 |
| [11] | Chen WZ, Zhang YF, Yeo WS, Bae T, Ji QJ. Rapid and efficient genome editing in Staphylococcus aureus by using an engineered CRISPR/Cas9 system. Journal of the American Chemical Society, 2017, 139(10): 3790-3795. DOI:10.1021/jacs.6b13317 |
| [12] | Bae T, Schneewind O. Allelic replacement in Staphylococcus aureus with inducible counter-selection. Plasmid, 2006, 55(1): 58-63. DOI:10.1016/j.plasmid.2005.05.005 |
| [13] | Luba J, Charrier V, Claiborne A. Coenzyme A-disulfide reductase from Staphylococcus aureus: evidence for asymmetric behavior on interaction with pyridine nucleotides. Biochemistry, 1999, 38(9): 2725-2737. DOI:10.1021/bi9825899 |
| [14] | Li MZ, Elledge SJ. Harnessing homologous recombination in vitro to generate recombinant DNA via SLIC. Nature Methods, 2007, 4(3): 251-256. DOI:10.1038/nmeth1010 |
| [15] | Olson ME. Bacteriophage transduction in Staphylococcus aureus//Bose J. The Genetic Manipulation of Staphylococci: Methods and Protocols. New York, NY: Humana Press, 2014. |
| [16] | Clinical and Laboratory Standards Institute. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically; approved standard-Ninth Edition (M07-A9). Wayne, PA: Clinical and Laboratory Standards Institute, 2012. |
| [17] | Li ZL, Tan J, Shao L, Dong XJ, Ye RD, Chen DJ. Selenium-mediated protection in reversing the sensitivity of bacterium to the bactericidal antibiotics. Journal of Trace Elements in Medicine and Biology, 2017, 41: 23-31. DOI:10.1016/j.jtemb.2017.02.007 |
| [18] | Mallett TC, Wallen JR, Karplus PA, Sakai H, Tsukihara T, Claiborne A. Structure of Coenzyme A-disulfide reductase from Staphylococcus aureus at 1.54 ? resolution. Biochemistry, 2006, 45(38): 11278-11289. DOI:10.1021/bi061139a |
| [19] | Schneider WP, Ho SK, Christine J, Yao MQ, Marra A, Hromockyj AE. Virulence gene identification by differential fluorescence induction analysis of Staphylococcus aureus gene expression during infection-simulating culture. Infection And Immunity, 2002, 70(3): 1326-1333. |
| [20] | van der Westhuyzen R, Strauss E. Michael acceptor-containing coenzyme A analogues as inhibitors of the atypical coenzyme A disulfide reductase from Staphylococcus aureus. Journal of the American Chemical Society, 2010, 132(37): 12853-12855. DOI:10.1021/ja106204m |
| [21] | Newton GL, Rawat M, La Clair JJ, Jothivasan VK, Budiarto T, Hamilton CJ, Claiborne A, Helmann JD, Fahey RC. Bacillithiol is an antioxidant thiol produced in Bacilli. Nature Chemical Biology, 2009, 5(9): 625-627. DOI:10.1038/nchembio.189 |
| [22] | Perera VR, Newton GL, Pogliano K. Bacillithiol: a key protective thiol in Staphylococcus aureus. Expert Review of Anti-Infective Therapy, 2015, 13(9): 1089-1107. DOI:10.1586/14787210.2015.1064309 |
| [23] | Van Acker H, Coenye T. The role of reactive oxygen species in antibiotic-mediated killing of bacteria. Trends in Microbiology, 2017, 25(6): 456-466. DOI:10.1016/j.tim.2016.12.008 |
