秦琪1, 董战旗1, 雷雪蛟1, 曹明亚1, 唐亮2, 石美宁2, 潘敏慧1


1. 西南大学家蚕基因组生物学国家重点实验室, 重庆 400716;
2. 广西壮族自治区蚕业技术推广总站, 广西 南宁 530007
收稿日期:2019-02-03;修回日期:2019-05-13;网络出版日期:2019-07-11
基金项目:国家自然科学基金(31872427);国家蚕桑产业技术体系(CARS-18)
*通信作者:潘敏慧, E-mail:pmh047@126.com.
摘要:[目的] 家蚕核型多角体病毒(Bombyx mori nucleopolyhedrovirus,BmNPV)促使的血液型脓病是一种产业上非常严重的家蚕疾病,目前有效的防控方法较少。本研究以大造和CVDAR家蚕品系(对BmNPV有较强抗性的品系)为试验材料,通过分析CVDAR对BmNPV抗性特征,以期确定CVDAR对BmNPV的抗性机制。[方法] 本研究通过半致死剂量分析,发现CVDAR品系比大造品系对BmNPV感染的半致死剂量提高10倍以上;进一步HE染色分析大造与CVDAR品系病毒感染前后的中肠组织的变化,具体解析抗性品系CVDAR的抗BmNPV机制。[结果] 感染BmNPV 72 h后,大造中肠细胞细胞核明显膨大,着色变浅,到96 h后,细胞核持续增大有脱落趋势;而CVDAR抗性品系只在感染96 h后有中肠部分细胞核膨大,但排列整齐;同时通过荧光定量分析大造与CVDAR品系病毒感染后的增殖情况,结合各个时期代表病毒基因的转录水平分析比较发现,感染BmNPV后0-12 h也没有发现抗性品系CVDAR和大造之间的病毒拷贝数以及病毒基因转录水平的不同,但感染24 h后发现抗性品系CVDAR无论是病毒拷贝数还是病毒基因的转录表达水平都明显低于对照大造。[结论] 证明CVDAR口服添毒后中肠中病毒基因的转录在第一轮复制期间不受影响,之后转录水平降低。鉴定CVDAR品系抑制BmNPV增殖的关键时期是在感染BmNPV后的24 h,为解析抗性机制奠定基础。
关键词:家蚕家蚕核型多角体病毒CVDAR抗病毒
Characteristic analysis of resistance to BmNPV in CVDAR strain of silkworm
Qi Qin1, Zhanqi Dong1, Xuejiao Lei1, Mingya Cao1, Liang Tang2, Meining Shi2, Minhui Pan1


1. State Key Laboratory of Silkworm Genome Biology, Southwest University, Chongqing 400716, China;
2. Guangxi Zhuang Autonomous Region Silkworm Technology Promotion Station, Nanning 530007, Guangxi Zhuang Autonomous Region, China
Received: 3 February 2019; Revised: 13 May 2019; Published online: 11 July 2019
*Corresponding author: Minhui Pan, E-mail:pmh047@126.com.
Foundation item: Supported by the National Natural Science Foundation of China (31872427) and by the National Silkworm Industrial Technical System (CARS-18)
Abstract: [Objective] Bombyx mori nucleopolyhedrovirus (BmNPV) induced hematogenous sepsis is a common severe disease of silkworm, and there are few effective prevention and control methods. In this study, CVDAR andDaZao (lines with strong resistance to BmNPV) silkworm strains were used as experimental materials. By analyzing the resistance characteristics of CVDAR silkworm, the resistance mechanism of CVDAR to BmNPV was determined. [Methods] In this study, we found that the lethal dose of CVDAR strain to BmNPV infection was more than 10 times higher than that of DaZao through semi lethal dose analysis. Further HE staining was performed to analyze the changes of midgut tissues before and after the infection of CVDAR and DaZao strains, and analyzed the anti-BmNPV mechanism of the resistant CVDAR strain. [Results] The results showed that after 72 hours of infection with BmNPV, the nucleus of large intestinal cells was enlarged and the staining became lighter; after 96 hours, the nuclei continued to increase and tended to fall off. The CVDAR-resistant strains only had enlarged nuclei in part of midgut after 96 hours of infection, but they were well arranged. At the same time by fluorescence quantitative analysis of the CVDAR and DaZao strain proliferation after virus infection, combined with the analysis and comparison of the transcriptional levels of the representative virus genes in each period, no difference in virus copy number and viral genes transcription level between the resistant CVDAR strain and the DaZao strain were found between 0-12 h after BmNPV infection. However, 24 hours after infection, we found that the CVDAR of the resistant strain was significantly lower than that of the control strain, regardless of the number of viral copies or the transcriptional expression level of viral genes. [Conclusion] Our study demonstrated that during the first round of replication after oral addition of CVDAR, the transcription of midgut virus genes was not affected; and later the transcription level was reduced. The critical period for the inhibition of BmNPV proliferation by CVDAR strain was identified to be 24 h after BmNPV infection, laying a foundation for the analysis of the resistance mechanism.
Keywords: Bombyx moriBombyx mori nuclear polyhedrosis virusCVDARantiviral
杆状病毒(Baculovirus)是现今昆虫病毒中所属的类群最大并且具有很大实用意义的一种杆状、有囊膜的双链DNA病毒[1],是节肢动物病原体且主要寄生于鳞翅目昆虫体内[2]。它囊括核型多角体病毒(nucleopolyhedrovirus,NPV)以及颗粒病毒(granulovirus,GV)科[3]两类。由家蚕核型多角体病毒(BmNPV)造成的脓病在蚕业生产上是最常有的严重蚕病之一,目前仍没有有效的防控方法。
家蚕(Bombyx mori)是一种寡食性泌丝昆虫,蚕桑产业既是丝绸之路的文化载体,也是中国农业的重要组成部分。迄今为止出现的家蚕品系很多,而各个品系之间的抗病能力和经济性状等特征也不尽相同。而从上个世纪开始就不断有****通过实验发现不同的家蚕品系对感染BmNPV存在抗性差异,但未发现有完全不感染的家蚕品系[4-6]。1982年,孟智启使用浓度-死亡率机率曲线法,确定了家蚕对BmNPV经口感染的抗性遗传规律方式,由一对主效显性基因和若干微效基因控制[4]。随后朱勇等[5]使用机率分析法分析鉴定了多个家蚕品系抗病能力;之后陈克平等对344个家蚕保存种进行BmNPV抗性实验[6],发现仅有4.9%的家蚕抗性品系,有41.6%家蚕较抗品系,剩余53.5%都是感性和较感性家蚕品系。
尽管经过很多蚕业****的努力已经鉴定出来部分抗BmNPV能力的家蚕品种,并且近年来也不断有新的家蚕抗性品系被筛选出来,比如张远能[7]研究多个代表性家蚕品系对多种家蚕蚕病的抗病力,得到其中5种家蚕品系有较强的抗病能力;陈克平等发现的家蚕品系NB[6];中国蚕业研究所选育的家蚕品系871C×872C,又称“华康一号”[8]等。近年来多位****专家集中探求家蚕的抗病基因[9-12]、解析抗性机制[13-15]、培育家蚕抗性品种[16-18],虽然在一些领域取得了一定进展,但关于家蚕抗性品系抗BmNPV的主效基因以及作用机制仍不清楚。
抗性育种作为防控BmNPV的有效方式,也是产业发展的急需解决的重要问题。而随着分子生物学技术的出现使得通过采用分子标记定位出调控家蚕抗BmNPV的基因这一想法得到可能。随着当前大数据时代来临,研究分析家蚕高抗和敏感品系的基因组、转录组[19-24]和蛋白质组等数据[13]对剖析家蚕抗病毒机理提供便利。本研究中所用的抗性品系CVDAR是由费美华等筛选出来的[25]。利用对BmNPV有抗性的CVDAR以及大造为材料,经口添食BmNPV后鉴定它们对BmNPV抗性差异,结合中肠石蜡切片、HE染色和定量PCR技术,观察了两种家蚕品系感染BmNPV后中肠病理学变化和中肠中BmNPV增殖复制情况。通过分析CVDAR、大造在感染BmNPV后中肠中病毒基因的转录水平,初步探索家蚕抗性品系CVDAR抗BmNPV机制,鉴定在对BmNPV侵染和增殖起关键作用的相关基因,以期为家蚕抗BmNPV研究提供基础依据,从而剖析更深一层家蚕抗性品系应对抵抗病毒侵染的机制。
1 材料和方法 1.1 材料和主要试剂 家蚕CVDAR和大造(P50)蚕卵由本实验室提供。BmNPV病毒株的多角体和家蚕卵巢培养细胞(BmN-SWU1)由本实验室保存。
切片石蜡(54–56 ℃,56–58 ℃)购自重庆化学试剂厂;苏木素伊红(HE)染色液试剂盒购自碧云天(Beyotime);卡尔诺氏固定液(100%酒精:冰醋酸:氯仿=6:1:3)。全基因组/RNA提取试剂盒/反转录试剂盒均购自宝日生公司。
1.2 家蚕品系的死亡率和半致死剂量测定 挑选叶面平整的新鲜桑叶剪裁成1 cm×1 cm,定量添加不同梯度的病毒悬液(109、108、l07、106、105 PIBs/mL)以便每头蚕添食的病毒粒子相同,阴性对照桑叶上添食相同体积的水,选择每组30头个体体型相似的健康的CVDAR和大造四龄起蚕,待桑叶表面风干后进行单头蚕喂食,挑取完全吃完桑叶的家蚕进行正常饲养,统计喂食4 d后的连续6 d内的死亡率。利用SPSS软件计算半致死剂量。
1.3 家蚕幼虫中肠材料准备 吸取少量109 PIBs/mL的新鲜BmNPV悬液涂于桑叶背面,对照组使用双蒸水,桑叶风干后喂食4龄起家蚕,挑取完全吃完桑叶的家蚕进行正常饲养。
从家蚕吃完抹有病毒的桑叶后开始计时,分别在6、12、24、48、72、96 hours post infection (h p.i.) 6个时间点取5–6头家蚕的中肠。用于解剖的一系列工具要经过酒精消毒以及高温灭菌,用解剖针固定家蚕头和尾,用解剖针轻轻划破家蚕表皮,镊子将表皮向四周展开并用解剖针固定好,将干净的中肠组织取出,放置于置有3倍体积以上的标记好的固定液中保存,固定1 d,用70%乙醇换洗到没有其他杂质,最后放于包埋盒中保存于70%乙醇中–4 ℃。
1.4 中肠石蜡切片制备与染色 将包埋盒进行脱水、透明、浸蜡、包埋以及切片等一系列的操作后,做好标记(名称,切片厚度,日期)置于展片板在37 ℃烘箱过夜或60 ℃烘烤2 h。
将蜡片经过脱蜡、水化后进行染色,其中苏木精染细胞核,伊红染细胞质,染色后进行脱水和透明,镜检检查染色情况是否合格,最后封片,干燥后可以显微观察。
1.5 中肠组织全基因组和RNA的抽提、反转录 取灭菌后预冷过的干净研钵,依次加入中肠和液氮,进行研磨成细粉状即可(以防RNA酶污染样品),收集到1.5 mL无RNA酶离心管中。提取中肠组织的基因组和RNA。提取基因组DNA步骤为:加600 μL核酸裂解液,剧烈振荡直到离心管内为流动液体;加200 μL蛋白质纯化液,振荡20 s,置于冰上5 min,13400 r/min离心10 min;吸取上清到加有600 μL室温异丙醇的离心管中,轻轻颠倒混匀,出现白色线性DNA,13400 r/min离心5 min;弃上清后加600 μL 70%乙醇,轻轻颠倒,13400 r/min离心5 min,吸去上清;风干酒精后加入30 μL DNA再分化液65 ℃ 1 h,测浓度,根据所测浓度加水稀释至浓度为100 ng/μL。
提取RNA步骤为:加600 μL RNA solo regant,剧烈振荡直到离心管内为流动液体,13400 r/min离心10 min;取上清加到有200 μL氯仿的离心管内,剧烈振荡后冰浴10 min再13400 r/min离心10 min;取最上层液体加到有2倍体积的无水乙醇的离心管中混匀,转入吸附柱,室温8000 r/min离心1 min,弃废液;加400 μL Buffer1,静置3 min,8000 r/min离心1 min,弃废液;重复1次;加300 μL Buffer11,静置3 min,8000 r/min离心1 min,弃废液;重复1次后,空离,静置风干酒精5 min,加DEPC水35 μL后静置5 min,13400 r/min离心3 min,测浓度。
测的浓度的RNA进行合成cDNA,步骤如下:稀释RNA浓度到1000 ng/μL;样品1 μL,ddH2O 6 μL,1 μL试剂I,2 μL试剂II,42 ℃热激2 min;加入1 μL试剂3,4 μL试剂4,4 μL试剂5,1 μL ddH2O,根据37 ℃ 30 min、85 ℃ 5 s、12 ℃保持体系合成cDNA。而合成的cDNA模板的检测是以家蚕肌动蛋白基因actin3为内参基因,引物序列见表 1。反应体系(15 μL)如下:1.5 μL 10×rTaq buffer (含Mg2+),1.5 μL dNTPs,0.6 μL rTaq酶,1 μL cDNA模板,0.3 μL Actin3-F/R,双蒸水加至15 μL。反应程序:94 ℃ 4 min;94 ℃ 40 s,58 ℃ 45 s,72 ℃ 30 s,30个循环;72 ℃ 10 min,12 ℃保持。反转出来的cDNA吸出5–10 μL进行琼脂糖凝胶电泳检测。
表 1. 本试验所用引物 Table 1. Primers used in this study
| Gene | Primer | Sequence (5′→3′) |
| ie-1 | Forward | CGAGACGGCTGCACAAAA |
| Reverse | TGCCCAAAAGAAACCCACA | |
| dnapol | Forward | GCCGATTTGCGTTTTTTGCC |
| Reverse | GATTGCCATTTGTGCTTGTT | |
| vp39 | Forward | AGACACCACAAACCCGAACAC |
| Reverse | TTGATCGCCAACACCACCT | |
| gp64 | Forward | CACCATCGTGGAGACGGACTAC |
| Reverse | ACCTCGCACTGCTGCCTGA | |
| gp41 | Forward | ATGTTGATGTGCGGAAAGC |
| Reverse | GTGGCGGAATCGGTGA | |
| actin3 | Forward | AACACCCCGTCCTGCTCACTG |
| Reverse | GGGCGAGACGTGTGATTTCCT | |
| sw22934 | Forward | TTCGTACTGGCTCTTCTCGT |
| Reverse | CAAAGTTGATAGCAATTCCCT |
表选项
1.6 RT-PCR检测家蚕品系的病毒增殖变化 以BmNPV病毒感染的相同浓度的中肠基因组DNA为模板,进行PCR扩增检测病毒的拷贝数,引物序列见表 1。反应体系为:5 μL SYBR,5 μL DEPC水,上下游引物均为0.3 μL,模板0.6 μL。反应程序为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,以上进行40个循环;延伸95 ℃ 10 s,退火15 s。
2 结果和分析 2.1 家蚕品系CVDAR对BmNPV的抗性检测 基于确定家蚕抗性品系CVDAR和家蚕大造品系之间的抗性差异,本研究通过观察两种家蚕品系经口添食BmNPV后期的不同发病症状和发病程度,结果表明了CVDAR家蚕品系经口添食含BmNPV的桑叶72 h后,与正常对照家蚕的外形差异不明显;而在84 h p.i发现家蚕体色乳白,环节肿胀,狂躁爬行;在120 h p.i体壁破裂,流脓而死,尸体快速腐败,镜检脓汁发现有大量病毒多角体存在。
对CVDAR、大造品系经口添食BmNPV后,观察到大造的发病高峰期是5–6 d,CVDAR的发病高峰期均推迟1–2 d,是在感染后6–7 d (图 1)。
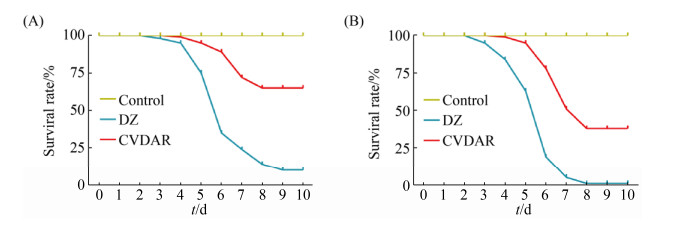 |
| 图 1 添食不同浓度病毒后CVDAR品系、大造家蚕存活率 Figure 1 The survival rate of CVDAR and DaZao were obtained after feeding with different concentrations of virus. A: Survival curve of Fourth-instar of Bombyx mori by oral administration of 1×105 PIBs/mL virus particles; B: Survival curve of Fourth-instar of Bombyx mori by oral administration of 1×106 PIBs/mL virus particles. Control stands for the DaZao of viruses that have not been added. |
| 图选项 |
统计经口添食不同病毒浓度后家蚕的死亡率(图 2)。病毒浓度1×108 PIBs/mL,CVDAR的死亡率在80%以上;浓度1×107 PIBs/mL,CVDAR的死亡率在56%以上;浓度1×106 PIBs/mL,CVDAR的死亡率在33%以上,此时大造的死亡率达到了85%以上;浓度1×105 PIBs/mL,大造的死亡率在77%以上;而浓度为1×104 PIBs/mL,大造的死亡率是42%以上。
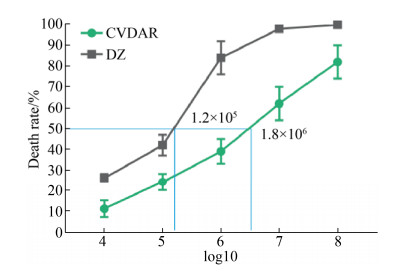 |
| 图 2 经口添食不同病毒浓度后家蚕的死亡率 Figure 2 Death rate of silkworm after oral feeding with different virus concentrations. *: P < 0.05, **: P < 0.01. |
| 图选项 |
利用SPSS软件得出CVDAR、大造品系感染BmNPV后半致死剂量LD50 (图 2)。发现CVDAR的LD50为1.8×106,相比大造高出一个数量级。综上结果表明,CVDAR品系经口添食BmNPV后的抗性水平高于对照品系大造。
2.2 家蚕感染BmNPV后中肠组织的病理学观察 基于之前中肠对BmNPV的抑制作用的研究,为了探究中肠组织作为家蚕防御病毒屏障的一系列的生理特点。本研究制作感染BmNPV后CVDAR、大造的中肠切片,观察中肠的病理变化(图 3)。无BmNPV的中肠切片图(图 3-A,G)显示上皮细胞层排列完整且有秩序,细胞外观形态光滑饱满,其中形态大多为圆筒形以及杯状,内面的围食膜为一层厚薄均匀、表面光滑有弹性的丝状薄膜。相比CVDAR的围食膜,大造的围食膜更单一紧实。观察病毒感染12 h和24 h (图 3-B,C,H,I)后,两个品系的中肠细胞的形状和细胞核的大小无明显差异。CVDAR、大造品系在感染48 h后(图 3-D,J),发现上皮细胞分泌物增多,但形态大小没有明显变化。病毒感染72 h后(图 3-E,K),两个品系的围食膜变薄并十分松散。大造上皮细胞大小缩减,细胞核体积增大且着色变浅,并迁向肠腔一边。CVDAR上皮细胞形态较整齐,出现少量红色颗粒。而感染96 h (图 3-F,L)后,CVDAR、大造品系的上皮细胞形状均观察到显著异常。其中作为对照的大造上皮细胞层中柱状细胞形态杂乱,细胞核一直膨胀而且也出现了一部分有脱落趋向细胞核,剩余部分近乎没有细胞质。CVDAR上皮细胞形态对比大造而言相对整齐,只有一些柱状细胞核增大,另外一些细胞里面有较多红色颗粒物。
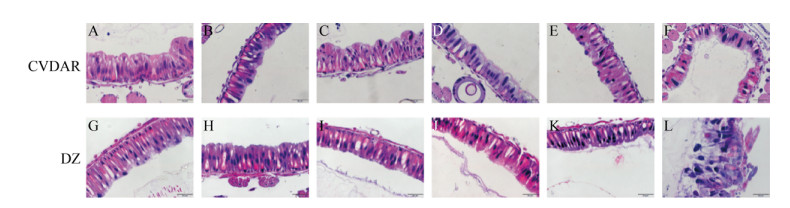 |
| 图 3 BmNPV感染后家蚕品系CVDAR、大造中肠组织切片观察(400倍) Figure 3 Histological section of midgut after Fourth-instar silkworm CVDAR and BmNPV infection (400×). A, G were midgut tissue section of the Fourth-instar of CVDAR and DaZao; B, C, D, E, F were the midgut sections of CVDAR at the fourth age of 12, 24, 48, 72, and 96 h p.i, respectively; H, I, J, K, L were the midgut sections of DaZao at the fourth age of 12, 24, 48, 72 and 96 h p.i, respectively. |
| 图选项 |
2.3 经口添食的家蚕中肠组织BmNPV复制增殖差异 由于家蚕中肠上皮是病毒经口感染遇到的第一个组织,为了进一步分析家蚕抗性品系CVDAR和对照大造品系的抗性,分析在经口添食条件下家蚕CVDAR的中肠组织对BmNPV的作用。本试验模板为经口添食BmNPV后的大造和CVDAR品系的中肠材料,根据实验设计定量引物(表 1) gp41进行实时荧光定量PCR,从而检测中肠中BmNPV病毒的拷贝数(图 4)。
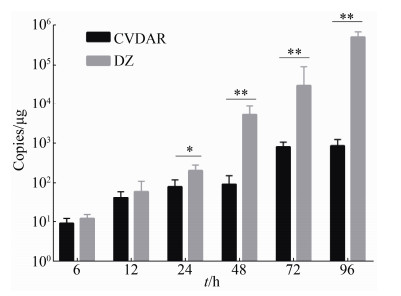 |
| 图 4 经口添食BmNPV后家蚕品系中肠组织拷贝数情况 Figure 4 Expression of virus in the midgut of Bombyx mori after oral infection with NPV. The error line represents the criterion deflection; *: express extremely significant, P < 0.05; **: express extremely significant, P < 0.01. |
| 图选项 |
经口添食BmNPV的6 h后,发现CVDAR、大造的中肠病毒拷贝数差异不明显,表明抗性品系CVDAR抗BmNPV作用不体现在抵制病毒入侵方面;大造中肠的病毒拷贝数在12 h和24 h p.i.上升,CVDAR抗性品系相较于大造是缓慢增殖,说明CVDAR在添毒12 h和24 h p.i时病毒在中肠的复制受到遏制;抗性品系中肠的病毒拷贝数在48 h p.i明显低于大造;而在之后的72和96 h p.i仍呈现此趋势。由此可知,经口添食BmNPV后,抗性品系CVDAR的中肠对病毒增殖的抑制时期和病毒早期DNA第一轮复制时期无关,是在病毒第一轮复制增殖后的时期即24–48 h p.i。
2.4 经口感染BmNPV后病毒基因在中肠中的转录水平 为了确定在经口感染病毒后在中肠中被遏制的主要病毒基因,本研究选择多个病毒基因作为检测的目标基因,利用RT-PCR方法检测中肠中不同时期病毒基因的转录水平。下图中各基因的定量引物见表 1。
经口添毒后检测中肠中不同时期的病毒基因的转录水平,发现在添毒24 h p.i,抗性品系CVDAR中肠病毒基因的转录水平达到最高值,而在48 h p.i有一个降低趋势(图 5)。
 |
| 图 5 经口感染BmNPV后家蚕中肠中病毒基因持续表达情况 Figure 5 Persistent expression of virus genes in midgut of silkworm after oral infection with BmNPV. ie-1 is a very early viral gene; early viral gene gp64; DNA polymerase gene dnapol; late gene vp39 is the capsid protein. The error bars indicate the standard deviations; *: express extremely significant, P < 0.05; **: express extremely significant, P < 0.01. |
| 图选项 |
结合之前对中肠拷贝数分析,CVDAR中肠中病毒在48 h p.i前被抑制,而在24 h p.i病毒基因的转录水平达到最高值,说明在经口添毒后在第一轮病毒复制期间,CVDAR中肠中的各个不同时期病毒基因的转录水平没有受到影响,而在之后这些基因的转录水平降低。
3 讨论 从古至今,种桑养蚕,缫丝织绸,不但解决了人们的穿衣问题,还推进了对外贸易,开拓了丝绸之路。而由病毒病引发的蚕病是威胁蚕桑产业发展的重要危害,每年因病毒性疾病所造成的蚕病损失,约占总蚕病损失的70%–80%,而BmNPV病是危害蚕业生产最严重的一种病毒病,生产上常有暴发。而生产上对BmNPV的防控只能基于对外界养蚕环境和工具进行及时消毒,但这种方式可以减小BmNPV感染几率,没有在根源上控制其发生,一旦暴发仍旧很难抑制。
培育抗性品系的现有方式主要有遗传育种和传统育种,随着现代科技的进步,蚕桑生产上也朝着省力化、轻简化的方向进行,从而对培育的家蚕品系NPV抵抗性也提出更高的要求,而利用分子育种技术来增强家蚕抗病力也成为重点。先前利用家蚕核型多角体病毒高抗品系和高感品系及其近等基因系成功获得了与家蚕抗NPV相关的分子标记,比如刘晓勇等[26],李木旺等[27],姚勤等[15]。本研究获得的CVDAR抗性品系是利用这种方法筛选获得,费美华等[25]通过多年的实验,选育出一种CVDAR家蚕抗NPV品系,结果发现以它为亲本材料进行杂交后,检测后代对NPV抵抗性指标LD50,比家蚕常规生产品系高5–6个数量级。近年****研究员利用人工转基因技术不受生物体间亲缘关系限制的优点,筛选得到品种良好的新抗性品系[28]。家蚕转基因育种一般分两种方式,一种是依靠RNA干扰(RNA interference,RNAi)、CRISPR/Cas9基因编辑技术抑制病毒复制基因阻止其表达,进而可以增强家蚕抗病毒能力。另一种是利用转基因技术将已经鉴定到的抗病基因导入蚕体内,得到具备抵抗性的家蚕,然后使用常规育种方法选育抗病品种。近年来涌现出很多涉及家蚕方面对BmNPV抗性的实验研究,期望解析出家蚕对BmNPV的抗性遗传规律,进而选育出抗BmNPV的家蚕品系以便投入生产使用。
当前围绕抗NPV的家蚕研究的重心大都放在家蚕抗NPV过程中宿主和病毒基因的响应应答以及发挥的功能上[29-31],关于家蚕抗BmNPV品系对BmNPV作用机制仍未有突破性进展。本研究围绕抗BmNPV家蚕品系在感染NPV后的抗性特征,以期解析抗性品系抗BmNPV的关键作用。首先对大造、CVDAR喂食不同梯度浓度的BmNPV,统计家蚕的个体死亡率和半致死剂量,证实CVDAR家蚕品系对BmNPV的抗性。进而通过制作正常家蚕中肠和大造、CVDAR品系病变后中肠石蜡切片以及利用荧光定量PCR方法检测大造、CVDAR中肠中多个病毒基因复制情况,发现两种品系病毒基因转录水平在感染早期基本一致,说明在抵抗病毒的入侵方面,CVDAR和对照大造并无差异。而侵染24 h后,抗性品系CVDAR在中肠中的病毒基因转录水平达到最高;在侵染48–96 h后,CVDAR品系中肠中的病毒基因转录水平都明显低于大造,说明CVDAR在经口添毒后中肠中病毒基因的转录在第一轮复制期间没有受到影响。
4 结论 通过检测大造、CVDAR家蚕品系对BmNPV的半致死剂量确定了品系CVDAR属于高抗品系,进一步利用荧光定量PCR技术检测病毒初次感染中肠后病毒基因的表达情况发现在经口添毒后CVDAR中肠中病毒基因的转录在第一轮复制期间没有受到影响,为解析抗性机制奠定基础。
References
| [1] | Meng QF, Liu XY. Research progress in the interactions of baculoviruses with host insects. Acta Entomologica Sinica, 2013, 56(8): 925-933. (in Chinese) 孟庆峰, 刘晓勇. 杆状病毒与昆虫宿主相互作用的研究进展. 昆虫学报, 2013, 56(8): 925-933. |
| [2] | Gao JM, Peng JX, Hong HZ. The genomic structure and characteristics of baculovirus. Microbiology China, 2003, 30(4): 99-103. (in Chinese) 高建明, 彭建新, 洪华珠. 杆状病毒基因组结构及其特征. 微生物学通报, 2003, 30(4): 99-103. DOI:10.3969/j.issn.0253-2654.2003.04.025 |
| [3] | Luo J, Zhou GY, Zhu JY. Progress in nuclear polyhedrosis virus genomics. Forest Research, 2014, 27(4): 551-556. (in Chinese) 罗辑, 周国英, 朱积余. 核型多角体病毒基因组学研究进展. 林业科学研究, 2014, 27(4): 551-556. |
| [4] | Meng ZQ. Study on resistance of Silkworm to nuclear polyhedral virus disease. Acta Sericologica Sinica, 1982, 8(3): 133-138. (in Chinese) 孟智启. 家蚕对核型多角体病毒病抵抗性遗传规律的研究. 蚕业科学, 1982, 8(3): 133-138. |
| [5] | Zhu Y, Lu C, Chen P, Yu GL, Zeng HM, Ran XZ, Zhao BM. Genetic studies on the resistance to npv in silkworm (Bombyx mori L.). Journal of Southwest Agricultural University, 1998, 20(2): 100-103. (in Chinese) 朱勇, 鲁成, 陈萍, 余贵玲, 曾华明, 冉小曾, 赵邦美. 家蚕对核型多角体病毒(NPV)抗性的遗传学研究. 西南农业大学学报, 1998, 20(2): 100-103. |
| [6] | Chen KP, Lin CQ, Yao Q. Resistance of Silkworm conservation species to nuclear polyhedral disease. Acta Sericologica Sinica, 1991, 17(1): 45-46. (in Chinese) 陈克平, 林昌麒, 姚琴. 家蚕保存种对核型多角体病的抗性. 蚕业科学, 1991, 17(1): 45-46. |
| [7] | Zhang YN, Liu SX, Huo YM, Ou SR. Identification of resistance of several Silkworm varieties to six major Silkworm diseases. Acta Sericologica Sinica, 1982, 8(2): 94-97. (in Chinese) 张远能, 刘仕贤, 霍用梅, 欧少容. 若干家蚕品种对六种主要蚕病的抗性鉴定. 蚕业科学, 1982, 8(2): 94-97. |
| [8] | Li WX, Qing XG, Liu JF, Liu G, Xiao JS, Xu AY. Appraisal study on Bombyx mori breed '871C×872C' Resistance to BmNPV. Southwest China Journal of Agricultural Sciences, 2011, 24(2): 779-781. (in Chinese) 李文学, 青学刚, 刘俊凤, 刘刚, 肖金树, 徐安英. 家蚕品种871C×872C对BmNPV抗性鉴定研究. 西南农业学报, 2011, 24(2): 779-781. DOI:10.3969/j.issn.1001-4829.2011.02.082 |
| [9] | Gomi S, Majima K, Maeda S. Sequence analysis of the genome of Bombyx mori nucleopolyhedrovirus. Journal of General Virology, 1999, 80(5): 1323-1337. DOI:10.1099/0022-1317-80-5-1323 |
| [10] | Okano K, Shimada T, Mita K, Maeda S. Comparative expressed-sequence-tag analysis of differential gene expression profiles in BmNpv-infected BmN cells. Virology, 2001, 282(2): 348-356. DOI:10.1006/viro.2001.0823 |
| [11] | Ishikawa H, Ogasawara T, Ikeda M, Kobayashi M. A recombinant Bombyx mori nucleopolyhedrovirus possessing hrf-1 gene replicates in nonpermissive Lymantria dispar IPLB-Ld652Y cell line. Journal of Insect Biotechnology and Sericology, 2006, 75(1): 31-38. |
| [12] | Chen CJ, Quentin ME, Brennan LA, Kukel C, Thiem SM. Lymantria dispar nucleopolyhedrovirus hrf-1 expands the larval host range of Autographa californica nucleopolyhedrovirus. Journal of Virology, 1998, 72(3): 2526-2531. |
| [13] | 刘晓勇.家蚕核型多角体病毒与家蚕抗病毒相关的蛋白质组分析.江苏大学博士学位论文, 2009. |
| [14] | Cao JR, Zhou WL, Weng HB, Ye AH, Wang YQ. Molecular markers-assisted breeding for silkworm resistant variety to BmNPV. Bulletin of Sericulture, 2008, 39(3): 19-22. (in Chinese) 曹锦如, 周文林, 翁宏飚, 叶爱红, 王永强. 家蚕抗核型多角体病毒病分子标记辅助新品种选育研究. 蚕桑通报, 2008, 39(3): 19-22. DOI:10.3969/j.issn.0258-4069.2008.03.006 |
| [15] | Yao Q, Liu XY, Tang XD, Chen KP. Molecular markers-assisted breeding for silkworm resistant variety to BmNPV. Molecular Plant Breeding, 2005, 3(4): 537-542. (in Chinese) 姚勤, 刘晓勇, 唐旭东, 陈克平. 家蚕抗核型多角体病毒病分子标记辅助育种. 分子植物育种, 2005, 3(4): 537-542. DOI:10.3969/j.issn.1672-416X.2005.04.016 |
| [16] | Chen SQ, Hou CX, Bi HL, Wang YQ, Xu J, Li MW, James AA, Huang YP, Tan AJ. Transgenic clustered regularly interspaced short palindromic repeat/Cas9-mediated viral gene targeting for antiviral therapy of Bombyx mori nucleopolyhedrovirus. Journal of Virology, 2017, 91(8): e02465-16. |
| [17] | Zhang F, Chen X, Zhao Y, Qi GR, Huang JT, Lu CD. Transgenic silkworm of anti-NPV ribozyme. Acta Biochimica et Biophysica Sinica, 1999, 31(3): 331-333. (in Chinese) 张峰, 陈秀, 赵昀, 祁国荣, 黄君霆, 陆长德. 抗NPV-核酶转基因蚕的研究. 生物化学与生物物理学报, 1999, 31(3): 331-333. |
| [18] | Jiang L, Sun Q, Jin SK, Xu MX, Cheng TC, Xia QY. An investigation on main traits of transgenic silkworm overex- pressing bmlipase-1. Science of Sericulture, 2012, 38(5): 822-824. (in Chinese) 蒋亮, 孙强, 金盛凯, 徐美茜, 程廷才, 夏庆友. 增量表达Bmlipase-1的转基因家蚕的主要经济性状调查. 蚕业科学, 2012, 38(5): 822-824. |
| [19] | Oomens AGP, Blissard GW. Requirement for GP64 to drive efficient budding of Autographa californica multicapsid nucleopolyhedrovirus. Virology, 1999, 254(2): 297-314. DOI:10.1006/viro.1998.9523 |
| [20] | Monsma SA, Oomens AG, Blissard GW. The GP64 envelope fusion protein is an essential baculovirus protein required for cell-to-cell transmission of infection. Journal of Virology, 1996, 70(7): 4607-4616. |
| [21] | Ono C, Kamagata T, Taka H, Sahara K, Asano S I, Bando H. Phenotypic grouping of 141 BmNPVs lacking viral gene sequences. Virus Research, 2012, 165(2): 197-206. DOI:10.1016/j.virusres.2012.02.016 |
| [22] | Braunagel SC, Russell WK, Rosas-Acosta G, Russell DH, Summers MD. Determination of the protein composition of the occlusion-derived virus of Autographa californica nucleopolyhedrovirus. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(17): 9797-9802. DOI:10.1073/pnas.1733972100 |
| [23] | Kool M, Ahrens CH, Goldbach RW, Rohrmann GF, Vlak JM. Identification of genes involved in DNA replication of the Autographa californica baculovirus. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(23): 11212-11216. DOI:10.1073/pnas.91.23.11212 |
| [24] | Gomi S, Zhou CE, Yih W, Majima K, Maeda S. Deletion analysis of four of eighteen late gene expression factor gene homologues of the baculovirus, BmNPV. Virology, 1997, 230(1): 35-47. |
| [25] | Fei MH, Shi MN, Bi LH, Gu JD, Luo J, Wei BY, Feng ZQ, Lu RH, Hu LS, Huang JT. Breeding test of Silkworm varieties resistant to NPV infection. Guangxi Sericulture, 2006, 43(2): 1-6. (in Chinese) 费美华, 石美宁, 闭立辉, 顾家栋, 罗坚, 韦博尤, 冯振强, 陆瑞好, 胡乐山, 黄君霆. 抗NPV感染蚕品种选育试验. 广西蚕业, 2006, 43(2): 1-6. DOI:10.3969/j.issn.1006-1657.2006.02.001 |
| [26] | Liu XY, Yao Q, Chen KP. Studies on RAPD markers for NPV resistance in silkworm (Bombyx mori) using RAPD method. Journal of Jiangsu University (Natural Science Edition), 2004, 25(1): 17-20. (in Chinese) 刘晓勇, 姚勤, 陈克平. 利用RAPD技术筛选家蚕抗核型多角体病分子标记. 江苏大学学报(自然科学版), 2004, 25(1): 17-20. DOI:10.3969/j.issn.1671-7775.2004.01.005 |
| [27] | Li MW, Hou CX, Yao Q, Xu AY, Zhang YH, Chen KP. Bombyx mori nuclear polyhedrosis virus and breeding of resistant races. Jiangsu Sericulture, 2002(2): 1-4. (in Chinese) 李木旺, 侯成香, 姚勤, 徐安英, 张月华, 陈克平. 家蚕核型多角体病毒及抗病育种. 江苏蚕业, 2002(2): 1-4. |
| [28] | Chen JE, Weng HB, Meng ZQ. Progress of the research on silkworm transgenic. Bulletin of Sericulture, 2008, 39(3): 5-8. (in Chinese) 陈金娥, 翁宏飚, 孟智启. 家蚕转基因研究进展. 蚕桑通报, 2008, 39(3): 5-8. DOI:10.3969/j.issn.0258-4069.2008.03.002 |
| [29] | Kamita SG, Majima K, Maeda S. Identification and characterization of the p35 gene of Bombyx mori nuclear polyhedrosis virus that prevents virus-induced apoptosis. Journal of Virology, 1993, 67(1): 455-463. |
| [30] | Singh CP, Singh J, Nagaraju J. bmnpv-miR-3 facilitates BmNPV infection by modulating the expression of viral P6.9 and other late genes in Bombyx mori. Insect Biochemistry and Molecular Biology, 2014, 49: 59-69. DOI:10.1016/j.ibmb.2014.03.008 |
| [31] | Liu LH, Shen WD, Li B, Wang WB. Effect of BmNPV on BmN cell cycle and expression level of cyclin in silkworm. Journal of Northwest A & F University (Natural Science Edition), 2014, 42(2): 41-45. (in Chinese) 刘丽华, 沈卫德, 李兵, 王文兵. BmNPV对家蚕BmN细胞周期及周期蛋白基因表达水平的影响. 西北农林科技大学学报(自然科学版), 2014, 42(2): 41-45. |
