张疆睿, 张利华, 石依博, 沈微, 樊游, 陈献忠


江南大学生物工程学院, 工业生物技术教育部重点实验室, 江苏 无锡 214122
收稿日期:2018-11-19;修回日期:2019-03-07;网络出版日期:2019-06-13
基金项目:江苏省自然科学基金(BK20171138)
*通信作者:陈献忠, Tel/Fax:+86-510-85918122;E-mail:xzchen@jiangnan.edu.cn.
摘要:[目的] 槐糖脂是一类生物表面活性剂,不仅具有常规表面活性剂所具有的增溶、乳化、润湿、发泡、分散、降低表面张力等通用性能,且对环境的耐受性极强。熊蜂生假丝酵母(Starmerella bombicola)能够发酵生产槐糖脂,但槐糖脂具有酸型、内酯型和乙酰化型等不同类型,结构多样,难以分离。本文拟通过代谢工程改造,构建高产酸型槐糖脂的熊蜂生假丝酵母工程菌株。[方法] 利用潮霉素抗性基因构建了标记基因重复利用系统Rec-six基因编辑系统,在此基础上将合成内酯型槐糖脂的关键基因——内酯酶基因SBLE敲除获得一株只产酸型槐糖脂的工程菌株Δsble,进一步同源过量表达葡萄糖基转移酶基因UGTB并敲除过氧化物酶体膜转运蛋白编码基因PXA1,构建了高产酸型槐糖脂的酵母工程菌。[结果] 与出发菌株相比,重组熊蜂生假丝酵母发酵油酸能够合成单一的酸型槐糖脂,而不再合成内酯型槐糖脂,同时酸型槐糖脂的产量由20 g/L提高到44 g/L,提高了2.1倍。[结论] 通过敲除PXA1、SBLE和过表达UGTB来改造熊蜂生假丝酵母,能够有效提高重组菌的酸型槐糖脂产量,为发酵法生产酸型槐糖脂奠定了基础。
关键词:熊蜂生假丝酵母酸型槐糖脂内酯酶代谢工程Rec-six
Metabolic engineering of Starmerella bombicola for enhanced acid-type sophorolipid production
Jiangrui Zhang, Lihua Zhang, Yibo Shi, Shen Wei, You Fan, Xianzhong Chen


Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Bioengineering, Jiangnan University, Wuxi 214122, Jiangsu Province, China
Received: 19 November 2018; Revised: 7 March 2019; Published online: 13 June 2019
*Corresponding author: Chen xianzhong, Tel/Fax:+86-510-85918122;E-mail:xzchen@jiangnan.edu.cn.
Foundation item: Supported by the Natural Science Foundation of Jiangsu Province (BK20171138)
Abstract: [Objective] Sophorolipids are biosurfactants with properties such as solubilization, emulsifying, wetting, foaming, dispersing, and reducing surface tension of conventional surfactants, and tolerance to the environment. Starmerella bombicola can produce sophorolipids, but the components of sophorolipids are complex and difficult to separate. In order to obtain the single high-yield acid type sophorolipid, the strain S. bombicola producing only acid sophorolipid was constructed by metabolic engineering. [Methods] The Rec-six gene editing system was developed using the hygromycin resistance gene as a selection marker. Based on this system, the critical lactonase gene SBLE for lactone-type sophorolipid was knocked out to obtain an engineered strain producing only acid-type sophorolipid. The expression cassette of the UGTB gene (glucosyltransferase) was further integrated into the genome of the recombinant strain and the PXA1 gene (peroxisome membrane transporter) was knocked out to construct a metabolic process yeast strain with high acid-producing sophorolipids. [Results] Compared with the original strain, the yield of oleic acid synthase was increased from 20 g/L to 44 g/L, and the lactone type of sophorolipid was undetectable. [Conclusion] The recombinant S. bombicola can effectively increase the yield of acid-type sophorolipids by over-expressing UGTB and knocking out PXA1 and SBLE, for enhanced the production of acid-type sophorolipid by fermentation.
Keywords: Starmerella bombicolaacid-type sophorolipidlactonemetabolic engineeringRec-six
槐糖脂是一类生物表面活性剂,具有常规表面活性剂所具有的增溶、乳化、润湿、发泡、分散、降低表面张力等通用性能,被广泛应用于石油、日化、环保等多个方面[1]。随着人们环境意识的提高,生物法合成槐糖脂逐渐引起了人们的兴趣。与化学表面活性剂相比,生物表面活性剂具有生物可降解性、低毒性、更好的环境相容性的优势,同时还具有良好的抗菌能力及环境耐受性[2]。Starmerella bombicola是一种非致病性酵母,在槐糖脂的生产中具有很大的优势[3]。
槐糖脂是一种两亲分子,由疏水性和亲水性两部分组成,亲水性部分主要是由2个葡萄糖基通过β-1, 2糖苷键连接形成的槐糖,疏水部分主要是长链的饱和或不饱和脂肪酸[4]。尽管S. bombicola在生产槐糖脂方面显示出独特的优势,具有潜在的工业应用前景,但是槐糖脂产物是含有多达23种同系物的混合物(8种主要的和15种次要的)[4],包括酸型槐糖脂和内酯型槐糖脂(图 1)。槐糖脂的应用在很大程度上取决于所产生的混合物的组成。例如,酸型槐糖脂对纤维蛋白溶解、伤口愈合、脱屑、脱色和巨噬细胞活化具有治疗活性[5];已经发现内酯型槐糖脂在化妆品中作为除臭剂和保湿剂的组分,用于治疗皮肤病,以及作为去头屑或抑菌剂。因此,根据工业需要,在最终产品配方中的功能/应用时需要特定的结构或结构比例[5]。
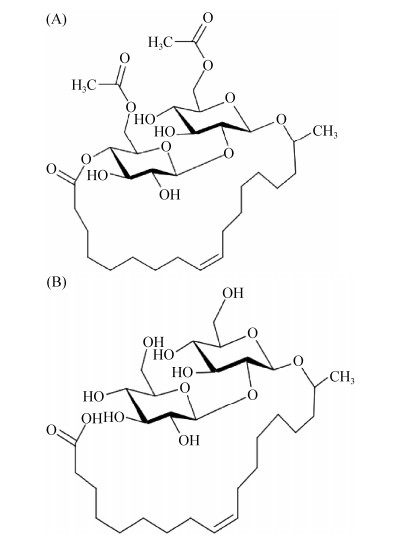 |
| 图 1 槐糖脂的结构 Figure 1 Structure of sophorolipid. A: lactone type sophorolipid; B: acid type sophorolipid. |
| 图选项 |
尽管已经有研究描述了用化学试剂来分离纯化酸型槐糖脂和内酯型槐糖脂[6],但由于槐糖脂作为生物表面活性剂,使用化学试剂不仅增加工艺环节和成本,而且最终槐糖脂产品可能含有残留的化学溶剂。有研究者认为发酵条件能够影响或决定发酵产物槐糖脂酸的类型[7],如生产菌株、营养物质(疏水性和亲水性碳源、氮源和无机盐离子)、环境条件(温度、pH、溶氧度和时间)以及补料方式(补料发酵、分批发酵和连续发酵),研究结果表明改变发酵培养条件确实影响槐糖脂成分[8],但是特定结构的槐糖脂产量比较低。进一步研究表明,槐糖脂的结构类型主要受到代谢途径的关键酶的调控[9]。因此,能够通过代谢工程手段选择性地生产某种特定槐糖脂[9]。槐糖脂的合成途径已经研究清楚,首先是从脂肪酸的羟基化开始,然后在葡萄糖基转移酶UGTA[10]和UGTB的作用下,将2分子的葡萄糖加至羟基化的脂肪酸上形成非乙酰化的酸型槐糖脂,这些酸型槐糖脂在乙酰基转移酶(AT)[11]和内酯酶(SBLE)[12]的作用下生成乙酰化的酸性和内酯型槐糖脂(图 2)。研究者利用代谢工程手段敲除了UGTB,使得熊蜂生假丝酵母主要生产葡萄糖脂;通过敲除AT可以使该菌只生产非乙酰化的槐糖脂[11];在该酵母的分泌蛋白中鉴定出了负责内酯化的酶[9],研究者发现该酶主要催化由酸型槐糖脂到内脂型槐糖脂的生成,敲除该酶获得的突变菌株(Δsble)仅产生酸型槐糖脂。因此,该菌株为选择性生产(乙酰化)酸性槐糖脂提供了第一个重要的生物技术机会[13]。虽然该菌株可以获得单一酸型槐糖脂,但其产量相对较低,不能满足市场的大规模需求。同时,有研究表明通过敲除过氧化物酶体ABC转运蛋白编码基因(PXA1),在基因组水平上阻断脂肪酸的β-氧化途径[14],可以提高总槐糖脂的产量。
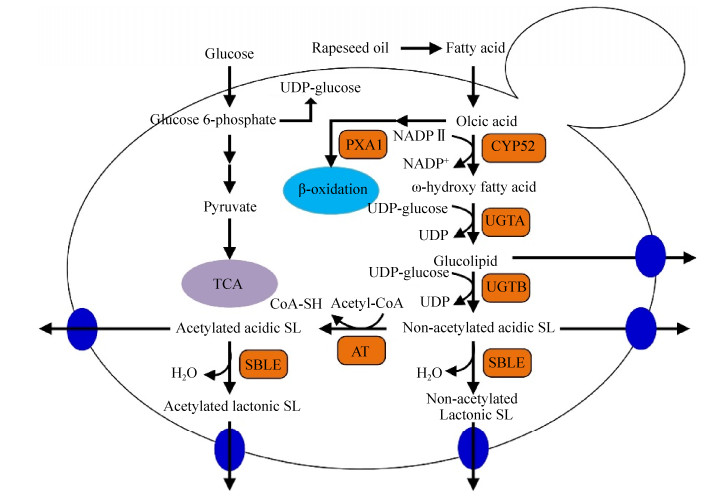 |
| 图 2 槐糖脂的合成代谢途径 Figure 2 Synthetic pathway of sophorolipids. |
| 图选项 |
在本研究中,首先构建了潮霉素重复利用系统Rec-six [15],以S. bombicola ATCC 22214菌株作为出发菌株,其次构建内酯酶基因敲除菌株SBSL1(Δsble)和UGTB(在SBLE位点)过表达菌株SBSL2,再次借助Rec-six系统将SBSL1菌株的抗性基因弹掉获得Δsble::six,在此基础上再次敲除过氧化物酶体ABC转运蛋白编码基因(PXA1)和过表达葡萄糖基转移酶基因(UGTB)在PXA1位点获得菌株SBSL4(ΔsbleΔpxa1::Pgki-ugtbex),以期构建高产酸型槐糖脂的工程菌株。
1 材料和方法 1.1 材料
1.1.1 菌株和质粒: 大肠杆菌JM109,由江南大学工业微生物资源与管理中心保藏,主要用于载体构建;pMD19-T Simple载体,购自TaKaRa公司,主要用于基因克隆;pRLMG (含有潮霉素抗性基因)质粒由山东大学宋欣老师馈赠。(本文所用菌株、质粒和引物见表 1和表 2)
表 1. 本研究所用到的菌株与质粒 Table 1. Strains and plasmids used in this study
| Name | Description | Source |
| W | S. bombicola ATCC 22214 | Our Lab |
| SBSL1 | S. bombicola ATCC 22214, sbleΔ | This study |
| SBSL2 | Pgki-ugtb-Tgki cassette integrated into SBLE site of W | This study |
| SBSL3 | S. bombicola ATCC 22214, sbleΔ, pxa1Δ | This study |
| SBSL4 | Pgki-ugtb-Tgki cassette integrated into PXA1 site of SBSL1 | This study |
| SSRH | SBLE knock outed cassette | This study |
| PSRH | PXA1 knock outed cassette | This study |
| PUHP | UGTB expression cassette containing PXA1 homogenous arm | This study |
| SUHS | UGTB expression cassette containing SBLE homogenous arm | This study |
表选项
表 2. 本研究所用到的引物 Table 2. Primers used in this study
| Primer name | Sequence (5'→3') | Restriction sites |
| SBLE-F | ATTGGAACCTAGCCCATAAGCTC | |
| SBLE-R | AAACCTACTGCTCTGCCGAT | |
| RSBL-F | CGGGGTACCCCTGAGCACGTATTCCGCTA | KpnⅠ |
| RSBL-R | CGACGCGTTTTGTAAGCCACTTGTACGAC | MluⅠ |
| HPH-F | CGACGCGTTAGACGTGCATACATGCGAGTT | MluⅠ |
| HPH-R | CGGGGTACCTATGGTTTCCACGTGCACTTACA | KpnⅠ |
| Sble-oF | TATCTGGTGAGTTGGCTTTACG | |
| Sble-oR | TCTCTCGAGATGGTTCTTCTCA | |
| Pgalk-FB | CGCGGATCCGGTCATTTTTTTGATTTTTTTTAAT | Bam HI |
| Pgalk-R | CGTAGCCGATCTTGGCCATGACAAAAGAGCTTTGTTTGTTTC | |
| Rect-F | GAAACAAACAAAGCTCTTTTGTCATGGCCAAGATCGGCTACG | |
| Rect-R | GAACTCGCATGTATGCACGTCTAATAACGTTCATGGTTACTATGTT | |
| Rhph-F | CCATAGTAACCATGAACGTTATTAGACGTGCATACATGCGAGTT | |
| Rhph-FB | CGCGGATCCTATGGTTTCCACGTGCACTTACA | Bam HI |
| Hph-u | ATGCCTGAACTCACCGCGACGT | |
| Hph-d | CTATTCCTTTGCCCTCGGACGA | |
| Pxa1-F | ATTTTGGAGAGTTTGTGACTGCTTTATCAA | |
| Pxa1-R | TGAGATGACACACGTGACATGTCGATCCTA | |
| rPxa1-F | CGACGCGTATCCGGAGCGTGTGGGGTCA | MluⅠ |
| rPxa1-R | CGGGGTACCTACAACTACCATCAGGGTCGTTAG | KpnⅠ |
| Pxa1-0F | GTCGCTATTGTCATCATT | |
| Pxa1-OR | CTCGGTCAGTTCCTTGTT | |
| Pro-F | CGACGCGTGGTGCTTAGGGTGCGTGTGCAA | MluⅠ |
| Pro-R | TCACTGGTTTCTCGATGGCCATTTTTTCTGGTTTGGAGGACC | |
| Ugtb-CF | GGTCCTCCAAACCAGAAAAAATGGCCATCGAGAAACCAGT | |
| Ugtb-CR | AGAGATGACTGCACATACCAGTTTAAGAAGCTAATTCACTA | |
| Ter-F | CAATTAGTGAATTAGCTTCTTAAACTGGTATGTGCAGTCATCTCT | |
| Ter-R | CGACGCGTATAACGTTCATGGTTACTATGG | MluⅠ |
| Actin-F | CTCATCTGCTCAACGAACTGTAT | |
| Actin-R | ATGTCCTTCTGAGCGGTCTG | |
| qugtb-F | GGCGTCACTTCCTGATAGC | |
| qugtb-F | GCTTGTCTACCAACATTCCTC |
表选项
1.1.2 主要试剂和仪器: 潮霉素购自北京鼎国生物有限公司;DNA聚合酶、核酸内切酶、DNA Marker、DNA Ligation kit均购自TaKaRa公司;SBA生物传感分析仪购自山东省科学院生物研究所;MicroPulser电转仪购自伯乐生命医学(上海)有限公司Bio-Rad。
1.1.3 培养基: (1) YPD培养基(g/L):酵母粉10,蛋白胨20,葡萄糖20。(2) LB培养基(g/L):酵母粉5,蛋白胨10,氯化钠10。(3) YPG诱导培养基(g/L):酵母粉10,蛋白胨20,半乳糖10。(4)潮霉素抗性培养基(g/L):将潮霉素母液加入到冷却至46的YPD培养基中,终浓度为500 g/mL。
1.2 含潮霉素自弹出系统的敲除盒构建 基于Rec-six系统的潮霉素抗性基因重复使用的敲除盒构建流程如图 3所示。以熊蜂生假丝酵母的染色体DNA为模板,利用sble-F和sble-R引物PCR扩增获得内酯酶基因片段SBLE[13],通过TA克隆连接到pMD19-T Simple载体上,所得质粒命名为Ts-sble;以质粒Ts-sble为模板,用引物rsble-F和rsble-R反向PCR扩增,获得携带同源臂的载体片段sble-Ts-sble。根据Rec-six系统敲除原理[16],将six重组位点的基因序列、β-rec重组酶编码区和Tgki终止子进行全序列合成,质粒分别为pUC57-six和pUC57-rec-Tgki。将pUC57-six和sble-Ts-sble用MluⅠ和KpnⅠ进行酶切消化,纯化six和sble-Ts-sble片段,最后将这2个片段连接,获得重组质粒Ts-sble-six;以熊蜂生假丝酵母的染色体DNA为模板,PCR扩增得到诱导型启动子Pgalk片段,以pUC57-rec-Tgki质粒为模板,PCR扩增得到rec-Tgki片段,以pRLMG质粒为模板,PCR扩增得到潮霉素抗性基因表达盒(hphex)。所有的扩增片段用高保真DNA聚合酶,将扩增得到的Pgalk片段、rec-Tgki片段、hphex经凝胶电泳回收后进行融合PCR,获得recex-hphex融合片段。将recex-hphex片段与Ts-sble-six质粒分别用BamHI进行酶切、连接后获得重组质粒SSRH (Ts-sble-six-recex-hphex-sble)。PXA1基因敲除质粒PSRH (Ts-pxa1-six-recex-hphex-pxa1)的构建与上述过程类似,片段扩增引物如表 2所示。
 |
| 图 3 含潮霉素抗性筛选标记自我弹出系统的敲除盒构建 Figure 3 A schematic presentation of the SSRH plasmid containing the self-excising hygromycin marker cassette. |
| 图选项 |
1.3 基因的敲除及潮霉素标记基因的弹出 根据Rec/six系统敲除原理[16],以SSRH质粒为模板,使用引物sble-F和sble-R进行PCR得到敲除盒,测序验证后,采用高效的电击转化法[11],将其转化熊蜂生假丝酵母。电转化条件为:电压1.5 kV,电容25 μF,电阻200 Ω,2 mm转化杯。通过潮霉素抗性平板筛选,提取基因组PCR验证后,获得阳性转化子。纯化得到的含有潮霉素抗性标记的敲除株Δsble,在不含有潮霉素抗性的YPG培养基中进行诱导培养,30 ℃孵育培养12 h后进行划线分纯,转化子分别点种在含有潮霉素和不含有抗生素的YPD固体平板上,30 ℃孵育48 h。选取能够在无抗生素平板上生长但是在含有潮霉素的平板上不能生长的转化子进行继续培养,最终获得不含有潮霉素抗性筛选标记的SBLE基因敲除株Δsble::six (图 4)。以Δsble::six菌株作为宿主细胞,以PSRH质粒为模板,PCR扩增获得线性化的PXA1敲除盒进行转化。
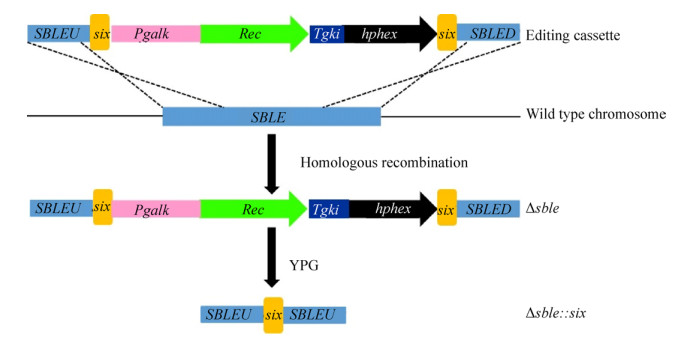 |
| 图 4 内酯酶SBLE基因敲除菌株Δsble::six的构建 Figure 4 Construction of SBLE gene deletion mutant, Δsble::six. The functional elements are as follows: the synthetic codon-optimized β-serine recombinase (Rec) gene was transcribed with the galactokinase (Pgalk) promoter from S. bombicola and with the (Tgki) terminator from S. bombicola; hphex: the selective marker hygromycin resistance gene (hph) expression cassette; six: recombinant site containing 90 bp. |
| 图选项 |
1.4 过表达质粒的构建及转化 以提取的熊蜂生假丝酵母基因组为模板,分别PCR扩增本源组成型启动子片段Pgki、UGTB编码区片段和终止子(Tgki)片段,然后将这3个片段利用融合PCR扩增得到UGTB基因表达盒。将过表达盒分别整合在PXA1位点和SBLE位点,构建了重组质粒Ts-sble-ugtbex-hphex-sble和Ts-pxa1-ugtbex-hphex-pxa1。将过表达质粒线性化,分别以野生型熊蜂生假丝酵母和Δsble::six细胞作为宿主细胞进行转化。
1.5 qRT-PCR对熊蜂生假丝酵母mRNA转录水平分析 挑取平板上的单菌落接种于5 mL的YPD液体培养基中,在30 ℃和200 r/min条件下过夜培养。然后以此作为种子液转接到新鲜的50 mL的YPD液体培养基中进行培养,菌液OD600达到1.5-2.5后,利用Yeast RNAiso Kit试剂盒提取总RNA。cDNA的合成采用PrimeScriptTM RT reagent Kit with gDNA Eraser试剂盒。根据目标基因编码区设计qPCR引物(表 2),使用SYBR? Premix Ex Taq?Ⅱ试剂盒,以cDNA为模板,actin为内参基因,应用CFX96Real-Time PCR Detection System扩增仪对目的基因进行qPCR检测。
1.6 酵母菌株的发酵培养 活化菌株后,挑取平板上长出的单菌落,接种到5 mL的YPD液体培养基中,在30 ℃和200 r/min条件下培养12-16 h。然后按1%的接种量接种到50 mL发酵培养基(葡萄糖132.00 g/L,酵母粉4.00 g/L,柠檬酸钠4.00 g/L,氯化铵1.50 g/L,磷酸二氢钾0.16 g/L,七水硫酸镁0.70 g/L,氯化钙0.27 g/L)中进行摇瓶培养,培养48 h到达稳定期后,添加菜籽油37.5 g/L进入发酵期,每隔24 h用5 mol/L的NaOH调节pH,使发酵培养基的pH维持在3.5。在发酵培养期间,每隔24 h测OD600和残糖量,发酵9 d结束后,取样测其槐糖脂产量。每个菌种做3个生物学平行,重复发酵培养2次,野生型菌株作为对照。
1.7 重组菌株酸型槐糖脂含量的测定 取发酵液500 μL,加入1 mL的乙醇,振荡混匀,12000 r/min离心9 min,取20 μL的上清液,加入至EP管中,然后再加入980 μL的蒸馏水和4 mL的蒽酮试剂,迅速置于冰上,然后置于沸水浴中加热8 min,冰浴冷却,用分光光度计测定反应液在620 nm下的OD值(以蒸馏水与蒽酮试剂反应获得溶液作为对照)。根据槐糖脂和葡萄糖分子量之间的比值,即1.91 g的槐糖脂相当于1 g葡萄糖,从而可以求出总槐糖脂含量[17]。测内酯型槐糖脂含量时,取发酵液,用乙酸乙酯提取即可,方法类似。酸型槐糖脂含量=总槐糖脂含量-内酯型槐糖脂含量。每个待测样进行3个生物学重复。
2 结果和分析 2.1 含潮霉素自弹出系统的敲除质粒构建 构建的重组质粒sble-Ts-sble-six经MluⅠ和KpnⅠ酶切验证,得到大约0.18 kb和3.4 kb的DNA片段,分别与six和sble-Ts-sble片段的大小相一致(图 5-A);分别进行PCR扩增潮霉素自弹出系统的各个元件,然后进行融合PCR,大小都与理论值相同(图 5-B);分别对构建的重组质粒SSRH (Ts-sble-six-recex-hphex-sble)、PXA1基因敲除质粒PSRH (Ts-pxa1-six-recex-hphex-pxa1)进行酶切验证,利用MluⅠ和KpnⅠ限制性内切酶作用于重组质粒,分别得到4.5 kb和大约3.5 kb的片段,与理论预测值大小相符(图 5-B),进一步测序验证,含有潮霉素自删除系统的SBLE和PXA1敲除质粒构建成功。
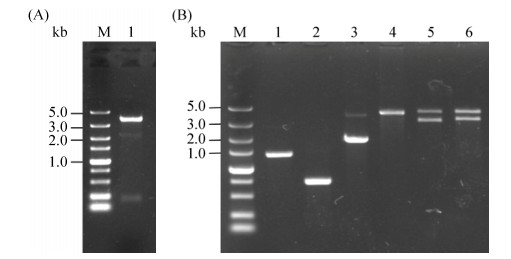 |
| 图 5 潮霉素自弹出系统的构建 Figure 5 Construction of the hygromycin self-excising system. A: The enzymatic digestion of Ts-sble-six. M: DL 5000 DNA marker; lane 1: recombinant plasmid Ts-sble-six digested by KpnⅠ and MluⅠ. B: Construction of SSRH and PSRH recombinant plasmid. M: DL 15000 DNA marker; lane 1: the PCR product of the Pgki promoter; lane 2: the PCR product of the rec-Tgki; lane 3: the PCR product of the hphex; lane 4: the fusion PCR product of the recex-hphex; lane 5: recombinant plasmid SSRH digested by MluⅠ and KpnⅠ; lane 6: recombinant plasmid PSRH digested by MluⅠ and KpnⅠ. |
| 图选项 |
2.2 基因缺失菌株的构建 利用潮霉素自删除系统构建了SBLE基因的敲除菌株,进一步对得到的敲除菌株的转化子进行了基因型与表型验证。分别提取敲除菌株的基因组进行PCR验证,当用同源臂外源引物Sble-oF和Sble-oR进行验证时,野生型菌株W基因组PCR扩增产物凝胶电泳条带大小为2.3 kb,敲除菌株Δsble条带大小为5.3 kb,Δsble::six为1.0 kb;当用潮霉素抗性基因编码区内部引物Hph-u和Hph-d作为引物进行验证,如(图 6-A)所示,野生型菌株W和敲除菌株Δsble::six均未扩增出特异性条带,而敲除株Δsble扩增出大小为1.0 kb的条带。经以上PCR验证说明,敲除株Δsble::six的SBLE基因不仅被敲除,而且经过半乳糖诱导后已经成功弹出了潮霉素基因,获得了不含有潮霉素抗性基因的SBLE基因敲除菌株。如图 6-B所示,W和经YPG培养基半乳糖诱导分离纯化后的转化子Δsble::six均在含有潮霉素的YPD平板上不能生长,而没有经过半乳糖诱导的敲除菌株Δsble在含有潮霉素的YPD平板上能够生长,与PCR验证结果相同。以Δsble::six菌株作为宿主细胞,进一步敲除脂肪酸转运蛋白PXA1,长出的转化子提取基因组经PCR验证(图 6-A),可知成功敲除了PXA1基因,获得了SBSL2 (ΔsbleΔpxa1)。
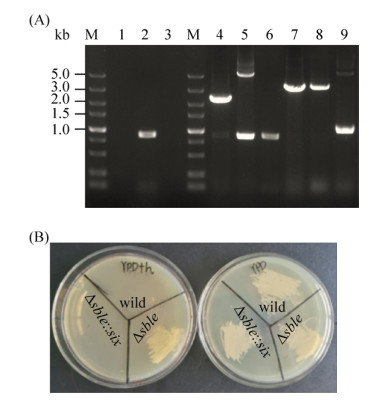 |
| 图 6 遗传改造突变菌株PCR验证及生长状况鉴定 Figure 6 PCR identification of the engineered mutant and determination of their growth status. A: PCR identification of overexpressing strains. M: 5 kb ladder DNA marker; lane 1: the PCR product using primers Hph-U/Hph-D of wild type; lane 2: the PCR product using primers Hph-U/Hph-D of Δsble; lane 3: the PCR product using primers Hph-U/Hph-D of Δsble::six; lane 4: the PCR product using primers sble-oF and sble-oR of wild type; lane 5: the PCR product using primers sble-oF and sble-oR of Δsble; lane 6: PCR product using primers sble-oF and sble-oR of Δsble::six; lane 7: the PCR product using primers pxa-oF and pxa-oR of wild type; lane 8: the PCR product using primers pxa-oF and pxa-oR of Δsble::six; lane 9: the PCR product using primers pxa-oF and pxa-oR of ΔsbleΔpxa1. B: Growth of the parental strain (wild-type) and mutants on YPD and YPD plate with 500 μg/mL hygromycin B. |
| 图选项 |
2.3 UGTB基因的整合表达 构建的两个过表达重组质粒分别用MluⅠ单酶切验证,发现都得到2.0 kb的UGTB表达盒片段、5.1 kb的同源臂和潮霉素表达盒重组质粒片段,经测序验证,过表达盒构建成功。将过表达盒线性化后转化后转入相应的宿主细胞中,提取转化子的基因组进行PCR验证,当用同源臂外侧引物pxa-oF和pxa-oR进行验证时,野生型细胞和宿主细胞Δsble::six扩增产物凝胶电泳条带大小为3.1 kb,而ΔsbleΔpxa1::Pgki-ugtb转化子扩增条带大小为5.1 kb,说明该菌株构建成功。同上,当用同源臂外侧引物sble-oF和sble-oR进行验证时(图 7-A),野生型细胞扩增产物凝胶电泳条带大小为2.3 kb,而Δsble::Pgki-ugtb转化子扩增条带大小为5.2 kb,说明UGTB表达盒在SBLE基因位点整合成功。经筛选,最终成功构建工程菌株Δsble::Pgki-ugtb和ΔsbleΔpxa1::Pgki-ugtb。荧光定量PCR法分析菌株UGTB表达量,结果显示(图 7-B),SBSL2菌株表达量是野生型菌株W的18.25倍,SBSL4菌株表达量是野生型菌株W的16.75倍,说明UGTB过表达菌构建成功。
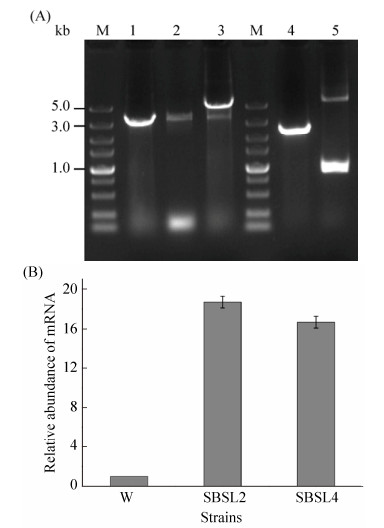 |
| 图 7 过表达菌株鉴定分析 Figure 7 Identification of overexpressing strains. A: PCR identification of overexpressing strains. M: 5 kb ladder DNA marker; lane 1: the PCR product using primers pxa-oF and Pxa-oR of wild type; lane 2: the PCR product using primers pxa-oF and Pxa-oR of Δsble::six; lane 3: the PCR product using primers pxa-oF and Pxa-oR of ΔsbleΔpxa1::Pgki-ugtb; lane 4: the PCR product using primers sble-oF and sble-oR of wild type; lane 5: the PCR product using primers sble-oF and sble-oR of Δsble::Pgki-ugtb. B: Gene expression levels of UGTB. W: wild type; SBSL2: Δsble::Pgki-ugtb; SBSL4: ΔsbleΔpxa1:: Pgki-ugtb. |
| 图选项 |
2.4 菌株摇瓶发酵生长测定 摇瓶发酵9 d后,野生型菌株W、内酯酶基因(SBLE)敲除菌株Δsble、UGTB基因在野生型菌株SBLE基因位点过表达菌株Δsble::Pgki-ugtb、内酯酶基因(SBLE)和脂肪酸膜转运蛋白(PXA1)双敲除菌株ΔsbleΔpxa1和UGTB基因在SBSL1敲除菌株PXA1基因位点过表达菌株ΔsbleΔpxa1::Pgki-ugtb的生长情况如图 8-A所示,以野生型菌株作为对照,敲除菌株或过表达菌株的生长速率与野生型菌株基本类似。葡萄糖量消耗情况如图 8-B所示,在生长期,各个菌株葡萄糖消耗率基本相同,到了发酵期,野生型菌株消耗糖的速度比较快,在发酵第7天时,葡萄糖已经消耗完,UGTB过表达菌株Δsble::Pgki-ugtb相比野生型菌株葡萄糖消耗比较慢,但相比其他菌株消耗速率较快。
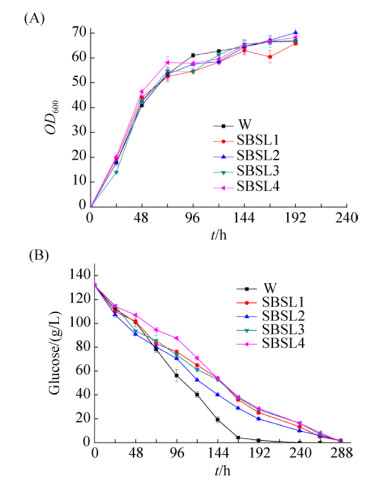 |
| 图 8 菌株生长性能测定 Figure 8 Determination of growth performance. A: growth curves of strains. B: determination of the glucose concentration. W: wild type; SBSL1: Δsble; SBSL2: Δsble::Pgki-ugtb; SBSL3: ΔsbleΔpxa1; SBSL4: ΔsbleΔpxa1:: Pgki-ugtb. |
| 图选项 |
2.5 重组菌株酸型槐糖脂含量测定 发酵结束时,对发酵液样品进行处理后,采用蒽铜硫酸法测定槐糖脂产量。在野生型菌株W中,不仅可以检测到酸型槐糖脂还可以检测到内酯型槐糖脂,酸型槐糖脂产量极低(图 9),还需进一步的分离纯化,因而很难运用到市场。然而在我们初次构建的内酯酶基因敲除菌株Δsble中,发酵液产物中只能检测到酸型槐糖脂,但是产量还是比较低,仅为20 g/L (图 9)。随着不断的基因工程改造,构建了一系列菌株并且筛选得到一株产酸型槐糖脂产量极高的菌株。测定结果如图 9所示,构建的菌株酸型槐糖脂产量均高于野生型槐糖脂产量,Δsble::Pgki-ugtb菌株产的酸型槐糖脂产量达到了41.26 g/L,将酸型槐糖脂的产量提高了约2.1倍,ΔsbleΔpxa1菌株产的酸型槐糖脂产量达到了39.72 g/L,ΔsbleΔpxa1::Pgki-ugtb菌株产的酸型槐糖脂产量为39.55 g/L。相比出发菌株,构建的工程菌株中,酸型槐糖脂产量均有不同程度提高,但是Δsble::Pgki-ugtb菌株产的酸型槐糖脂量最高,这表明SBLE和UGTB基因在槐糖脂的合成中扮演了重要的角色。
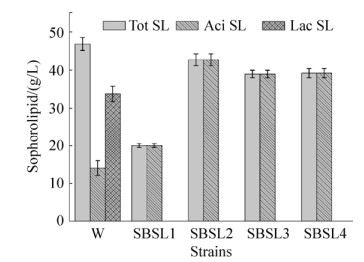 |
| 图 9 熊蜂生假丝酵母工程菌株生产酸性槐糖脂 Figure 9 Production of acid sophorilipid by metabolically engineered Starmerella bombicola. W: wild type; SBSL1:Δsble; SBSL2: Δsble::Pgki-ugtb; SBSL3: ΔsbleΔpxa1; SBSL4: ΔsbleΔpxa1:: Pgki-ugtb. Tot SL: total sophorolipid; Aci SL: acid type sophorolipid; Lac SL: lactone type sophorolipid. |
| 图选项 |
3 讨论 槐糖脂在市场上应用比较广泛,但是微生物法合成的槐糖脂是一种混合物,成分多达二十多种,分离比较困难,很难应用于市场。以前研究多集中于利用传统的发酵工艺获得特定的槐糖脂,但是远远达不到工业要求,生产分离纯化过程复杂,而且生产成本高,产量低。在本研究中,我们利用疏水性底物菜籽油和亲水性底物葡萄糖作为发酵底物,通过代谢工程手段获得了单一的酸型槐糖脂。
近几年,很多研究者旨在获得特定的槐糖脂,以便得到广泛应用。在2013年,发现了负责槐糖脂内酯化的酶,发现敲除该基因,可以获得单一的酸型槐糖脂,但是产量比较低[12]。由于产槐糖脂总量较高的熊蜂生假丝酵母对很多抗生素不敏感,潮霉素是目前已知的唯一能够抑制该酵母生长的抗生素,同时营养缺陷型菌株对槐糖脂的产量也会造成一定的影响,使得对该酵母进行遗传改造非常不方便。在真菌中,利用基因同源重组的原理实现抗性标记重复利用的系统主要有Cre-loxp[18]、FLP-FRT[19]和Rec-six系统,与FLP重组酶和Cre重组酶相比,Rec重组酶的碱基序列比较短,更容易进行基因操作,而且该酶的特异性识别序列只有90 bp,特异性重组效率会更高[16]。本文成功构建了潮霉素抗性筛选标记的自我弹出系统,实现了潮霉素标记的多次使用。
在敲除了SBLE基因后,发现产物中仅仅含有酸型槐糖脂,但是产量比较低,这个结果与前人的研究结果类似[13],同时也说明了只有将内酯酶基因敲除,我们才会获得单一的酸型槐糖脂。有人研究发现PXA1基因敲除菌株发酵后总槐糖脂产量提高了25%左右,当脂肪酸转运膜蛋白基因敲除后,阻断了脂肪酸的β-氧化[20],积累了脂肪酸,使代谢流流向脂肪酸的ω-氧化,使总的槐糖脂产量提高,于是我们在内酯酶基因敲除菌株Δsble的基础上进一步敲除了PXA1基因到菌株ΔsbleΔpxa1,发现酸型槐糖脂产量显著提高,从20 g/L提高到39 g/L,进一步证明了PXA1基因的作用。
还有研究表明,当敲除UGTB时,基本检测不到槐糖脂产物[21],说明葡萄糖基转移酶UGTB基因对槐糖脂的合成极其重要,想进一步过表达UGTB基因提高酸型槐糖脂产量,于是构建了Δsble::Pgki-ugtb突变菌株。发酵结果显示,酸型槐糖脂产量确实提高了将近2倍。由以上结果可知,PXA1基因和UGTB基因对酸性槐糖脂产量提高有很大的作用,于是我们构建了将UGTB基因在Δsble敲除菌株的PXA1基因位点过表达的菌株ΔsbleΔpxa1:: Pgki-ugtb,以期获得酸型槐糖脂产量更高的工程菌株,测定结果发现该菌株相比出发菌株,产量确实提高,但相比Δsble::Pgki-ugtb菌株,产量略低。综上所述,我们构建的一系列工程菌株,不仅获得了只产酸型槐糖脂的菌株,而且将酸型槐糖脂产量提高了2倍,这将为槐糖脂的市场应用奠定了良好的基础。
References
| [1] | Daverey A, Pakshirajan K, Sumalatha S. Sophorolipids production by Candida bombicola using dairy industry wastewater. Clean Technologies and Environmental Policy, 2011, 13(3): 481-488. DOI:10.1007/s10098-010-0330-4 |
| [2] | Develter DWG, Lauryssen LML. Properties and industrial applications of sophorolipids. European Journal of Lipid Science and Technology, 2010, 112(6): 628-638. DOI:10.1002/ejlt.200900153 |
| [3] | Pekin G, Vardar-Sukan F, Kosaric N. Production of sophorolipids from Candida bombicola ATCC 22214 using Turkish corn oil and honey. Engineering in Life Sciences, 2005, 5(4): 357-362. DOI:10.1002/elsc.200520086 |
| [4] | Davila AM, Marchal R, Monin N, Vandecasteele JP. Identification and determination of individual sophorolipids in fermentation products by gradient elution high-performance liquid chromatography with evaporative light-scattering detection. Journal of Chromatography A, 1993, 648(1): 139-149. |
| [5] | Marchant R, Banat IM. Biosurfactants: a sustainable replacement for chemical surfactants?. Biotechnology Letters, 2012, 34(9): 1597-1605. DOI:10.1007/s10529-012-0956-x |
| [6] | Baccile N, Cuvier AS, Valotteau C, Van Bogaert INA. Practical methods to reduce impurities for gram-scale amounts of acidic sophorolipid biosurfactants. European Journal of Lipid Science and Technology, 2013, 115(12): 1404-1412. DOI:10.1002/ejlt.201300131 |
| [7] | Lang S, Brakemeier A, Heckmann R, Sp?ckner S, Rau U. Production of native and modified sophorose lipids. Chimica Oggi, 2000, 18(10): 76-79. |
| [8] | van Bogaert INA, Saerens K, de Muynck C, Develter D, Soetaert W, Vandamme EJ. Microbial production and application of sophorolipids. Applied Microbiology and Biotechnology, 2007, 76(1): 23-24. DOI:10.1007/s00253-007-0988-7 |
| [9] | Ciesielska K, Roelants SLKM, van Bogaert INA, de Waele S, Vandenberghe I, Groeneboer S, Soetaert W, Devreese B. Characterization of a novel enzyme—Starmerella bombicola lactone esterase (SBLE)—responsible for sophorolipid lactonization. Applied Microbiology and Biotechnology, 2016, 100(22): 9529-9541. DOI:10.1007/s00253-016-7633-2 |
| [10] | Saerens KMJ, Roelants SLKW, van Bogaert INA, Soetaert W. Identification of the UDP-glucosyltransferase gene UGTA1, responsible for the first glucosylation step in the sophorolipid biosynthetic pathway of Candida bombicola ATCC 22214. FEMS Yeast Research, 2011, 11(1): 123-132. DOI:10.1111/j.1567-1364.2010.00695.x |
| [11] | Saerens KMJ, Saey L, Soetaert W. One-step production of unacetylated sophorolipids by an acetyltransferase negative Candida bombicola. Biotechnology and Bioengineering, 2011, 108(12): 2923-2931. DOI:10.1002/bit.23248 |
| [12] | Ciesielska K, Van Bogaert IN, Chevineau S, Li B, Groeneboer S, Soetaert W, van de Peer Y, Devreese B. Exoproteome analysis of Starmerella bombicola results in the discovery of an esterase required for lactonization of sophorolipids. Journal of Proteomics, 2014, 98: 159-174. DOI:10.1016/j.jprot.2013.12.026 |
| [13] | Roelants SLKW, Ciesielska K, de Maeseneire SL, Moens H, Everaert B, Verweire S, Denon Q, Vanlerberghe B, van Bogaert INA, van der Meeren P, Devreese B, Soetaert W. Towards the industrialization of new biosurfactants: Biotechnological opportunities for the lactone esterase gene from Starmerella bombicola. Biotechnology and Bioengineering, 2016, 113(3): 550-559. |
| [14] | Kunz HH, Scharnewski M, Feussner K, Feussner I, Flügge UI, Fulda A, Gierth M. The ABC transporter PXA1 and peroxisomal β-oxidation are vital for metabolism in mature leaves of Arabidopsis during extended darkness. The Plant Cell, 2009, 21(9): 2733-2749. DOI:10.1105/tpc.108.064857 |
| [15] | Li JS, Xia CQ, Fang XR, Xue HZ, Song X. Identification and characterization of a long-chain fatty acid transporter in the sophorolipid-producing strain Starmerella bombicola. Applied Microbiology and Biotechnology, 2016, 100(16): 7137-7150. DOI:10.1007/s00253-016-7580-y |
| [16] | Hartmann T, Dümig M, Jaber BM, Szewczyk E, Olbermann P, Morschh?user J, Krappmann S. Validation of a self-excising marker in the human pathogen Aspergillus fumigatus by employing the β-rec/six site-specific recombination system. Applied and Environmental Microbiology, 2010, 76(18): 6313-6317. DOI:10.1128/AEM.00882-10 |
| [17] | Shao LJ. Studies on fed-batch fermentation, antifungal and anticancer activities of sophorolipids. Doctor Dissertation of Shandong University, 2010. (in Chinese) 邵凌健.槐糖脂补料发酵及抗真菌、抗肿瘤活性的研究.山东大学硕士学位论文, 2010. http://cdmd.cnki.com.cn/article/cdmd-10422-1011062786.htm |
| [18] | Long DP, Tan B, Zhao AC, Xu LX, Xiang ZH. Progress in Cre/lox site-specific recombination system in higher eukaryotes. Hereditas (Beijing), 2012, 34(2): 177-189. (in Chinese) 龙定沛, 谭兵, 赵爱春, 许龙霞, 向仲怀. Cre/lox位点特异性重组系统在高等真核生物中的研究进展. 遗传, 2012, 34(2): 177-189. |
| [19] | Zhao AC, Long DP, Tan B, Xu LX, Xiang ZH. Progress in research of FLP/FRT site-specific recombination system in higher eukaryotes. Scientia Agricultura Sinica, 2011, 44(15): 3252-3263. (in Chinese) 赵爱春, 龙定沛, 谭兵, 许龙霞, 向仲怀. FLP/FRT位点特异性重组系统在高等真核生物中的研究进展. 中国农业科学, 2011, 44(15): 3252-3263. |
| [20] | Ichihara T, Tohata M, Hayase A, Takahashi F. Sophorolipid highly-productive mutant strain. JP: WO2017014175A1. 2017-01-26. |
| [21] | Saerens KMJ, Zhang JX, Saey L, van Bogaert INA, Soetaert W. Cloning and functional characterization of the UDP-glucosyltransferase UgtB1 involved in sophorolipid production by Candida bombicola and creation of a glucolipid-producing yeast strain. Yeast, 2011, 28(4): 279-292. DOI:10.1002/yea.1838 |
