冯杰1,2#, Hamed I. Hamouda2,3#, Nasir Ali2,3, 王雨铭4, 张培玉1

 , 吕明2,5
, 吕明2,5

1. 青岛大学环境科学与工程学院, 山东 青岛 266071;
2. 中国科学院青岛生物能源与过程研究所, 中国科学院生物燃料重点实验室, 山东省合成生物学重点实验室, 山东 青岛 266101;
3. 中国科学院大学, 北京 100039;
4. 黑龙江科技大学管理学院, 黑龙江 哈尔滨 150022;
5. 洁净能源国家实验室, 辽宁 大连 116023
收稿日期:2018-12-06;修回日期:2019-03-15;网络出版日期:2019-04-04
基金项目:中国科学院战略性先导科技专项(XDA21060400);国家自然科学基金(31400060);青岛能源所科研创新基金及中国科学院洁净能源创新研究院资助项目(QIBEBT-ZZBS-201805)
*通信作者:张培玉, Tel:+86-532-83780155, E-mail:envbio@163.com;
吕明, Tel/Fax:+86-532-80662644, E-mail:lvming@qibebt.ac.cn.
#并列第一作者
摘要:[目的] 通过研究来自极端嗜热厌氧菌Caldicellulosiruptor sp.F32中3个可降解β-1,3-1,4葡聚糖(β-葡聚糖)的糖苷水解酶,解析其在降解β-葡聚糖过程中协同作用,以及异源表达的糖基化修饰对β-葡聚糖酶F32EG5热稳定性的影响,为该系列水解酶的应用提供考据。[方法] 通过大肠杆菌异源表达β-葡聚糖酶F32EG5和Lam16A-GH,以及β-葡萄糖苷酶BlgA,利用DNS、TLC等方法检测其在β-葡聚糖降解过程中的协同性及底物耐受能力。随后,利用毕赤酵母对F32EG5进行异源表达,以及对糖基化修饰的p-F32EG5进行酶学对比。[结果] β-葡聚糖酶F32EG5和Lam16A-GH单独作用于底物时,水解产物不同。但混合使用时,低聚合度寡糖的比例增加。β-葡萄糖苷酶BlgA分别与F32EG5和Lam16A-GH复配时,均展示出良好的协同效应和底物耐受能力。此外,利用毕赤酵母异源表达的p-F32EG5,没有明显改变其最适pH和最适温度,但在超高温下(80-90℃)的热稳定性和催化效率相对于未被糖基化的F32EG5提高2倍以上。[结论] 葡萄糖糖苷水解酶BlgA分别与β-葡聚糖酶F32EG5、Lam16A-GH复配,在水解β-葡聚糖过程中表现出良好的协同性和底物耐受能力,同时毕赤酵母异源表达的糖基化修饰能提高在超高温环境下的热稳定性能,有利于酶制剂生产造粒过程中的酶活保留,从而使F32EG5具备应用化潜力。
关键词:β-葡聚糖Caldicellulosiruptor sp.F32糖苷水解酶糖基化
β-glucan degrading hydrolases from Caldicellulosiruptor sp. F32 and influence of glycosylation on F32EG5 thermostability
Jie Feng1,2#, Hamed I. Hamouda2,3#, Nasir Ali2,3, Yuming Wang4, Peiyu Zhang1

 , Ming Lv2,5
, Ming Lv2,5

1. College of Environmental Science and Engineering, Qingdao University, Qingdao 266071, Shandong Province, China;
2. Key Laboratory of Biofuels, Shandong Provincial Key Laboratory of Synthetic Biology, Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101, Shandong Province, China;
3. University of Chinese Academy of Sciences, Beijing 100039, China;
4. School of Management, Heilongjiang University of Science and Technology, Harbin 150022, Heilongjiang Province, China;
5. Dalian National Laboratory for Clean Energy, Dalian 116023, Liaoning Province, China
Received: 6 December 2018; Revised: 15 March 2019; Published online: 4 April 2019
*Corresponding author: Peiyu Zhang, Tel:+86-532-83780155, E-mail:envbio@163.com;
Ming Lv, Tel/Fax:+86-532-80662644, E-mail:lvming@qibebt.ac.cn.
Foundation item: Supported by the Strategic Priority Research Program of the Chinese Academy of Sciences (XDA21060400), by the National Natural Science Foundation of China (31400060) and by the QIBEBT and Dalian National Laboratory for Clean Energy (QIBEBT-ZZBS-201805)
#These authors contributed equally to this work
Abstract: [Objective] Three β-glucan degrading glycoside hydrolases from an extreme thermophilic anaerobic bacterium Caldicellulosiruptor sp. F32 were investigated, including the synergistic effect. The effect of glycosylation on β-glucanase F32EG5 thermostability was also studied. [Methods] Two β-glucanases (F32EG5, Lam16A-GH) and β-glucosidase (BlgA) were heterologously expressed in E. coli. The synergistic effect of all these enzymes on β-glucan degradation was evaluated by 3, 5-Dinitrosalicylic acid (DNS) and Thin-layer chromatography (TLC) assays including substrate tolerant abilities. Furthermore, the glycosylated p-F32EG5 was expressed in Pichia pastoris, and compared with F32EG5 from E. coli. [Results] F32EG5 and Lam16A-GH released oligosaccharides with different degrees of polymerization (DP) after hydrolyzing β-glucan. The proportion of low-DP oligosaccharides was increased, when two enzymes used together. BlgA showed excellent synergistic effect with F32EG5 and Lam16A-GH, respectively. Although the glycosylated p-F32EG5 from Pichia pastoris did not obviously change its optimum pH and temperature when compared with E. coli-expressed F32EG5, both thermal stability and catalytic efficiency were found two-folds higher than those of E. coli-expressed F32EG5 at the extreme-high temperature (80-90℃). [Conclusion] F32EG5 and Lam16A-GH showed excellent synergistic effect and substrate tolerant abilities with BlgA. The heterologous glycosylation by Pichia pastoris could improve the thermal stability of F32EG5 under extreme thermophilic environment, which was a benefit during the granulation process of enzyme.
Keywords: β-glucanCaldicellulosiruptor sp. F32glycoside hydrolaseglycosylation
秸秆等生物质是一种重要且储量丰富的可再生资源,其中可被利用的木质纤维素主要分为纤维素、半纤维素、木质素等[1-2]。木质纤维素的结构极其复杂,由多种聚糖组成,因此需多种酶进行复配,才能完全降解成可发酵单糖。β-1, 3-1, 4葡聚糖(β-葡聚糖)是一种半纤维素,在谷物和地衣等植物的胚乳细胞壁中含量丰富,是植物重要的结构和能量储存多糖[3]。β-葡聚糖是由聚合度超过1000的β-D-葡萄糖残基组成的线性多糖,其中25%-30%的糖苷键为β-1, 3糖苷键连接。
在啤酒用大麦芽前期处理过程中,难降解的高聚合度β-1, 3-1, 4葡聚糖会增加糖化产物的粘稠度,增加其过滤时间和成本,同时还对啤酒的风味产生不良影响。在畜禽饲料处理过程中,高含量的β-1, 3-1, 4葡聚糖导致饲料食糜粘度增加,阻隔动物肠道对饲料营养的吸收与利用[4]。因此,用于降解β-1, 3-1, 4葡聚糖的糖苷水解酶具有广泛的应用前景。Ali等从中国白酒大曲中分离得到葡聚糖酶NFEg16A,可在底物浓度为15 mg/mL时有效水解底物,并将葡萄糖和纤维二糖作为其主要终产物[5]。严巧娟等从嗜热真菌Thermoascus aurantiacus CAU830分离出来的β-1, 3-1, 4葡聚糖酶TaGlu34能有效降解燕麦麸皮中的β-葡聚糖成分,产生聚合度(DP)为3-5的低聚糖,最高转化率可达到47.1%[6]。
Caldicellulosiruptor属是一种极端嗜热厌氧菌属,目前包含13个种,属于革兰氏阳性菌,GC含量较低,具有极强的木质纤维素降解能力[7]。本课题组已开展了多个木质纤维素酶的表征[8],其中F32EG5、Lam16A-GH是从Caldicellulosiruptor sp. F32中分离出的新型β-葡聚糖酶,两种酶具有不同的催化特性。与传统的β-葡聚糖酶相比,F32EG5和Lam16A-GH具有新颖的酶切位点,其水解产物为低聚合度的纤维寡糖[9-10]。来自糖苷水解酶5家族(GH5)的F32EG5对β-1, 3-1, 4葡聚糖具有较高活性,当底物-1和-2位之间为β-1, 4糖苷键时,它具有较强的切断β-1, 3糖苷键能力。同时,F32EG5还具有弱的β-1, 4糖苷键水解能力[9]。来自糖苷水解酶16家族(GH16)的Lam16A-GH可以水解β-1, 3葡聚糖(昆布多糖)和β-1, 3-1, 4葡聚糖(大麦β-葡聚糖)。同时,Lam16A-GH可通过水解酵母细胞壁中β-1, 3葡聚糖来抑制酵母的生长[10]。
同样从Caldicellulosiruptor sp. F32获得的β-葡萄糖苷酶(BlgA)来自糖苷水解酶1家族(GH1),具有很好的水解纤维二糖的能力[8]。BlgA与F32EG5、Lam16A-GH具有相近的最适反应条件,同时先前的研究证实BlgA可将纤维二糖、三糖、四糖、五糖、六糖水解为葡萄糖,并与Clostridium cellulosi来源的纤维素酶CcCel9A等具有协同作用[11]。孟冬冬等将一种β-1, 4葡聚糖酶CelB与BlgA复配使用时,实验结果证明在木质纤维素生物质水解过程中,BlgA可有效地消除内切葡聚糖酶的产物抑制剂[8]。刘亚君等研究发现BglA与热纤梭菌自身分泌的纤维小体组装成融合纤维小体CaBg1A-CohII,可有效降低纤维二糖对纤维小体的底物抑制作用[12]。
本实验将β-葡萄糖苷酶BlgA分别与F32EG5、Lam16A-GH复配,检测复配后对大麦β-1, 3-1, 4葡聚糖的降解效果。结果显示复配后的水解产物糖聚合度明显降低,同时β-葡聚糖酶F32EG5和Lam16A-GH展示出较好的底物耐受性。此外,利用毕赤酵母的糖基化修饰可提升p-F32EG5在超高温下的热稳定性与催化效率,有利于酶制剂生产中高温造粒过程。上述结果展示出Caldicellulosiruptor sp. F32中的β-葡聚糖降解酶具有应用化潜力。
1 材料和方法 1.1 主要仪器和材料 质粒提取试剂盒及pEASY-E2表达载体、感受态细胞大肠杆菌(Escherichia coli)的Trans-T1、BL21(DE3)购于北京全式金生物技术有限公司;大麦β-葡聚糖购于爱尔兰Megezyme公司;BCA蛋白浓度测定试剂盒购于美国Thermo Scientific公司;薄层层析硅胶板购于德国Merck KGaA公司;紫外分光光度计购于美国GE公司。巴斯德毕赤酵母GS115及其表达载体pPIC9K由本实验室保存。
1.2 质粒构建与蛋白制备 将含有目标蛋白基因的重组质粒转化大肠杆菌BL21(DE3)后,在平板上挑取其阳性克隆,分别接种于10 mL含100 μg/mL氨苄青霉素的LB (Luria-Bertani)培养液中。在37 ℃下200 r/min振荡培养6-8 h后,将活化后的菌液加入到1 L的LB培养液中,200 r/min振荡培养至OD600达到0.6-0.8,随后加入终浓度为300 μmol/L的IPTG进行诱导,于16 ℃继续培养20 h。
将构建好的质粒pPIC9K-F32EG5电击转染入毕赤酵母中,步骤如下:培养毕赤酵母GS115的OD600达到1.3-1.5,放入冰浴混合液(600 mmol/L山梨醇、10 mmol/L DTT、10 mmol/L Tris-HCl pH 7.5、100 mmol/L LiAC)中,室温下孵育30 min后加入线性化的pPIC9K-F32EG5质粒。电击转化的参数为1.5 kV、25 μF、200 Ω (ECM600 HARVARD Apparatus)。电击后立刻加入1 mol/L的山梨醇,30 ℃下200 r/min振荡培养2 h,转到RD (Regeneration Dextrose)平板后在30 ℃下培养直至长出菌落,通过菌落PCR进行验证得到阳性克隆。随后将阳性克隆接种于5 mL BMGY培养基中,在250 r/min、30 ℃下摇床培养至OD600为6.0左右。随后,转接到500 mL BMGY培养基中,继续培养至OD600为15-20,离心收集菌体转接到BMMY培养基中进行诱导,每12 h补加终浓度为0.5%的甲醇,摇床诱导表达5-7 d。
1.3 重组葡聚糖酶的纯化与检测 诱导后的培养基经过离心并破碎(大肠杆菌表达)或离心得到上清(酵母表达)处理后,上清液通过镍离子亲和吸附层析柱(Ni-NTA)进行纯化。纯化后蛋白经过蛋白质电泳(SDS-PAGE)的检验,确定蛋白纯度为90%以上,目标蛋白经过超滤浓缩后保存于-80 ℃超低温冰箱中。蛋白浓度参照BCA蛋白定量试剂盒步骤进行定量,毕赤酵母糖基化蛋白的电泳染色采用阿利新蓝糖染色法[13]。
1.4 酶学特性分析 F32EG5、Lam16A-GH与p-F32EG5的比酶活力通过DNS法(3’, 5’-二硝基水杨酸法)测定,将大麦β-葡聚糖溶于0.1 mol/L柠檬酸钠缓冲液(pH 5.6)中,终浓度为0.9% (W/V)下进行反应;反应体系由90 μL 1% (W/V)底物和10 μL稀释酶液组成,70 ℃下反应10 min,后加入100 μL DNS,煮沸5 min,加入300 μL去离子水,以13000 r/min离心1 min,取200 μL在540 nm下测定OD值;一个酶活单位(U)定义为:在特定的条件下,1 min能转化1 μmol底物的酶量。
在设定温度下测定F32EG5在不同pH范围(4.0-8.0)的酶活,确定最适反应pH值;在其最适pH值条件下测定其在不同温度(60-90 ℃)范围内的酶活,确定F32EG5的最适反应温度。将目的蛋白稀释到设定的浓度,分别置于70、80、90 ℃,每隔一定时间取样200 μL,最适反应条件下反应10 min测定残余酶活力,以确定其热稳定性。
1.5 酶促反应动力学参数设定 β-葡聚糖酶F32EG5的米氏常数Km值和催化常数kcat值的测定采用Lineweaver-Burk双倒数作图法。将底物用磷酸缓冲液配制成不同的浓度,测定等量的酶液与不同浓度的底物,在最适条件下反应10 min生成的还原糖,分别计算出反应速度V。以1/[S]为横坐标、1/V为纵坐标作图,得到一条直线,其横轴截距为-1/Km,纵轴截距为1/Vmax,斜率为Km/Vmax,由此计算出Km和Vmax。当底物浓度远超过酶浓度([E])时,根据kcat=Vmax/[E],计算得出kcat值。
1.6 酶解产物分析 检测酶解产物的反应体系由140 μL 1% (W/V)大麦β-葡聚糖和10 μL稀酶液(最终活性单位12 U/mL,将F32EG5与Lam16A-GH组合时,将其均匀混合后使得二者活性单位各为6 U/mL,总活性单位12 U/mL,体系不变)组成。反应条件为pH 5.6、70 ℃,分别在反应的0、0.5、1.0、2.0、3.0 h收集适量的样品,100 ℃下灭活5 min,采用薄层层析法分析其水解产物。
在测试F32EG5、Lam16A-GH分别与BlgA的协同性时,反应体系底物由140 μL 1% (W/V)底物(大麦β-葡聚糖)组成,同时将BlgA分别与F32EG5、Lam16A-GH均匀混合,吸取10 μL加入底物中(F32EG5与Lam16A-GH最终活性单位12 U/mL,BlgA最终活性单位为3 U/mL)。反应条件为pH 5.6、70 ℃,分别在反应的0、0.5、1.0、2.0、3.0、6.0 h收集适量的样品,100 ℃下灭活5 min,采用薄层层析法分析其水解产物。
1.7 对底物的耐受性分析 检测底物耐受性的反应体系中底物由140 μL 1% (W/V)底物大麦β-葡聚糖分别与葡萄糖、纤维二糖混合组成,10 μL稀酶液(最终活性单位12 U/mL)组成。反应条件为pH 5.6、70 ℃,分别在反应的0、1、2、3、6 h收集适量的样品,100 ℃下灭活5 min,采用薄层层析法分析其水解产物。
以pNP-β-D-glucopyranoside (pNP-Glup)作为底物,分别向其添加100-500 mmol/L的葡萄糖、阿拉伯糖、木糖,以不添加单糖时的BlgA酶活力作为基准,测定不同添加量时的酶活力,计算残余酶活。将20 mmol/L pNP-Glup在0.1 mol/L柠檬酸钠缓冲液(pH 5.6)中稀释为2 mmol/L后,吸取190 μL与10 μL稀酶液混合后,于水浴70 ℃反应5 min,后加入300 μL 1 mol/L碳酸钠溶液终止反应。将样品放入分光光度计,405 nm处测定吸光值。对硝基苯酚的摩尔消光系数ε为18700,测定的pH和温度相对稳定。一个酶活力单位为:以每分钟从底物中水解释放1 μmol的对硝基苯酚(pNP)的量。
1.8 F32EG5和Lam16A-GH复配对底物的酶活力测定 将F32EG5和Lam16A-GH以不同摩尔比例混合,通过DNS法(3’, 5’-二硝基水杨酸法)测定混合组分的酶活。将大麦β-葡聚糖溶于0.1 mmol/L柠檬酸钠缓冲液(pH 5.6)中,终浓度为0.9% (W/V)下进行反应;反应体系由90 μL 1%底物和10 μL混合后的稀酶液组成,70 ℃下反应10 min,后加入100 μL DNS,煮沸5 min,后加入300 μL去离子水,以13000 r/min离心1 min,取200 μL在540 nm下测定吸光值;一个酶活力单位为:在给定条件下,产生1 μmol还原糖所需要的酶的量。
2 结果和分析 2.1 F32EG5、Lam16A-GH、BlgA、p-F32EG5的制备 分别将含F32EG5、Lam16A-GH、BlgA目标基因的重组质粒转化入大肠杆菌BL21(DE3),经过诱导表达和镍柱纯化,获得3个目标蛋白。经蛋白质电泳检测,显示条带大小与理论分子量相符合(图 1-A)。经过毕赤酵母表达并纯化的p-F32EG5在分子量上大于大肠杆菌胞内表达的F32EG5 (图 1-B),并且纯化后的p-F32EG5样品在蛋白质电泳上方有一块阴影。随后,我们对含相同蛋白样品的电泳胶进行糖基化蛋白染色处理(图 1-C)。结果发现,毕赤酵母表达的p-F32EG5可以被糖基化染色,而大肠杆菌胞内表达的F32EG5则不能。同时,在图 1-C中p-F32EG5上方的阴影部分在糖基化染色后颜色更深,推测可能是过度糖基化的p-F32EG5在蛋白质电泳上移动较慢造成的。相似的现象在另一个糖苷水解酶也发现过[14]。
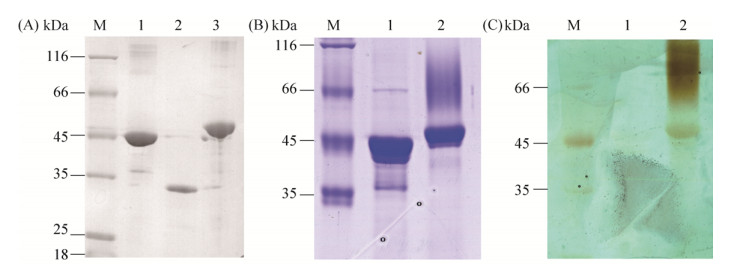 |
| 图 1 纯化后的F32EG5、Lam16A-GH、BlgA的蛋白质电泳分析 Figure 1 SDS-PAGE analysis of purified proteins. A: SDS-PAGE analysis of E. coli-expressed proteins; M: protein marker; lane 1: F32EG5;lane 2: Lam16A-GH; lane 3: BlgA. B: SDS-PAGE analysis of F32EG5 expressed in E. coli and Pichia pastoris; M: protein marker; lane 1: F32EG5 in E. coli; lane 2: F32EG5 in Pichia pastoris.C: Glycosylation staining of F32EG5; M: protein marker; lane 1: F32EG5 in E. coli; lane 2: F32EG5 in Pichia pastoris. |
| 图选项 |
2.2 不同复配组合对大麦β-葡聚糖的水解产物分析 不同酶之间的协同作用是降解木质纤维素的关键之一,而不同酶之间协同效应的高低也在一定程度上反映了其在工业应用上的潜力。实验中的TLC结果(图 2)表明,在单独使用的情况下,F32EG5可将大麦β-葡聚糖水解为纤维二糖等寡糖。Lam16A-GH的水解产物同样以寡糖为主,但移动位置与F32EG5的水解产物有所差异;这也说明了二者的酶切位点具有差异性。将二者以不同比例复配,DNS结果发现共同作用于大麦β-葡聚糖时,未出现明显的活性累加效应,即未出现明显的协同效应(图 3),但通过TLC结果(图 2)发现,纤维二糖等低聚合度寡糖所占的水解产物比例明显上升。由上述结果发现:两个酶的识别位点不同,同时作用时,可以降低水解产物的糖的聚合度,有利于后续的微生物发酵摄取。
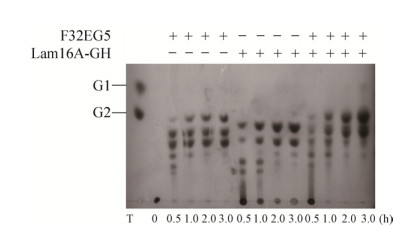 |
| 图 2 β-葡聚糖酶F32EG5和Lam16A-GH水解大麦β-葡聚糖的产物分析 Figure 2 TLC analysis of hydrolysis products from barley β-glucan. G1: glucose; G2: cellobiose; +: enzyme; -: blank; 0, 0.5, 1.0, 2.0, 3.0 means hydrolyzed time (hours) by enzymes. |
| 图选项 |
 |
| 图 3 不同摩尔比例F32EG5与Lam16A-GH混合后的酶活对比 Figure 3 Measured enzyme activity of combined Lam16A-GH and F32EG5 with different molar ratio. All of the experiments were performed in triplicates. |
| 图选项 |
当β-葡萄糖苷酶BlgA分别与β-葡聚糖酶F32EG5和Lam16A-GH复配时,水解产物均发生明显变化(图 4)。当单独使用F32EG5时,孵育6 h后仍存在不同聚合度的纤维寡糖,也未发现葡萄糖的条带;而BlgA与F32EG5复配时,水解产物基本变为葡萄糖(图 4-A)。类似的现象也发生在BlgA与Lam16A-GH相配合时,但6 h时的水解产物依然存在少量寡糖(图 4-B)。上述结果说明β-葡萄糖苷酶BlgA能辅助β-葡聚糖酶快速降解β-葡聚糖,同时也暗示Lam16A-GH与F32EG5对底物大麦β-葡聚糖的识别位点有差异,Lam16A-GH水解产生的部分纤维寡糖(或许含有β-1, 3糖苷键)难以被BlgA降解。
 |
| 图 4 β-葡萄糖苷酶BlgA分别与F32EG5(A)和Lam16A-GH(B)复配时的水解大麦β-葡聚糖产物分析 Figure 4 TLC analysis of hydrolysis products by combination of BlgA and F32EF5 (A) or Lam16A-GH (B). G1: glucose; G2: cellobiose; C: control; +: enzyme; -: enzymeless. 0.5, 1.0, 2.0, 3.0, 6.0 means hydrolyzed time (hours) by enzyme. |
| 图选项 |
2.3 对纤维二糖与葡萄糖等抑制剂的耐受性检测 葡萄糖与纤维二糖在木质纤维素酶水解过程中通常起抑制作用,从而影响工业化应用。在1% (W/V)的β-葡聚糖中添加1% (W/V)的葡糖糖或纤维二糖,随后分别添加F32EG5 (图 5-A、5-B)和Lam16A-GH (图 5-C、5-D),在不同时间点取出等量反应产物进行水解产物分析。由结果可知,添加了葡萄糖与纤维二糖的反应体系产物中,在相同的孵育时间下,各种寡糖的产量和比例与未添加的样品无明显差异。说明作为终产物的葡萄糖和纤维二糖不会明显抑制这两种酶在水解大麦β-葡聚糖过程的产物。
 |
| 图 5 β-葡聚糖酶F32EG5与Lam16A-GH的产物耐受性分析 Figure 5 Inhibition effects of glucose and cellobiose on F32EG5 and Lam16A-GH. A: Inhibition effect of glucose on F32EG5; B: Inhibition effect of cellobiose on F32EG5; C: Inhibition effect of glucose on Lam16A-GH; D: Inhibition effect of cellobiose on Lam16A-GH. G1: glucose; G2: cellobiose; +: glucose or cellobiose addition; -: without glucose or cellobiose. 0, 1, 2, 3, 6 means hydrolyzed time (hours) by enzymes. |
| 图选项 |
β-葡萄糖苷酶在辅助β-葡聚糖酶消除产物抑制的同时,自身也受到其水解产物的抑制作用,因而决定在实际应用中的潜力。以pNP-β-D- glucopyranoside (pNP-Glup)作为底物测定在含有不同浓度抑制产物的反应体系中BlgA的残余酶活。结果显示,当底物中含有200 mmol/L的葡萄糖将使BlgA的活性降到42%,而500 mmol/L的木糖对其活性没有较明显抑制作用,残余酶活仍保持在90%以上,而500 mmol/L的阿拉伯糖将使其残余酶活保持在75% (图 6)。上述分析可以说明BlgA对不同类型单糖具有较好的耐受性,为协同降解木制纤维素提供了基础。
 |
| 图 6 不同浓度的木糖、阿拉伯糖、葡萄糖对BlgA抑制作用 Figure 6 Inhibition effects of glucose, xylose or arabinose on BlgA activity. All of the experiments were performed in triplicate. |
| 图选项 |
由上述实验结果可知,与Lam16A-GH相比,F32EG5与BlgA复配的效果更显著。同时Lam16A-GH因为缺少底物结合模块,与底物的结合能力也相对较弱。我们遂选取了F32EG5进行毕赤酵母异源表达,研究异源糖基化修饰对F32EG5的影响。
2.4 毕赤酵母的糖基化修饰对F32EG5的作用 以大麦β-葡聚糖为底物,利用DNS法分别测定了F32EG5和p-F32EG5的最适温度和最适pH。结果显示,p-F32EG5和F32EG5的最适温度均在80-85 ℃之间,其最适pH则由F32EG5的pH 6.0变为p-F32EG5的pH 5.6 (图 7)。此外,两者在最适条件(80 ℃)的比酶活力也未发生明显变化(F32EG5的比酶活力为941 U/mg而p-F32EG5为1026 U/mg)。以不同浓度的大麦葡聚糖作为底物,分别测定两种F32EG5对β-1, 3-1, 4葡聚糖的酶促反应动力学参数。如表 1所示,毕赤酵母表达的p-F32EG5对底物的亲和力没有明显降低,但具有较高的酶反应常数(kcat值为13.87 min-1)和催化效率[(5.33 > 3.25 mL/(mg·min)]。因此糖基化没有明显改变F32EG5的最适温度、pH、比酶活力和底物亲和能力,但提高了酶的催化效率。
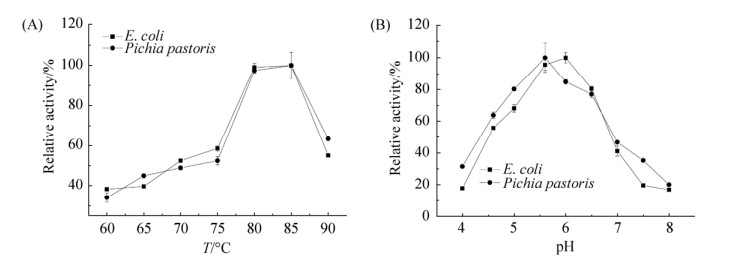 |
| 图 7 F32EG5与p-F32EG5的最适温度和最适pH比较 Figure 7 Optimum temperatures (A) and optimum pHs (B) of F32EG5 and p-F32EG5. All of the experiments were performed in triplicates. |
| 图选项 |
表 1. F32EG5的酶反应动力学参数 Table 1. Kinetic parameters of purified F32EG5
| Enzyme | Km/ (mg/mL) | kcat/ (min-1) | kcat/Km/ [mL/(mg?min)] |
| F32EG5 | 2.1±0.2 | 6.9±0.8 | 3.3 |
| p-F32EG5 | 2.6±0.3 | 13.9±1.2 | 5.3 |
表选项
随后,分别在70、80、90 ℃温度下对两者的热稳定性进行比较。在不同时间取样后测定其最适条件下的残余酶活。如图 8所示,从大肠杆菌中分离纯化的F32EG5在70、80、90 ℃的酶活半衰期(t1/2)分别为17 h、4 h和2.5 min。而在80 ℃ (图 8-B)和90 ℃ (图 8-C)下,毕赤酵母表达的p-F32EG5的t1/2是大肠杆菌表达的F32EG5的2.0-2.5倍;在70 ℃ (图 8-A)下的t1/2则没有显著变化。
 |
| 图 8 毕赤酵母与大肠杆菌异源表达的F32EG5在70、80、90 ℃下热稳定性的比较 Figure 8 Thermostability of F32EG5s from Pichia pastoris and E. coli at 70 ℃ (A), 80 ℃ (B) and 90 ℃ (C). All of the experiments were performed in triplicates. |
| 图选项 |
3 讨论 Caldicellulosiruptor属细菌是一类在高温下(75-85 ℃)高效降解木质纤维素(生物质)的微生物。其基因组中含有一系列高效水解未预处理生物质的嗜热纤维素酶,为酶制剂的工业化应用提供了资源[15-16]。前期研究发现F32EG5与Lam16A- GH具有新颖的催化位点,从而带来了更多应用化潜力,如Lam16A-GH与蛋白酶配合对酵母细胞壁的裂解作用。同时,Lam16A-GH具有良好的热稳定性,为大麦芽糖化过程中降低β-葡聚糖浓度提供了应用潜力[10]。来自Caldicellulosiruptor sp. F32的全长Lam16A含有6个底物结合模块(CBM4及CBM6)[10],暗示出Lam16A具有更好结合复杂不溶性底物的能力。因此,F32EG5与Lam16A-GH之间协同效率不高,可能是因为Lam16A-GH只包含1个活性催化区域,缺乏底物结合区域,从而导致其底物识别能力较差。后续研究可通过制备含有不同数目底物结合模块的Lam16A-GH突变体,揭示不同数量底物结合模块在Lam16A水解β-葡聚糖过程中的功能。
木质纤维素的高效糖化是生物燃料和生物基材料制备过程中的关键步骤[17]。刘亚君等在Clostridium thermocellum中将BlgA组装到纤维小体,对预处理的小麦秸秆进行降解,葡萄糖占总组分的比例由未改造的40%提升至60%[12]。β-葡聚糖是木质纤维素的重要成分之一,从薄层层析结果(图 4-A)发现F32EG5与BlgA组合的水解终产物中葡萄糖占绝大多数。因此F32EG5和BlgA可与其他多糖水解酶复配,从而提高水解木质纤维素的能力,也为秸秆饲料降低食糜粘度提供应用可能性。
前人研究发现,对于Caldicellulosiruptor属胞外糖苷水解酶,糖基化修饰后可大幅提高糖苷水解酶的稳定性和比酶活力[18]。毕赤酵母是一种高效的蛋白重组表达系统, 在胞外分泌蛋白过程中,常形成二硫键或糖基化等翻译后修饰,从而提高重组蛋白质的热稳定性[19-20]。在本研究中,经毕赤酵母重组表达的p-F32EG5发现被糖基化修饰的现象(图 1-C)。与大肠杆菌表达的F32EG5相比,虽然在最适温度、最适pH、比酶活力没有明显变化(图 7-A、B),但在超高温下(80-90 ℃)的热稳定性有近2倍提升(图 8-B、C)。在工业酶制剂生产过程中,最后阶段通常有瞬间高温造粒过程。毕赤酵母表达的p-F32EG5在90 ℃超高温下有更长的酶活半衰期,意味着在实际生产中能保留更多酶活,从而增强了其商业化的潜力。
References
| [1] | Chaudhuri SK, Lovley DR. Electricity generation by direct oxidation of glucose in mediatorless microbial fuel cells. Nature Biotechnology, 2003, 21(10): 1229-1232. DOI:10.1038/nbt867 |
| [2] | Claassen PAM, van Lier JB, Lopez Contreras AM, van Niel EWJ, Sijtsma L, Stams AJM, de Vries SS, Weusthuis RA. Utilisation of biomass for the supply of energy carriers. Applied Microbiology and Biotechnology, 1999, 52(6): 741-755. DOI:10.1007/s002530051586 |
| [3] | Planas A. Bacterial β-1, 3-1, 4-β-glucanases: structure, function and protein engineering. Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology, 2000, 1543(2): 361-382. DOI:10.1016/S0167-4838(00)00231-4 |
| [4] | Von Wettstein D, Warner J, Kannangara CG. Supplements of transgenic malt or grain containing (1, 3-1, 4)-β-glucanase increase the nutritive value of barley-based broiler diets to that of maize. British Poultry Science, 2003, 44(3): 438-449. DOI:10.1080/0007166031000085526 |
| [5] | Ali B, Yi ZL, Fang Y, Chen LC, He KZ, Liu DY, Luo HB, Zhao D, Zheng J, He H, Jin YL, Zhao H. Characterization of a fungal thermostable endoglucanase from Chinese Nong-flavor daqu by metatranscriptomic method. International Journal of Biological Macromolecules, 2019, 121: 183-190. DOI:10.1016/j.ijbiomac.2018.09.173 |
| [6] | Yan QJ, Yang HY, Jiang ZQ, Liu EW, Yang SQ. A novel thermostable β-1, 3-1, 4-glucanase from Thermoascus aurantiacus and its application in oligosaccharide production from oat bran. Carbohydrate Research, 2018, 469: 31-37. DOI:10.1016/j.carres.2018.08.017 |
| [7] | Rainey FA, Donnison AM, Janssen PH, Saul D, Rodrigo A, Bergquist PL, Daniel RM, Stackebrandt E, Morgan HW. Description of Caldicellulosiruptor saccharolyticus gen. nov., sp. nov: an obligately anaerobic, extremely thermophilic, cellulolytic bacterium. FEMS Microbiology Letters, 1994, 120(3): 263-266. DOI:10.1111/j.1574-6968.1994.tb07043.x |
| [8] | Meng DD, Ying Y, Zhang KD, Lu M, Li FL. Depiction of carbohydrate-active enzyme diversity in Caldicellulosiruptor sp. F32 at the genome level reveals insights into distinct polysaccharide degradation features. Molecular Biosystems, 2015, 11(11): 3164-3173. DOI:10.1039/C5MB00409H |
| [9] | Meng DD, Liu X, Dong S, Wang YF, Ma XQ, Zhou HX, Wang XQ, Yao LS, Feng YG, Li FL. Structural insights into the substrate specificity of a glycoside hydrolase family 5 lichenase from Caldicellulosiruptor sp. F32. Biochemical Journal, 2017, 474(20): 3373-3389. DOI:10.1042/BCJ20170328 |
| [10] | Meng DD, Wang B, Ma XQ, Ji SQ, Lu M, Li FL. Characterization of a thermostable endo-1, 3(4)-β-glucanase from Caldicellulosiruptor sp. strain F32 and its application for yeast lysis. Applied Microbiology and Biotechnology, 2016, 100(11): 4923-4934. DOI:10.1007/s00253-016-7334-x |
| [11] | Yang M, Zhang KD, Zhang PY, Zhou X, Ma XQ, Li FL. Synergistic cellulose hydrolysis dominated by a multi-modular processive endoglucanase from Clostridium cellulosi. Frontiers in Microbiology, 2016, 7: 932. |
| [12] | Li XY, Xiao Y, Feng YG, Li B, Li WL, Cui Q. The spatial proximity effect of beta-glucosidase and cellulosomes on cellulose degradation. Enzyme and Microbial Technology, 2018, 115: 52-61. DOI:10.1016/j.enzmictec.2018.04.009 |
| [13] | Moller HJ, Poulsen JH. Improved method for silver staining of glycoproteins in thin sodium dodecyl sulfate polyacrylamide gels. Analytical Biochemistry, 1995, 226(2): 371-374. DOI:10.1006/abio.1995.1238 |
| [14] | Wang L, Han WJ, Meng DD, Zhu J, Li FL, Lv M. Effect of glycosylation on a thermophilic β-1, 4-endoxylanase from Caldicellulosiruptor sp. F32. Biotechnology, 2016, 26(3): 300-306. (in Chinese) 王灵, 韩文杰, 孟冬冬, 朱静, 李福利, 吕明. 糖基化对Caldicellulosiruptor sp. F32中内切型木聚糖酶热稳定性的影响. 生物技术, 2016, 26(3): 300-306. |
| [15] | Lee LL, Hart WS, Lunin VV, Alahuhta M, Bomble YJ, Himmel ME, Blumer-Schuette SE, Adams MWW, Kelly RM. Comparative biochemical and structural analysis of novel cellulose binding proteins (Tāpirins) from extremely thermophilic Caldicellulosiruptor species. Applied and Environmental Microbiology, 2019, 85(3): e01983. |
| [16] | Chen ZW, Chen JJ, Zhang WL, Zhang T, Guang CE, Mu WM. Improving thermostability and catalytic behavior of L-rhamnose isomerase from Caldicellulosiruptor obsidiansis OB47 toward d-allulose by site-directed mutagenesis. Journal of Agricultural and Food Chemistry, 2018, 66(45): 12017-12024. DOI:10.1021/acs.jafc.8b05107 |
| [17] | Hwangbo M, Tran JL, Chu KH. Effective one-step saccharification of lignocellulosic biomass using magnetite-biocatalysts containing saccharifying enzymes. Science of the Total Environment, 2019, 647: 806-813. DOI:10.1016/j.scitotenv.2018.08.066 |
| [18] | Chung D, Young J, Bomble YJ, Wall TAV, Groom J, Himmel ME, Westpheling J. Homologous expression of the Caldicellulosiruptor bescii CelA reveals that the extracellular protein is glycosylated. PLoS One, 2015, 10(3): e0119508. DOI:10.1371/journal.pone.0119508 |
| [19] | ?berg F, Sj?hamn J, Fischer G, Moberg A, Pedersen A, Neutze R, Hedfalk K. Glycosylation increases the thermostability of human aquaporin 10 protein. Journal of Biological Chemistry, 2011, 286(36): 31915-31923. DOI:10.1074/jbc.M111.242677 |
| [20] | Daly R, Hearn MTW. Expression of heterologous proteins in Pichia pastoris: a useful experimental tool in protein engineering and production. Journal of Molecular Recognition, 2005, 18(2): 119-138. DOI:10.1002/jmr.687 |
