刘强1,3#, 赵本宣1,2#, 李汝伟1,3, 吴冬梅1, 徐大鹏4, 程传东1,3, 赵淑江1,3


1.浙江海洋大学, 浙江 舟山 316022;
2.国家海洋设施养殖工程技术研究中心, 浙江 舟山 316022;
3.舟山碳汇联合监测站, 浙江 舟山 316022;
4.厦门大学近海海洋环境科学国家重点实验室, 福建 厦门 361005
收稿日期:2017-03-10;修回日期:2017-05-19;网络出版日期:2017-06-16
基金项目:国家海洋局公益性行业科研专项(201505025,201505003);国家重点研发项目支持计划(2017YFA0604902)
*通信作者:赵淑江, E-mail:joyriver@163.com
#并列第一作者。
摘要:[目的]为了解舟山群岛不同功能区划海域细菌群落结构及丰度变化,探索海洋生态因子对细菌群落结构的影响。[方法]于2016年夏季(8月)在舟山群岛不同功能区划海域共设置8个典型站位采集表层海水,基于细菌16S rRNA基因进行高通量测序;利用流式细胞术揭示各海域细菌丰度;利用典范对应分析(Canonical correspondence analysis,CCA)探讨海洋生态因子与细菌多样性之间的关系。[结果]共获取到305487条原始序列,基于97%相似性水平进行OTU(Operational Taxonomic Units)聚类分析,共得到1088个OTUs,包括29个门、62个纲、138个目、239个科、416个属。细菌群落组成在各个站位之间不尽相同,但都主要包括Flavobacteria、Alphaproteobacteria、Gammaproteobacteria三大优势菌纲。CCA结果表明细菌群落结构和多样性情况与站位分布和所在站位的环境因子息息相关,Cyanobacteria受硝酸盐影响显著,Parcubacteria受温度影响最大,而磷酸盐对本实验海域菌群影响甚微。对海洋菌群潜在功能进行预测的结果显示,各海域菌群在氨基酸代谢、碳水化合物代谢、膜运输等方面功能较为突出,为今后舟山海洋微生物研究提供了新的方向。[结论]高通量测序分析可以更精确地揭示海洋菌群的群落结构信息。该研究为细菌群落结构与环境因素的关联提供参考。本研究所取得的大量数据既可以作为对舟山市海洋功能区划施行情况的响应,又将为舟山及其邻近海域浮游细菌群落结构的进一步研究奠定基础。
关键词: 细菌多样性 群落结构 流式细胞术 16S rRNA基因 高通量测序
Bacterial community structure in different functional sea areas of Zhoushan archipelago
Qiang Liu1,3#, Benxuan Zhao1,2#, Ruwei Li1,3, Dongmei Wu1, Dapeng Xu4, Chuandong Cheng 1,3, Shujiang Zhao 1,3


1.Zhejiang Ocean University, Zhoushan 316022, Zhejiang Province, China;
2.National Engineering Research Center of Marine Facilities Aquaculture, Zhoushan 316022, Zhejiang Province, China;
3.Carbon Sink Time Series Station at Zhoushan, Zhoushan 316022, Zhejiang Province, China;
4.State Key Laboratory of Marine Environmental Science, Xiamen University, Xiamen 361005, Fujian Province, China
Received 10 March 2017; Revised 19 May 2017; Published online 16 June 2017
*Corresponding author: Shujiang Zhao, E-mail:joyriver@163.com
Supported by the Nonprofit Research Project of the State Oceanic Administration (201505025, 201505003) and by the National Key Research and Development Program of China (2017YFA0604902)
#These authors contributed equally to this work
Abstract: [Objective]The aim of this study was to analyze the bacterial community structure in different functional sea areas of Zhoushan archipelago.[Methods]Samples were collected in surface seawater from Zhoushan Archipelago of the East China Sea in 8 typical sites representative of 8 functional zones in the summer (August) of 2016. We used high throughput sequencing to study bacterial diversity and community structure in seawater of the of Zhoushan archipelago based on the bacterial 16S rRNA gene. Flow cytometry was used to reveal the abundance of bacteria in each site. The technique of Canonical correspondence analysis was used to analyze the effects of the environmental factors on bacterial community composition.[Results]In this research, 305487 raw reads were obtained. OTU cluster analysis was performed at the 97% similarity level, and all the sequences were grouped into 1088 OTUs, including 29 phyla, 62 classes, 138 orders, 239 families, and 416 genera. The bacterial community structure of each station were different, but they all included three dominant strains of Flavobacteria, Alphaproteobacteria and Gammaproteobacteria. A canonical correspondence analysis showed that different stations and different Phyla were affected by different ecological factors, Cyanobacteria was most affected by nitrate, Parcubacteria was most affected by temperature, and phosphate had little effect on all bacteria in this study area. The prediction of the potential function of marine microflora showed that the sea areas of each site were more prominent in Amino Acid Metabolism, Carbohydrate Metabolism, Membrane Transport and so on, which provided a new direction for marine microbial research in the future.[Conclusion]High throughput sequencing analysis can accurately reveal the bacterial structure information of marine bacteria. This research provides references for the association of bacterial composition and diversity with environmental factors. The large amount of data that was obtained not only as a response of Zhoushan marine function zoning purposes of the case but also lay foundations for further bacterial community structure research in the east China sea.
Key words: bacterial diversity community structure flow cytometry 16S rRNA gene high-throughput sequencing
在浩瀚无垠的海洋中,海洋细菌无处不在,多样性和丰度分布情况极其复杂,它们主要参与大气产生、微食物网、有机物质的生物地球化学循环过程[1]。据报道,自然海域中表层海水细菌的丰度可达106 cell/mL的数量级[2],甚至更高,其种类之多远超我们的想象[3]。丰富的细菌种类对海洋水体生物多样性具有重要贡献,同时,细菌的多样性又与环境条件息息相关,海洋细菌群落结构一定程度上可以反映出该海域的生态环境状况。此外,该类研究还将帮助科研人员更好地了解海洋细菌的全球分布模式[4]以及细菌群落与环境或生物因子之间的相互关系[5-6]。目前关于海洋浮游细菌群落组成方面的研究是海洋科学领域的热点问题,纵观国内外在相关领域的研究,可以说已经取得了一定的成果。正如Comeau等[7]的研究,在博福特海气温快速变暖、海冰减少期间,运用高通量测序的方法发现海冰减少前后海洋中优势菌群组成结构发生显著变化。Luria等[8]应用焦磷酸测序方法研究南极西部半岛大陆架海域细菌多样性和群落结构时发现,寒冷极地水域中的细菌活性比低纬度地区低,近岸和远海细菌丰度无明显区别,但是随采样深度增加丰度变化明显。Bowman等[9]对北极海冰中微生物群落结构进行研究,首次在北极海冰中发现蓝细菌,并且观察到许多之前没有报道过的低丰度的分支,如TM7菌门和Spartobacteria、Opitutae菌纲。
舟山群岛位于长江口外海域,受我国东海和长江径流影响,属于咸淡水生态系统的交错群落,具有独特的生物地球化学循环特征[10]。舟山群岛海域是东海地区集旅游、港口、工业、渔业、养殖区等于一体的重要海域。近年来,关于舟山群岛海域的微生物多样性的研究不断出现,尹冰玉等[11]利用构建克隆文库和系统发育树的方法,对舟山枸杞岛海藻床沉积物细菌群落组成进行了初步研究;蒋学兵等[12]对我国舟山群岛海域海洋细菌种类与分布进行调研,分析该海域海洋细菌对抗菌药物的敏感性;张东声等[10]应用16S rRNA基因文库和克隆测序的方法研究了舟山群岛海域沉积物中厌氧氨氧化细菌(AAOB)的多样性。目前尚未出现关于舟山群岛不同功能海域细菌多样性及其群落结构的报道。
本文首次根据舟山市海洋功能区划[13],结合岛礁分布和行政区划,在基本涵盖舟山所有功能海域的基础上,我们选择了8个典型站位:枸杞岛海域(GQ)代表贻贝养殖区,桃花岛海域(TH)代表旅游区,沈家门海域(SJM)代表港口区,朱家尖海域(ZJJ)代表捕捞区,东极岛海域(DJ)代表大黄鱼养殖区,岱山岛海域(DS)代表盐田区,六横岛海域(LH)代表排污区,金塘岛海域(JT)代表工业区。运用流式细胞仪(BECKMAN COULTER Cytomics FC500)检测该8个站位表层海水微微型浮游生物(Picoplankton)的丰度,并基于高通量测序手段,揭示目标海域的细菌群落组成,同时应用CCA分析探索海洋细菌群落结构与环境因素之间的关系。最后,基于基因序列对海洋细菌进行功能预测,探索海洋菌群的开发价值。本研究将为进一步了解海洋微生物群落及功能多样性提供了分子生物学层面的数据支持,也为海洋细菌与生态环境之间的关联研究提供参考。
1 材料和方法 1.1 材料 2016年8月期间,在舟山群岛各目标海域共8个站点利用灭过菌的便携式采水器采集表层海水样品,各站点分布如图 1所示。
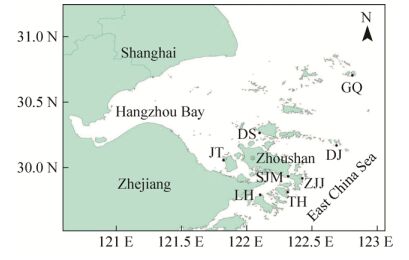 |
| 图 1 舟山群岛海域采样站点分布图 Figure 1 The sampling station of the Zhoushan Archipelago. DJ: Dongji Island (东极岛), GQ: Gouqi Island (枸杞岛), JT: Jintang Island (金塘岛), LH: Liuheng Island (六横岛), SJM: Shenjiamen (沈家门), TH: Taohua Island (桃花岛), ZJJ: Zhujiajian (朱家尖), DS: Daishan Island (岱山岛). Samples were collected in August 2016. |
| 图选项 |
1.1.1 生态因子采集: 在水样采集现场,利用便携式HQ-30D溶氧仪立即测定采样区溶解氧(DO)和水温(Temperature),便携式盐度计测定盐度。营养盐参数包括磷酸盐(PO43–)、硝酸盐(NO3–)、硅酸盐(SiO32–)、氨氮(NH3-N)在实验室利用Smartchem-200全自动间断式化学分析仪进行测定。
1.1.2 微微型浮游生物样品采集: 采集表层(0.5 m)海水50 mL,经20μm的筛绢预过滤以筛除小型浮游生物,分别采集过滤后样品(1.98 mL)分装至5个2 mL的无菌冻存管中,立即加入终浓度为0.5%的戊二醛混匀固定[14],4℃黑暗固定15 min后放入液氮中保存。
1.1.3 水体总DNA样品采集: 各站点分别采集表层(0.5 m)海水6 L,分装在灭菌的聚乙烯塑料瓶中,在船上立即使用脚踏式真空抽滤装置(富林004)进行抽滤,先经3 μm混合纤维素滤膜(Millipore公司)预过滤大颗粒杂质,然后使用0.22 μm混合纤维素滤膜(直径47 mm)富集海洋细菌于膜上,6 L海水共抽滤3张滤膜。将过滤后的0.22μm滤膜放入灭菌的2 mL冻存管中,置于液氮罐中速冻,然后带回实验室置于-80℃超低温冰箱中保存。
1.2 流式细胞仪检测微微型浮游生物丰度 利用流式细胞术检测微微型浮游生物丰度的方法参照焦念志等[15]的方法,并稍作改进。
1.3 DNA提取和16S rRNA基因PCR扩增 全基因组DNA采用水体DNA试剂盒(OMEGA Water DNA Kit:D525-01)进行提取,DNA提取完成后用紫外分光光度计(NANO Drop 2000)检测其浓度和纯度,质量合格后即可进行PCR扩增(V3–V4区)。扩增使用细菌16S rRNA通用引物[16]:338 f (5′-ACTCCTACGGGAGGCAGC AG-3′)和806 r (5′-GGACTACHVGGGTWTCTAA T-3′),20μL反应体系为:10μL的PCR mastermix (TaKaRa),0.5 μL的正反引物,2μL DNA,7μL ddH2O。PCR扩增条件为:95 ℃预变性3 min,95 ℃变性30 s,55℃退火30 s,72℃延伸45 s,循环35次,72℃终延伸10 min。扩增完成之后,用2%浓度的琼脂糖凝胶电泳检测扩增效果[17]。
1.4 高通量测序和生物信息分析 伴随着分子生物学技术的快速发展,高通量测序技术以其成本更低、测序深度更大、准确性更好的独特优势风靡科研界[18-19]。将PCR产物送至上海美吉生物医药科技有限公司在Illumina MiSeq PE300平台上进行高通量测序,平均读取长度为437 bp。
测序结束后,在Usearch (vsesion 7.1 http://drive5.com/uparse/)软件平台下,进行序列优化并按照97%相似性[20]对非重复序列(不含单序列)进行OTU聚类。将OTU的代表序列与NCBI数据库对比得到该OTU的分类学信息并进行分类学分析。基于OTU聚类分析结果,可以对OTU进行多种多样性指数分析,以及对测序深度检测;基于分类学信息,可以在各个分类水平上进行群落结构统计分析;基于系统发育可以进行unifrac等分析;采用序列进行随机抽样的方法,以抽到的序列数与它们所能代表OTU的数目构建稀释曲线[21]来反映物种丰富度和检测测序深度是否合理。
利用R语言“pheatmap”包[22],在门水平做heatmap[23]图,直观反映出多个样本在门水平上群落组成的相似性和差异性。Picrust (Phylogenetic Investigation of Communities by Reconstruction of Unobserved States) V1.0.0通道用来预测原核生物群落功能潜力[24]。基于QIIME软件,利用pick_ closed_reference_otus.py脚本将聚类后的OTUs (97%相似性)与Greengenes数据库比对,舍弃无法比对参考序列的读取,从而对海洋菌群功能进行预测。利用R语言“vegan”包,趋势对应分析(Detrended correspondence analysis,DCA)结果显示,样品矩阵第一轴的梯度长度大于3,因此选择CCA来分析环境因子与海洋细菌群落结构变化的相关性。
本研究使用的所有原始数据全部上传到NCBI-SRA(Sequence Read Archive)数据库(http://www.ncbi.nlm.nih.gov/sra/ SRP093799),登录号:SRP093799。
2 结果和分析 2.1 舟山群岛环境特点分布情况 按照功能分区原则,围绕舟山群岛设置的8个采样站位的坐标、各生态因子和无机营养盐数据见表 1。针对该批次样品,由表可见,温度为26.6–33.5℃,溶解氧为6.39–10.78 mg/L,盐度为21‰–30‰,总体来说,各生态因子的变化还算相对明显,能够在一定程度上将该8个样品定义为来自不同的环境。在所有营养盐数据中,除PO43–外,东极岛海域的营养盐浓度最高。而除SiO32–以外,六横岛海域所有营养盐浓度最低。聚球藻(Synechococcus; syn)和微微型真核生物(Picoeukaryotes; Picoeuk)的丰度分别为(0.39–6.62)×106 cells/mL和(0.24–3.59)×104 cells/mL。其中,聚球藻最高、最低丰度分别出现在桃花岛和沈家门海域,微微型真核生物最高、最低丰度分别出现在桃花岛和六横岛海域。
表 1. 采样点生态因子 Table 1. The ecological factors of each sampling station
| Sampling station | Longitude | Latitude | T/℃ | DO/ (mg/L) | Saliniy/ ‰ | NH3-N/ (mg/L) | PO43–/ (mg/L) | NO3–/ (mg/L) | SiO32–/ (mg/L) | Picoplankton abundance (cells/mL) | ||
| HB (×106) | Syn (×105) | Picoeuk (×104) | ||||||||||
| DJ | 122.69°E | 30.19°N | 27.0 | 8.78 | 27 | 0.648 | 0.026 | 1.001 | 1.475 | 5.90 | 2.15 | 1.32 |
| SJM | 122.32°E | 29.94°N | 26.6 | 6.39 | 29 | 0.571 | 0.030 | 0.79 | 1.171 | 1.65 | 0.39 | 0.32 |
| GQ | 122.81°E | 30.72°N | 26.9 | 7.21 | 30 | 0.621 | 0.028 | 0.902 | 0.785 | 7.41 | 1.28 | 1.68 |
| DS | 122.11°E | 30.27°N | 27.7 | 7.26 | 29 | 0.579 | 0.026 | 0.687 | 0.639 | 1.69 | 0.43 | 1.65 |
| ZJJ | 122.41°E | 29.92°N | 27.7 | 8.63 | 30 | 0.586 | 0.030 | 0.648 | 0.623 | 6.58 | 2.84 | 1.27 |
| JT | 121.85°E | 30.07°N | 28.7 | 6.95 | 21 | 0.580 | 0.036 | 0.727 | 0.639 | 0.24 | 6.33 | 0.34 |
| LH | 122.11°E | 29.79°N | 33.5 | 7.01 | 27 | 0.538 | 0.021 | 0.593 | 1.072 | 2.45 | 1.05 | 0.24 |
| TH | 122.30°E | 29.81°N | 28.2 | 10.78 | 30 | 0.575 | 0.034 | 0.628 | 0.639 | 5.23 | 6.62 | 3.59 |
| DJ: Dongji Island (东极岛); GQ: Gouqi Island (枸杞岛); JT: Jintang Island (金塘岛); LH: Liuheng Island (六横岛); SJM: Shenjiamen (沈家门); TH: Taohua Island (桃花岛); ZJJ: Zhujiajian (朱家尖); DS: Daishan Island (岱山岛). HB (heterotrophic bacteria); Syn (Synechococcus); Picoeuk (Picoeukaryotes). | ||||||||||||
表选项
2.2 细菌丰度和多样性 首先,流式细胞仪计数结果如表 1所示,根据计数结果显示,枸杞岛海域异养细菌(Heterotrophic bacteria; HB)丰度(7.41×106 cells/mL)最高,其次为朱家尖海域(6.58×106 cells/mL),金塘岛海域HB丰度(0.24×106 cells/mL)最低,平均丰度为3.89×106 cells/mL,说明舟山群岛海域夏季HB丰度非常高。从流式细胞仪计数情况来看各站位所在海域的HB丰度情况:GQ>ZJJ>DJ>TH>LH>DS>SJM>JT。其次,样品的稀释曲线可以比较测序数据量不同的样本中物种的丰富度,也可以用来说明样本的测序数据量是否合理(图 2)。如图所示,当测序深度达到30000条时,所有曲线都基本趋于平缓,说明测序深度已经足够,进一步测序对新OTU的产生贡献不大。本次实验平均每个样品的测序深度都超过了35000条(表 2),一共获取了5036个OTU,基本上覆盖了全部的OTU (0.994–0.997)。从稀释曲线显然易见,当测序深度一致时,各海域细菌丰富度排序为:LH>JT>DS>SJM>DJ>ZJJ>GQ>TH,但是随着测序深度增加,ZJJ的丰富度已经超越DJ。
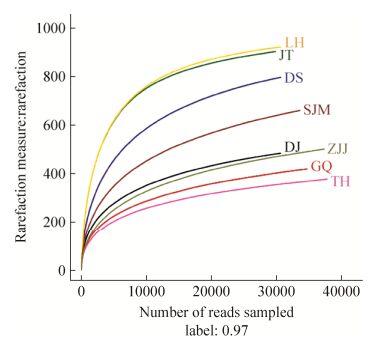 |
| 图 2 97%相似水平下样品的稀释性曲线 Figure 2 Rarefaction curves of the 97% similarity level. DJ: Dongji Island (东极岛); GQ: Gouqi Island (枸杞岛); JT: Jintang Island (金塘岛); LH: Liuheng Island (六横岛); SJM: Shenjiamen (沈家门); TH: Taohua Island (桃花岛); ZJJ: Zhujiajian (朱家尖); DS: Daishan Island (岱山岛). |
| 图选项 |
表 2. 97%相似水平下8个海水样品的OTU丰度和多样性情况 Table 2. Richness and diversity at the 97% similarity level in the 8 seawater samples
| Sample | Optimized reads | OTUs | ACE | Chao 1 | Shannon | Simpson | Coverage |
| LH | 36878 | 922 | 972.405 | 987.000 | 5.358 | 0.013 | 0.997 |
| JT | 39234 | 903 | 956.620 | 986.630 | 5.377 | 0.011 | 0.996 |
| DS | 34340 | 797 | 930.760 | 932.255 | 4.789 | 0.022 | 0.994 |
| SJM | 38903 | 660 | 839.579 | 835.161 | 4.275 | 0.035 | 0.995 |
| DJ | 38866 | 501 | 596.656 | 601.159 | 4.038 | 0.047 | 0.996 |
| ZJJ | 39608 | 484 | 647.189 | 659.641 | 3.686 | 0.059 | 0.996 |
| GQ | 38436 | 419 | 529.663 | 536.283 | 3.667 | 0.075 | 0.997 |
| TH | 39222 | 377 | 470.503 | 485.279 | 3.760 | 0.045 | 0.997 |
| DJ: Dongji Island (东极岛); GQ: Gouqi Island (枸杞岛); JT: Jintang Island (金塘岛); LH: Liuheng Island (六横岛); SJM: Shenjiamen (沈家门); TH: Taohua Island (桃花岛); ZJJ: Zhujiajian (朱家尖); DS: Daishan Island (岱山岛). | |||||||
表选项
另外,Chao1指数和ACE指数用来反映菌群丰度(表 2)。Shannon指数和Simpson指数可用来进行菌群多样性评估,Shannon指数越大,说明物种多样性越高,Simpson指数值越高,说明群落中的各种个体分配越均匀,指示群落多样性越好。OTU数量、ACE和Chao1指数所反映出的细菌丰度与多样性情况与稀释曲线反映的情况吻合。
2.3 细菌群落组成及结构 从OTU聚类结果来看,本次实验共得到29个门(Phyla),62个纲(Class),138个目(Order),239个科(Family),415个属(Genus)。其中丰度较高的细菌门(图 3)分别是:Proteobacteria (变形菌门)、Bacteroidetes (拟杆菌门)、Cyanobacteria (蓝藻门)、Actinobacteria (放线菌门)、Parcubacteria、Chloroflexi (绿弯菌门)和Gemmatimonadetes (芽单胞菌门)。除GQ站点外,Proteobacteria是占有绝对优势的细菌门,其次是Bacteroidetes,Proteobacteria在各站位海域中的比例分别为:LH (66.62%)、JT (66.16%)、SJM (57.96%)、DJ (47.62%)、DS (47.20%)、TH (38.18%)、ZJJ (34.56%)。GQ站点海域与其他海域情况正好相反,其优势菌门是Bacteroidetes (54.95%),其次是Proteobacteria (34.30%)。各海域中出现最少的细菌门为Gemmatimonadetes,其中GQ海域没有检测到该菌门,TH海域仅检测到1个OTU。
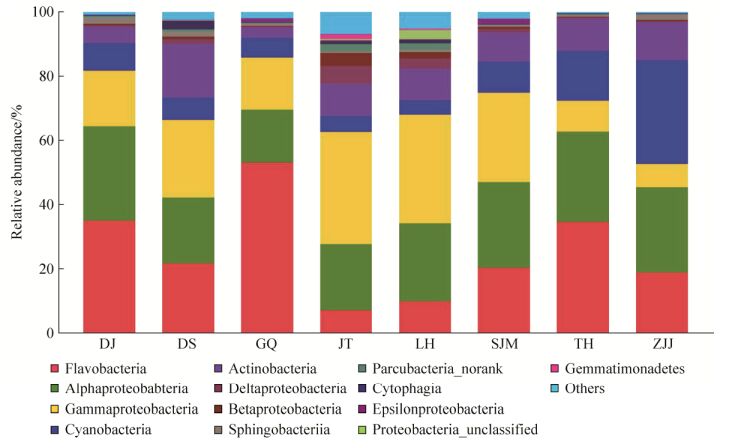 |
| 图 3 8个海水样品纲水平的群落结构 Figure 3 Community structure in the 8 seawater samples at the class level. DJ (东极岛), GQ (枸杞岛), JT (金塘岛), LH (六横岛), SJM (沈家门), TH (桃花岛), ZJJ (朱家尖), DS (岱山岛). |
| 图选项 |
本文还在纲水平详细比较了各站点的细菌组成和结构差异(图 3)。图 3可以明显看出DJ、GQ、TH站点的优势种群为Flavobacteria (34.68%–53.13%),DS、JT、LH、SJM的优势种群为Gammaproteobacteria (24.13%–34.93%),Cyanobacteria作为ZJJ的优势种群(32.16%),在其他站点所在海域丰度却比较低(4.42%–15.44%)。细菌群落结构多样而且复杂,图 3中各种菌纲所占据的比例不尽相同,足以说明各海区细菌群落组成各异,结构多样。
2.4 细菌群落间相似性分析 多样本相似度树状图可以利用树枝结构描述和比较多个样本间的相似性和差异关系,是一种基于beta多样性距离矩阵进行层次聚类(Hierarchical cluatering)的分析[25]。本文基于OTU水平构建物种相似树图(图 4),物种相似树反映出的情况可以在class水平上取得比较好的解释。如图所示,JT和LH相似性最高,又与其他各站点区分性较大,这一特点与其都是以Gammaproteobacteria为优势菌纲(>30%)相吻合。ZJJ和TH相似性较高,聚在一支,源于Alphaproteobacteria作为他们的优势菌纲(>25%)之一。SJM和GQ之间的相似性相对于剩余的其他各站位稍高,源于他们都是以Flavobacteria为优势菌纲(>20%)之一。
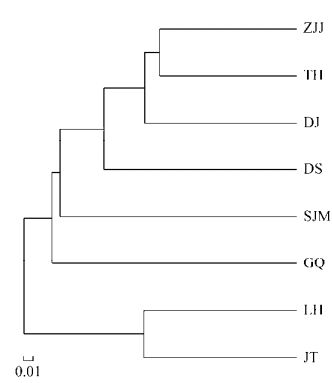 |
| 图 4 基于OTU的样品间聚类关系树 Figure 4 Similarity tree based on the OTUs of the 8 seawater sample. DJ: Dongji Island (东极岛); GQ: Gouqi Island (枸杞岛); JT: Jintang Island (金塘岛); LH: Liuheng Island (六横岛); SJM: Shenjiamen (沈家门); TH: Taohua Island (桃花岛); ZJJ: Zhujiajian (朱家尖); DS: Daishan Island (岱山岛). |
| 图选项 |
Heatmap图[23]可以将高丰度和低丰度的物种分块聚集,通过颜色梯度及相似程度来直观地反映多个样本在各分类水平上群落组成的相似性和差异性。本文在门水平构建丰度相似性热图(图 5),图中颜色越深说明该细菌门类丰度越高,该图验证了Proteobacteria菌门是绝对的优势菌门。该图也直观地展示出了各菌门在各站点的丰度分布情况。如Cyanobacteria在ZJJ站点的丰度较高(>30%),而在其他站点则相对较低。Gemmatimonadetes、Planctomycetes在JT、LH站点分布较高,而在其他6个站点丰度极低。
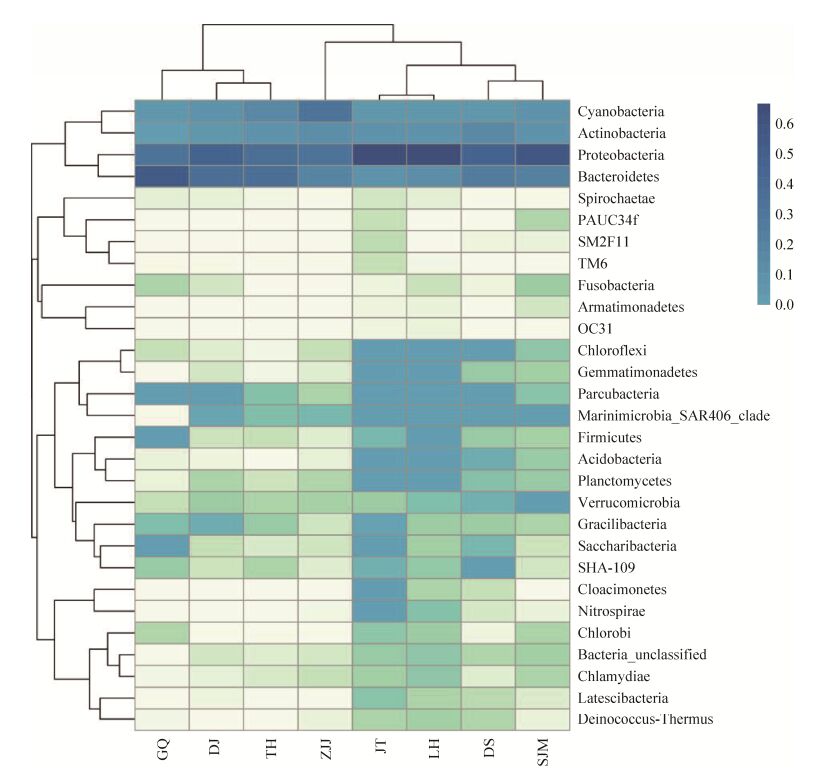 |
| 图 5 8个样品的丰度相似性热图 Figure 5 Heatmap of the 8 seawater samples based on the similar abundance of the 29 phyla. DJ: Dongji Island (东极岛); GQ: Gouqi Island (枸杞岛); JT: Jintang Island (金塘岛); LH: Liuheng Island (六横岛); SJM: Shenjiamen (沈家门); TH: Taohua Island (桃花岛); ZJJ: Zhujiajian (朱家尖); DS: Daishan Island (岱山岛). |
| 图选项 |
目前,关于细菌功能预测的研究逐渐显现[26]。Langille等[24]首次提出基于picrust软件平台,利用基因测序所得的16S rRNA基因全长序列信息推断其功能基因谱,通过与Greengenes数据库中的功能基因图谱比对,从而预测样本对应菌群的代谢功能图谱。本文利用picrust构建了各站位基于OTU的细菌功能预测的多样性热图(图 6),其表现出的组间进化关系与图 5反映的情况一致。总体来看,各海域中细菌功能多样性并非很高,主要包括7种:氨基酸代谢(Amino acid metabolism)、碳水化合物代谢(Carbohydrate metabolism)、膜运输(Membrane transport)、能量代谢(Energy metabolism)、复制和修复(Replication and repair)、辅酶和维生素的代谢(Metabolism of cofactors and vitamins)、转换(Translation)。其中ZJJ站位功能多样性明显高于其他站位,TH次之。
 |
| 图 6 8个站位细菌功能预测多样性热图 Figure 6 Heatmap of the 8 samples based on the similar abundance of the predicted functions. DJ: Dongji Island (东极岛); GQ: Gouqi Island (枸杞岛); JT: Jintang Island (金塘岛); LH: Liuheng Island (六横岛); SJM: Shenjiamen (沈家门); TH: Taohua Island (桃花岛); ZJJ: Zhujiajian (朱家尖); DS: Daishan Island (岱山岛). |
| 图选项 |
2.5 不同生境海域对细菌群落的响应 CCA用于揭示环境变量与细菌群落结构之间的关系。本文在门水平构建了细菌群落与环境因子之间的CCA分析图(图 7)。如图所示,NH3–N、NO3–与Actinobacteria、Cyanobacteria之间有着极强的正相关性,与其他菌门均呈现负相关性。温度与Proteobacteria、Parcubacteria之间存在较强的正相关性,SiO32–次之。DO和盐度与Gemmatimonadetes、Chloroflexi之间呈正相关性,其他菌门负相关。CCA分析图显示,在本研究海域PO43–具有其独特性,与Proteobacteria、Parcubacteria、Bacteroidetes之间呈现负相关性,与其他菌门呈较弱的正相关性。
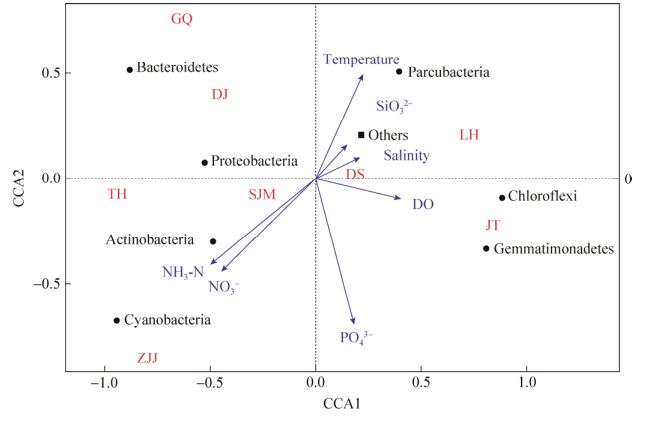 |
| 图 7 细菌群落与生态因子之间关系的CCA分析 Figure 7 CCA ordination diagram of different seawater samples associated with ecological factors. DJ: Dongji Island (东极岛); GQ: Gouqi Island (枸杞岛); JT: Jintang Island (金塘岛); LH: Liuheng Island (六横岛); SJM: Shenjiamen (沈家门); TH: Taohua Island (桃花岛); ZJJ: Zhujiajian (朱家尖); DS: Daishan Island (岱山岛). |
| 图选项 |
3 讨论和结论 海洋生态系统的健康多取决于海洋微生物群落的变化,而海洋细菌作为丰度最高的海洋微生物种群之一,必然对海洋生态系统的发展有着举足轻重的作用。通过不断探究海洋细菌群落结构及其对自然环境和人类活动的响应,必然有利于我国乃至国际海洋生态监测。
3.1 舟山群岛海域海洋微微型浮游生物丰度及碳生物量贡献 目前尚未出现关于舟山群岛细菌丰度及时空分布研究的报道,但我国****已对舟山群岛邻近海域(长江口及东海海域)进行了大量相关研究。刘材材等[27]对长江口异养细菌丰度分布研究发现长江口表层水体异养细菌丰度为(1.35–9.40)×105 cells/mL;Zhao等[28]对东海秋季赤潮和非赤潮期间微微型浮游生物丰度研究发现,非赤潮期间Synechococcus、Picoeukaryotes和heterotrophic bacteria的平均丰度分别为6.09×103 cells/cm3、1.02×103 cells/cm3和9.86×105 cells/cm3,赤潮期间的平均丰度分别为26.80×103 cells/cm3、2.95×103 cells/cm3和13.07×105 cells/cm3,两个时期的picoplankton丰度并无显著性差异。Zhao等[29]对秋季山东荣成桑沟湾海域海藻养殖区的picoplankton分布的研究发现,Synechococcus、Picoeukaryotes和heterotrophic bacteria的丰度为(11.04±11.85)×103 cells/cm3,(8.75±12.88)×103 cells/cm3和(8.2±3.24)×103 cells/cm3。本研究发现,舟山群岛各海域的Synechococcus、Picoeukaryotes和heterotrophic bacteria的丰度均值分别2.64×105 cells/mL、1.30×104 cells/mL和3.89×106 cells/mL,比其临近海域的picoplankton丰度稍高,在正常范围之内,也从侧面反映出舟山群岛海域细菌多样性可能比其邻近海域高。
各类微微型浮游生物的碳生物量(mg/m3)是由其丰度乘细胞碳含量得出,但不同种类细胞的碳含量不同。据了解,Synechococcus、Picoeukaryotes和heterotrophic bacteria的碳转换因子分别为175 fg/cell[30],1500 fg/cell[31]和20 fg/cell[32]。乐凤凤等[33]对2006年秋季长江口微微型浮游生物分布特征研究发现,Synechococcus、Picoeukaryotes和heterotrophic bacteria的碳生物量均值分别为(5.2±6.1) mg/m3、(1.4±0.9) mg/m3和(15.2±8.6) mg/m3(以碳计)。已有研究发现近岸海域特别是长江口海域的细菌丰度要比东海远离海岸海域的细菌丰度高[34-35]。舟山群岛海域海岛分布密集,作为典型的近岸海岸带海域,本研究已证明其picoplankton丰度略高于邻近海域,在相同海域面积下,其碳生物量必然远大于其邻近海域。因此,舟山群岛海域在海洋固碳方面起着巨大的作用。
3.2 舟山群岛海域细菌多样性及群落结构
3.2.1 高通量测序技术的应用: 高通量测序可以检测到非常稀有的物种[36],其提供的DNA序列数据或许可以作为海洋环境变化的指示器[37]。早前的细菌多样性研究主要应用传统的分离培养方法[38]、DGGE/TGGE[39-40]、构建克隆文库[35]、焦磷酸测序[41-42]等,其中依赖纯培养的方法只能揭示少部分种类的细菌[43]。现如今,高通量测序已经广泛应用于微生物多样性的研究之中。本文的高通量测序数据揭示了舟山群岛部分功能海域细菌的α多样性和β多样性,可为今后舟山群岛海域及其邻近东海海域的海洋微生物生态研究提供数据参考。本文关于海域功能区划所造成的细菌结构差异值得进一步研究。
3.2.2 海洋细菌多样性及群落结构: 近年来,国内外众多****围绕舟山群岛邻近海域开展的细菌群落结构研究成果丰硕,也为本文的研究提供了强有力的数据参考。如李和阳等[44]研究长江口典型站位浮游细菌的组成特征,结果发现变形菌门为该海域优势类群,此外,高G+C含量革兰氏阳性菌也是该站位细菌的主要类群之一。Liu等[45]对长江口及毗连东海海域的细菌群落结构的时空分布进行研究,结果发现γ-变形菌纲和黄杆菌纲为该海区优势菌群。Lu等[46]对中国东海及南海近海4采样点海水可培养细菌的多样性进行研究,结果发现东海分离菌株中α-变形菌占33.3%,γ-变形菌占57.2%,充分说明变形菌门也是该海域的优势菌群。本实验主要检测到4个优势类群,变形菌门(49.08%)、拟杆菌门(27.15%)、蓝藻门(10.97%)、放线菌门(高G+C含量革兰氏阳性菌,9.55%)。对比前人研究结果,舟山群岛邻近海域中主要的海洋菌群为变形菌门,这也与本研究结果基本一致。
关于海洋生态系统中变形菌门的研究已经颇为广泛。据报道,α-变形菌纲在近岸海域生态系统及受人类活动产生的各种颗粒影响频繁的海域中分布广泛[47-48]。这一特性在本研究中得以证实。例如,α-变形菌在ZJJ站位是优势菌群(26.46%),作者推测其原因可能是ZJJ作为捕捞区,捕捞作业过程中渔民及渔船产生大量的颗粒有机物可作为α-变形菌的营养物质,供其大量繁殖。α-变形菌也在港口区(SJM)表现出相对极高的优势性(26.57%),作者分析其可能与每天过往大量的游轮、货运船舶有关。γ-变形菌是海水特别是海洋沉积环境中的常见菌群,与海洋降硫过程密切相关。有研究发现γ-变形菌是海洋沉积环境中的绝对优势菌群,但在淡水和潮间带环境及海水环境中并无绝对优势[49-50]。本研究发现,γ-变形菌为JT、LH、SJM三个站位所在海域的优势菌群,这三个站位的共同特点是泥沙含量相对较高,海水尤为浑浊。该海域水文环境特殊[51],作者推测此现象可能源于海底覆盖层松散,而海潮流式较快,大量的海底泥沙被快速的急流、涡流上搅至浅水层。沉积环境中高比例的γ-变形菌群在表层海水中相应表现出来。δ-变形菌在甲烷转化方面起着重要作用[52],刘晓辉等[35]研究发现δ-变形菌与原油泄漏海域中可降解石油烃类有机物的脱硫杆菌高度相似,其认为δ-变形菌丰度可能与石油烃类污染呈正相关关系。JT作为舟山工业区,LH作为排污区,该两海域难免会受油污影响。本研究发现各站位δ-变形菌均呈现相对较低的丰度,但JT海域丰度相对最高占5.50%,LH次之占3.23%,其他海域均小于1.50%,验证了刘晓辉等的研究成果。
关于拟杆菌门、放线菌门和蓝藻门也是本次研究中分布比较广并且比例也较高的类群。本次实验观察到的拟杆菌主要是黄杆菌纲。黄杆菌作为海洋赤潮的“第一反应者”,专门负责生物聚合物的降解,在海洋生态系统中具有非常重要的意义[53-54]。黄杆菌靶向高分子量化合物,并且在浮游植物水华期间具有极高的丰度[53]。本研究中发现,黄杆菌在DJ (35.05%)、DS (21.73%)、GQ (53.13%)、TH (34.68%) 4个站位中为优势种。样品采集期间,DJ和GQ站位发生大面积赤潮,可能是引起该海域黄杆菌高丰度现象的原因。但是DS、TH采样海域并未观察到明显赤潮现象,作者推测可能某种不易观察到颜色的浮游植物大量繁殖或者赤潮现象刚刚消退。蓝藻作为海洋初级生产力和微食物网中重要的组成成分,是多种鱼类的饵料。本研究中观察到的蓝藻门主要为蓝藻纲,虽然分布广泛,但丰度相对不高(均10.97%)。但是蓝藻纲作为ZJJ海域的优势菌群,丰度达32.16%。8个站位中,放线菌门相对于变形菌门、拟杆菌门丰度要大大降低,与蓝藻门丰度接近,但在DS站放线菌纲表现出了较高的丰度(16.80%),DS作为盐田区,海水中盐度较高,作者猜想放线菌群是否与盐度之间存在相关性,有待进一步研究。
3.3 群落结构与环境变量之间的关系 细菌群落结构与环境变量之间有着密切的联系,不同尺度的环境因子必然导致细菌群落构成的多样性。不同的海区具有其独特的生态系统,促进浮游细菌生长分布的主要环境因子也各不相同。比较常被引用的环境因素主要包括水温、盐度、DO和无机营养盐等[55-57]。陈梦齐等[58]研究象山港电厂温排水对浮游细菌群落空间分布的影响发现,部分γ-变形菌分支的丰度随水温升高而升高。在本研究中,LH、JT水温明显高于其他站位,作者推测这也是该海域γ-变形菌群丰度极高的原因之一。Dong等[59]研究东海细菌群落结构发现,PO43–和SiO32–与深海区细菌群落之间表现出极强的正相关性,与其他中层、浅层海水菌群之间则表现出负相关性。本文观察到的现象与上述基本一致,由于本研究是采集表层水为研究对象,PO43–与各站位、各菌门之间呈现微正相关或者是负相关性。PO43–与中上层海水菌群之间的负相关机制值得****们的进一步深入研究。
3.4 海域细菌群落功能预测 Picrust是最新兴起的功能预测平台,越来越广泛地被应用于基因功能发掘。但目前细菌功能预测多应用于根际微生物群落研究[26]。但随着测序技术的广泛应用,探索海洋细菌群落功能是科研工作者的一个重要方向。针对海洋细菌功能预测结果,我们或许可以从一个新的思路去探讨海洋细菌的生态及应用价值。如ZJJ、TH和SJM海域发现细菌群落在氨基酸代谢、碳水化合物代谢方面都发挥着极强的作用。对于氨基酸代谢,异养细菌会利用各种含氮有机物(氨基酸、嘌呤、嘧啶等)作为碳源和能量[60],从而表明此三个站位海域在海洋固碳方面起到较强的积极作用。而关于碳水化合物代谢方面,有研究表明厚壁菌门细菌,如真杆菌属,可能在代谢碳水化合物方面扮演非常重要的角色[61],参考动物肠道菌群研究结果,部分拟杆菌门细菌基因组中存在许多编码糖苷水解酶和多糖裂解酶的基因,受编码的酶类能促进多糖的降解[62]。因此作者推断碳水化合物代谢较强的海域在降解部分有机物方面具有优势,而且,根据其降解碳水化合物特性,是否可以尝试研发相应海洋生物活性物质作为辅助多糖分解消化物质的添加剂。
虽然Picrust功能强大,预测精确,但也有其局限性。Greengenes数据库主要为纯培养微生物数据,而海洋菌群包含极大量不可培养物种。如果Greengenes数据库中没有同源物种的参考序列供测序序列参考比对,那么对应的物种将无法被预测。又如,高分类介元,如门、目,很难准确预测细菌的功能,即使同一个属的细菌生理功能也不尽相同。因此,海洋菌群的功能预测分析尚不成熟,本研究中功能预测部分仅为保守预测,尚不能作为重要结论处理。此项研究值得广大****进一步探索。
综上,作者认为将目前非常具有科研、应用价值的海洋微生物活性物质研究与细菌功能预测研究相结合,必将促进海洋微生物资源的深入利用。本文对舟山群岛海域细菌群落功能的首次探索结果,将为舟山临近海域今后在细菌基因功能研究方面提供一定参考。
References
| [1] | DeLong EF. The microbial ocean from genomes to biomes. Nature, 2009, 459(7244): 200-206. DOI:10.1038/nature08059 |
| [2] | Li SN, Wang XJ, Zhou J, Kong FX, Shi XL. Application of flow cytometry to enumerate small plankton. Journal of Lake Science, 2015, 27(5): 757-766. (in Chinese) 李胜男, 王秀娟, 周建, 孔繁翔, 史小丽. 利用流式细胞仪计数微型浮游生物的方法. 湖泊科学, 2015, 27(5): 757-766. DOI:10.18307/2015.0501 |
| [3] | Pedrós-Alió C. Marine microbial diversity:can it be determined?. Trends in Microbiology, 2006, 14(6): 257-263. DOI:10.1016/j.tim.2006.04.007 |
| [4] | Pommier T, Canb?ck B, Riemann L, Bostr?m KH, Simu K, Lundberg P, Tunlid A, Hagstr?m ?. Global patterns of diversity and community structure in marine bacterioplankton. Molecular Ecology, 2007, 16(4): 867-880. |
| [5] | Qu P, Wang ZL, Pang M, Fu MZ, Pu XM, Sun P, Xu ZJ. Influence of environmental factors on picoplankton in the southern Yellow Sea in summer. Acta Oceanologica Sinica, 2013, 35(4): 176-187. (in Chinese) 屈佩, 王宗灵, 庞敏, 傅明珠, 蒲新明, 孙萍, 徐宗军. 夏季南黄海主要环境因子对微微型浮游生物分布影响. 海洋学报, 2013, 35(4): 176-187. |
| [6] | Sch?ttner S, Hoffmann F, Cárdenas P, Rapp HT, Boetius A, Ramette A. Relationships between host phylogeny, host type and bacterial community diversity in cold-water coral reef sponges. PLoS One, 2013, 8(2): e55505. DOI:10.1371/journal.pone.0055505 |
| [7] | Comeau AM, Li WKW, Tremblay Jé, Carmack EC, Lovejoy C. Arctic ocean microbial community structure before and after the 2007 record sea Ice minimum. PLoS One, 2012, 6(11): e27492. |
| [8] | Luria CM, Ducklow HW, Amaral-Zettler LA. Marine bacterial, archaeal and eukaryotic diversity and community structure on the continental shelf of the western Antarctic Peninsula. Aquatic Microbial Ecology, 2014, 73(2): 107-121. DOI:10.3354/ame01703 |
| [9] | Bowman JS, Rasmussen S, Blom N, Deming JW, Rysgaard S, Sicheritz-Ponten T. Microbial community structure of Arctic multiyear sea ice and surface seawater by 454 sequencing of the 16S RNA gene. The ISME Journal, 2011, 6(1): 11-20. |
| [10] | Zhang DS, Liu ZS, Zhang HF, Wang XG, Wang CS. Diversity of anaerobic ammonium oxidizing bacteria in marine sediments from the Zhoushan Islands. Acta Ecologica Sinica, 2015, 35(19): 6250-6258. (in Chinese) 张东声, 刘镇盛, 张海峰, 王小谷, 王春生. 舟山群岛海域沉积物厌氧氨氧化细菌多样性. 生态学报, 2015, 35(19): 6250-6258. |
| [11] | Yin BY, Zhang SY. A preliminary study on the composition of bacterial community in the seaweed bed sediment of Gouqi Island. Journal of Shanghai Ocean University, 2011, 20(1): 126-130. (in Chinese) 尹冰玉, 章守宇. 枸杞岛海藻场沉积物细菌群落组成的初步研究. 上海海洋大学学报, 2011, 20(1): 126-130. |
| [12] | Jiang XB, Cheng H, Zhang LP, Wang YJ, Li WJ, Zhang R. Studies on the species and antimicrobial sensitivity of marine bacteria off Zhoushan Archipelago. Chinese Journal of Nautical Medicine and Hyperbaric Medicine, 2014, 21(5): 336-339. (in Chinese) 蒋学兵, 成海, 张立萍, 王燕菊, 李文静, 张蓉. 舟山群岛海域海洋细菌种类与药物敏感性研究. 中华航海医学与高气压医学杂志, 2014, 21(5): 336-339. |
| [13] | Peng M, Wu JX, Xie LF, Song WH, Wang LF. Study on Zhoushan marine function zoning. Journal of Zhejiang Ocean University (Natural Science Edition), 2011, 30(3): 264-268. (in Chinese) 彭苗, 吴佳兴, 谢立峰, 宋伟华, 王蕾飞. 舟山市海洋功能区划研究. 浙江海洋学院学报(自然科学版), 2011, 30(3): 264-268. |
| [14] | Ni ZX, Huang XP, Zhang X. Picoplankton and virioplankton abundance and community structure in Pearl River Estuary and Daya Bay, South China. Journal of Environmental Sciences, 2015, 32: 146-154. DOI:10.1016/j.jes.2014.12.019 |
| [15] | Jiao NZ, Yang YH. Simultaneous monitoring of autotrophic picoplankton and heterotrophic bacteria. Oceanologia et Limnologia Sinica, 1999, 30(5): 506-511. (in Chinese) 焦念志, 杨燕辉. 四类海洋超微型浮游生物的同步监测. 海洋与湖沼, 1999, 30(5): 506-511. |
| [16] | Xu N, Tan GC, Wang HY, Gai XP. Effect of biochar additions to soil on nitrogen leaching, microbial biomass and bacterial community structure. European Journal of Soil Biology, 2016, 74: 1-8. DOI:10.1016/j.ejsobi.2016.02.004 |
| [17] | Liu SP, Luo ZY. Agarose gel electrophoresis technique. Practical Preventive Medicine, 2006, 13(4): 1068-1069. (in Chinese) 刘水平, 罗志勇. 琼脂糖凝胶电泳实验技巧. 实用预防医学, 2006, 13(4): 1068-1069. |
| [18] | Qin N, Li DF, Yang RF. Next-generation sequencing technologies and the application in microbiology——a review. Acta Microbiologica Sinica, 2011, 51(4): 445-457. (in Chinese) 秦楠, 栗东芳, 杨瑞馥. 高通量测序技术及其在微生物学研究中的应用. 微生物学报, 2011, 51(4): 445-457. |
| [19] | Wang L, Li B, Zhu J. Review of High-throughput sequencing techniques in studies of constructedwetland microbial diversity. Chinese Agricultural Science Bulletin, 2016, 32(5): 10-15. (in Chinese) 王林, 李冰, 朱健. 高通量测序技术在人工湿地微生物多样性研究中的研究进展. 中国农学通报, 2016, 32(5): 10-15. DOI:10.11924/j.issn.1000-6850.casb15090065 |
| [20] | Hagstr?m ?, Pommier T, Rohwer F, Simu K, Stolte W, Svensson D, Zweifel UL. Use of 16S ribosomal DNA for delineation of marine bacterioplankton species. Applied and Environmental Microbiology, 2002, 68(7): 3628-3633. DOI:10.1128/AEM.68.7.3628-3633.2002 |
| [21] | Amato KR, Yeoman CJ, Kent A, Righini N, Carbonero F, Estrada A, Gaskins HR, Stumpf RM, Yildirim S, Torralba M, Gillis M, Wilson BA, Nelson KE, White BA, Leigh SR. Habitat degradation impacts black howler monkey (Alouatta pigra) gastrointestinal microbiomes. The ISME Journal, 2013, 7(7): 1344-1353. DOI:10.1038/ismej.2013.16 |
| [22] | Wang K, Ye XS, Zhang HJ, Chen HP, Zhang DM, Liu L. Regional variations in the diversity and predicted metabolic potential of benthic prokaryotes in coastal northern Zhejiang, East China Sea. Scientific Reports, 2016, 6: 38709. DOI:10.1038/srep38709 |
| [23] | Jami E, Israel A, Kotser A, Mizrahi I. Exploring the bovine rumen bacterial community from birth to adulthood. The ISME Journal, 2013, 7(6): 1069-1079. DOI:10.1038/ismej.2013.2 |
| [24] | Langille MGI, Zaneveld J, Caporaso JG, McDonald D, Knights D, Reyes JA, Clemente JC, Burkepile DE, Thurber RLV, Knight R, Beiko RG, Huttenhower C. Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences. Nature Biotechnology, 2013, 31(9): 814-821. DOI:10.1038/nbt.2676 |
| [25] | Jiang XT, Peng X, Deng GH, Sheng HF, Wang Y, Zhou HW, Tam NFY. Illumina sequencing of 16S rRNA tag revealed spatial variations of bacterial communities in a Mangrove Wetland. Microbial Ecology, 2013, 66(1): 96-104. DOI:10.1007/s00248-013-0238-8 |
| [26] | Wu ZX, Hao ZP, Sun YQ, Guo LP, Huang LQ, Zeng Y, Wang Y, Yang L, Chen BD. Comparison on the structure and function of the rhizosphere microbial community between healthy and root-rot Panax notoginseng. Applied Soil Ecology, 2016, 107: 99-107. DOI:10.1016/j.apsoil.2016.05.017 |
| [27] | Liu CC, Xiang LY, Zhang HF, Wang JH. Distribution and relationship between heterotrophic bacteria and environmental factors in Changjiang Estuary. Marine Environmental Science, 2009, 28(S1): 1-4. (in Chinese) 刘材材, 项凌云, 张昊飞, 王金辉. 长江口异养细菌生态分布特征及其与环境因子的关系. 海洋环境科学, 2009, 28(S1): 1-4. |
| [28] | Zhao L, Zhao Y, Xu JH, Zhang WC, Huang LF, Jiang JZ, Fang JG, Xiao T. Distribution and seasonal variation of picoplankton in Sanggou Bay, China. Aquaculture Environment Interactions, 2016, 8: 261-271. DOI:10.3354/aei00168 |
| [29] | Zhao Y, Zhao L, Zhang WC, Sun J, Huang LF, Li J, Zhai HC, Liu SM, Xiao T. Variations of picoplankton abundances during blooms in the East China Sea. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 2016, 124: 100-108. DOI:10.1016/j.dsr2.2015.03.010 |
| [30] | Veldhuis MJW, Timmermans KR, Croot P, van der Wagt B. Picophytoplankton; a comparative study of their biochemical composition and photosynthetic properties. Journal of Sea Research, 2005, 53(1/2): 7-24. |
| [31] | Zubkov MV, Sleigh MA, Tarran GA, Burkill PH, Leakey RJG. Picoplanktonic community structure on an Atlantic transect from 50°N to 50°S. Deep Sea Research Part Ⅰ:Oceanographic Research Papers, 1998, 45(8): 1339-1355. DOI:10.1016/S0967-0637(98)00015-6 |
| [32] | Cho BC, Azam F. Biogeochemical significance of bacterial biomass in the ocean's euphotic zone. Marine Ecology Progress, 1990, 63(2/3): 253-259. |
| [33] | Le FF, Liu CG, Hao Q, Shi JX, Zhai HC. Distribution and environmental impact factors of picoplankton in Changjiang River Estuary and its adjacent sea areas in autumn of 2006. Journal of Marine Sciences, 2011, 29(3): 108-117. (in Chinese) 乐凤凤, 刘诚刚, 郝锵, 史君贤, 翟红昌. 2006年秋季长江口及邻近海域微微型浮游生物的分布特征及环境影响因素. 海洋学研究, 2011, 29(3): 108-117. |
| [34] | Chen BZ, Huang BQ, Xie YY, Guo C, Song SQ, Li HB, Liu HB. The bacterial abundance and production in the East China Sea:seasonal variations and relationships with the phytoplankton biomass and production. Acta Oceanologica Sinica, 2014, 33(9): 166-177. (in Chinese) 陈炳章, 黄邦钦, 谢聿原. 东海细菌丰度和生产力的季节变化及与浮游植物生物量和生产力的关系(英文). 海洋学报, 2014, 33(9): 166-177. |
| [35] | Liu XH, Wang JX, Wang SB, Fan YP, Yu KC, Jiang R, Liu MH. Bacterial diversity and community structure in surface seawater of Changjiang river estuary and adjacent areas. Oceanologia et Limnologia Sinica, 2015, 46(6): 1531-1541. (in Chinese) 刘晓辉, 王健鑫, 王帅兵, 樊英萍, 俞凯成, 蒋然, 刘明华. 长江口及邻近海域表层海水细菌多样性及群落结构. 海洋与湖沼, 2015, 46(6): 1531-1541. |
| [36] | Pedrós-Alió C. The rare bacterial biosphere. Annual Review of Marine Science, 2012, 4: 449-466. DOI:10.1146/annurev-marine-120710-100948 |
| [37] | Kirchman DL, Cottrell MT, Lovejoy C. The structure of bacterial communities in the western Arctic Ocean as revealed by pyrosequencing of 16S rRNA genes. Environmental Microbiology, 2010, 12(5): 1132-1143. DOI:10.1111/emi.2010.12.issue-5 |
| [38] | Rappé MS, Connon SA, Vergin KL, Giovannoni SJ. Cultivation of the ubiquitous SAR11 marine bacterioplankton clade. Nature, 2002, 418(6898): 630-633. DOI:10.1038/nature00917 |
| [39] | Muyzer G, Smalla K. Application of denaturing gradient gel electrophoresis (DGGE) and temperature gradient gel electrophoresis (TGGE) in microbial ecology. Antonie van Leeuwenhoek, 1998, 73(1): 127-141. DOI:10.1023/A:1000669317571 |
| [40] | Vaz-Moreira I, Egas C, Nunes OC, Manaia CM. Bacterial diversity from the source to the tap:a comparative study based on 16S rRNA gene-DGGE and culture-dependent methods. FEMS Microbiology Ecology, 2013, 83(2): 361-374. DOI:10.1111/1574-6941.12002 |
| [41] | Zhang T, Shao MF, Ye L. 454 pyrosequencing reveals bacterial diversity of activated sludge from 14 sewage treatment plants. The ISME Journal, 2011, 6(6): 1137-1147. |
| [42] | Sundberg C, Al-Soud WA, Larsson M, Alm E, Yekta SS, Svensson BH, S?rensen SJ, Karlsson A. 454 pyrosequencing analyses of bacterial and archaeal richness in 21 full-scale biogas digesters. FEMS Microbiology Ecology, 2013, 85(3): 612-626. DOI:10.1111/1574-6941.12148 |
| [43] | Du P, Liu JJ, Zeng JN, Chen QZ, Jiang ZB, Zhu XY. Spatial distribution patterns of heterotrophic, nitrogen, and phosphate bacteria in hypoxic zone of Yangtze River Estuary. Chinese Journal of Applied Ecology, 2011, 22(5): 1316-1324. (in Chinese) 杜萍, 刘晶晶, 曾江宁, 陈全震, 江志兵, 朱旭宇. 长江口低氧区异养细菌及氮磷细菌分布. 应用生态学报, 2011, 22(5): 1316-1324. |
| [44] | Li HY, Chen MX, Jiao NZ. The community composition of bacterioplankton at typical station in the Changjiang Estuary. Acta Oceanologica Sinica, 2012, 34(1): 183-188. (in Chinese) 李和阳, 陈明霞, 焦念志. 长江口典型站位浮游细菌类群的组成特征研究. 海洋学报, 2012, 34(1): 183-188. |
| [45] | Liu M, Xiao T, Wu Y, Zhou F, Huang HQ, Bao SX, Zhang WC. Temporal distribution of bacterial community structure in the Changjiang Estuary hypoxia area and the adjacent East China Sea. Environmental Research Letters, 2012, 7(2): 025001. DOI:10.1088/1748-9326/7/2/025001 |
| [46] | Lu JW, Zhang XQ, Du LL, Yang ZJ, Wu M, Lu LD. Bacterial isolation and diversity analysis of four seawater sampling sites of the East China Sea and the South China Sea. Journal of Zhejiang University (Science Edition), 2012, 39(4): 443-449. (in Chinese) 卢婧雯, 张心齐, 杜丽丽, 杨志坚, 吴敏, 卢龙斗. 中国东海及南海近海4采样点海水可培养细菌的多样性研究. 浙江大学学报(理学版), 2012, 39(4): 443-449. |
| [47] | Alonso-Sáez L, Balagué V, Sà EL, Sánchez O, González JM, Pinhassi J, Massana R, Pernthaler J, Pedrós-Alió C, Gasol JM. Seasonality in bacterial diversity in north-west Mediterranean coastal waters:assessment through clone libraries, fingerprinting and FISH. FEMS Microbiology Ecology, 2007, 60(1): 98-112. DOI:10.1111/fem.2007.60.issue-1 |
| [48] | Papadatou M, Harder J. Bacterial diversity associated with anthropogenic particles and neuston in the surface layer of the East Atlantic Ocean//11th Panhellenic Symposium on Oceanography and Fisheries. Lesvos Island, Greece, 2016: 561-564. |
| [49] | Bowman JP, McCuaig RD. Biodiversity, community structural shifts, and biogeography of prokaryotes within Antarctic Continental Shelf Sediment. Applied and Environmental Microbiology, 2003, 69(5): 2463-2483. DOI:10.1128/AEM.69.5.2463-2483.2003 |
| [50] | Wang Y, Sheng HF, He Y, Wu JY, Jiang YX, Tam NFY, Zhou HW. Comparison of the levels of bacterial diversity in freshwater, intertidal wetland, and marine sediments by using millions of Illumina tags. Applied and Environmental Microbiology, 2012, 78(23): 8264-8271. DOI:10.1128/AEM.01821-12 |
| [51] | Bi PJ. Exploration and practice of maritime safety management in Zhoushan continental one-stage project. China High Technology Enterprises, 2007(10): 146. (in Chinese) 毕鹏军. 舟山大陆连岛一期工程海上安全管理的探索与实践. 中国高新技术企业, 2007(10): 146. DOI:10.3969/j.issn.1009-2374.2007.10.104 |
| [52] | Andreote FD, Jiménez DJ, Chaves D, Dias ACF, Luvizotto DM, Dini-Andreote F, Fasanella CC, Lopez MV, Baena S, Taketani RG, De Melo IS. The microbiome of Brazilian mangrove sediments as revealed by metagenomics. PLoS One, 2012, 7(6): e38600. DOI:10.1371/journal.pone.0038600 |
| [53] | Teeling H, Fuchs BM, Becher D, Klockow C, Gardebrecht A, Bennke CM, Kassabgy M, Huang SX, Mann AJ, Waldmann J, Weber M, Klindworth A, Otto A, Lange J, Bernhardt J, Reinsch C, Hecker M, Peplies J, Bockelmann FD, Callies U, Gerdts G, Wichels A, Wiltshire KH, Gl?ckner FO, Schweder T, Amann R. Substrate-controlled succession of marine bacterioplankton populations induced by a phytoplankton bloom. Science, 2012, 336(6081): 608-611. DOI:10.1126/science.1218344 |
| [54] | Williams TJ, Wilkins D, Long E, Evans F, de Maere MZ, Raftery MJ, Cavicchioli R. The role of planktonic Flavobacteria in processing algal organic matter in coastal East Antarctica revealed using metagenomics and metaproteomics. Environmental Microbiology, 2013, 15(5): 1302-1317. DOI:10.1111/emi.2013.15.issue-5 |
| [55] | Shish FK, Ducklow HW. Temperature regulation of heterotrophic bacterioplankton abundance, production, and specific growth rate in Chesapeake Bay. Limnology and Oceanography, 1994, 39(6): 1243-1258. DOI:10.4319/lo.1994.39.6.1243 |
| [56] | Cotner JB, Ammerman JW, Peele ER, Bentzen E. Cotner JB, Ammerman JW, Peele ER, Bentzen E. Phosphorus-limited bacterioplankton growth in the Sargasso Sea. Aquatic Microbial Ecology, 1997, 13(2): 141-149. |
| [57] | Bacelar-Nicolau P, Nicolau LB, Marques JC, Morgado F, Pastorinho R, Azeiteiro UM. Bacterioplankton dynamics in the Mondego estuary (Portugal). Acta Oecologica, 2003, 24(1): S67-S75. |
| [58] | Chen MQ, Liu ZD, Dai WF, Ye XS, Liang XY, Xiong JB. Effects of thermal discharge on the spatial distribution of bacterioplankton community near a power plant in Xiangshan Bay. Acta Ecologica Sinica, 2016, 36(20): 6574-6582. (in Chinese) 陈梦齐, 刘紫丹, 戴文芳, 叶仙森, 梁新友, 熊金波. 象山港电厂温排水增温对浮游细菌群落空间分布的影响. 生态学报, 2016, 36(20): 6574-6582. |
| [59] | Dong Y, Zhao Y, Zhang WY, Li Y, Zhou F, Liu CG, Wu Y, Liu SM, Zhang WC, Xiao T. Bacterial diversity and community structure in the East China Sea by 454 sequencing of the 16S rRNA gene. Chinese Journal of Oceanology and Limnology, 2014, 32(3): 527-541. DOI:10.1007/s00343-014-3215-2 |
| [60] | Shi W, Liu LR, Su XR. Studies on the metabolism procedure of some amino acids in the bacteria along the coast of Zhejiang Province. Reservoir Fisheries, 2007, 27(2): 22-23. (in Chinese) 史薇, 刘乐然, 苏秀榕. 浙江沿海细菌芳香族氨基酸代谢途径的研究. 水利渔业, 2007, 27(2): 22-23. |
| [61] | Walker AW, Ince J, Duncan SH, Webster LM, Holtrop G, Ze XL, Brown D, Stares MD, Scott P, Bergerat A, Louis P, McIntosh F, Johnstone AM, Lobley GE, Parkhill J, Flint HJ. Dominant and diet-responsive groups of bacteria within the human colonic microbiota. The ISME Journal, 2010, 5(2): 220-230. |
| [62] | Kaoutari AE, Armougom F, Gordon JI, Raoult D, Henrissat B. The abundance and variety of carbohydrate-active enzymes in the human gut microbiota. Nature Reviews Microbiology, 2013, 11(7): 497-504. DOI:10.1038/nrmicro3050 |
