白云鹏, 程欢, 许建和


华东理工大学, 生物反应器工程国家重点实验室, 上海 200237
收稿日期:2017-03-28;修回日期:2017-05-25;网络出版日期:2017-06-26
基金项目:上海市浦江人才计划(15PJ1401200);国家自然科学基金(21536004,21505044)
*通信作者:许建和, Tel/Fax:+86-21-64250840;E-mail:jianhexu@ecust.edu.cn
摘要:有机磷化合物是一类广泛用作杀虫剂、增塑剂、阻燃剂的有毒化学品,由于难以降解而在农产品、水体和土壤中逐渐累积,容易引发严重的食品安全和环境污染问题。有机磷的酶促降解具有反应速度高和绿色环保等优点,是当前的研究热点。本文综述了近年来在有机磷水解酶的挖掘、改造及应用方面的研究进展,提出了进一步发展所面临的挑战和未来的研究方向,旨在为有机磷化合物的生物降解研究提供参考。
关键词: 有机磷水解酶 理性设计 随机突变 高通量筛选 生物降解
Recent advances in discovery, engineering and applications of organophosphorus hydrolases
Yunpeng Bai, Huan Cheng, Jianhe Xu


State Key Laboratory of Bioreactor Engineering, East China University of Science and Technology, Shanghai 200237, China
Received 28 March 2017; Revised 25 May 2017; Published online 26 June 2017
*Corresponding author: Jianhe Xu, Tel/Fax:+86-21-64250840;E-mail:jianhexu@ecust.edu.cn
Supported by Shanghai Pujiang Program (15PJ1401200) and by the National Natural Science Foundation of China (21536004, 21505044)
Abstract: Organophosphorus compounds are highly toxic chemicals and widely used as insecticides, plasticizers and flame retardants. Due to the difficulty of degradation these toxic chemicals have gradually accumulated in agricultural products, waters and soils, raising serious public concerns regarding health, environment and food safety. The enzymatic degradation of organophosphorus compounds is highly efficient and environmental friendly, which is the current research hotspot. This paper reviewed recent advances in discovery, engineering and applications of organophosphorus hydrolases, and highlighted the current challenges and the future research directions with the aim to provide an insight into the biodegradation of organophosphorus compounds.
Key words: organophosphorus hydrolase rational design random mutagenesis high throughput screening biodegradation
有机磷化合物是人工合成的含磷高毒物质,包括磷酸酯类、磷酸硫醇酯类、膦酸或氨基磷酸酯类、V型和G型神经毒剂等多种类型(图 1)。自二次世界大战结束以来,有机磷化合物作为主要有效成分被广泛应用于农药、阻燃剂、增塑剂、化学武器等农业、工业和国防领域。有机磷酯能够与昆虫和哺乳动物体内的乙酰胆碱酯酶不可逆结合,导致神经系统紊乱,严重时致人死亡。由于自然界对此类化合物的降解能力有限,大量使用的有机磷化合物逐渐积累,造成了严重的食品和环境问题。有机磷化合物的降解始终是科学研究的热点,也是一项十分有挑战性的任务。
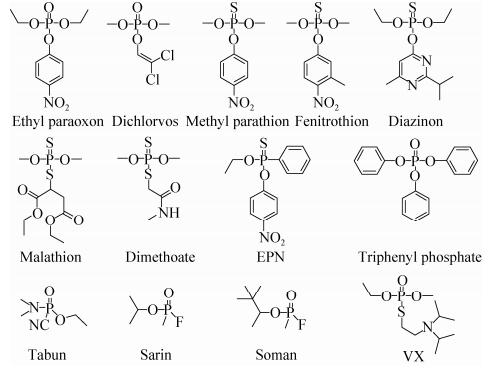 |
| 图 1 常见有机磷化合物的分子结构 Figure 1 Chemical structures of common organophosphorus compounds. |
| 图选项 |
微生物由于基因信息丰富、代谢途径多样、生长周期短,以其为代表的生物降解技术具有降解效率高、条件温和、价格低廉等优点,显示出了良好的应用前景。酶在微生物降解有机磷的过程中起到主要作用,其中有机磷水解酶(organophosphorushydrolase,OPH)催化酯键断裂,而生成的低毒性产物可被微生物进一步代谢。通过酶工程方法开发一系列广谱、高效的有机磷水解酶是研究的热点之一。本文总结了最近有机磷水解酶在资源挖掘、分子改造及应用方面的研究进展,着重介绍研究中所面临的关键科学问题和创新型方法,列出了有机磷水解酶在有机磷化合物生物检测和降解中的应用,并结合本实验室的研究进展对目前存在的挑战和未来的研究前景进行展望。
1 有机磷水解酶的基因挖掘 自上世纪70年代发现能降解有机磷的微生物后,从微生物体内克隆获取新酶是有机磷水解酶资源发掘的主要途径。根据国际生物化学与分子生物学学会的规则,这些酶被分为两类:一类是芳基二烷基磷酸酯酶(E.C. 3.1.8.1);另一类是二异丙基-氟磷酸酯酶(E.C. 3.1.8.2)。
1.1 芳基二烷基磷酸酯酶(E.C. 3.1.8.1) 磷酸三酯酶(phosphotriesterase, PTE)是首个从细菌opd基因中克隆得到的有机磷水解酶,对其结构和功能的研究最为深入。PTE的活性依赖于Zn2+离子,将其替换为Co2+后可使酶的活力提高近4倍[1]。PTE的底物谱较广,可以水解多种有机磷酸三酯、硫酯、氟磷酯和对硫磷,但几乎不能水解磷酸二酯。目前PTE的天然生理底物尚未确定,但已发现PTE具有混杂的内酯酶活性,而内酯化合物广泛存在于生物体内[2]。类似PTE的内酯酶(PTE-like lactonases, PLLs)与PTE有约30%的序列一致性,来源广泛,具有较低的有机磷水解活性,但其热稳定性一般高于PTE[3]。例如,最近从红球菌中克隆得到的N-酰基高丝氨酸内酯酶AhlA能够降解有机磷农药[4],说明该类酶与PTE在进化关系上具有相近性。
甲基对硫磷水解酶(methyl parathion hydrolase, MPH)是另一类研究较广泛的酶,其编码基因mpd与opd无同源性。陈亚丽等首先从农药污染土样中筛选得到一株可降解甲基对硫磷的假单胞菌WBC-3,对甲基对硫磷的耐受浓度在无机盐培养基中达到800 mg/L[5]。周宁一等从假单胞菌WBC-3中克隆的mpd基因在重组表达后,对甲基对硫磷的活力达12.71 U/mg[6]。最近,本实验室从农药厂旧址的土壤中分离筛选得到一株能高效水解甲基对硫磷的伯克氏属新菌种(Burkholderiajiangsuensis sp. nov)[7]。伍宁丰等克隆了来源于类产碱假单胞菌的有机磷降解酶基因ophc2,其与MPH的序列一致性为46%[8],随后在多个菌种中也都发现了类似的基因[9]。贾阳等从农药降解菌YC-YH1中克隆得到的MPH和有机磷水解酶OPHC2也具有较高的活力和稳定性,表明这些基因在微生物中广泛存在[10]。
哺乳动物血清中的对氧磷酶PON1和PON3也可以催化水解有机磷酸三酯化合物,而PON2几乎存在于所有的组织中,对高丝氨酸内酯具有水解活力。PON1是研究最充分的酶,它可以水解不同的底物,包括内酯、硫代内酯、酯、磷酸三酯等。最近的研究显示,活性位点附近的E53、D269与His115的协同作用对PON1活性起作用[11]。
除了有机磷农药,最近研究人员发现了一类可催化其他结构不同的有机磷化合物的水解酶,与PTE无序列一致性。2014年,Yoshio Kera等从鞘氨醇单胞菌属中发现卤代烷基磷酸酯水解酶Sb-PTE[12],能够降解磷酸三苯酯,催化效率高达2×106 mol/(L·s)[13]。磷酸三苯酯广泛用于阻燃剂、增塑剂、耐用塑料等,是一类新增的环境污染物,该酶的发现为有机磷降解开辟了新的应用前景。由于Sb-PTE能够降解非活化解离基团的磷酸三酯类化合物,表明其与传统的PTE具有不同的催化机理[14]。
1.2 二异丙基氟磷酸酯酶(E.C. 3.1.8.2) 二异丙基氟磷酸酯酶类主要包含以交替单胞菌(Alteromonas)来源为代表的有机磷酸酐酶(OPAA)和以欧洲乌贼(Loligo vulgaris)来源为代表的二异丙基氟磷酸酯酶(DFPase)。与PTE偏好水解P-O键和P-S键不同,OPAA对水解P-F键和P-CN键具有更高的活性。OPAA比PTE更容易重组表达和纯化,蛋白产量更高,使得OPAA成为具有解毒应用潜力的新酶[15]。DFPase来源于欧洲乌贼的神经节,在水和盐溶液中非常稳定,在pH 5-11和55 ℃以上均有活性,能够水解DFP、沙林、环沙林、梭曼和塔崩等神经毒剂。
有机磷水解酶因来源不同而导致活力差异很大,其中PTE及其同源酶OpdA的活力较高。有机磷水解酶对常用底物对氧磷的动力学参数如表 1所示。
表 1. 不同有机磷水解酶对对氧磷底物的动力学参数 Table 1. Kinetic parameters of various organophosphorus hydrolases against paraoxon
| Enzymes | kcat/(s-1) | KM/(mmol/L) | kcat/KM/mol/(L·s) | References |
| Pseudomonas diminuta PTE | 2100.00 | 0.200 | 4.0×107 | [1] |
| Pseudomonas sp. WBC-3 MPH a | 37.10 | 0.037 | 9.9×105 | [5] |
| Mammalian PON1 | 4.80 | 0.800 | 5.8×103 | [16] |
| Sulfolobus solfataricus SsoPox | 0.24 | 0.060 | 4.0×103 | [17] |
| Sulfolobus acidocaldarius SacPox | n.d. | n.d. | 9.0×102 | [18] |
| Deinococcus radiodurans Dr0930 | 0.07 | 1.400 | 0.83 | [19] |
| a Methyl parathion was used as the substrate. | ||||
表选项
2 有机磷水解酶的分子改造 由于从自然界中获得的天然酶往往活力不高或热稳定性不好,且部分酶在重组菌中可溶性表达较差,制约了有机磷水解酶的实际应用。为了解决这一问题,许多研究者致力于通过理性设计和随机突变等蛋白质工程手段对有机磷水解酶进行改造,以提高酶的催化性能。
2.1 提高催化效率 有机磷化合物近几十年才广泛使用,在微生物体内缺少结构类似物,因此有机磷水解酶是刚进化出来的“年轻”幼酶。例如,磷酸三酯酶是从结构有相似性的具有混杂活力的内酯酶PLLs进化而来。通过对PLLs的分子改造能够将其转变为具有高活力、高稳定性的有机磷水解酶。冯雁课题组对内酯酶GkaP进行定点突变和易错PCR随机突变筛选后,得到的突变体有机磷水解活力显著提高[20]。Raushel等通过多轮定向进化提高了DrPLL对多种有机磷化合物的催化效率[21]。Manco等通过交错延伸PCR将两种酶进行体外重组,使得新酶对于对氧磷的活力比母本提高了300倍[22]。本实验室对不同来源的AbOPH和BjMPH进行分子改造,前者对甲基对硫磷的活力实现了由0到1.68 U/mg的突破[23],后者的单突变体BjMPHT64N相对于母本的催化效率增加了3.78倍[24]。Blaha-Nelson等发现位于71位的酪氨酸突变对PON活力具有显著的影响,当酪氨酸被推到活性位点以外,使得活性口袋呈敞开状态时,导致了PON1的对氧磷活力增加,表明活性位点的疏水性是促进有机磷酯水解酶进化的关键[25]。
野生型PTE对有机磷神经毒剂的催化效率不能满足应用需求。为了提高PTE对神经毒剂的催化效率,通过构建活性口袋突变库和易错PCR突变库,筛选得到的PTE突变体对VX的水解速率可达7×104 mol/(L·s),比母本提高了230倍[26]。为了提高PTE对V型神经毒剂的水解活力,通过计算理性设计更小的突变库,利用乙酰胆碱酯酶AChE偶联筛选,最终得到的突变体对V型神经毒剂的催化效率最高可达105 mol/(L·s)[27]。问县芳等从铜绿假单胞菌克隆酶出发,通过定点突变提高了其降解神经毒剂模拟剂二异丙基氟磷酸酯的活力,比活达到218 U/mg,显示了较好的应用前景[28]。
超高通量筛选技术,例如流式细胞仪分选技术,也已应用于有机磷水解酶的定向进化。该技术大幅度增加了突变体的筛选速率和通量,1 h可筛选高达107个突变体。基本策略是采用合成生物学的手段在重组大肠杆菌中引入包含转录因子DmpR、启动子和荧光报告蛋白模块,构建整细胞生物传感器(图 2-A)。DmpR可结合有机磷水解产生的酚类产物,启动下游绿色荧光蛋白的表达,产生可供分析与筛选的荧光信号[29]。基于这一原理,Kim等对来自Pseudomonas sp. WBC-3的MPH进行了三轮定向进化,最终的三突变体对于对硝基苯酚磷酸二苯酯(G型神经毒剂类似物)的活力提高了100倍[30]。他们对具有内酯酶活力的AiiA构建了相似的基因回路,经过三轮定向进化使其活力提高了31倍[31]。Lee等利用基于整细胞生物传感的筛选方法从土壤中筛选得到具有磷酸酯酶活力的菌株[32]。
 |
| 图 2 有机磷整细胞生物传感器(A)及单细胞高通量筛选示意图(B) Figure 2 Schematic illustration of the whole-cell biosensor for detecting organophosphorus compounds (A) andthe high throughput screening of single cells using droplet microfluidics (B). |
| 图选项 |
基于荧光分析的微液滴筛选技术也可用于有机磷水解酶的定向进化(图 2-B)。Hollfelder等将表达PTE的重组大肠杆菌包裹于聚电解质凝胶的壳层微囊中,利用荧光生色底物和流式细胞仪筛选得到一株PTE突变体,其对于对氧磷底物的活力为母本的8倍[33]。杨广宇等利用基于体外区域化荧光激活细胞分选(IVC-FACS)的方法, 对包括有机磷水解酶的多种水解酶进行定向进化,通过对筛选底物的分子设计,使其严格控制酶反应,减小液滴间的相互作用和降低背景荧光,从而提高了筛选方法的可靠性[34]。
2.2 拓宽酶的底物谱 具有混杂活力的内酯酶可以通过分子改造提高其对某一种有机磷的催化活力,改变其底物偏好性,使其能够水解更多种类的有机磷化合物。本实验室采用基因挖掘的方法,从食油假单胞菌(Pseudomonas oleovorans)中挖掘到一种新型内酯酶PoOPH,经序列共义性分析,揭示250位和263位氨基酸可能是决定催化活力和底物专一性的关键位点,经基因突变后发现PoOPHH250I/I263W对甲基对硫磷和乙基对氧磷的活力分别提高了6962倍和106倍[35]。
PoOPH虽然对甲基对硫磷具有较高的催化效率,但对常用农药马拉硫磷的水解活力却很低,因此我们希望通过分子改造提高其对马拉硫磷的催化活力。为了尽快实现这一目标,我们提出分层次迭代突变策略(hierarchical iteration mutagenesis,HIM)。该策略将酶分子分为3个层次:核心壳层(距离催化中心5-8 ?),中间壳层(距离催化中心8-15 ?)以及表面壳层,如图 3所示。突变实验依次从内部向表面逐步进行迭代突变。第1轮采用组合活性位点饱和突变(CASTing)获得在活性中心最优的突变组合;第2轮采用易错PCR发现敏感位点,由于核心壳层已在第一轮进行过突变,新增的突变位点主要位于中间壳层;第3轮利用DNA重排将发现的敏感位点进行快速组合;第4轮根据计算机热失活能量模拟结果,对表面壳层氨基酸残基进行突变设计,提高突变体的稳定性。最终所得的突变体对马拉硫磷的催化活力提高了22倍[36]。
 |
| 图 3 PoOPHM2结构中氨基酸残基的分级 Figure 3 The hierarchy of amino acid residues in thePoOPHM2 structure. The core region ( < 8 ?), themantle region (8-15 ?), and the surface region (> 15 ?)are shown in red, blue and green, respectively. |
| 图选项 |
2.3 提高酶的表达量 磷酸三酯酶虽然能够高效水解有机磷酸酯类化合物,但是它们在大肠杆菌中难以实现可溶性表达。通过密码子优化和包涵体复性等手段可能提高可溶性蛋白的比例[37]。在大肠杆菌中过表达伴侣蛋白GroEL/GroES,显著提高了PTE的上清表达量,增强了酶突变体结构的稳定性[16]。Tawfik等通过DNA改组和筛选,第一次实现了PON1和PON3在大肠杆菌中可溶和功能表达,获得的突变体对于对氧磷的水解速率提高了40倍[38]。Li等在研究群体感应淬灭酶huPON2时,发现在大肠杆菌中的可溶性表达较差,通过同源建模发现去除H1?H3等疏水区域后能够有效地提高其可溶性,且并不影响该酶的催化性能[39]。
2.4 提高酶的稳定性 酶的稳定性是衡量其应用价值的重要参数。Baker和Montclare报道利用氟营养缺陷型E. coliAF-IQ将PTE中所有苯丙氨酸取代为非天然氨基酸氟苯丙氨酸,改造后的酶热稳定性获得了提高[40]。对该突变体进行从头设计,引入新的F104A突变,可进一步提高其热稳定性,最终所得的pFF-F104A突变体在室温放置7 d仍保留66%的活力[41]。蛋白表面的脯氨酸可能会影响酶的稳定性。例如,伍宁丰课题组利用同源模建和分子动力学模拟,在MPH中具有高度构象柔性的loop区进行G194P、G198P、G194P/G198P突变,结果突变体G194P提高了酶的热稳定性[42]。接着基于序列比对的结果,对上述MPH蛋白表面的Pro76和Pro78进行了定点突变,提高了酶的热稳定性,推测是由于新引入的氨基酸残基(Asp76和Lys78) 之间形成了一对离子键而对蛋白分子起到了稳定化作用[43]。在PTE蛋白表面用聚乙二醇进行共价修饰也可以提高酶的活性和稳定性[44]。
2.5 改变立体选择性 当有机磷酸酯化合物的2个取代基R1和R2不同时,则存在1对手性对映体。以Pseudomonasdiminuta PTE为例,对(-)型对映体的水解动力学常数要比(+)型对映体大1至2个数量级,而(+)型对映体能够更快地抑制人AChE的活性,显示出更大的毒性。根据酶-底物类似物的复合物结构,推断出底物3个不同亚基结合的氨基酸残基,包括小亚位点、大亚位点以及解离基团亚位点[45]。对PTE的这些氨基酸位点进行丙氨酸扫描突变实验,结果发现G60A突变体由于减小了小亚位点口袋,显著增加了立体选择性;而将Ile106、Ser308、Phe132突变为丙氨酸,由于增大了小亚位点或解离基团的口袋,因而消除了立体选择性。突变体的晶体结构解析和动力学模拟结果证实了上述推理[46]。类似的,在最近的研究中,通过理性设计PTE突变体,使其对于V型神经毒剂RVX的催化效率提高,同时其对映选择性也发生了反转[47]。
3 有机磷水解酶的应用研究 3.1 利用重组工程菌降解有机磷 早期人们将微生物直接加入到过滤生物反应器、膜反应器中降解水体中的有机磷化合物。随后,构建高效、广谱的工程菌株是生物降解技术的研究热点。Keasling课题组通过引入有机磷水解酶和对硝基苯酚降解酶系,构建了工程菌体内矿化对硫磷的通路,使其能够利用0.8 mmol/L对硫磷作为碳源和能量来源[48]。胞内表达的有机磷水解酶易受到细胞膜对底物传质的限制,细胞表面展示技术应用于大肠杆菌、酵母、假单胞菌等表达系统,提高了整细胞降解的效率和稳定性[49-50]。乔传令等将具有不同底物谱的MPH和PTE在大肠杆菌中共表达,所得重组菌株的整细胞活力比胞内表达菌株高出6倍,并且能在2周内保持100%的活性[51]。
3.2 利用固定化酶制剂降解有机磷 由于工程菌的环境影响难以估量,菌体存活率受环境因素的影响很大,因此工程菌的应用受到限制。目前研究者更加关注利用廉价、稳定和可重复使用的有机磷水解酶制剂进行生物降解。共价交联法是一种有效固定化酶、提高酶稳定性的策略。将PTE与活化的聚合物Pluronic F127共价交联后,固定化酶表现出比游离酶更高的活力和稳定性,室温下可储存3个月[52]。OpdA通过戊二醛与聚酯织物共价交联后稳定性提高,在4 ℃溶液中或干燥状态下储存1个月仍保持大部分的活力。固定OpdA的织物加入柱式反应器中,可重复使用2个月以上[53]。将OPHC2通过戊二醛固载于尼龙纳米纤维膜上,活力回收率可达53%,在25 ℃保存30 d后残余活力为40%[54]。
纳米颗粒固定化酶具有扩散限制小、比表面积高和催化效率高的优势。将带有组氨酸标签的PTE与CdSe/ZnS量子点结合后,固载酶后的纳米颗粒表现出游离酶4倍的初速度和2倍的催化效率[55]。将PTE表面的赖氨酸残基与N-丙烯酰氧基琥珀酰亚胺交联后在表面原位聚合形成聚合薄层,所制备的PTE纳米微囊具有比游离酶更高的催化效率,在4 ℃条件下保存8个月无明显活力损失[56]。Farha等合成了以锆为基体的金属有机框架NU-1003,可以作为有机磷水解酶OPAA的固定化载体,固定化后的OPAA能显著提高其水解效率[57]。
将酶直接固定在细胞内颗粒上可以简化纯化步骤,生产稳定、可循环利用的酶制剂。例如,Ginet等将OPH和MamC基因融合表达,由于MamC可锚定在细菌磁小体表面,因此制备了具有有机磷水解酶活力的磁性纳米颗粒,可以方便地循环利用[58]。Blatchford等将OpdA与聚酯颗粒合酶PhaC融合表达,使得OpdA高效地固定在天然的聚酯颗粒上[59]。该固定化酶在25 ℃条件下,保存11 d后只有少量的酶活损失。将OpdA与绿色荧光蛋白融合表达,可在4-45 ℃、pH 5-10的环境中重复使用[60]。
3.3 有机磷的快速、高灵敏度检测 生物传感器可作为现场快速检测有机磷农药残留的有效方法。基于有机磷水解酶的生物传感器灵敏度高,反应速度快,可行性强。根据信号转换形式的不同,这类生物传感器可分为安培型、电位型和光学型。
安培型传感器利用水解生成的对硝基苯酚在检测元件的阳极上发生氧化反应而生成电流,而电位型传感器是用pH电极检测OPH水解释放的H+浓度变化的差异。Zhao等将Fe3O4@Au通过静电相互作用与带正电的MPH (pI=8.3) 结合,制备的传感器具有高效的电导率、高表面积以及良好的生物兼容性,方便使用和回收[61]。此外,将有机磷水解酶与类弹性蛋白融合后固定在多壁纳米碳管或二氧化钛纳米纤维上,可以用来快速检测低浓度的甲基对硫磷,检出限达到12 nmol/L,整个过程只需要5 s[62]。
光学型传感器是基于水解产物引起的颜色变化检测有机磷化合物。例如,甲基丙烯酸甲酯吸附异硫氰酸荧光素(FITC)标记的OPH,当水解引起pH发生变化时,FITC可感知并引起发光能力的变化。该方法可以检测大多数有机磷农药。Simonian等报道了一种有机磷水解酶-纳米金聚合物组成的光学型传感器,对于对氧磷的检测限可以达到20 μmol/L [63]。另一种光学性检测器为PTE与CdSe/ZnS量子点(QDs)由静电相互作用组成的聚合物,该检测器利用了对氧磷可引起PTE/QDs光致发光强度猝灭的原理,其对对氧磷的检测限可达10-8 mol/L [64]。
3.4 酶用于有机磷中毒的预防和治疗 预防和治疗有机磷中毒是有机磷水解酶应用研究的一个重要方向。由于有机磷水解酶能够高效、专一性地水解这类化合物,可作为清除剂快速清理生物体内的有机磷。例如,Worek等发现PTE的突变体能够降解神经毒剂VX、CVX和VR等。动物实验表明,对于中毒的动物迅速注射磷酸三酯酶突变体C23AL能够起到明显的缓解作用[65]。Tawfik等对PON1进行了定向进化,将其与谷氨酸-草酰乙酸氨基转移酶一起使用时可使患者迅速脱毒,增加生还的可能性[66]。化学当量的BChE可以有效地与AChE竞争有机磷化合物,但是由于BChE分子量大、成本高,极大地限制了这一类蛋白的应用。Jacob等通过计算和结构挖掘的策略寻找到这类蛋白的替代分子Smu.1393c,它能够有效地水解氧化乐果、对氧磷、V型、G型神经毒剂,这类替代分子的研究将为其工业应用开辟新思路[67]。
4 总结和展望 随着生物信息学、计算机辅助蛋白质从头设计以及高通量筛选技术的不断发展,有机磷水解酶的发现和改造逐渐从微生物挖掘向基因数据库挖掘,从理性设计向理性设计与高通量筛选相结合的迭代组合进化方向发展。通过定向进化,目前有机磷水解酶的催化效率大幅度提高,稳定性和选择性有所增强,底物谱范围已逐渐从传统的有机磷农药向有机磷阻燃剂、增塑剂和耐用塑料等新兴的污染物拓展。在应用方面,有机磷水解酶通过固定化可实现与纳米材料、高分子材料的结合,不仅提高了催化活力和稳定性,也大幅增强了重复利用率,在生物降解、生物传感和生物治疗领域得到广泛应用。
展望未来,有机磷水解酶需要通过生物分子工程手段进一步提高催化效率和稳定性,拓宽底物范围,与合成生物学结合开发更加灵敏的整细胞生物传感器,通过固定化技术研究开发出将酶负载于纸、织物、薄膜等更加便捷、易检测的分析方法,以及开发可与有机磷水解酶复合使用的日用洗涤剂等,推动有机磷水解酶在分析和降解有机磷污染物的工业应用和成果转化。
References
| [1] | Omburo GA, Kuo JM, Mullins LS, Raushel FM. Characterization of the zinc binding site of bacterial phosphotriesterase. Journal of Biological Chemistry, 1992, 267(19): 13278-13283. |
| [2] | Roodveldt C, Tawfik DS. Shared promiscuous activities and evolutionary features in various members of the amidohydrolase superfamily. Biochemistry, 2005, 44(38): 12728-12736. DOI:10.1021/bi051021e |
| [3] | Afriat L, Roodveldt C, Manco G, Tawfik DS. The latent promiscuity of newly identified microbial lactonases is linked to a recently diverged phosphotriesterase. Biochemistry, 2006, 45(46): 13677-13686. DOI:10.1021/bi061268r |
| [4] | Sirotkina M, Efremenko EN. Rhodococcus lactonase with organophosphate hydrolase (OPH) activity and His6-tagged OPH with lactonase activity:evolutionary proximity of the enzymes and new possibilities in their application. Applied Microbiology and Biotechnology, 2014, 98(6): 2647-2656. DOI:10.1007/s00253-013-5233-y |
| [5] | Chen YL, Zhang XE, Liu H, Wang YS, Xia XM. Pseudomonas sp. WBC-3 capable of complete degradation of methylparathion. Acta Microbiologica Sinica, 2002, 42(4): 490-497. (in Chinese) 陈亚丽, 张先恩, 刘虹, 王银善, 夏祥明. 甲基对硫磷降解菌假单胞菌WBC-3的筛选及其降解性能的研究. 微生物学报, 2002, 42(4): 490-497. |
| [6] | Liu H, Zhang JJ, Wang SJ, Zhang XE, Zhou NY. Plasmid-borne catabolism of methyl parathion and p-nitrophenol in Pseudomonas sp strain WBC-3. Biochemical and Biophysical Research Communications, 2005, 334(4): 1107-1114. DOI:10.1016/j.bbrc.2005.07.006 |
| [7] | Liu XY, Li CX, Luo XJ, Lai QL, Xu JH. Burkholderia jiangsuensis sp. nov., a methyl parathion degrading bacterium, isolated from methyl parathion contaminated soil. International Journal of Systematic and Evolutionary Microbiology, 2014, 64(3247): 3253. |
| [8] | Wu NF, Deng MJ, Liang GY, Chu XY, Yao B, Fan YL. Cloning and expression of ophc2, a new organphosphorus hydrolase gene. Chinese Science Bulletin, 2004, 49(12): 1245-1249. DOI:10.1360/04wc0146 |
| [9] | Shen YJ, Lu P, Mei HA, Yu HJ, Hong Q, Li SP. Isolation of a methyl parathion-degrading strain Stenotrophomonas sp. SMSP-1 and cloning of the ophc2 gene. Biodegradation, 2010, 21(5): 785-792. DOI:10.1007/s10532-010-9343-2 |
| [10] | Jia Y, Shi YH, Ren L, Qiao C, Wang JH, Yan YC. Cloning and characterization of mpd and ophc2 from an organophosphorus pesticide-degrading bacteria YC-YH1. Biotechnology Bulletin, 2015, 31(11): 228-235. (in Chinese) 贾阳, 史延华, 任磊, 乔铖, 王俊欢, 闫艳春. 有机磷农药降解菌YC-YH1中mpd和ophc2的克隆及酶学性质分析. 生物技术通报, 2015, 31(11): 228-235. |
| [11] | Ben-David M, Elias M, Filippi JJ, Du?ach E, Silman I, Sussman JL, Tawfik DS. Catalytic versatility and backups in enzyme active sites:the case of Serum Paraoxonase 1. Journal of Molecular Biology, 2012, 418(3/4): 181-196. |
| [12] | Abe K, Yoshida S, Suzuki Y, Mori J, Doi Y, Takahashi S, Kera Y. Haloalkylphosphorus hydrolases purified from Sphingomonas sp. strain TDK1 and Sphingobium sp. strain TCM1. Applied and Environmental Microbiology, 2014, 80(18): 5866-5873. DOI:10.1128/AEM.01845-14 |
| [13] | Xiang DF, Bigley AN, Ren ZJ, Xue HR, Hull KG, Romo D, Raushel FM. Interrogation of the substrate profile and catalytic properties of the phosphotriesterase from Sphingobium sp. Strain TCM1:an enzyme capable of hydrolyzing organophosphate flame retardants and plasticizers. Biochemistry, 2015, 54(51): 7539-7549. DOI:10.1021/acs.biochem.5b01144 |
| [14] | Bigley AN, Xiang DF, Ren ZJ, Xue HR, Hull KG, Romo D, Raushel FM. Chemical mechanism of the phosphotriesterase from Sphingobium sp. strain TCM1, an enzyme capable of hydrolyzing organophosphate flame retardants. Journal of the American Chemical Society, 2016, 138(9): 2921-2924. DOI:10.1021/jacs.5b12739 |
| [15] | Theriot CM, Grunden AM. Hydrolysis of organophosphorus compounds by microbial enzymes. Applied Microbiology and Biotechnology, 2011, 89(1): 35-43. DOI:10.1007/s00253-010-2807-9 |
| [16] | Tokuriki N, Tawfik DS. Chaperonin overexpression promotes genetic variation and enzyme evolution. Nature, 2009, 459(7247): 668-671. DOI:10.1038/nature08009 |
| [17] | Merone L, Mandrich L, Rossi M, Manco G. A thermostable phosphotriesterase from the archaeon Sulfolobus solfataricus:cloning, overexpression and properties. Extremophiles, 2005, 9(4): 297-305. DOI:10.1007/s00792-005-0445-4 |
| [18] | Porzio E, Merone L, Mandrich L, Rossi M, Manco G. A new phosphotriesterase from Sulfolobus acidocaldarius and its comparison with the homologue from Sulfolobus solfataricus. Biochimie, 2007, 89(5): 625-636. DOI:10.1016/j.biochi.2007.01.007 |
| [19] | Xiang DF, Kolb P, Fedorov AA, Meier MM, Fedorov LV, Nguyen TT, Sterner R, Almo SC, Shoichet BK, Raushel FM. Functional annotation and three-dimensional structure of Dr0930 from Deinococcus radiodurans, a close relative of phosphotriesterase in the amidohydrolase superfamily. Biochemistry, 2009, 48(10): 2237-2247. DOI:10.1021/bi802274f |
| [20] | Zhang Y, An J, Ye W, Yang GY, Qian ZG, Chen HF, Cui L, Feng Y. Enhancing the promiscuous phosphotriesterase activity of a thermostable lactonase (GkaP) for the efficient degradation of organophosphate pesticides. Applied and Environmental Microbiology, 2012, 78(18): 6647-6655. DOI:10.1128/AEM.01122-12 |
| [21] | Meier MM, Rajendran C, Malisi C, Fox NG, Xu CF, Schlee S, Barondeau DP, H?cker B, Sterner R, Raushel FM. Molecular engineering of organophosphate hydrolysis activity from a weak promiscuous lactonase template. Journal of the American Chemical Society, 2013, 135(31): 11670-11677. DOI:10.1021/ja405911h |
| [22] | Del Giudice I, Coppolecchia R, Merone L, Porzio E, Carusone TM, Mandrich L, Worek F, Manco G. An efficient thermostable organophosphate hydrolase and its application in pesticide decontamination. Biotechnology and Bioengineering, 2016, 113(4): 724-734. DOI:10.1002/bit.25843 |
| [23] | Chen J, Luo XJ, Chen Q, Pan J, Zhou JH, Xu JH. Marked enhancement of Acinetobacter sp. organophosphorus hydrolase activity by a single residue substitution Ile211Ala. Bioresources and Bioprocessing, 2015, 2: 39. DOI:10.1186/s40643-015-0067-3 |
| [24] | Liu XY, Chen FF, Li CX, Luo XJ, Chen Q, Bai YP, Xu JH. Improved efficiency of a novel methyl parathion hydrolase using consensus approach. Enzyme and Microbial Technology, 2016, 93-94: 11-17. DOI:10.1016/j.enzmictec.2016.07.005 |
| [25] | Blaha-Nelson D, Krüger DM, Szeler K, Ben-David M, Kamerlin SCL. Active site hydrophobicity and the convergent evolution of paraoxonase activity in structurally divergent enzymes:the case of Serum Paraoxonase 1. Journal of the American Chemical Society, 2017, 139(3): 1155-1167. DOI:10.1021/jacs.6b10801 |
| [26] | Bigley AN, Xu CF, Henderson TJ, Harvey SP, Raushel FM. Enzymatic neutralization of the chemical warfare agent VX:evolution of phosphotriesterase for phosphorothiolate hydrolysis. Journal of the American Chemical Society, 2013, 135(28): 10426-10432. DOI:10.1021/ja402832z |
| [27] | Cherny I, Greisen Jr PJ, Ashani Y, Khare SD, Oberdorfer G, Leader H, Baker D, Tawfik DS. Engineering V-type nerve agents detoxifying enzymes using computationally focused libraries. ACS Chemical Biology, 2013, 8(11): 2394-2403. DOI:10.1021/cb4004892 |
| [28] | Wen XF, Yuan YZ, Xi HL, Zhong JY, Chen LK, Wang P, Xiao WJ, Liu DL. Characteristics of a novel organophosphorus pesticide-degrading enzyme on diisopropyl fluorophosphates. Journal of Central China Normal University (Natural Sciences), 2013, 47(1): 53-56. (in Chinese) 问县芳, 袁永泽, 习海玲, 钟近艺, 陈立坤, 王攀, 肖文精, 刘德立. 一种新型有机磷降解酶的二异丙基氟磷酸酯水解特性研究. 华中师范大学学报(自然科学版), 2013, 47(1): 53-56. |
| [29] | Libis V, Delépine B, Faulon JL. Expanding biosensing abilities through computer-aided design of metabolic pathways. ACS Synthetic Biology, 2016, 5(10): 1076-1085. DOI:10.1021/acssynbio.5b00225 |
| [30] | Jeong YS, Choi SL, Kyeong HH, Kim JH, Kim EJ, Pan JG, Rha E, Song JJ, Lee SG, Kim HS. High-throughput screening system based on phenolics-responsive transcription activator for directed evolution of organophosphate-degrading enzymes. Protein Engineering Design & Selection, 2012, 25(11): 725-731. |
| [31] | Han SS, Park WJ, Kim HS, Kim GJ. Antisense RNA-based high-throughput screen system for directed evolution of quorum quenching enzymes. ACS Chemical Biology, 2015, 10(11): 2598-2605. DOI:10.1021/acschembio.5b00714 |
| [32] | Kim H, Rha E, Seong W, Yeom SJ, Lee DH, Lee SG. A cell-cell communication-based screening system for novel microbes with target enzyme activities. ACS Synthetic Biology, 2016, 5(11): 1231-1238. |
| [33] | Fischlechner M, Schaerli Y, Mohamed MF, Patil S, Abell C, Hollfelder F. Evolution of enzyme catalysts caged in biomimetic gel-shell beads. Nature Chemistry, 2014, 6(9): 791-796. DOI:10.1038/nchem.1996 |
| [34] | Ma FQ, Fischer M, Han YB, Withers SG, Feng Y, Yang GY. Substrate engineering enabling fluorescence droplet entrapment for IVC-FACS-based ultrahigh-throughput screening. Analytical Chemistry, 2016, 88(17): 8587-8595. DOI:10.1021/acs.analchem.6b01712 |
| [35] | Luo XJ, Kong XD, Zhao J, Chen Q, Zhou JH, Xu JH. Switching a newly discovered lactonase into an efficient and thermostable phosphotriesterase by simple double mutations His250Ile/Ile263Trp. Biotechnology and Bioengineering, 2014, 111(10): 1920-1930. DOI:10.1002/bit.25272 |
| [36] | Luo XJ, Zhao J, Li CX, Bai YP, Reetz MT, Yu HL, Xu JH. Combinatorial evolution of phosphotriesterase toward a robust malathion degrader by hierarchical iteration mutagenesis. Biotechnology and Bioengineering, 2016, 113(11): 2350-2357. DOI:10.1002/bit.26012 |
| [37] | Kapoor M, Rajagopal R. Enzymatic bioremediation of organophosphorus insecticides by recombinant organophosphorous hydrolase. International Biodeterioration & Biodegradation, 2011, 65(6): 896-901. |
| [38] | Aharoni A, Gaidukov L, Yagur S, Toker L, Silman I, Tawfik DS. Directed evolution of mammalian paraoxonases PON1 and PON3 for bacterial expression and catalytic specialization. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(2): 482-487. DOI:10.1073/pnas.2536901100 |
| [39] | Li XC, Wang C, Mulchandani A, Ge X. Engineering soluble human paraoxonase 2 for quorum quenching. ACS Chemical Biology, 2016, 11(11): 3122-3131. DOI:10.1021/acschembio.6b00527 |
| [40] | Baker PJ, Montclare JK. Enhanced refoldability and thermoactivity of fluorinated phosphotriesterase. Chembiochem, 2011, 12(12): 1845-1848. DOI:10.1002/cbic.v12.12 |
| [41] | Yang CY, Renfrew PD, Olsen AJ, Zhang M, Yuvienco C, Bonneau R, Montclare JK. Improved stability and half-life of fluorinated phosphotriesterase using Rosetta. Chembiochem, 2014, 15(12): 1761-1764. DOI:10.1002/cbic.201402062 |
| [42] | Tian JA, Wang P, Gao S, Chu XY, Wu NF, Fan YL. Enhanced thermostability of methyl parathion hydrolase from Ochrobactrum sp. M231 by rational engineering of a glycine to proline mutation. The FEBS Journal, 2010, 277(23): 4901-4908. DOI:10.1111/j.1742-4658.2010.07895.x |
| [43] | Su YD, Tian J, Wang P, Chu XY, Liu GA, Wu NF, Fan YL. Improving the thermostability of a methyl parathion hydrolase by adding the ionic bond on protein surface. Applied Biochemistry and Biotechnology, 2011, 165(3/4): 989-997. |
| [44] | Perezgasga L, Sánchez-Sánchez L, Aguila S, Vazquez-Duhalt R. Substitution of the catalytic metal and protein PEGylation enhances activity and stability of bacterial phosphotriesterase. Applied Biochemistry and Biotechnology, 2012, 166(5): 1236-1247. DOI:10.1007/s12010-011-9510-x |
| [45] | Chen-Goodspeed M, Sogorb MA, Wu FY, Hong SB, Raushel FM. Structural determinants of the substrate and stereochemical specificity of phosphotriesterase. Biochemistry, 2001, 40(5): 1325-1331. DOI:10.1021/bi001548l |
| [46] | Tsai PC, Fan YB, Kim J, Yang LJ, Almo SC, Gao YQ, Raushel FM. Structural determinants for the stereoselective hydrolysis of chiral substrates by phosphotriesterase. Biochemistry, 2010, 49(37): 7988-7997. DOI:10.1021/bi101058z |
| [47] | Bigley AN, Mabanglo MF, Harvey SP, Raushel FM. Variants of phosphotriesterase for the enhanced detoxification of the chemical warfare Agent VR. Biochemistry, 2015, 54(35): 5502-5512. DOI:10.1021/acs.biochem.5b00629 |
| [48] | Walker AW, Keasling JD. Metabolic engineering of Pseudomonas putida for the utilization of parathion as a carbon and energy source. Biotechnology and Bioengineering, 2002, 78(7): 715-721. DOI:10.1002/(ISSN)1097-0290 |
| [49] | Yang JJ, Liu RH, Jiang H, Yang Y, Qiao CL. Selection of a whole-cell biocatalyst for methyl parathion biodegradation. Applied Microbiology and Biotechnology, 2012, 95(6): 1625-1632. DOI:10.1007/s00253-011-3792-3 |
| [50] | Khodi S, Latifi AM, Saadati M, Mirzaei M, Aghamollaei H. Surface display of organophosphorus hydrolase on E. coli using N-terminal domain of ice nucleation protein InaV. Journal of Microbiology and Biotechnology, 2012, 22(2): 234-238. DOI:10.4014/jmb |
| [51] | Yang C, Freudl R, Qiao CL, Mulchandani A. Cotranslocation of methyl parathion hydrolase to the periplasm and of organophosphorus hydrolase to the cell surface of Escherichia coli by the Tat pathway and ice nucleation protein display system. Applied and Environmental Microbiology, 2010, 76(2): 434-440. DOI:10.1128/AEM.02162-09 |
| [52] | Suthiwangcharoen N, Nagarajan R. Enhancing enzyme stability by construction of polymer-enzyme conjugate micelles for decontamination of organophosphate agents. Biomacromolecules, 2014, 15(4): 1142-1152. DOI:10.1021/bm401531d |
| [53] | Gao Y, Truong YB, Cacioli P, Butler P, Kyratzis IL. Bioremediation of pesticide contaminated water using an organophosphate degrading enzyme immobilized on nonwoven polyester textiles. Enzyme and Microbial Technology, 2014, 54: 38-44. DOI:10.1016/j.enzmictec.2013.10.001 |
| [54] | Yan XY, Jiang YJ, Zhang SP, Gao J, Zhang YF. Dual-functional OPH-immobilized polyamide nanofibrous membrane for effective organophosphorus toxic agents protection. Biochemical Engineering Journal, 2015, 98: 47-55. DOI:10.1016/j.bej.2015.02.022 |
| [55] | Breger JC, Ancona MG, Walper SA, Oh E, Susumu K, Stewart MH, Deschamps JR, Medintz IL. Understanding how nanoparticle attachment enhances phosphotriesterase kinetic efficiency. ACS Nano, 2015, 9(8): 8491-8503. DOI:10.1021/acsnano.5b03459 |
| [56] | Wei W, Du JJ, Li J, Yan M, Zhu Q, Jin X, Zhu XY, Hu ZM, Tang Y, Lu YF. Construction of robust enzyme nanocapsules for effective organophosphate decontamination, detoxification, and protection. Advanced Materials, 2013, 25(15): 2212-2218. DOI:10.1002/adma.201205138 |
| [57] | Li P, Moon SY, Guelta MA, Lin L, Gómez-Gualdron DA, Snurr RQ, Harvey SP, Hupp JT, Farha OK. Nanosizing a metal-organic framework enzyme carrier for accelerating nerve agent hydrolysis. ACS Nano, 2016, 10(10): 9174-9182. DOI:10.1021/acsnano.6b04996 |
| [58] | Ginet N, Pardoux R, Adryanczyk G, Garcia D, Brutesco C, Pignol D. Single-step production of a recyclable nanobiocatalyst for organophosphate pesticides biodegradation using functionalized bacterial magnetosomes. PLoS One, 2011, 6(6): e21442. DOI:10.1371/journal.pone.0021442 |
| [59] | Blatchford PA, Scott C, French N, Rehm BHA. Immobilization of organophosphohydrolase OpdA from Agrobacterium radiobacter by overproduction at the surface of polyester inclusions inside engineered Escherichia coli. Biotechnology and Bioengineering, 2012, 109(5): 1101-1108. DOI:10.1002/bit.24402 |
| [60] | Venning-Slater M, Hooks DO, Rehm BHA. In vivo self-assembly of stable green fluorescent protein fusion particles and their uses in enzyme immobilization. Applied and Environmental Microbiology, 2014, 80(10): 3062-3071. DOI:10.1128/AEM.00323-14 |
| [61] | Zhao YT, Zhang WY, Lin YH, Du D. The vital function of Fe3O4@Au nanocomposites for hydrolase biosensor design and its application in detection of methyl parathion. Nanoscale, 2013, 5(3): 1121-1126. DOI:10.1039/c2nr33107a |
| [62] | Bao J, Hou CJ, Dong QC, Ma XY, Chen J, Huo DQ, Yang M, El Galil KHA, Chen W, Lei Y. ELP-OPH/BSA/TiO2 nanofibers/c-MWCNTs based biosensor for sensitive and selective determination of p-nitrophenyl substituted organophosphate pesticides in aqueous system. Biosensors and Bioelectronics, 2016, 85: 935-942. DOI:10.1016/j.bios.2016.05.094 |
| [63] | Simonian AL, Good TA, Wang SS, Wild JR. Nanoparticle-based optical biosensors for the direct detection of organophosphate chemical warfare agents and pesticides. Analytica Chimica Acta, 2005, 534(1): 69-77. DOI:10.1016/j.aca.2004.06.056 |
| [64] | Ji XJ, Zheng JY, Xu JM, Rastogi VK, Cheng TC, DeFrank JJ, Leblanc RM. (CdSe)ZnS quantum dots and organophosphorus hydrolase bioconjugate as biosensors for detection of paraoxon. The Journal of Physical Chemistry B, 2005, 109(9): 3793-3799. DOI:10.1021/jp044928f |
| [65] | Goldsmith M, Eckstein S, Ashani Y, Greisen Jr P, Leader H, Sussman JL, Aggarwal N, Ovchinnikov S, Tawfik DS, Baker D, Thiermann H, Worek F. Catalytic efficiencies of directly evolved phosphotriesterase variants with structurally different organophosphorus compounds in vitro. Archives of Toxicology, 2016, 90(11): 2711-2724. DOI:10.1007/s00204-015-1626-2 |
| [66] | Goldsmith M, Ashani Y, Margalit R, Nyska A, Mirelman D, Tawfik DS. A new post-intoxication treatment of paraoxon and parathion poisonings using an evolved PON1 variant and recombinant GOT1. Chemico-Biological Interactions, 2016, 259: 242-251. DOI:10.1016/j.cbi.2016.05.034 |
| [67] | Jacob RB, Michaels KC, Anderson CJ, Fay JM, Dokholyan NV. Harnessing nature's diversity:discovering organophosphate bioscavenger characteristics among low molecular weight proteins. Scientific Reports, 2016, 6: 37175. DOI:10.1038/srep37175 |
