肖超1, 张梁1

 , 李颜颜1
, 李颜颜1
 , 辛瑜1, 陈国安2, 杨盛荣2
, 辛瑜1, 陈国安2, 杨盛荣2 1.江南大学, 粮食发酵工艺与技术国家工程实验室, 工业生物技术教育部重点实验室, 食品科学与技术国家重点实验室, 江苏 无锡 214122;
2.无锡江大百泰科技有限公司, 江苏 无锡 214122
收稿日期:2016-05-09;修回日期:2016-08-01;网络出版日期:2016-09-26
基金项目:国家星火计划重点项目(2015GA690004);江苏省科技项目(BE2015306,BY2015019-36,BE2016628)
*通信作者:张梁, E-mail:zhangl@jiangnan.edu.cn
李颜颜, Tel:+86-510-85197729, E-mail:yanyanli@jiangnan.edu.cn
摘要: [目的]构建蜡样芽胞杆菌(Bacillus cereus)磷脂酶C(Phospholipase C,PLC)的重组乳酸克鲁维酵母(Kluyveromyces lactis)菌株、纯化重组蛋白并对其进行酶学性质分析。[方法]以B.cereus基因组DNA为模板,PCR扩增得到磷脂酶C基因(bcplc),构建重组乳酸克鲁维酵母表达质粒并转化到乳酸克鲁维酵母中,实现bcplc基因的表达。利用镍柱亲和层析纯化和脱盐柱得到电泳纯的重组磷脂酶C(rbcPLC)。[结果]成功构建产磷脂酶C的重组乳酸克鲁维酵母并纯化了重组磷脂酶C,纯化后rbcPLC经SDS-PAGE分析在40 kDa附近出现显性条带。NPPC法测得rbcPLC酶活为19251 U/mg,最适反应温度为80℃,最适pH为9.0。在低于40℃时,pH 7.0-8.0时,rbcPLC重组酶较稳定。Cu2+和Co2+对其有明显的抑制作用;Zn2+、Mn2+、Ca2+、Mg2+对其有明显的促进作用。[结论]首次实现了对蜡样芽胞杆菌来源的磷脂酶C在乳酸克鲁维酵母中的重组表达、纯化及其酶学性质分析,为其它食品安全性微生物来源的磷脂酶C的研究提供了借鉴意义。
关键词: 蜡样芽胞杆菌 乳酸克鲁维酵母 重组表达 纯化 酶学性质
Heterologous expression, purification and characterization of phospholipase C from Bacillus cereus in Kluyveromyces lactis
Xiao Chao1, Zhang Liang1

 , Li Yanyan1
, Li Yanyan1
 , Xin Yu1, Chen Guoan2, Yang Shengrong2
, Xin Yu1, Chen Guoan2, Yang Shengrong2 1.The Key Laboratory of Industrial Biotechnology, Ministry of Education, National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi 214122, Jiangsu Province, China;
2.Wuxi Jiangda Baitai Technology Co, Ltd, Wuxi 214122, Jiangsu Province, China
Received 09 May 2016; Revised 01 August 2016; Published online 26 September 2016
*Corresponding author: Liang Zhang, E-mail:zhangl@jiangnan.edu.cn
Yanyan Li, Tel:+86-510-85197729, E-mail:yanyanli@jiangnan.edu.cn
Supported by the China Spark Program (2015GA690004), and by the Science and Technology Project of Jiangsu Province (BE2015306, BY2015019-36, BE2016628)
Abstract: [Objective]In this study, we constructed recombinant Kluyveromyces lactis strains to produce phospholipase C (PLC) of Bacillus cereus.The recombinant enzymes were purified and characterized.[Methods]We cloned the PLC encoding gene bcplc of Bacillus cereus.And the amplified fragments were inserted into pKLAC1 to obtain expression plasmids.K.lactis harboring the above plasmids was cultivated to express PLC that was purified by HisTrapTM affinity chromatography and characterized.[Results]PLC of B.cereus was cloned and expressed in K.lactis.The recombinant enzyme had shown activity of 19251 U/mg when using p-nitrophenyl phosphorycholine as substrate.Purified PLC exhibited optimum temperature at 80℃ and optimal pH at 9.0.The recombinant enzyme was stable below 40℃ and pH between 7.0 and 8.0.Cu2+ and Co2+ inhibited its activity whereas Zn2+, Mn2+, Ca2+ and Mg2+ stimulated its activity.[Conclusion]It is the first time to express and characterize the PLC gene in K.lactis.These research results provide reference for the study of recombinant PLC.
Key words: Bacillus cereus Kluyveromyces lactis recombinant purification characterization
磷脂酶C (phospholipase C,PLC,EC3.1.4.3),是一种水解甘油磷脂C3位点磷脂酰键生成甘油二酯和磷酸胆碱、磷酸肌醇、磷酸乙醇胺等的脂类水解酶[1]。磷脂酶C水解产物甘油二酯是一种生理活性物质,在细胞信号传导途径上起着第二信使的作用,能激活蛋白激酶C (PKC)而引起细胞增殖、分化、收缩、分泌和代谢等功能变化[2-3],此外还具有明显的抗血小板粘附、聚集等功能,对抗血小板新型药物及抗静脉血栓医疗方面的研究意义重大[4-6]。随着对磷脂酶C研究的深入及工业发展的要求,磷脂酶C的应用价值逐渐被挖掘开发,已经逐渐从药品生产延伸至油脂精炼、食品加工、磷脂改性[7-9]等领域。食品工业中磷脂酶C可用来改善面包的冷冻保存,生面团烤制时在面包表面产生的老化、缓和梨皮状表皮等;而最近磷脂酶C作为一种新型食品添加剂势必会推动磷脂酶C的广泛应用和研究。
从B. cereus-PLC被人类发现时起,研究者就开始研究磷脂酶C与B. cereus致病性之间的联系,目前尚无研究证明磷脂酶C与B. cereus的致病性相关,也没有相关PLC引起生物感染的病例,鉴于此蜡样芽孢杆菌来源的磷脂酶C被认为是安全的。另外bcPLC可水解多种底物及具有较高的水解活性,在植物油脱胶方面具有良好的应用前景[10-11]。
目前,蜡样芽孢杆菌来源的磷脂酶C已经在大肠杆菌及毕赤酵母中成功表达,大肠杆菌发酵过程产内毒素,易染噬菌体,并且在磷脂酶C纯化过程中出现失活现象[10-12]。毕赤酵母以甲醇为碳源时,利用甲醇氧化酶的AOX1启动子介导外源基因在毕赤酵母中表达。虽然AOX1启动子是高效启动子,但发酵诱导过程中甲醇的加入给高密度发酵及发酵产物带来安全性问题[13]。
乳酸克鲁维酵母(K. lactis)表达系统作为外源基因表达系统[14-15],与其他表达系统相比,具有很多优势,如较广的碳源利用范围、生长速率快、不会对蛋白高糖基化以及能够分泌高分子量蛋白等,同时与甲醇营养型酵母不同,其发酵过程不需要防爆设备[16]。K. lactis是美国FDA (food and drug administration)认定为GRAS (generally regarded as safe)的酵母菌,是食品安全级微生物,因此在食品和医药领域,可以利用K. lactis异源蛋白的大规模生产及应用。
本实验研究了蜡样芽胞杆菌来源的磷脂酶C在乳酸克鲁维酵母中重组表达,进一步实现了对重组酶的首次分离纯化并对重组酶进行了酶学性质分析。为研究乳酸克鲁维表达系统的建立和磷脂酶C的纯化打下了基础。
1 材料和方法 1.1 材料
1.1.1 培养基 SOB液体培养基(g/L):蛋白胨10.0,酵母粉5.0,氯化钠0.5,氯化钾0.186,氯化镁0.95,pH 7.2-7.4;固体培养基中另加1.6%的琼脂粉。YPD培养基(g/L):葡萄糖20.0,蛋白胨20.0,酵母粉10.0。硼砂卵黄固体培养基(g/L):硼砂1.9,氯化钠6.6,硼酸10.9,琼脂粉15,pH 7.2-7.4,灭菌后加入终浓度为5% (W/V)的卵黄溶液。YCB固体培养基(100 mL):酵母基础碳源(YCB) 1.17 g,pH 7.0的KH2PO4-K2HPO4缓冲液(终浓度30 mmol/L) 3 mL,琼脂粉1.5 g,灭菌后加入乙酰胺至终浓度5 mmol/L。
1.1.2 菌株、质粒及引物 蜡样芽孢杆菌(Bacillus cereus)、大肠杆菌JM109、乳酸克鲁维酵母(Kluyveromyces lactis GG799)和K. lactis GG799/pKLAC1 (空载)由实验室保存;pMD19-T Simple Vector购自TaKaRa公司,pKLAC1购自New England Biolabs公司。 本研究中所用的引物及其序列见表 1。引物设计使用Primer Premier 5.0软件。引物于生工生物工程股份有限公司(上海)合成。 表 1. 引物 Table 1. Primers
| Primers | Sequences (5′→3′) |
| P1-F | TACCGACGTATATCAAGCCCA |
| P2-R | ATCATCCTTGTCAGCGAAAGC |
| P3-F | CAGTGATTACATGCATATTGT |
| pKLAC1-plc-F | CGCTCGAGAAAAGAATGATTACACGTCGTAAATT |
| pKLAC1-plc-R | CCGAGATCTTAGTGGTGGTGGTGGTGGTGTTAGATCATTGCAGGATCAC |
| The underlined are restriction enzyme cutting sites. | |
表选项
1.1.3 工具酶和主要生化试剂 限制性内切酶XhoⅠ、Bgl Ⅱ、Sac Ⅱ、EcoRⅠ及T4 DNA连接酶、2×Taq Mix、氨苄青霉素购自上海生工生物工程股份有限公司;PCR产物纯化试剂盒、质粒小量提取试剂盒和胶回收试剂盒等购自北京博大泰克生物基因技术有限责任公司;Yeast Carbon Base (YCB)购自New England Biolabs公司;其他试剂为国产分析纯。 1.2 基因组DNA的提取 蜡状芽胞杆菌基因组DNA的提取参考分子克隆实验指南[17]相关方法进行。
1.3 bcplc基因的克隆 以NCBI (GenBank:ATCC10987)上报道的bcplc基因为模板设计PCR引物pKLAC1-bcplc-F/ pKLAC1-bcplc-R。以Bacillus cereus染色体为模板,以pKLAC1-bcplc-F/pKLAC1-bcplc-R为引物进行扩增。PCR扩增体系(100 μL):2×Taq Mix 50 μL,无菌水46 μL,模板2 μL,上下游引物(10 μmol/L)各1 μL;PCR反应条件:95 ℃ 5 min;94 ℃ 30 s,55 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃ 10 min。PCR终产物连接pMD19-T-Simple Vector载体后转化大肠杆菌JM109感受态细胞,筛选阳性转化子接种至氨苄抗性SOB培养基中筛选阳性转化子,提出的质粒分别用XhoⅠ/Bgl Ⅱ进行酶切验证。将验证正确的克隆子送到上海生工生物工程进行测序。
1.4 重组质粒pKLAC1-bcplc的构建 测序结果正确的质粒pMD19-T-bcplc,经限制性内切酶XhoⅠ、Bgl Ⅱ双酶切后与相同酶切后的载体pKLAC1相连,转入大肠杆菌JM109,涂布氨苄抗性平板,挑转化子,提取质粒,经XhoⅠ/Bgl Ⅱ酶切验证,得到构建成功的重组载体pKLAC1-bcplc。
1.5 K. lactis GG799转化子的筛选与验证 提取重组质粒pKLAC1-bcplc,SacⅡ线性化后电转K. lactis GG799,涂布YCB平板,于30 ℃恒温培养箱培养4 d后挑选转化子,在YCB平板划线,挑选单菌落接种于YPD培养基,提取K. lactis GG799转化子的染色体,以染色体为模板,分别利用整合引物P1和P2及P2和P3引物进行PCR扩增,琼脂糖凝胶电泳进行分析。PCR扩增条件为:95 ℃ 10 min;80℃ 2 min,95 ℃ 30 s,50 ℃ 30 s,72 ℃ 3 min,30个循环;72 ℃ 10 min。
1.6 磷脂酶C活力的测定
1.6.1 硼砂卵黄平板法测定酶活[18] 取200 μL酶液加入到等距放置在硼砂卵黄平板上的牛津杯中,37 ℃温育12 h,分解圈的大小定性判断酶活的高低。
1.6.2 p-NPPC定量测定酶活[19-20] p-NPPC是卵磷脂的一种底物结构类似物,PLC可以分解其生成对硝基苯酚,对硝基苯酚是一种黄色物质,在410 nm处的吸光值,可反映PLC水解p-NPPC产生对硝基苯酚的量,根据对硝基苯酚的标准曲线来定量计算出相应酶活力的大小。 有研究发现B. cereus的鞘磷脂酶C也可以水解p-NPPC,因为卵磷脂和鞘磷脂的头部很相似。故而以p-NPPC法测定粗酶液的酶活结果可能不准确,粗酶液中的其他种类的酶对p-NPPC的水解有干扰。磷脂酰胆碱的头部基团被发色物质硝基苯酚所取代形成p-NPPC[10],所以本研究酶活都是用纯酶所测。 反应体系组成:0.25 mol/L的Tris-HCl (pH 7.2)缓冲液,1 mmol/L的ZnCl2,60%的山梨醇(W/V),10 mmol/L的p-NPPC。200 μL反应体系中加入20 μL的酶样品溶液,37 ℃反应30 min,用酶标仪测定在410 nm波长处的吸收值。 酶活力单位的定义:在pH 7.2,温度为37 ℃的条件下,每分钟水解p-NPPC产生1 nmol对硝基苯酚所需的酶量为1个酶活力单位(U)。计算公式如下:U=CV/tm。 U为磷脂酶C活力(U/mL),C为对硝基苯酚浓度(nmol/mL),V为反应体系体积(mL),t为测定酶活时的反应时间(min),m为酶液的用量(mL)。 酶的比活力:酶的比活力代表酶的纯度,根据国际酶学委员会的规定比活力用每mg蛋白质所具有的酶活力单位数表示,对同一种酶来说,比活力愈大,表示酶的纯度愈高。比活力=酶活力/蛋白浓度。 1.7 重组蛋白的SDS-PAGE分析 将筛选得到的重组菌K. lactis GG799/pKLAC1-bcplc和K. lactis GG799/pKLAC1接种于50 mL液体YPD培养基中,30 ℃、200 r/min培养5 d,将发酵液于10000 r/min离心5 min,取上清进行SDS-PAGE分析。
1.8 磷脂酶C的纯化 将重组乳酸克鲁维酵母接种于YPD液体培养基中,按1.3中方法培养表达。离心收集上清得到粗酶液,其用于镍柱亲和层析,穿透峰和洗脱峰用NPPC法和SDS-PAGE分析。平衡缓冲液:25 mmol/L Tris-HCl (pH 7.4),0.5 mol/L NaCl;结合缓冲液:25 mmol/L Tris-HCl (pH 7.4),0.5 mol/L NaCl,10 mmol/L咪唑;洗脱缓冲液:25 mmol/L Tris-HCl (pH 7.4),0.5 mol/L NaCl,300 mmol/L咪唑。HisTrapTMHP亲和层析柱:上样前预先5倍柱体积(CV)平衡缓冲液平衡亲和柱,上样后以10 CV结合缓冲液洗脱杂蛋白,再以10 CV洗脱缓冲液洗脱重组蛋白。HiPrepTM26/10 Desalting亲和层析柱:所得洗脱峰用HiPrepTM26/10 Desalting柱脱去高浓度的咪唑。上样量为5 mL,上样前预先2 CV平衡缓冲液平衡亲和柱,上样后以1.5 CV平衡缓冲液洗脱蛋白,收集蛋白峰,即为除去咪唑的磷脂酶C纯蛋白。
2 结果和分析 2.1 磷脂酶C基因在重组K. lactis GG799中的重组表达
2.1.1 B. cereus plc基因编码氨基酸序列信号肽的预测 根据NCBI上B. cereus plc基因编码的氨基酸序列信息,对该氨基酸序列进行信号肽的预测,该bcplc基因编码的氨基酸序列存在信号肽序列,且信号肽切除位点位于第24和第25个氨基酸之间。
2.1.2 磷脂酶C基因的克隆与分析 bcplc基因的扩增片段如图 1所示,在800 bp左右有单一扩增片段,与目的片段大小(795 bp)一致。
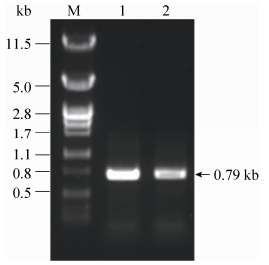 |
| 图 1. bcplc基因琼脂糖凝胶电泳分析 Figure 1. Agarose gel electrophoresis of bcplc. M:λ/Pst I DNA marker; 1, 2: PCR product of bcplc. |
| 图选项 |
2.1.3 K. lactis GG799表达载体pKLAC1-bcplc的构建 测序结果正确的质粒pMD19-T-bcplc经限制性内切酶XhoⅠ、Bgl Ⅱ双酶切后与相同酶切后的载体pKLAC1连接,转化E. coli JM109后挑取转化子,提取质粒进行酶切验证,双酶切验证图如图 2所示。
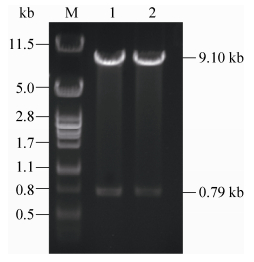 |
| 图 2. 重组载体pKLAC1-bcplc酶切验证 Figure 2. The enzymatic digestion of pKLAC1-bcplc. M: λ/Pst I DNA marker; lane 1, 2: recombinant plasmid pKLAC1-bcplc digested by XhoⅠ and Bgl Ⅱ. |
| 图选项 |
由图 2可知,提取的质粒载体经双酶切后得到了0.79 kb和9.10 kb的片段,与预期片段大小相同,说明表达载体pKLAC1-bcplc构建成功。
2.1.4 K. lactis GG799转化子的筛选与验证 pKLAC1为K. lactis整合型表达载体,转化前需先线性化以使其与K. lactis基因组DNA发生同源重组。线性化后载体分为两部分,胶回收大小为6.7 kb的片段,电转化K. lactis后涂布含5 mmol/L乙酰胺的YCB平板。含有bcplc基因的DNA片段与K. lactis GG799染色体上的LAC4基因在PLAC4位点发生同源重组,整合进染色体基因组上,同时整合进去的还有pKLAC1载体上的乙酰胺(amds)基因,YCB平板含有酵母生长所需要的营养物质,但是不含氮源,而amds基因可以使阳性菌株分解利用乙酰胺,从而为其生长提供氮源,据此对转化子进行筛选。同样的操作将质粒pKLAC1转化K. lactis,得到的阳性重组菌作为对照菌株。将筛选到的转化子划YCB平板后接种YPD液体培养基,提取染色体后以其为模板,利用整合引物P1和P2,P2和P3进行PCR扩增,若线性化的载体正确整合至LAC4位点启动子区域,则可以分别扩增出1.9 kb片段和2.3 kb片段(Manual I. K. lactis Protein Expression Kit,NEB)。对挑取转化子的验证结果如图 3所示。
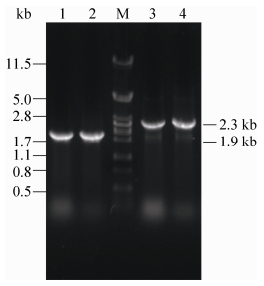 |
| 图 3. 重组菌bcplc基因多拷贝整合验证 Figure 3. The multiply integrated identification of recombinant plc gene. M: λ/Pst I DNA marker; lane 1-4: PCR product of K. lactis/pKLAC1-bcplc (1, 2: P1/P2; 3, 4: P2/P3). |
| 图选项 |
对转化子的验证结果同时表明,对于K. lactis GG799菌株,利用线性化载体pKLAC1与其基因组LAC4位点启动子区域发生同源重组时,在乙酰胺的筛选条件下,发生多拷贝整合的效率很高,这一结果在相关研究中已经得到了证实[21]。 由图 3可知,转化子成功克隆出1.9 kb片段说明bcplc基因成功整合进K. lactis染色体DNA中;由图 3还可知重组菌K. lactis/pKLAC1-bcplc均成功扩增出了2.3 kb的片段,说明外源DNA片段与其染色体基因组发生了多拷贝整合。
2.1.5 B. cereus plc基因在K. lactis中的分泌表达 (1)?卵黄平板初步检测酶活:bcplc基因在K. lactis α-mating factor信号肽的引导下进行分泌表达,K. lactis/pKLAC1-bcplc的发酵上清液,卵黄平板检测bcplc基因在K. lactis GG799中的表达情况,卵黄平板酶活检测情况(图 4)。
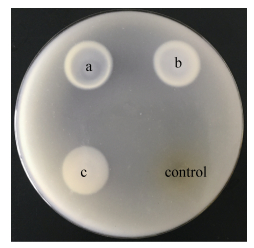 |
| 图 4. 重组磷脂酶C活性测定 Figure 4. Analysis of phospholipase C on egg yolk. a, b, c: K. lactis/pKLAC1-bcplc; control: K. lactis/ pKLAC1. |
| 图选项 |
由图 4可知,对于K. lactis/pKLAC1-bcplc的发酵上清液,由于重组菌成功分泌表达了有活性的rbcPLC,该酶催化卵黄平板中的磷脂水解,从而产生了沉淀圈(a、b、c),而对照菌株K. lactis/pKLAC1的发酵上清液未能产生该水解圈(control)。 (2)?K. lactis/pKLAC1-bcplc SDS-PAGE分析:为了进一步研究重组乳酸克鲁维酵母蛋白表达情况,对重组磷脂酶C进行分离纯化,重组酶纯化后比酶活为19251 U/mg。由图 5可知,在SDS-PAGE上显示单一条带,大小约为40 kDa,重组蛋白分子量高于氨基酸序列计算的理论蛋白大小(28 kDa)。用NetNGlyc 1.0 Server在线软件对重组蛋白潜在糖基化位点进行预测,结果表明在氨基酸169位有1个潜在的N糖基化位点,从而可能使得重组蛋白的实际分子量较其理论分子量有所增大。
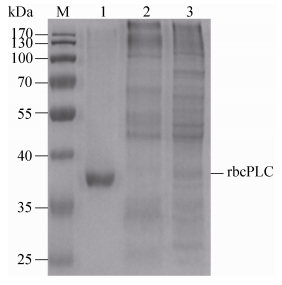 |
| 图 5. 重组菌K. lactis/pKLAC1-bcplc表达产物的SDS-PAGE电泳分析 Figure 5. The SDS-PAGE analysis of expression product in recombinant strain. Standard protein marker; lane 1: purification of rbcPLC; lane 2: K. lactis/pKLAC1; lane 3: fermentation supernatant of recombinant strain. |
| 图选项 |
2.2 重组磷脂酶酶学性质分析
2.2.1 最适反应温度的测定 将rbcPLC纯酶液分别置于20、25、30、35、40、45、50、55、60、65、70、75、80、85、90 ℃下反应并测定酶活力,以测得最高酶活力(8370 U/mg)为100%计算相对酶活,结果见图 6-A。
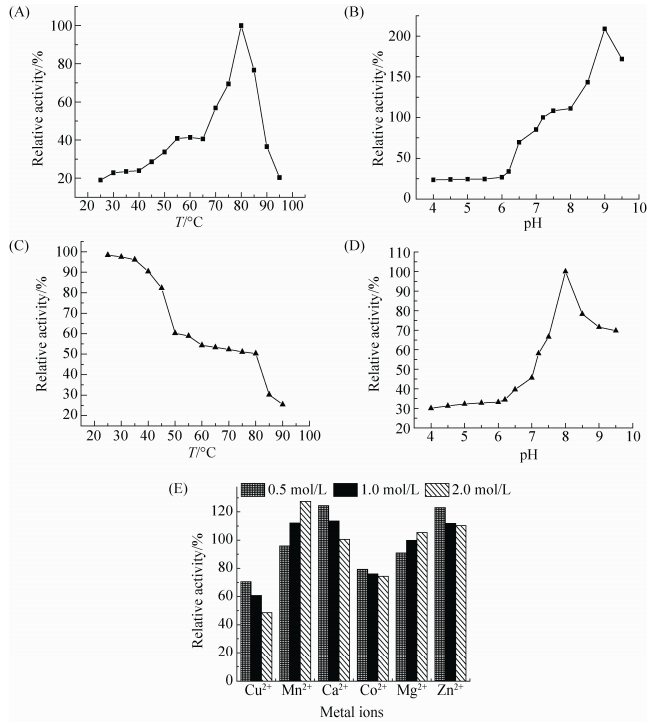 |
| 图 6. 温度(A),pH (B),酶的热稳定性(C),酶的pH稳定性(D),金属离子(E)对重组磷脂酶活力的影响 Figure 6. Effect of reaction temperature (A), pH (B), Thermal stability of the enzyme (C), pH stability of the enzyme (D), mental ions (E) on PLC enzymes activity. |
| 图选项 |
由图 6-A分析可知,rbcPLC最适反应温度为80 ℃,在20-65 ℃酶活力较低,随着温度的升高酶活力大幅度提高,在80 ℃时达到最高,但是在90 ℃时酶活力骤降。
2.2.2 最适pH值分析 分别用0.25 mol/L、pH 4.0、4.5、5.0、5.5、6.0的柠檬酸-柠檬酸钠缓冲液、0.25 mol/L、pH 6.5、7.0的磷酸氢二钾-磷酸二氢钾缓冲液及0.25 mol/L、pH 7.5、8.0、8.5、9.0的Tris-HCl缓冲液配置底物反应液,测其酶活力,并以pH 7.2时的酶活力(2147 U/mg)为100%计算相对酶活,结果见图 6-B。 由图 6-B可知,酶反应的最适pH为9.0,此时酶活力提高至200%,在pH为4-6时酶活力剩余25%,pH大于9.0之后,酶活力有所下降,该重组酶较为适合在偏碱性pH范围内作用。
2.2.3 热稳定性分析 将酶液分别置于20、25、30、35、40、45、50、55、60、65、70、75、80、85、90 ℃水浴30 min,然后37 ℃反应测剩余酶活力,并以未保温时的酶活(2147 U/mg)为100%计算相对酶活,结果见图 6-C。 由图 6-C可知,该酶在20 ℃到40 ℃下保温30 min后酶活力剩余90%以上,当温度高于85 ℃时,酶活力损失严重,剩余酶活力在30%以下。由此可见,该重组酶的热稳定性较差。
2.2.4 pH耐受性分析 将酶液分别置于上述相应的pH缓冲液中于4 ℃放置过夜,并在pH 7.2下测剩余酶活力,pH 7.2处理下的酶活力(2147 U/mg) 100%大小作为对照,计算相对酶活,结果见图 6-D。 由图 6-D可知,该酶在pH 7.0-9.5间剩余酶活力在90%以上较为稳定,当pH低于6.0时,相对酶活力剩余50%。所以该酶适合保存在偏碱性的环境中。
2.2.5 金属离子对酶活性的影响 分别添加CuCl2、MgCl2、MnCl2、CaCl2、CoCl2、ZnCl2等二价金属离子至终浓度为0.5、1.0、2.0 mmol/L测定酶活力,并计算相应的酶活,结果见图 6-E。 由图 6-E可知,Cu2+和Co2+对其有明显的抑制作用,且随着金属离子浓度的增加,抑制作用越明显;Zn2+、Mn2+、Ca2+对其有明显的促进作用;Mg2+随着浓度的升高对其有明显的促进作用。 3 讨论 微生物来源磷脂酶C较动植物来源具有生产周期短,结构简单,可工业化大规模培养等优势,但野生菌株产量低、分离纯化耗资大[22],使得高纯度磷脂酶C的商业化生产难以实现;而且大多数来源菌株都具有病原性,在食品安全性方面存在一定的隐患。因此,构建食品安全性菌株显得尤为重要。
目前,磷脂酶C已在大肠杆菌以及毕赤酵母中成功表达。大肠杆菌发酵过程产内毒素,易染噬菌体。毕赤酵母是AOX1启动子介导的甲醇诱导型表达,有毒性的诱导剂甲醇的添加给发酵过程及发酵产物带来安全性隐患。K. lactis是美国FDA认定为GRAS的酵母菌,是食品安全级微生物,因此在食品和医药领域,可以利用K. lactis异源蛋白的大规模生产及应用。
近几年来报道的蜡样芽胞杆菌来源的磷脂酶C在大肠杆菌中表达的相关研究显示,在磷脂酶C纯化过程中普遍存在着纯化失活的现象:细胞破碎上清液通过Ni柱亲和层析,在咪唑线性洗脱过程中有峰出现,收集到的流出液通过蛋白电泳验证与目的蛋白大小一致,但是在卵黄平板上无乳白色沉淀圈形成,p-NPPC法也没有检测到酶活[10, 22]。为此本研究优化了磷脂酶C的纯化方法,并尝试在新的表达宿主乳酸克鲁维酵母里面进行表达。
本实验在国内外首次实现了对蜡样芽胞杆菌来源的磷脂酶C在乳酸克鲁维酵母中的重组表达、纯化及其酶学性质分析。通过新的纯化策略,首次成功纯化得到磷脂酶C,对PLC应用于食品添加剂的安全应用及磷脂酶C的纯化具有一定的指导意义。NPPC法测得酶活为2147 U/mg。酶学性质结果显示最适反应温度为80 ℃,最适pH为9.0。在低于40 ℃时,pH 7.0-8.0时,重组酶稳定。Cu2+和Co2+对其有明显的抑制作用;Zn2+、Mn2+、Ca2+、Mg2+对其有明显的促进作用。
综上所述,乳酸克鲁维酵母可以作为表达磷脂酶C的宿主在工业生产中具有很大的优势,但是乳酸克鲁维酵母分泌外源蛋白的水平较低。为了提高重组酶在K. lactis中的表达量,可以通过以下方法:(1)?K. lactis基因组中编码Ca2+-ATPase的PMR1[23]基因涉及到外源蛋白的分泌,而MNN10[24]基因在高拷贝状态下也会影响蛋白的分泌,对这两个基因进行敲除,可以提高重组酶的表达量。(2)?由于不同宿主间密码子的使用频率和偏好性存在差异,这是导致基因在异源宿主内不能高效表达的主要原因。将rbcPLC脱氨酶的稀有密码子换成乳酸克鲁维酵母偏好或使用频率高的密码子,提高目的基因的表达水平。
参考文献
| [1] | Zhao JX, Zhang L, Gu ZH, Ding CY, Shi GY. Expression of hemolytic phospholipase C from Pseudomonas aeruginosa in Escherichia coli.Acta Microbiologica Sinica, 2013, 53(3): 259–268(in Chinese).赵金星, 张梁, 顾正华, 丁重阳, 石贵阳. 重组大肠杆菌表达铜绿假单胞菌溶血性磷脂酶C.微生物学报, 2013, 53(3): 259–268. |
| [2] | Titball RW. Bacterial phospholipases C.Microbiological Reviews, 1993, 57(2): 347–366. |
| [3] | Levine L, Xiao DM, Little C. Increased arachidonic acid metabolites from cells in culture after treatment with the phosphatidylcholine-hydrolyzing phospholipase C from Bacillus cereus.Prostaglandins, 1987, 34(5): 633–642. |
| [4] | Chen MK, Chen W, Song JH, Tong X, Chen T. Effects of phospholipase C on experiment thrombosis and fibrinolytic activity.Chinese Pharmacological Bulletin, 2002, 18(4): 477–479(in Chinese).陈明锴, 陈蔚, 宋建华, 童骁, 陈涛. 磷酯酶C对实验性血栓形成和纤溶功能的影响.中国药理学通报, 2002, 18(4): 477–479. |
| [5] | Chen T, Song JH, Chen MK, Wang X, Wang CG, Sun S. Study on the antiplatelet effects of phospholipase C I-the effects of PLC on platelet aggregation and adhesion.Chinese Pharmacological Bulletin, 2003, 19(10): 1107–1111(in Chinese).陈涛, 宋建华, 陈明锴, 王歆, 王常高, 孙松. 磷酯酶C抗血小板功能的研究Ⅰ-对血小板聚集率和粘附率的作用.中国药理学通报, 2003, 19(10): 1107–1111. |
| [6] | Chen MK, Song JH, Wang X, Wang CG, Sun SB, Chen T. Study on the antiplatelet effect of phospholipase C:release function and metabolism.Chinese Pharmacological Bulletin, 2003, 19(12): 1340–1344(in Chinese).陈明锴, 宋建华, 王歆, 王常高, 孙松柏, 陈涛. 磷酯酶C抗血小板功能的研究Ⅱ-对血小板释放和代谢的作用.中国药理学通报, 2003, 19(12): 1340–1344. |
| [7] | Wang CG, Liu YC, Gan X, Chen T. Study on some properties of phospholipase C from Bacillus mycoides.Chemistry & Bioengineering, 2007, 24(7): 52–54(in Chinese).王常高, 刘彦昌, 干信, 陈涛. Bacillus Mycoides磷脂酶C部分特性研究.化学与生物工程, 2007, 24(7): 52–54. |
| [8] | 小野泰典, 深泽彻也, 长崎咏子.新型磷脂酶C:CN200680053785.2. 2006-03-10. |
| [9] | De Maria L, Vind J, Oxenboll KM, Svendsen A, Patkar S. Phospholipases and their industrial applications.Applied Microbiology and Biotechnology, 2007, 74(2): 290–300DOI:10.1007/s00253-006-0775-x. |
| [10] | 汪艳红.磷脂酶C的异源表达及其酶学性质分析.江南大学硕士学位论文, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10295-1014370751.htm |
| [11] | Lyu Y Y, Ye L, Xu J, Yang X, Chen W, Yu H. Recent research progress with phospholipase C from Bacillus cereus.Biotechnology Letters, 2015, 38(1): 23–31. |
| [12] | Liu FF, Zhang L, Gu ZH, Ding CY, Shi GY. Cloning and heterologous expression in E. coli of phospholipase C gene from Bacillus cereus.Food Science, 2013, 34(11): 182–187(in Chinese).刘菲菲, 张梁, 顾正华, 丁重阳, 石贵阳. 蜡状芽孢杆菌磷脂酶C基因在大肠杆菌中的异源表达.食品科学, 2013, 34(11): 182–187. |
| [13] | Huang XY, Zhang L, Li Y. Constitutive expression of feruloyl esterase from Aspergillus niger in Pichia pastoris. Microbiology China, 2016:1-13. 黄雪月, 张梁, 李赢.黑曲霉阿魏酸酯酶在毕赤酵母中的组成型表达.微生物学通报, DOI:10.13344/j.microbiol.china.160018. |
| [14] | van Ooyen AJJ, Dekker P, Huang M, Olsthoorn MMA, Jacobs DI, Colussi PA, Taron CH. Heterologous protein production in the yeast Kluyveromyces lactis.FEMS Yeast Research, 2006, 6(3): 381–392DOI:10.1111/fyr.2006.6.issue-3. |
| [15] | van den Berg JA, van den Laken K J, van Ooyen AJJ, Renniers TC, Rietveld K, Schaap A, Brake AJ, Bishop RJ, Schultz K, Moyer D. Kluyveromyces as a host for heterologous gene expression:expression and secretion of prochymosin.Biotechnology, 1990, 8(2): 135–139DOI:10.1038/nbt0290-135. |
| [16] | Swinkels BW, van Ooyen AJJ, Bonekamp FJ. The yeast Kluyveromyces lactis as an efficient host for heterologous gene expression.Antonie van Leeuwenhoek, 1993, 64(2): 187–201DOI:10.1007/BF00873027. |
| [17] | 黄培堂. 分子克隆实验指南精编版.北京: 化学工业出版社, 2008: 707. |
| [18] | Gubash SM. Improved egg-yolk agar plate medium for the detection of clostridial phospholipase C activity.Research in Microbiology, 1991, 142(1): 87–93DOI:10.1016/0923-2508(91)90100-O. |
| [19] | Peng Y, Zhou D. The method of phospholipase C assay and application.Journal of Harbin Institute of Technology, 1989(3): 34–38(in Chinese).彭愈生, 周定. 磷脂酶C活性测定方法及其应用的研究.哈尔滨工业大学学报, 1989(3): 34–38. |
| [20] | Kurioka S, Matsuda M. Phospholipase C assay using p-nitrophenylphosphorylcholine together with sorbitol and its application to studying the metal and detergent requirement of the enzyme.Analytical Biochemistry, 1976, 75(1): 281–289DOI:10.1016/0003-2697(76)90078-6. |
| [21] | Read JD, Colussi PA, Ganatra MB, Taron CH. Acetamide selection of Kluyveromyces lactis cells transformed with an integrative vector leads to high-frequency formation of multicopy strains.Applied & Environmental Microbiology, 2007, 73(16): 5088–5096. |
| [22] | 刘菲菲.微生物产磷脂酶C的筛选、发酵优化及重组表达.江南大学硕士学位论文, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10295-1013129664.htm |
| [23] | Feng Z, Ren J, Zhang YH, Hu S. Improved secretory production of calf prochymosin by codon optimization and disruption of PMR1 in Kluyveromyces lactis GG799.African Journal of Biotechnology, 2011, 10(52): 10786–10789DOI:10.5897/AJB. |
| [24] | Bartkeviciūte D, Sasnauskas K. Disruption of the MNN10 gene enhances protein secretion in Kluyveromyces lactis and Saccharomyces cerevisiae.FEMS Yeast Research, 2004, 4(8): 833–840DOI:10.1016/j.femsyr.2004.03.001. |
