 , 朱远墨, 丰传雯, 嵇鸿民, 任洪强, 耿金菊, 许柯
, 朱远墨, 丰传雯, 嵇鸿民, 任洪强, 耿金菊, 许柯

南京大学环境学院, 污染控制与资源再利用国家重点实验室, 南京 210023
收稿日期: 2020-05-13; 修回日期: 2020-07-12; 录用日期: 2020-07-12
基金项目: 国家水体污染控制与治理科技重大专项(No.2017ZX07202003)
作者简介: 李志豪(1995-), 男, E-mail:15851235535@163.com
通讯作者(责任作者): 许柯, E-mail:kexu@nju.edu.cn
摘要:本研究采用普通陶粒、普通陶粒外加静态磁场(50 mT)和磁性陶粒(2.5 mT和5 mT)曝气生物滤池处理高浓度氨氮废水,对比研究了不同类型和强度的磁场强化下曝气生物滤池的硝化反硝化效果,并通过分子生物学手段系统分析了磁场强化硝化反硝化的微生物学机理.结果表明,随着氨氮浓度增加,磁场强化下曝气生物滤池硝化反硝化效果显著高于普通陶粒曝气生物滤池.当氨氮浓度提高到400 mg·L-1时,磁场强化曝气生物滤池(磁性陶粒和外加静态磁场)的氨氮去除率大于97%,高于普通陶粒曝气生物滤池的氨氮去除率(88%);磁场强度为2.5 mT的磁性陶粒曝气生物滤池的总氮去除率达到67%,显著高于其他3个曝气生物滤池(p < 0.05)(分别为55%、54%和55%).分子生物学检测结果表明,2.5 mT磁场强度的磁性陶粒上生物膜的硝化反硝化酶活性和功能基因丰度大幅提高,硝化反硝化细菌的丰度及多样性显著增加.
关键词:高氨氮磁性陶粒填料酶活性微生物群落结构
Treatment of high concentration ammonia wastewater by using aeration biological filter enhanced by magnetic field
LI Zhihao
 , ZHU Yuanmo, FENG Chuanwen, JI Hongmin, REN Hongqiang, GENG Jinju, XU Ke
, ZHU Yuanmo, FENG Chuanwen, JI Hongmin, REN Hongqiang, GENG Jinju, XU Ke

State Key Laboratory of Pollution Control and Resource Reuse, School of the Environment, Nanjing University, Nanjing 210023
Received 13 May 2020; received in revised from 12 July 2020; accepted 12 July 2020
Abstract: In this study, four reactors filled with normal ceramsite packing materials, with/without 50 mT static magnetic field, and magnetic ceramsite (2.5 mT and 5 mT, respectively) were used to treat high-concentration ammonia nitrogen wastewater. The performance of different type and strength of magnetic field on the nitrification and denitrification performance were investigated. Molecular biology methods were used to clarify the microbial mechanism of magnetic field enhancing the nitrification and denitrification processes. The results showed that with the increase of ammonium concentration, the nitrification and denitrification performance of the reactors enhanced by magnetic field were significantly higher than that of reactor filled with normal ceramsite. When the ammonium concentration increased to 400 mg·L-1, the ammonium removals of the reactors enhanced by magnetic field were greater than 97%, which was higher than that of the reactor filled with ordinary ceramsite (88%). The total nitrogen removal of the reactor filled with magnetic ceramsite filler of 2.5 mT reached 67%, which was significantly higher than those of the other three reactors (55%, 54% and 55%) (p < 0.05). The results of molecular biological analysis showed that the enzyme activities, the abundance of functional genes, and the abundance and diversity of bacteria for nitrification and denitrification greatly increased in the biofilm on the magnetic ceramsite under 2.5 mT.
Keywords: high ammonia nitrogenmagnetic fillerenzyme activitymicrobial community structure
1 引言(Introduction)我国高氨氮废水种类多、排量大、污染重(Statistics et al., 2014; Wang et al., 2020).生物除氨(即硝化反硝化)具有成本低、处理效果好、无二次污染、操作方便等优点, 是目前主流的除氮技术.然而, 当废水中NH3-N浓度超过100 mg·L-1时, 水中游离氨(FA)和游离亚硝酸(FNA)浓度增加, 对氨氧化菌(AOB)与亚硝酸盐氧化菌(NOB)活性产生抑制, 进而导致硝化速率变慢、氨去除率降低(Ying et al., 2011; Wei et al., 2014).
近年来有研究表明, 氨氮浓度超过60 mg·L-1时, 外加静态磁场可以提高硝化反硝化效果(Zieliński et al., 2017; Liu et al., 2018).磁场能够促进AOB和NOB生长, 增强硝化反硝化功能酶的活性并促进底物如氨、氧的转移(Wang et al., 2017; Jia et al., 2018; Beretta et al., 2019).然而, 现有研究均采用永磁铁产生的静态磁场进行强化, 永磁铁受自身规模所限, 难以进行工业化规模应用, 从而限制了磁场强化生物脱氮在高氨氮废水处理方面的应用.
硝化菌(AOB和NOB)属于化能自养菌, 具有生长速率慢、世代周期长、对环境因子敏感、可附着生长的特性, 因此, 普遍认为提供适宜的载体有利于硝化菌富集, 从而可提高硝化效果.例如, Wang等(2018b)制备了一种含有锌纳米颗粒的新型生物载体, 用于处理氨氮浓度为80~100 mg·L-1的纺织废水, 但氨氮去除率低于80%.Massoompour等(2020)采用回收材料制备了一种新型载体, 在氨氮浓度为55 mg·L-1和水力停留时间为6 h时微生物生长良好, 填料表面黏附力增强, 氨氮和总氮(TN)去除率有所提高.
本研究基于磁场对硝化菌的强化效果及载体对硝化菌的固定作用, 研制了磁性陶粒填料, 并采用普通陶粒填料、普通陶粒填料外加静态磁场和两种磁场强度(2.5 mT和5 mT)的磁性陶粒填料处理高浓度氨氮废水, 系统研究磁场强度和类型、氨氮浓度对硝化反硝化效果的影响, 并通过多种分子生物学手段深入分析磁场强化硝化反硝化的微生物学机理, 以期为磁场强化生物脱氮技术的应用提供理论依据与参考.
2 材料与方法(Materials and methods)2.1 陶粒填料制备以凹凸棒土粉为主要原料, 通过添加不同量的Fe3O4粉获得不同磁场强度的陶粒填料, 其电镜图见图 1.具体制备步骤如下:①将凹凸棒粘土粉、Fe3O4粉(马克林, 中国)和水分别以质量比为150:0:80、100:50:80和100:100:80的比例混合, 这3种比例的填料分别称为普通陶粒填料、磁性陶粒填料1和磁性陶粒填料2.②将混合物按压成直径为6~8 mm的球形颗粒, 然后在105 ℃的温度下干燥1~2 h, 并在装有氮气的马弗炉中以600 ℃煅烧8 h, 最后在环境中冷却.氮气是为了防止Fe3O4在高温下氧化变性, 降低磁性陶粒填料的磁场强度.③用水洗涤煅烧的球形颗粒, 然后在105 ℃的干燥真空环境中干燥12 h.在该步骤结束时, 普通陶粒填料制作完成.④使用充磁机(1500 mV)将磁性陶粒填料1和磁性陶粒填料2磁化.
图 1(Fig. 1)
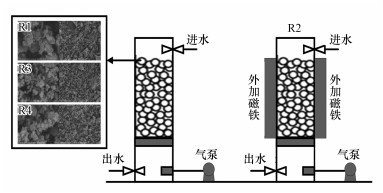 |
| 图 1 反应器示意图和陶粒填料电镜图 Fig. 1Operating reactors and fillers′ SEM |
2.2 实验装置本研究设置4个反应器并列运行(图 1).4个反应器设置如下:R1填充普通陶粒填料;R2填充普通陶粒填料, 反应器两侧安装永磁体, 使反应器中心磁场强度为50 mT;R3填充磁性陶粒填料1(反应器中心磁场强度为2.5 mT);R4填充磁性陶粒填料2(反应器中心磁场强度为5 mT).4个反应器中填料填充率均为70%.反应器为高度50 cm、直径6 cm的圆柱体, 上向流连续运行.水力停留时间为12 h, 气液比为6:1.通过水浴将反应器温度保持在(20±2) ℃, 通过添加NaHCO3维持进水pH在7.0~8.0.
2.3 实验用水实验用水为人工配制, 具体组成如表 1所示.微量元素溶液组成如表 2所示.
表 1(Table 1)
| 表 1 阶段1~3的进水成分 Table 1 Influent composition table in stage 1~3mg·L-1 | ||||||||||||||||||||
表 1 阶段1~3的进水成分 Table 1 Influent composition table in stage 1~3mg·L-1
| ||||||||||||||||||||
表 2(Table 2)
| 表 2 微量元素成分表 Table 2 Trace element composition table | ||||||||||||||||||||
表 2 微量元素成分表 Table 2 Trace element composition table
| ||||||||||||||||||||
2.4 挂膜启动采用快速排泥法, 以南京市污水处理厂好氧池活性污泥作为接种污泥, 混合液悬浮固体浓度约为3000 mg·L-1, 添加至反应器中曝气24 h后, 排出所有接种污泥.
2.5 分析检测方法2.5.1 理化指标检测NH4+-N、TN和MLSS采用标准方法测定(APHA 1998).COD采用快速消解-分光光度法测定.溶解氧(DO)、pH和温度(T)采用便携式溶氧仪测定(HQ40d, HACH, America and PB-10, Sartorius, Germany).磁强度采用高斯仪(HT100S)测量, 测量精度为±5%.陶粒填料表面形貌采用扫描电子显微镜检测(SEM)(QUANTA 250FEG, FEI, America).陶粒填料比表面积、孔体积和平均孔径采用物理吸附法检测(ASAP 2020, Micromeritics, America).
2.5.2 微生物特性指标检测① 比耗氧速率与氨氧化速率测定:硝化效率采用比耗氧速率(SOUR)和氨氧化速率(SAUR)表征, 其中, SOUR的测定方法参照文献(Li et al., 2018), SAUR测定方法如下:从反应器中取若干生物填料, 用去离子水清洗后, 加入内置有磁力搅拌子的锥形瓶中, 并投加一定量的NH4Cl溶液使反应体系内氨氮浓度为50 mg·L-1, 以NaHCO3调节碱度使pH为7.5;然后将锥形瓶置于磁力搅拌器上, 开动电磁搅拌器, 温度控制在20 ℃, 控制曝气量使DO处于2~4 mg·L-1, 间隔10 min取样, 样品在3000 r·min-1下离心, 取上清液并测定上清液中的氨氮浓度, 根据不同时间点的氨氮浓度作NH4+-N~t曲线, 同时测定混合液的MLSS值, 计算出污泥的氨氧化速率.
② 生物膜形貌分析:取适量填料放入50 mL烧杯中, 通过超声振荡获得生物膜.生物膜样品预处理参考Araujo等(2003)的方法, 使用扫描电子显微镜观测生物膜的表面形态(QUANTA 250FEG, FEI, America).
③ 硝化反硝化酶活检测:氨单加氧酶(AMO)、亚硝酸盐氧化还原酶(NXR)、硝酸还原酶(NAR)、亚硝酸盐还原酶(NIR)的活性测量参考Zheng等(2011)的方法.
④ 硝化反硝化功能基因丰度检测:1)DNA提取:从反应器中取适量的活性污泥样品, 12000 g离心5 min后去掉上清液, 加入50%的乙醇浸没样品, 于-80 ℃下保存.采用FastDNATM Spin Kit土壤试剂盒提取DNA, 严格遵照试剂盒所配套的说明书进行.最后将提取的DNA于-80 ℃下保存.
2) 实时荧光定量PCR(qPCR)扩增:本研究中定量PCR分析选取6种氮素转化功能基因, 分别为amoA、nxrA、napA、narG、nirK、nirS.引物选取参考已发表文献, 由南京金斯瑞生物科技有限公司合成, 具体引物序列基因片段长度及扩增条件见表 3.在所有qPCR运行程序中应生成包括5个或6个点的标准曲线.携带目标基因的质粒用于产生标准曲线.使用纯化试剂盒(Axyprep)纯化PCR扩增后的产物, 将纯化的PCR产物连接到pMD 18-T载体(TaKaRa)中, 然后克隆到JM 109大肠杆菌(TaKaRa)中.通过PCR验证克隆目标基因筛选阳性克隆.使用MiniBest Plasmid Purification Kit Ver. 3.0质粒DNA提取试剂盒(Takara, 日本)提取质粒标准品, 根据标准曲线确定测试样品的相应基因拷贝.qPCR反应在96孔板中进行, 反应体系为20 μL, 包括10.0 μL的2×AceQ qPCR SYBR? Green Master Mix(低ROX预混, Vazyme, 中国), 正、反向引物各0.4 μL(10 μmol·L-1), 1.6 μL DNA模板(20 ng·μL-1)及7.6 μL的ddH2O(0.1% DEPC水溶液, KeyGEN BioTECH, 中国).每个样品做3个平行, 阴性对照以ddH2O代替DNA模板.定量基因的引物与定性基因的引物一致, 引物的纯化方式为PAGE级别.每种基因的PCR效率范围为90%~100%, 所有标准曲线的R2值均大于0.99.
表 3(Table 3)
| 表 3 qPCR中使用的引物 Table 3 Primers used in qPCR | ||||||||||||||||||||||||||||||||||||||||||
表 3 qPCR中使用的引物 Table 3 Primers used in qPCR
| ||||||||||||||||||||||||||||||||||||||||||
⑤ 微生物群落结构分析:1)定性PCR扩增:首先用④中的方法提取DNA.将提取的每种DNA样品稀释至20 ng·μL-1以作为模板进行定性PCR扩增.扩增体系为25 μL, 包含Supermix 12.5 μL, 正向和反向引物各1 μL, DNA模板2 μL, Milli-Q超纯水8.5 μL.每个样品做4个平行.热循环程序:95 ℃预变性5 min;95 ℃变性30 s, 60 ℃退火30 s, 72 ℃延伸40 s, 40个循环;最后72 ℃延伸10 min.PCR扩增产物用1%琼脂糖凝胶电泳检测.
2) 扩增产物纯化:将PCR扩增的4个平行样合并, 用E.Z.N.A.TM Cycle-Pure试剂盒(Omega Bio-tek Inc., 美国)按照说明书中的步骤对扩增产物进行纯化.纯化后, 用NanoDrop2000超微量分光光度计测定纯化样品浓度和纯度.
3) 高通量测序及分析:纯化产物送至美吉生物科技公司(中国上海), 使用Illumian测序平台(Miseq, Illumina Inc., 美国)进行高通量测序.使用Sickle估计测序数据以去除低质量碱基(Q < 25)和具有多于一个N的任何序列.Mothur程序用于序列解复用和过滤, 一般步骤如下:(1)基于条形码对序列进行解复用;(2)将Read1和Read2组合成重叠群(参数:minoverlap=10, maxhomop=8, maxambig=0);(3)丢弃未与V3V4区域对齐的序列;(4)将具有不超过3种不同碱基的序列预聚类成一个序列;(5)通过使用Mothur中包装的chimera.uchime命令将序列与参考数据库进行比较来检测嵌合体;(6)将16S rRNA基因序列分类为3%截止值(或97%相似性)的操作分类单位(OTU).过滤的序列由独立的RDP分类器分类.
3 结果(Results)3.1 陶粒填料理化特性表征由图 1中陶粒填料的SEM图像和表 4可以看出, 普通陶粒填料具有许多沟壑和大小不一的孔道, 平均孔径约为14.989 nm;磁性陶粒填料1和2中的凹凸棒土与Fe3O4晶体形成了团聚体, 二者在煅烧过程中得到均匀混合, Fe3O4成功固定于陶粒填料中.随着Fe3O4含量的增加, 磁性陶粒填料表面更加紧密, 孔径、孔体积进一步缩小.
表 4(Table 4)
| 表 4 不同填料的比表面积、孔体积、平均孔径 Table 4 Specific surface area, pore volume, average pore size of different kinds of fillers | ||||||||||||||||
表 4 不同填料的比表面积、孔体积、平均孔径 Table 4 Specific surface area, pore volume, average pore size of different kinds of fillers
| ||||||||||||||||
3.2 反应器出水水质反应器共运行53 d, 按照进水氨氮浓度可分为3个阶段.由图 2a可知, 在阶段1(进水NH4+-N浓度100 mg·L-1), 6 d后R3和R4的NH4+-N去除率都高于95%, 13 d后稳定达到99%以上, 而R2的NH4+-N去除率在第13 d才达到95%, R1的NH4+-N去除率则到第23 d才达到95%.在阶段2(进水NH4+-N浓度200 mg·L-1), R1的NH4+-N去除率下降至90%, 而其他3个反应器均保持在99%.在阶段3(进水NH4+-N浓度400 mg·L-1), 4个反应器的NH4+-N去除率都保持稳定, 在第53 d时分别为88%、98%、100%、99%.
图 2(Fig. 2)
 |
| 图 2 不同阶段出水的氨氮(a)、总氮(b)、COD(c)去除率 Fig. 2Ammonia nitrogen removal rate(a), total nitrogen removal rate(b) and COD removal rate(c) for effluent |
由图 2b可知, 阶段1中4个反应器的TN去除率均有较大波动, 可能是由于此阶段中生物膜厚度较小, 无法为反硝化反应提供稳定的缺氧环境.随着反应器运行时间的增加, 阶段2中各反应器的TN去除率呈上升趋势, 并出现一定差异.阶段3中各反应器的TN去除率趋于稳定, 但差异较为明显, R3的TN去除率显著高于其他3个反应器(p < 0.05), 另外3个反应器的TN去除率相近, 4个反应器的TN去除率分别55%、54%、67%和55%.
由图 2c可知, 除阶段1的COD去除率有一定波动外, 阶段2和3的COD去除率均稳定在95%以上.
3.3 生物膜SAUR和SOUR图 3为运行53 d后4个反应器中生物膜的SAUR和SOUR.由图可知, 4个反应器中生物膜的SAUR分别为0.364、0.478、0.586和0.452 mg·g-1·min-1, 普通填料的SAUR最低, 表明磁场可以提高生物膜的氨氧化速率.R3中生物膜的SAUR最高, 分别是R1、R2和R4中生物膜SAUR的1.61、1.23和1.30倍.4个反应器中生物膜的SOUR分别为90.12、117.03、148.21、121.09 mg·g-1·h-1, 与SAUR结果一致.
图 3(Fig. 3)
 |
| 图 3 4种反应器的SAUR(a)和SOUR(b) Fig. 3SAUR (a) and SOUR(b) of four reactors |
3.4 生物膜形貌图 4为5 μm和50 μm尺度下的生物膜形貌.4个反应器的生物膜均由球菌和杆菌组成, R2生物膜中球菌比例更大, 而R3和R4生物膜中球菌与杆菌聚集更加紧密, 表明磁性陶粒填料表面的生物膜生长更好.
图 4(Fig. 4)
 |
| 图 4 生物膜形态的SEM图像(a.普通填料, b.普通填料外加磁场, c.磁性陶粒填料1, d.磁性陶粒填料2) Fig. 4SEM image of biofilm morphology (a.ordinary filler, b.ordinary filler with magnetic field, c.magnetic filler 1, d. magnetic filler 2) |
3.5 生物膜酶活和功能基因丰度4个反应器生物膜中功能酶AMO、NXR、NIR和NAR的活性及对应的6种功能基因amoA、nxrA、nirS、nirK、narG和napA的丰度见图 5.AMO和NXR是氨氧化和亚硝酸盐氧化过程中的功能酶, NAR和NIR是硝酸盐和亚硝酸盐还原过程中的功能酶.4个反应器中AMO的活性分别为1.68、2.49、3.81、3.18 mg·mg-1·h-1, NXR的活性分别为3.00、3.95、5.67、6.24 mg·mg-1·h-1, NAR的活性分别为4.42、5.22、5.58、4.41 mg·mg-1·h-1, NIR的活性分别为6.09、4.79、10.01、8.94 mg·mg-1·h-1(图 5a).可以看出, 两种磁性陶粒填料及外加磁场普通填料上生物膜的硝化反硝化酶活性均高于普通填料, 仅磁性陶粒填料2的NAR活性略低于普通填料, 磁性陶粒填料1的功能酶活性均为最高.
图 5(Fig. 5)
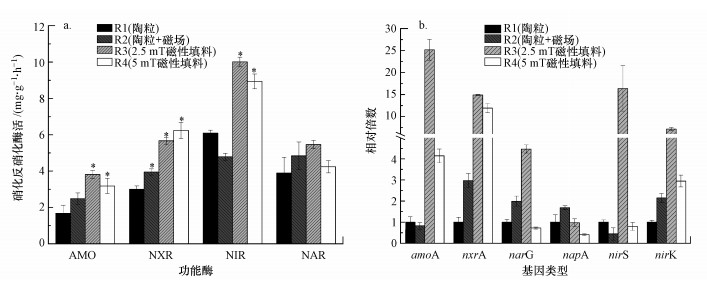 |
| 图 5 反应器中生物膜酶活(a)和功能基因丰度(b) Fig. 5Reactors′ biofilm enzyme activity(a) and functional gene abundance(b) |
图 5b为生物膜硝化反硝化功能基因的丰度.amoA和nxrA是两种硝化酶AMO和NXR的主要编码基因, 硝酸还原酶基因(narG和napA)和亚硝酸还原酶基因(nirS和nirK)是控制NAR和NIR表达的主要功能基因(Smith et al., 2007).由图 5b可知, 基因丰度与酶活的大小基本上具有相同变化趋势, 磁性陶粒填料1中各功能基因丰度最高, 控制NAR表达的两种功能基因(narG和napA)的丰度在磁性陶粒填料2生物膜中则降低(p < 0.05).
上述结果表明, 两种磁性陶粒填料均能显著提高生物膜硝化基因丰度(p < 0.05), 从而增加硝化功能酶活性, 但只有磁性陶粒填料1对反硝化功能基因丰度及其功能酶活性有增强作用.
3.6 生物膜微生物菌群分析图 6为4个反应器中生物膜属水平的微生物菌群结构热图.由图可知, 4个反应器中的硝化细菌主要为Nitrosomonas和Nitrospira.各反应器中Nitrosomonas丰度占比分别为0.53%、1.13%、1.94%、1.51%, Nitrospira丰度占比分别为1.42%、1.37%、12.93%、10.27%, 两种磁性陶粒填料生物膜中Nitrosomonas和Nitrospira的丰度显著高于另外两种填料.4个反应器中Thauera都是最主要的反硝化细菌, 丰度分别为49.64%、40.78%、25.77%和26.18%.磁性陶粒填料生物膜中Thauera占比较低, 但反硝化菌属Ignavibacterium和Dechloromonas的丰度较高, 两种菌属在R3中的丰度分别为6.18%、5.65%, 在R4中的丰度分别为4.69%、4.08%, 但在R1和R2中的丰度极低.反硝化菌属Denitratisoma也在磁性陶粒填料生物膜中有更高的丰度, 在4个反应器生物膜中的丰度占比分别为0.30%、0.59%、1.23%、1.48%.
图 6(Fig. 6)
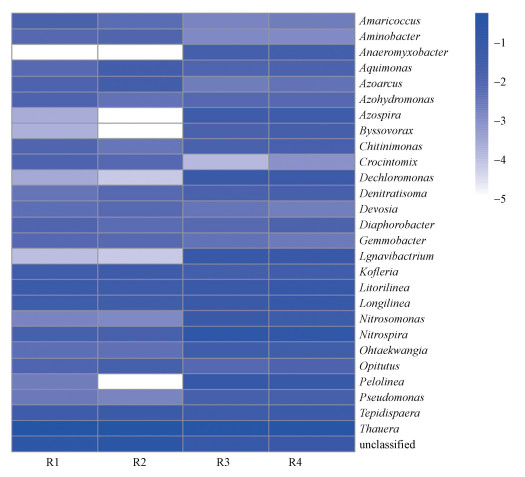 |
| 图 6 生物膜属水平的微生物群落结构 Fig. 6Microbial community structure at the level of genus in biofilm |
反应器性能、菌群结构、生物膜活性和功能酶活间关系的RDA分析见图 7.氨氮去除率、生物膜活性(SOUR和SAUR)及AMO、NXR的活性与Nitrosomonas和Nitrospira呈正相关, 表明这两个菌属与磁性陶粒填料生物膜硝化性能增强相关.TN去除率和NIR活性与Dentitrasoma、Dechloromonas及Ignavivacterium呈正相关, 表明这3个反硝化菌属与磁性陶粒填料生物膜反硝化性能增强相关.
图 7(Fig. 7)
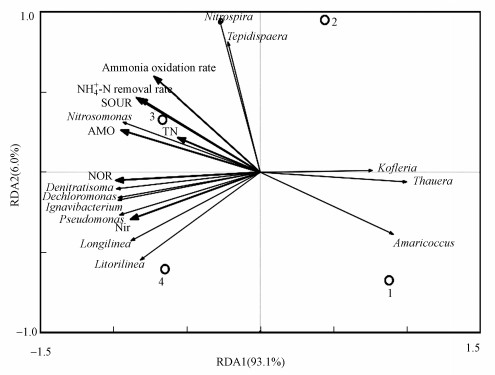 |
| 图 7 反应器性能、菌群结构、生物膜活性和功能酶活间关系的RDA分析(1~4代表R1~R4生物膜样品) Fig. 7RDA analysis(the composition of microbial communities related to the effluent quality of biofilm samples and biofilm activity) |
4 讨论(Discussion)本研究基于磁场对硝化菌的强化效果及载体对硝化菌的固定作用, 研制了磁性陶粒填料.制备的两种磁场强度磁性陶粒填料性能优异, NH4+-N浓度为400 mg·L-1时氨氮去除率大于99%, 且2.5 mT磁性陶粒填料具有较高的TN去除率(67%).Wei等(2014)采用好氧颗粒污泥处理NH4+-N浓度为200 mg·L-1的废水, 在C/N=3、HRT为16 h条件下, NH4+-N去除率为95%, TN去除率为48%.Hossain等(2019)采用聚糖菌生物膜处理含氨废水, 在C/N>10、HRT为8 h条件下, 当NH4+-N浓度从42 mg·L-1提高至168 mg·L-1时, 氨氮去除率下降至70%.Tan等(2018)的研究表明, 当进水氨氮浓度为200 mg·L-1、C/N为1.5、HRT为5 h时, NH4+-N去除率仅为46%, TN去除率为40%, 而当进水氨氮浓度为40~50 mg·L-1、C/N为9.5、HRT为5 h时, 出水氨氮几乎被完全去除.与上述研究结果相比, 本研究制备的磁性陶粒填料表现出更优的硝化反硝化效果, 氨氮和总氮去除率更高、更稳定, 且磁性陶粒填料挂膜启动更快, 仅6 d氨氮去除率即高于95%.
与普通填料及普通填料外加静态磁场相比, 磁性陶粒填料生物膜的活性(SAUR和SOUR)、硝化酶活(AMO和NXR)、硝化基因丰度(amoA和nxrA)及硝化菌属丰度均更高, 这表明磁性陶粒填料形成的弱磁场可以有效增强功能基因的表达、提高功能酶活性, 同时富集适应高氨氮的硝化菌.磁场可能通过以下途径提高微生物的硝化反硝化酶活与基因丰度, 从而提高硝化反硝化效果:①提高细胞膜的通透性.磁场可促进细胞膜的磷脂双分子层的重排, 从而增加细胞膜的通透性, 提高微生物利用外界物质的能力.有研究发现, 5 mT磁场没有增加AOB的丰度, 而是通过提高游离氨进入微生物细胞内的速率来提高AOB活性(Wang et al., 2017).②促进细胞内氧的使用效率.氧气是硝化过程的重要底物, 磁场作用下微生物传递和利用氧的效率得到提高, 从而提高了硝化能力(Rosen, 2003);③提高微生物细胞内电子传递效率.反硝化过程中降解碳源产生的电子通过微生物电子传递系统传递给反硝化酶, 磁场可能提高了电子产生与消耗的速率(Berks et al., 1995).④提高微生物细胞内铁含量.铁是参与微生物生长代谢、DNA/RNA合成、酶催化、电子转移的重要微量元素, 也是细胞色素和大多数硝化反硝化酶的活性位点.已有研究发现, 石墨烯可以使细胞吸收水中的铁元素, 提高细胞内铁含量, 从而提高微生物的酶活与基因丰度, 最终提高氮去除效率(Berks et al., 1995;Jiang et al., 2020).
适当强度的磁场可以提高微生物的生长代谢, 例如, Ji等(2010)发现在5 mT和20 mT磁场作用下, 混合污泥中菌种生长的迟滞期缩短了5 h, 对数生长期延长了2.5 h, 磁场作用下菌种生长曲线更大, 说明磁场提高了菌种的生长速度.Xu等(2014)发现6~10 mT的磁场可以促进蜡状芽孢杆菌表面胞外聚合物的分泌, 从而提高微生物的吸附作用.Filipic等(2015)发现暴露于30 mT和50 mT静态磁场的反应器的硝化率更高.本研究中4个反应器生物膜中的两个主要硝化细菌属均为Nitrosomonas和Nitrospira, Nitrosomonas为AOB (Sathvika et al., 2019), Nitrospira是两种主要的NOB之一, 二者在氨氧化过程中发挥着重要作用(Palomo et al., 2018).磁性陶粒填料反应器中的Nitrosomonas和Nitrospira丰度显著提高, Filipic等(2015)也发现低强度磁场对Nitrosomonas europaea生长有显著促进作用.酶是微生物体内重要的组成物质, 微生物从外界吸收降解物质的过程都需要多种酶的参与, 磁场可以提高微生物酶活从而提高处理效率.研究表明, 低强度磁场对大肠杆菌和恶臭假单胞菌具有正影响, 脱氢酶活性均有明显提升(Filipic et al., 2012).本研究也发现, 磁性陶粒填料生物膜的硝化基因丰度和酶活均高于普通填料及普通陶粒填料外加静态磁场.以上结果表明, 虽然磁性陶粒填料的孔径与孔体积小于普通陶粒填料, 但其形成的弱磁场可以提高硝化菌活性并富集硝化菌, 从而降低比表面积损失带来的负影响;磁性陶粒填料生物膜对于氨氮浓度升高造成的冲击也具有更好的适应能力, 从而避免了高氨氮抑制下硝化细菌生长慢、活性弱、去除率不高等问题(Liu et al., 2017; Wang et al., 2018a; Yang et al., 2019).
在阶段3中, 尽管进水C/N仅为1.25, 但R3反应器仍有较高的总氮去除率(67%), 达到了其他先进脱氮工艺的总氮去除水平, 如藻类细菌生物膜工艺(61%)(Johnson et al., 2018)和完全自养生物膜氮去除工艺(61.4%)(Liang et al., 2014).R3生物膜中的反硝化功能基因丰度和酶活显著高于其他3个反应器, 且R4生物膜中的反硝化功能基因丰度和酶活低于普通陶粒填料, 说明只有适宜的磁场强度才能提高反硝化性能, 磁场对反硝化菌的影响存在“窗口效应”.微生物结构群落分析表明, 普通填料(无外加磁场和外加50 mT静态磁场)上生物膜的反硝化优势菌属为Thauera.Thauera是一种具有有氧反硝化能力的异养菌属(Scholten et al., 1999; Kwon et al., 2019), 但有研究发现当环境中存在NO2--N时Thauera属内的一些菌株将停止反硝化(Liu et al., 2013), 因此, 可能是高氨氮下亚硝氮浓度升高抑制了Thauera的反硝化能力.此外, 碳氮比低也是导致Thauera反硝化能力下降的重要原因.两种磁性陶粒填料都可以提高反硝化菌属的多样性, 包括Denittrasoma、Dechloromonas和Ignavibacterium, RDA分析表明它们是提高R3反硝化能力的关键菌属.有研究指出, Denittrasoma和Ignavibacterium在反硝化过程中对外加碳源的需求较低.例如, Chang等(2011)指出, 从污水处理厂分离出的一株Denittrasoma菌株可以将NO2--N转化成N2O而不是N2, 这说明Denittrasoma可能存在不完全反硝化过程, 对于碳源需求较小.Ignavibacterium由于缺乏硝酸盐还原酶, 只能利用NO2--N而不是NO3--N作为电子受体进行反硝化(Liu et al., 2012; Ramos et al., 2016), 因而降低了对于碳源的需求.此外, 有研究表明Denittrasoma和Dechloromonas菌属能够利用微生物本身裂解和腐烂形成的内部碳源进行反硝化(Cao et al., 2016; Du et al., 2017; Zhang et al., 2019), 因此, 磁性陶粒填料生物膜可能通过短程反硝化和内源反硝化去除总氮.尽管磁性陶粒填料2(5 mT)上生物膜的关键反硝化微生物结构(Denittrasoma、Dechloromonas和Ignavibacterium)与磁性陶粒填料1(2.5 mT)相似, 但没有提高TN去除效率.这可能是由于磁性陶粒填料2(5 mT)形成的微观磁场虽然提高了大部分硝化反硝化酶活, 但抑制了NAR活性和功能基因narG和napA的丰度, 甚至低于普通填料, 导致水中大部分硝酸盐无法转化为亚硝酸盐, 从而降低了反硝化能力.
5 结论(Conclusions)本研究制备的两种磁性陶粒填料在氨氮浓度为400 mg·L-1时对氨氮的去除率均高于99%, 且挂膜启动时间更短, 对于氨氮浓度升高造成的冲击具有更强的适应能力.在氨氮浓度为400 mg·L-1、C/N为1.25时, 磁性陶粒填料1(2.5 mT)的TN去除率达67%, 其生物膜活性、硝化反硝化酶活性和功能基因丰度均显著高于普通陶粒填料及外加静态磁场的普通陶粒填料(p < 0.05).磁性陶粒填料能够富集硝化菌(Nitrospira、Nitrosomonas)并提高反硝化菌的多样性(Dechloromonas、Denittrasoma和Ignavibacterium), 其反硝化途径可能为短程反硝化和内源反硝化.
参考文献
| Araujo J C, Teran F C, Oliveira R A, et al. 2003. Comparison of hexamethyidisilazane and critical point drying treatments for SEM analysis of anaerobic biofilms and granular sludge[J]. Journal of Electron Microscopy, 52: 429-433. DOI:10.1093/jmicro/52.4.429 |
| Beretta G, Mastorgio A F, Pedrali L, et al. 2019. The effects of electric, magnetic and electromagnetic fields on microorganisms in the perspective of bioremediation[J]. Reviews in Environmental Science and Biotechnology, 18: 29-75. DOI:10.1007/s11157-018-09491-9 |
| Berks B C, Ferguson S J, Moir J W B, et al. 1995. Enzymes and associated electron transport systems that catalyse the respiratory reduction of nitrogen oxides and oxyanions[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1232: 97-173. |
| Bru D, Sarr A, Philippot L. 2007. Relative abundances of proteobacterial membrane-bound and periplasmic nitrate reductases in selected environments[J]. Applied and Environmental Microbiology, 73: 5971-5974. DOI:10.1128/AEM.00643-07 |
| Cao S, Du R, Li B, et al. 2016. High-throughput profiling of microbial community structures in an ANAMMOX-UASB reactor treating high-strength wastewater[J]. Applied Microbiology and Biotechnology, 100: 6457-6467. DOI:10.1007/s00253-016-7427-6 |
| Chang Y M, Yang Q, Hao C B, et al. 2011. activated sludge; nitrate removal; autotrophic denitrifying bacteria; clone library; phylogenetic analysis[J]. Chinese Journal of Environmental Science, 32: 1210-1216. |
| Dionisi H M, Layton A C, Harms G, et al. 2002. Quantification of Nitrosomonas oligotropha-like ammonia-oxidizing bacteria and Nitrospira spp.from full-scale wastewater treatment plants by competitive PCR[J]. Applied and Environmental Microbiology, 68: 245-253. DOI:10.1128/AEM.68.1.245-253.2002 |
| Du R, Cao S, Li B, et al. 2017. Performance and microbial community analysis of a novel DEAMOX based on partial-denitrification and anammox treating ammonia and nitrate wastewaters[J]. Water Research, 108: 46-56. DOI:10.1016/j.watres.2016.10.051 |
| Filipic J, Kraigher B, Tepus B, et al. 2012. Effects of low-density static magnetic fields on the growth and activities of wastewater bacteria Escherichia coli and Pseudomonas putida[J]. Bioresource Technology, 120: 225-232. DOI:10.1016/j.biortech.2012.06.023 |
| Filipic J, Kraigher B, Tepus B, et al. 2015. Effect of low-density static magnetic field on the oxidation of ammonium by Nitrosomonas europaea and by activated sludge in municipal wastewater[J]. Food Technology and Biotechnology, 53: 201-206. |
| Hossain M I, Cheng L, Cord-Ruwisch R. 2019. Energy efficient COD and N-removal from high-strength wastewater by a passively aerated GAO dominated biofilm[J]. Bioresource Technology, 283: 148-158. DOI:10.1016/j.biortech.2019.03.056 |
| Ji Y, Wang Y, Sun J, et al. 2010. Enhancement of biological treatment of wastewater by magnetic field[J]. Bioresource Technology, 101: 8535-8540. DOI:10.1016/j.biortech.2010.05.094 |
| Jia W, Zhang J, Lu Y, et al. 2018. Response of nitrite accumulation and microbial characteristics to low-intensity static magnetic field during partial nitrification[J]. Bioresource Technology, 259: 214-220. DOI:10.1016/j.biortech.2018.03.060 |
| Jiang M, Feng L, Zheng X, et al. 2020. Bio-denitrification performance enhanced by graphene-facilitated iron acquisition[J]. Water Research, 180: 115916. DOI:10.1016/j.watres.2020.115916 |
| Johnson D B, Schideman L C, Canam T, et al. 2018. Pilot-scale demonstration of efficient ammonia removal from a high-strength municipal wastewater treatment sidestream by algal-bacterial biofilms affixed to rotating contactors[J]. Algal Research, 34: 143-153. DOI:10.1016/j.algal.2018.07.009 |
| Kwon J H, Park H J, Lee Y Y, et al. 2019. Evaluation of denitrification performance and bacterial community of a sequencing batch reactor under intermittent aeration[J]. Journal of Environmental Science and Health Part a-Toxic/Hazardous Substances & Environmental Engineering, 2: 179-192. |
| Li Z, Zhu Y, Zhang J, et al. 2018. Evaluation of robustness of activated sludge using calcium-induced enhancement of respiration[J]. Bioresource Technology, 253: 55-63. DOI:10.1016/j.biortech.2018.01.013 |
| Liang Y, Li D, Zhang X, et al. 2014. Nitrogen removal and microbial characteristics in CANON biofilters fed with different ammonia levels[J]. Bioresource Technology, 171: 168-174. DOI:10.1016/j.biortech.2014.08.072 |
| Liu B, Mao Y, Bergaust L, et al. 2013. Strains in the genus Thauera exhibit remarkably different denitrification regulatory phenotypes[J]. Environmental Microbiology, 15: 2816-2828. |
| Liu T, Ma B, Chen X, et al. 2017. Evaluation of mainstream nitrogen removal by simultaneous partial nitrification, anammox and denitrification (SNAD) process in a granule-based reactor[J]. Chemical Engineering Journal, 327: 973-981. DOI:10.1016/j.cej.2017.06.173 |
| Liu Y, Liu Q, Li J, et al. 2018. Effect of magnetic powder on membrane fouling mitigation and microbial community/composition in membrane bioreactors (MBRs) for municipal wastewater treatment[J]. Bioresource Technology, 249: 377-385. DOI:10.1016/j.biortech.2017.10.027 |
| Liu Z, Frigaard N U, Vogl K, et al. 2012. Complete genome of Ignavibacterium album, a metabolically versatile, flagellated, facultative anaerobe from the phylum Chlorobi[J]. Frontiers in Microbiology, 3. |
| Massoompour A R, Borghei S M, Raie M. 2020. Enhancement of biological nitrogen removal performance using novel carriers based on the recycling of waste materials[J]. Water Research, 170: 115340. DOI:10.1016/j.watres.2019.115340 |
| Palomo A, Pedersen A G, Fowler S J, et al. 2018. Comparative genomics sheds light on niche differentiation and the evolutionary history of comammox Nitrospira[J]. Isme Journal, 12: 1779-1793. DOI:10.1038/s41396-018-0083-3 |
| Ramos C, Suárez-Ojeda M E, Carrera J. 2016. Denitritation in an anoxic granular reactor using phenol as sole organic carbon source[J]. Chemical Engineering Journal, 288: 289-297. DOI:10.1016/j.cej.2015.11.099 |
| Rosen A D. 2003. Effect of a 125 mT static magnetic field on the kinetics of voltage activated Na+ channels in GH3 cells[J]. Bioelectromagnetics, 24: 517-523. DOI:10.1002/bem.10124 |
| Sathvika T, Balaji S, Chandra M, et al. 2019. A co-operative endeavor by nitrifying bacteria Nitrosomonas and Zirconium based metal organic framework to remove hexavalent chromium[J]. Chemical Engineering Journal, 360: 879-889. DOI:10.1016/j.cej.2018.12.015 |
| Scholten E, Lukow T, Auling G, et al. 1999. Thauera mechernichensis sp nov., an aerobic denitrifier from a leachate treatment plant[J]. International Journal of Systematic Bacteriology, 49: 1045-1051. |
| Smith C J, Nedwell D B, Dong L F, et al. 2007. Diversity and abundance of nitrate reductase genes (narG and napA), nitrite reductase genes (nirS and nrfA), and their transcripts in estuarine sediments[J]. Applied and Environmental Microbiology, 73: 3612-3622. DOI:10.1128/AEM.02894-06 |
| Statistics C N B O, Protection C M O E. 2014. China Statistical Yearbook on Environment[M]. Beijing: China Statistics Press, 266. |
| Tan C, Xu H, Cui D, et al. 2018. Effects of tourmaline on nitrogen removal performance and biofilm structures in the sequencing batch biofilm reactor[J]. Journal of Environmental Sciences, 67: 127-135. DOI:10.1016/j.jes.2017.08.012 |
| Throback I N, Enwall K, Jarvis A, et al. 2004. Reassessing PCR primers targeting nirS, nirK and nosZ genes for community surveys of denitrifying bacteria with DGGE[J]. Fems Microbiology Ecology, 49: 401-417. DOI:10.1016/j.femsec.2004.04.011 |
| Wang C, Liu S, Xu X, et al. 2018a. Achieving mainstream nitrogen removal through simultaneous partial nitrification, anammox and denitrification process in an integrated fixed film activated sludge reactor[J]. Chemosphere, 203: 457-466. DOI:10.1016/j.chemosphere.2018.04.016 |
| Wang F, Zhou L, Zhao J. 2018b. The performance of biocarrier containing zinc nanoparticles in biofilm reactor for treating textile wastewater[J]. Process Biochemistry, 74: 125-131. DOI:10.1016/j.procbio.2018.08.022 |
| Wang X, Li J, Chen J, et al. 2020. Water quality criteria of total ammonia nitrogen (TAN) and un-ionized ammonia (NH3-N) and their ecological risk in the Liao River, China[J]. Chemosphere, 243: 125328. DOI:10.1016/j.chemosphere.2019.125328 |
| Wang Z, Liu X, Ni S Q, et al. 2017. Weak magnetic field:A powerful strategy to enhance partial nitrification[J]. Water Research, 120: 190-198. DOI:10.1016/j.watres.2017.04.058 |
| Wei D, Shi L, Yan T, et al. 2014. Aerobic granules formation and simultaneous nitrogen and phosphorus removal treating high strength ammonia wastewater in sequencing batch reactor[J]. Bioresource Technology, 171: 211-216. DOI:10.1016/j.biortech.2014.08.001 |
| Wertz S, Poly F, Le Roux X, et al. 2008. Development and application of a PCR-denaturing gradient gel electrophoresis tool to study the diversity of Nitrobacter-like nxrA sequences in soil[J]. Fems Microbiology Ecology, 63: 261-271. DOI:10.1111/j.1574-6941.2007.00416.x |
| Xu Y B, Hou M Y, Ruan J J, et al. 2014. Effect of magnetic field on surface properties of Bacillus cereus CrA and its extracellular polymeric substances (EPS)[J]. Journal of Adhesion Science and Technology, 28: 2196-2208. DOI:10.1080/01694243.2014.951303 |
| Yan T F, Fields M W, Wu L Y, et al. 2003. Molecular diversity and characterization of nitrite reductase gene fragments (nirK and nirS) from nitrate- and uranium-contaminated groundwater[J]. Environmental Microbiology, 5: 13-24. DOI:10.1046/j.1462-2920.2003.00393.x |
| Yang S, Xu S, Mohammed A, et al. 2019. Anammox reactor optimization for the treatment of ammonium rich digestate lagoon supernatant-Step feeding mitigates nitrite inhibition[J]. International Biodeterioration & Biodegradation, 143: 104733. |
| Ying L, Ai-Jun G, Jing Z. 2011. Study of treating high ammonia-N domestic wastewater with CASS process[J]. Procedia Environmental Sciences, 11: 858-863. DOI:10.1016/j.proenv.2011.12.131 |
| Zhang J, Zhang L, Miao Y, et al. 2019. Enhancing sewage nitrogen removal via anammox and endogenous denitrification:Significance of anaerobic/oxic/anoxic operation mode[J]. Bioresource Technology, 289: 121665. DOI:10.1016/j.biortech.2019.121665 |
| Zheng X O, Wu R, Chen Y G. 2011. Effects of ZnO nanoparticles on wastewater biological nitrogen and phosphorus removal[J]. Environmental Science & Technology, 45: 2826-2832. |
| Zieliński M, Cydzik-Kwiatkowska A, Zielińska M, et al. 2017. Nitrification in activated sludge exposed to static magnetic field[J]. Water, Air, & Soil Pollution, 228: 126. |
