 , 宫徽1, 苑泉1, 常风民1, 王建兵2, 王凯军1
, 宫徽1, 苑泉1, 常风民1, 王建兵2, 王凯军1

1. 清华大学, 环境学院, 北京 100084;
2. 中国矿业大学(北京), 化学与环境工程学院, 北京 100083
收稿日期: 2020-06-20; 修回日期: 2020-08-20; 录用日期: 2020-08-20
基金项目: 国家水体污染控制与治理科技重大专项(No.2017ZX07102,2017ZX07102-002)
作者简介: 宋亚朋(1992-), 男, E-mail:1053097879@qq.com
通讯作者(责任作者): 王凯军(1960—), 男, 博士, 教授, 主要研究方向为:厌氧生物发酵、水污染控制. E-mail: wkj@tsinghua.edu.cn
摘要:采用两种不同形态(固定生物膜和颗粒态)的厌氧氨氧化菌(AnAOB),考察了其对磁分离出水的脱氮性能、氮负荷的差异,同时从分子生物学的角度分析了微生物群落结构的变化.结果表明:采用自模拟污水,35℃恒温、不同水力停留时间(HRT)条件下,两个反应器对NH4+-N和NO2--N的去除率均大于90%.此外,反应器内的微生物群落结构也发生改变,固定生物膜和颗粒反应器中Candidatus Kuenenia菌属消失,Candidatus_Brocadia、Candidatus_Jettenia成为体系厌氧氨氧化优势菌属,相对丰度分别上升至0.89%、0.63%(固定生物膜)和8.79%、2.92%(颗粒).采用磁分离出水,随着HRT的降低,两种形态的厌氧氨氧化菌对NH4+-N和NO2--N去除率均在80%以上.反应器中厌氧氨氧化菌Candidatus_Brocadia、Candidatus_Jettenia的相对丰度明显下降,最终稳定维持在0.7%左右,并伴随异养菌的出现.
关键词:厌氧氨氧化菌固定生物膜颗粒磁分离微生物群落
Nitrogen removal performance through different AnAOB processes treating wastewater pretreated by magnetic separation and microbial community structure shifting analysis
SONG Yapeng1,2
 , GONG Hui1, YUAN Quan1, CHANG Fengmin1, WANG Jianbing2, WANG Kaijun1
, GONG Hui1, YUAN Quan1, CHANG Fengmin1, WANG Jianbing2, WANG Kaijun1

1. School of Environment, Tsinghua University, Beijing 100084;
2. School of Chemical and Environmental Engineering, China University of Mining and Technology(Beijing), Beijing 100083
Received 20 June 2020; received in revised from 20 August 2020; accepted 20 August 2020
Abstract: Two different anaerobic ammonia oxidation bacteria (AnAOB) processes (A: fixed biofilm process, B: granular process), which treated wastewater pretreated by magnetic separation, were compared. The performance of nitrogen removal and the nitrogen loading were investigated in this study. At the same time, the microbial community structure shift was also analyzed. The results showed that when treating simulated wastewater under different HRTs (5.4 h, 2.7 h and 2.1 h), both of NH4+-N and NO2--N removal rates were more than 90% at the constant temperature of 35 ℃. The microbial community analysis of both reactors revealed that the Candidatus Kuenenia bacteria disappeared, while Candidatus Brocadia and Candidatus Jettenia became the dominant AnAOB bacteria with relative abundance increasing to 0.89%, 0.63% (fixed biofilm) and 8.79%, 2.92% (granular), respectively. When treating wastewater pretreated by magnetic separation, the removal rates of NH4+-N and NO2--N at different HRTs (8 h, 4 h, 2 h and 1 h) were maintained above 80% for both reactors. The relative abundance of Candidatus Brocadia and Candidatus Jettenia were decreased (stable at about 0.7%) with the heterotrophic bacteria showing up.
Keywords: AnAOBfixed biofilmparticlemagnetic separationmicrobial community
1 引言(Introduction)厌氧氨氧化(Anaerobic Ammonium Oxidation, Anammox)是在缺氧条件下以氨为电子供体, 亚硝酸盐为电子受体, 直接将氨氧化为氮气的过程, 它可以同步去除氨氮和亚硝酸盐两种污染物, 参与这种脱氮反应的菌被称为厌氧氨氧化菌(Anaerobic Ammonium-Oxidizing Bacteria, AnAOB)(Kartal et al., 2013; Gao et al., 2018).厌氧氨氧化过程相比于传统硝化反硝化工艺具有节能降耗、脱氮高效等优势, 一经发现便备受关注(Fux et al., 2004; Tomaszewski et al., 2017).但AnAOB生长缓慢, 倍增周期较长, 并且污水中的有机物会导致异养菌的增殖, 抑制AnAOB的生长(Dapena-Mora et al., 2006; Jin et al., 2012; Zhu et al., 2016).所以主流厌氧氨氧化工艺应用于城市污水时, 需先对污水进行预处理去除部分有机物, 减少对AnAOB的影响(Chen et al., 2013).前端预处理包括膜分离工艺、AB法、磁分离碳源浓缩等(Laureni et al., 2015; Cao et al., 2017).采用前端预处理进行碳源富集、后端厌氧氨氧化工艺进行低碳源脱氮, 可有效进行碳源回收, 减少后端污水脱氮成本, 具有产能和节能的双重优势.另外, AnAOB在反应器中的存在形态可分为絮体、生物膜附着以及颗粒等(Strous et al., 1998), AnAOB可分泌胞外聚合物, 菌体之间可以相互附着生长从而形成颗粒污泥, 菌群也可以在载体上附着生长进而形成生物膜(Trigo et al., 2006; Star et al., 2008; Tao et al., 2009).
基于此, 本研究采用磁分离碳源浓缩出水为实验对象, 考察两种不同形态的AnAOB对氮的去除效果, 并通过考察微生物群落的变化情况, 验证低碳源磁分离出水对AnAOB的影响, 以期为主流厌氧氨氧化工艺的实际运用提供理论支撑.
2 材料与方法(Materials and methods)2.1 试验装置实验采用玻璃制成的升流式厌氧污泥反应床(UASB), 固定生物膜和颗粒反应器的有效体积分别为2.7、1 L(磁分离出水阶段反应器体积均为1 L).反应器上部设置三效分离器, 下部设置溢流口.每次配水结束使用氮气进行曝气20 min以除去水中的溶解氧, 并使用充满氮气的气袋对进水桶进行气压平衡, 反应器外裹锡箔纸防止产生光合细菌对AnAOB产生影响(图 1c).
图 1(Fig. 1)
 |
| 图 1 固定生物膜及AnAOB颗粒(a)、不同形态厌氧氨氧化反应器示意图(b)及实物图(c) Fig. 1Fixed biofilm, AnAOB bacteria particles(a), different forms of Anammox bacteria reactor(b) and reactor physical diagram(c) |
2.2 实验水质实验共分为模拟配水(表 1)和磁分离出水(表 2)两个阶段.模拟配水阶段, (NH4)2SO4和NaNO2按需添加, 微量元素浓缩液A、B各1 mL·L-1.其中, 微量元素浓缩液A的组成成分(mg·L-1)为:EDTA 5、FeSO4·7H2O 9.14;微量元素浓缩液B的组成成分(mg·L-1)为:EDTA 15、ZnSO4·7H2O 0.43、CoCl2·6H2O 0.24、MnCl2·4H2O 0.99、CuSO4·5H2O 0.25、NA2MoO4·2H2O 0.22、NiCl2·6H2O 0.19、H3BO3 0.014.反应温度为35 ℃, HRT分别为5.4、2.7 h(固定生物膜)和2、1 h(颗粒).
表 1(Table 1)
| 表 1 模拟配水水质 Table 1 Simulate wastewater quality | ||||||||||||
表 1 模拟配水水质 Table 1 Simulate wastewater quality
| ||||||||||||
表 2(Table 2)
| 表 2 磁分离出水水质 Table 2 Magnetic separation effluent water quality index | ||||||||||||
表 2 磁分离出水水质 Table 2 Magnetic separation effluent water quality index
| ||||||||||||
实际废水阶段, 采用磁分离出水作为处理对象, 首先城市污水经过磁分离工艺, 在磁粉、碳粉、混凝剂(PAC)、絮凝剂(PAM)等化学药剂的作用下完成碳源浓缩, 将污水中的部分杂质颗粒、SS等不溶性有机物去除, 采用磁分离上清液出水作为实验进水, 水质指标见表 2.其中, 厌氧氨氧化过程所需的亚硝酸盐根据进水氨氮浓度按需添加, 反应温度为室温, HRT分别为8、4、2、1 h.
2.3 实验项目及分析方法氨氮采用纳氏试剂分光光度法测定;亚硝酸盐氮采用N(1-萘基)-乙二胺分光光度法测定;硝态氮采用紫外分光光度法测定;总氮采用碱性过硫酸钾消解紫外分光光度法测定:COD采用重铬酸钾法测定;MLSS和MLVSS采用重量法测定.
3 结果与讨论(Results and discussion)3.1 模拟配水条件下不同形态厌氧氨氧化菌脱氮性能研究3.1.1 氮素变化图 2a表示不同HRT条件下固定生物膜反应器中NH4+-N、NO2--N及NO3--N浓度变化情况.进水NH4+-N和NO2--N浓度分别为37.14 mg·L-1和40.97 mg·L-1, 去除率分别为99.65%和90.68%.当进水NH4+-N/NO2--N接近1时, NO2--N存在剩余.可能是因为进水溶解氧较高, 部分NH4+-N被氨氧化细菌(AOB)所利用.通过缩短HRT, 同时降低NH4+-N和NO2--N进水浓度的方式保持系统负荷一致, NH4+-N和NO2--N去除率下降, 分别为95.43%和90.93%, 但出水NO3--N浓度下降.由于进水流量增加, 系统传质效果改善, 并且出水流速增加, 部分NO3--N被有效排出反应器.
图 2(Fig. 2)
 |
| 图 2 不同HRT固定生物膜(a)及颗粒(b)厌氧氨氧化反应器氮素变化(模拟配水) Fig. 2Nitrogen removal of fixed biofilm (a) and granular (b) anammox systems under different HRT |
颗粒反应器运行效果较好(图 2b), HRT为2 h, 进水NH4+-N和NO2--N的去除率分别为100%和97.25%, 缩短HRT为1 h后, 去除率分别为96.08%和86.39%.由于反应器AnAOB呈颗粒状, 菌体较重, 存于反应器的底部, 所以菌体与污染物的接触时间较短, NH4+-N和NO2--N不能被有效去除.总体比较固定生物膜和颗粒反应器运行过程中的氮素变化情况可以看出, 适当提高HRT有利于AnAOB脱氮性能提升.
3.1.2 化学计量比关系图 3a表示不同HRT条件下固定生物膜反应器NO2--N、NH4+-N的去除量与NO3--N的生成量的比值关系.从图中可以看出, 当HRT为5.4 h时, ΔNO2--N/ΔNH4+-N的值为0.93, 小于理论值1.32.主要是因为进水中部分NH4+-N发生硝化反应, 生成的NO2--N再发生厌氧氨氧化过程.HRT为2.7 h时, ΔNO2--N/ΔNH4+-N的值为1.14, 其值比较接近理论值.其中在第76 d时, ΔNO2--N/ΔNH4+-N值升高至2.42, 高于理论值1.32.这是因为当天进水NO2--N/NH4+-N比值较大, 过量的NO2--N发生了内源反硝化过程.另外当HRT为5.4 h, ΔNO3--N/ΔNH4+-N值为0.18, 低于理论值0.26, 因为进水部分NH4+-N发生硝化作用造成损失, 并且生物细胞的死亡与裂解为内源反硝化提供了碳源, 造成部分NO3--N消耗.HRT为2.7h, ΔNO3--N/ΔNH4+-N比较接近0.26, 运行状态较好.
图 3(Fig. 3)
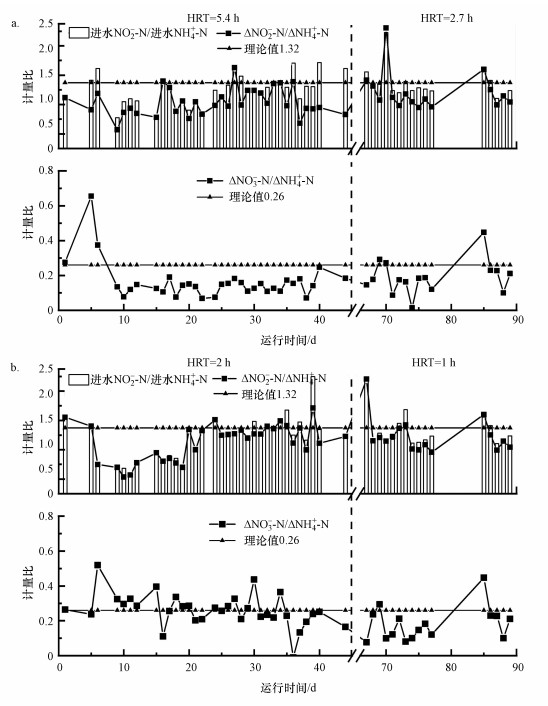 |
| 图 3 不同HRT固定生物膜(a)及颗粒(b)厌氧氨氧化反应器化学计量比变化(模拟配水) Fig. 3The stoichiometric ratio of fixed biofilm (a) and granular (b) anammox systems under different HRT |
颗粒反应器运行效果较好(图 3b), HRT为2 h, ΔNO2--N/ΔNH4+-N值为1.00, 小于理论值1.32.运行至第25 d后, 反应器趋于稳定.HRT为1 h, ΔNO2--N/ΔNH4+-N为1.21, 运行状态较好.其中在第70和74 d时, ΔNO2--N/ΔNH4+-N分别达到1.72和2.30.因为当天进水NO2--N/NH4+-N较大, 过量的NO2--N发生内源反硝化过程, 消耗量增加.启动初期, ΔNO3--N/ΔNH4+-N高于理论值.经过将近8 d的运行, ΔNO3--N/ΔNH4+-N为0.29, 接近理论值.在配水实验中, ΔNO2--N/ΔNH4+-N基本都小于理论值, 主要是因为进水溶解氧消耗了部分NH4+-N.而ΔNO3--N/ΔNH4+-N与理论值也有差别, 主要是因为部分细胞解体, 反应器内发生异养反硝化过程.
3.1.3 氮处理负荷图 4表示不同HRT条件下, 反应器容积氮负荷(NLR)、容积氮去除负荷(NRR)及容积氮去除率(NRE)的变化特征.从图 4a(固定生物膜)中可以看出, HRT为5.4 h, 反应器的容积氮负荷为0.38 g·L-1·d-1, 氮去除负荷为0.30 g·L-1·d-1, 容积氮去除率为78.85%.HRT为2.7 h, 反应器的氮容积负荷为0.30 g·L-1·d-1, 氮去除负荷为0.22 g·L-1·d-1, TN去除率(70.56%)略有下降.第73和74 d时, TN的去除率低至45%.因为进水NO2--N/NH4+-N较大, 部分NO2--N被亚硝酸盐氧化细菌(NOB)氧化为NO3--N, 并且内源反硝化程度有限, TN去除率下降.总体而言, 在不增加氮负荷的前提下, 减小HRT对生物膜反应器的脱氮效能影响较大.
图 4(Fig. 4)
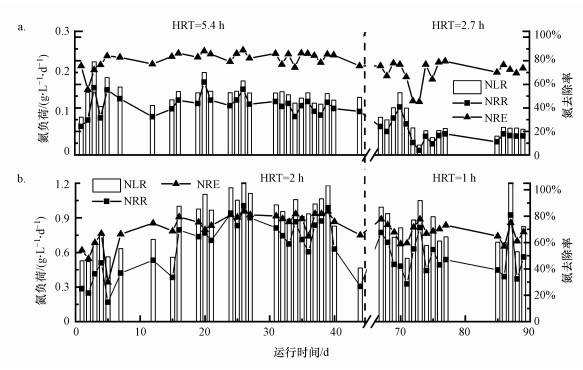 |
| 图 4 不同HRT固定生物膜(a)及颗粒(b)厌氧氨氧化反应器氮负荷变化(模拟配水) Fig. 4Total nitrogen load of fixed biofilm (a) and granular (b) anammox systems under different HRT |
颗粒反应器运行效果较好(图 4b), HRT为2 h, 反应器氮容积负荷为0.94 g·L-1·d-1, 氮去除负荷为0.71 g·L-1·d-1, TN去除率为78.85%.HRT为1 h, 氮容积负荷为0.79 g·L-1·d-1, 氮去除负荷为0.55 g·L-1·d-1, TN去除率为68.09%.HRT的降低减少了菌体与污染物的接触时间, 体系传质效果下降.另外, HRT的降低会造成反应器水体流速上升, 个别质量较轻的固定生物膜类的AnAOB会随着出水流出反应器, 造成体系生物量减少, 总氮去除率下降.
3.2 不同形态厌氧氨氧化细菌处理磁分离出水性能研究虽然厌氧氨氧化一直备受关注, 但主流厌氧氨氧化工艺发展缓慢.由于废水中氮浓度较低而有机物浓度相对较高等问题, 使其在主流工艺的应用中存在很大的限制(Wah et al., 2016; Cao et al., 2017).本文利用磁分离上清液进行后续厌氧氨氧化脱氮处理, 研究不同形态的AnAOB对磁分离出水的脱氮性能及其微生物群落的变化情况, 分析磁分离出水对AnAOB的影响.
3.2.1 氮素变化图 5所示为磁分离出水阶段, 固定生物膜及颗粒厌氧氨氧化反应器不同HRT条件下NH4+-N、NO2--N及NO3--N浓度的变化情况.HRT为8 h, 固定生物膜反应器进水NH4+-N和NO2--N的浓度分别为24.03 mg·L-1和16.30 mg·L-1, 去除率分别为96.79%和65.02%(图 5a).启动前期, 系统对NH4+-N的去除效果较好, 去除率均可达到90%以上;但对NO2--N的去除效果较差, 去除率仅为54.41%.反应前期AnAOB处于对实际废水的适应过程, 并且部分NH4+-N通过硝化过程去除.21 d以后, 系统对NO2--N的去除率逐渐上升, 由39.44%上升至100%.颗粒反应器对NH4+-N和NO2--N的去除率分别为98.35%和66.05%, 10 d以后, NO2--N的去除率逐渐上升至100%(图 5b).
图 5(Fig. 5)
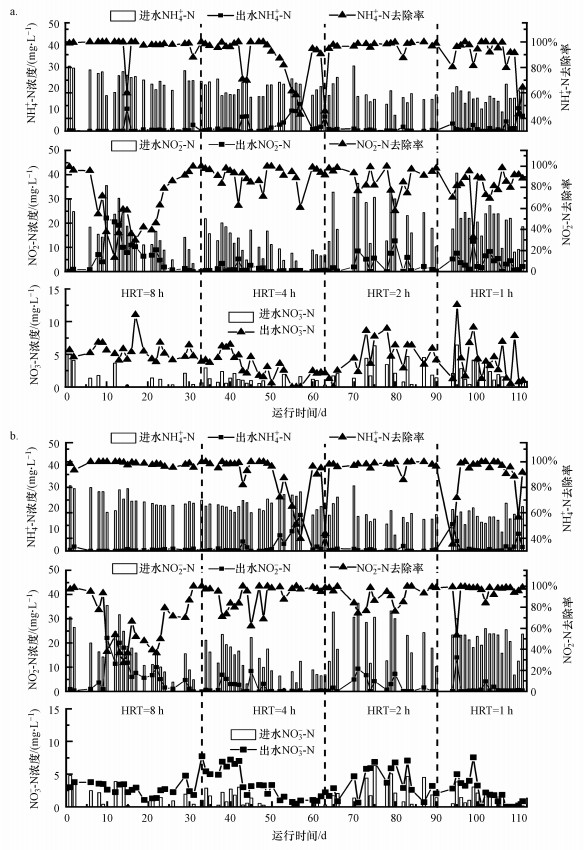 |
| 图 5 不同HRT固定生物膜(a)及颗粒(b)厌氧氨氧化反应器氮素变化(磁分离出水) Fig. 5Nitrogen removal of fixed biofilm (a) and granular (b) anammox systems under different HRT |
HRT为4 h, 固定生物膜和颗粒厌氧氨氧化反应器脱氮性能较好, 固定生物膜反应器对NH4+-N、NO2--N的去除率分别为86.19%、89.97%, 颗粒反应器对NH4+-N、NO2--N的去除率分别为87.36%和90.69%.说明两种形态的AnAOB逐渐适应磁分离出水水质, 在NO2--N充足的条件下, NH4+-N均可被高效去除.其中, 反应器运行至第43 d和51~57 d时, NH4+-N去除率明显下降, 主要是进水NO2--N浓度过低的原因.一方面, 人为添加NO2--N的量出现不足.另外实验过程中发现, 进水水箱中添加的NO2--N浓度会随着实验的进行降低.因为实际废水中存在部分COD和微生物, 不排除水箱中异养反硝化的发生, 造成反应器中NO2--N浓度不足, NH4+-N出现剩余.
HRT为2 h, 固定生物膜反应器对NH4+-N、NO2--N的去除率分别为97.31%、88.38%, 颗粒反应器对NH4+-N、NO2--N的去除率分别为97.37%、91.19%, NH4+-N去除率明显提高.HRT降低, 换水频率升高, 进水中的NO2--N可得到快速补充, 并且反应器进水流量增加造成少量溶解氧进入反应器, 加速NH4+-N的去除.HRT为1 h, 固定生物膜反应器对NH4+-N、NO2--N的去除率分别为89.12%、81.60%, 颗粒反应器对NH4+-N、NO2--N的去除率分别为89.49%、94.40%.HRT降低导致菌体与污染物接触时间不足, 脱氮效果下降.
3.2.2 化学计量比关系图 6表示磁分离出水条件下, 固定生物膜(图 6a)和颗粒(图 6b)厌氧氨氧化反应器不同HRT条件下NO2--N、NH4+-N的去除量与NO3--N的生成量, 即ΔNO2--N/ΔNH4+-N与ΔNO3--N/ΔNH4+-N的比值关系.HRT为8 h, 固定生物膜和颗粒反应器的ΔNO2--N/ΔNH4+-N值分别为0.41、0.43, 均低于理论值1.32, 并且有不断降低的趋势.可能是因为前期配水时, NO2--N浓度较低.另一方面, 进水溶解氧较高, 造成部分NH4+-N通过AOB的作用转化为NO2--N, 甚至存在NO2--N通过NOB的作用转化为NO3--N的情况.ΔNO3--N/ΔNH4+-N值分别为0.44、0.38, 高于理论值0.26, 这也佐证了前边的论述.
图 6(Fig. 6)
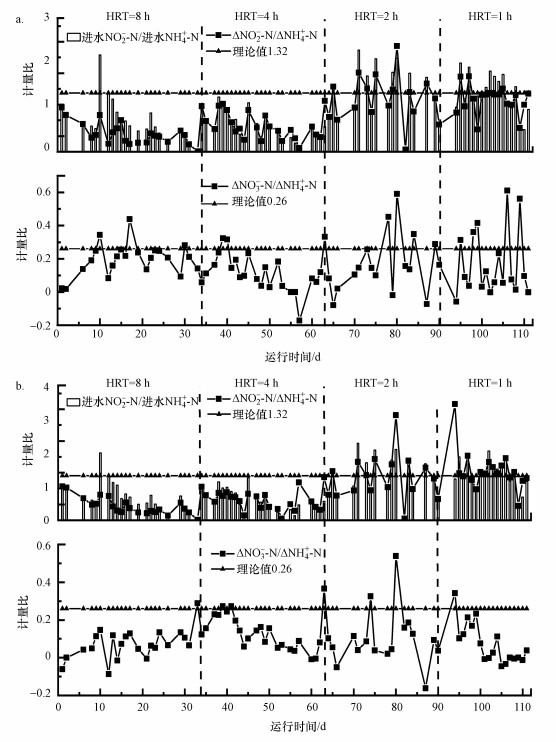 |
| 图 6 不同HRT固定生物膜(a)及颗粒(b)厌氧氨氧化反应器化学计量比变化(磁分离出水) Fig. 6The stoichiometric ratio of fixed biofilm (a) and granular (b) anammox systems under different HRT |
HRT为4 h, 固定生物膜和颗粒厌氧氨氧化反应器ΔNO2--N/ΔNH4+-N比值分别为0.59、0.61.并且从图中可看出, 根据换水频率, 进水NO2--N浓度出现周期性下降, 造成进水ΔNO2--N/ΔNH4+-N变小.并且从换水首次取样, 其值与理论值较为接近, 也说明进水箱中存在异养反硝化过程造成NO2--N的消耗.固定生物膜和颗粒厌氧氨氧化反应器ΔNO3--N/ΔNH4+-N分别为0.12、0.14, 也均较理论值小.主要原因是实际废水中存在的有机物造成异养反硝化脱氮过程, 反应器中NO3--N浓度降低.
HRT为2 h, 固定生物膜和颗粒厌氧氨氧化反应器ΔNO2--N/ΔNH4+-N分别为1.19、1.26, 接近理论值1.32.由于HRT降低换水频率升高, NO2--N得到有效补充, 厌氧氨氧化脱氮过程有序进行.其中, 固定生物膜反应器运行至第70、73、75、80和87 d、颗粒反应器运行至第71、75、80、83和87 d时, 两反应器ΔNO2--N/ΔNH4+-N明显高于理论值, 原因是磁分离出水NH4+-N浓度过低, 过量的NO2--N通过异养反硝化过程被去除.HRT为1 h, 固定生物膜和颗粒厌氧氨氧化反应器ΔNO2--N/ΔNH4+-N分别为1.17、1.48.
3.2.3 氮处理负荷图 7表示不同HRT条件下, 厌氧氨氧化系统容积氮负荷(NLR)、容积氮去除负荷(NRR)及容积氮去除率(NRE)的变化特征.HRT为8 h, 固定生物膜和颗粒反应器容积氮负荷分别为0.13和0.13 g·L-1·d-1, 氮去除负荷分别为0.07和0.08 g·L-1·d-1.反应前期, 两个反应器处于稳定期, 菌群对水质波动的适应缓冲能力较弱.HRT为4 h, 固定生物膜和颗粒反应器的容积氮负荷分别为0.19和0.20 g·L-1·d-1, 氮去除负荷分别为0.15和0.16 g·L-1·d-1, TN去除率分别为77.57%和77.55%.体系NO2--N浓度不足, 厌氧氨氧化脱氮过程受阻, TN去除率下降.但是, 虽然进水存在的有机物造成反应器内异养反硝化过程发生, 但AnAOB依然发挥着重要的脱氮作用.HRT为2 h, 固定生物膜和颗粒反应器容积氮负荷分别升高至0.49和0.49 g·L-1·d-1, 氮去除负荷分别为0.39和0.41 g·L-1·d-1, TN去除率分别为79.09%和83.60%. HRT为1 h, 固定生物膜和颗粒反应器容积氮负荷分别升高至0.91和0.93 g·L-1·d-1, 氮去除负荷分别为0.67和0.80 g·L-1·d-1, TN去除率分别为73.04%和86.51%.固定生物膜反应器的TN去除率开始降低, 而颗粒反应器进一步提高, 但提升幅度开始下降.
图 7(Fig. 7)
 |
| 图 7 不同HRT固定生物膜(a)及颗粒(b)厌氧氨氧化反应器总氮负荷变化(磁分离出水) Fig. 7Total nitrogen load of fixed biofilm (a), granular (b) anammox systems under different HRT |
3.2.4 COD变化图 8表示磁分离出水阶段, 不同HRT条件下固定生物膜和颗粒厌氧氨氧化反应器对COD的去除情况.固定生物膜和颗粒反应器进水COD分别为101.98和101.41 mg·L-1.实验前期(1~40 d), 固定生物膜和颗粒反应器对COD的去除率分别为41.70%和42.23%, 去除量分别为36.30和38.73 mg·L-1;实验后期对COD的去除率分别为49.31%和53.75%, COD的去除量也分别升高至65.27和64.38 mg·L-1.实验初始阶段, 厌氧氨氧化过程为主要脱氮方式, 异养反硝化过程较弱.随着反应器的运行, 异养反硝化作用逐渐增强, COD的消耗量逐渐增多.利用含有少量有机物的磁分离出水作为处理对象, 厌氧氨氧化过程和异养反硝化过程可同步发挥脱氮作用.并且厌氧氨氧化过程所产生的NO3--N可被异养反硝化作用去除, 反硝化过程所产生的CO2也可为厌氧氨氧化过程提供碳源.因此, AnAOB和异养反硝化菌等各类菌体可在低碳源磁分离出水中发挥协同脱氮效果.
图 8(Fig. 8)
 |
| 图 8 不同HRT固定生物膜(a)及颗粒(b)厌氧氨氧化反应器COD变化 Fig. 8COD removal of fixed biofilm (a) and granule (b) Anammox systems under different HRT |
3.3 微生物群落结构特征在系统发生学或群体遗传学研究中, 为了便于分析, 人为地划分操作分类单元, 称为OTU.本测试中将相似水平97%以上的聚类划定为一个OTU单元.因为分类层次越细, 鉴定率越大, 菌群解析结构越真实.综合考虑分类层次和鉴定率, 试验对微生物门和属水平的数据进行分析, 得到不同单元中的OTU、Shannon、Simpson、Chao、Ace指数和覆盖率如表 3所示, 其中, 1、2、3号样品分别为启动阶段、配水结束阶段、磁分离出水结束阶段所取样品.
表 3(Table 3)
| 表 3 反应器内微生物多样性和丰富度 Table 3 Microbial diversity and abundance in the reactor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 反应器内微生物多样性和丰富度 Table 3 Microbial diversity and abundance in the reactor
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
实验中固定生物膜和颗粒反应器3组微生物测序样本覆盖率均大0.98, 能保证测序结果的准确性.Shannon和Simpson指数代表样品多样性, OTU、Ace和Chao指数代表样品丰富度.由表 3可知, 随着反应器运行工况的改变, 微生物群落的多样性及丰富度均有所升高, 尤其经过磁分离出水阶段, 反应器Shannon、Simpson、OTU、Ace和Chao指数显著提高.磁分离出水中含有少量有机碳源, 有机物加入后异养菌得到增殖, 反应器内微生物种类增多, 异养反硝化菌丰度明显提高.
3.3.1 微生物门水平群落结构分析表 4表示不同阶段固定生物膜与颗粒反应器微生物门水平群落结构变化, 将微生物相对丰度大于1%的菌门作为主要菌门.两个反应器中主要包括绿弯菌门(Chloroflexi)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)、浮霉菌门(Planctomycetes)、厚壁菌门(Firmicutes)、装甲菌门(Armatimonadetes).其中, 固定生物膜反应器启动时主要包括Proteobacteria、Chloroflexi、Planctomycetes、Acidobacteria、Bacteroidetes、Firmicutes、Armatimonadetes、Actinobacteria, 相对丰度分别为36.33%、10.84%、9.01%、7.82%、5.01%、4.76%、2.68%、2.21%.颗粒反应器与固定生物膜反应器相似, 优势菌门为Bacteroidetes、Proteobacteria、Chloroflexi、Armatimonadetes、Planctomycetes、Firmicutes, 相对丰度分别为43.70%、22.64%、7.33%、6.01%、5.56%、2.89%.虽然两个反应器菌门种类基本相似, 但主要菌门略有区别, 固定生物膜反应器中优势菌门为Proteobacteria、Chloroflexi, 而颗粒反应器优势菌门为Bacteroidetes、Proteobacteria.模拟污水结束时, 固定生物膜反应器中的优势菌群由最初的Proteobacteria变为Chloroflexi(39.79%), 并且Actinobacteria(2.21%~12.62%)、Acidobacteria(7.81%~2.45%)、Planctomycetes(9.01%~2.38%)、Firmicutes(4.77%~0.91%)的相对丰度均有不同程度的升高或降低.颗粒反应器优势菌门也由Bacteroidetes变为Chloroflexi(37.98%), 这一特点与固定生物膜反应器相似.Chloroflexi是线形兼性厌氧菌, 通过滑行来移动, 是厌氧氨氧化体系中常见的菌门.研究发现, Chloroflexi的丝状结构有利于生物膜的形成, 并且可分解死亡的厌氧氨氧化细菌(Li et al., 2009; Kindaichi et al., 2012).另外, Chloroflexi也被认为是形成颗粒化污泥的主要菌门, 它可以与丝状菌相互缠绕形成颗粒核心, 稳定颗粒结构(Li et al., 2009), 因此, Chloroflexi在厌氧氨氧化体系中发挥着重要的作用.
表 4(Table 4)
| 表 4 不同阶段固定生物膜及颗粒厌氧氨氧化反应器门水平微生物群落结构变化及占比 Table 4 The microbial community and the proportion for Phylum level of fixed biofilm and granule Anammox systems under different HRT | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 4 不同阶段固定生物膜及颗粒厌氧氨氧化反应器门水平微生物群落结构变化及占比 Table 4 The microbial community and the proportion for Phylum level of fixed biofilm and granule Anammox systems under different HRT
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
磁分离出水阶段, 两反应器微生物群落丰度变化较大, 优势菌门发生改变.两反应器中Chloroflexi菌门相对丰度明显降低, Proteobacteria菌门相对丰度显著升高.反应初期, 固定生物膜反应器中的Chloroflexi(39.79%)、Proteobacteria(21.18%)、Actinobacteria(12.63%)、Bacteroidetes(5.75%)等优势菌门分别上升或下降至22.08%、29.87%、2.11%、9.14%.运行结束后, Proteobacteria、Chloroflexi、Bacteroidetes菌门的相对丰度分别为38.45%、22.80%、12.63%, 三者占总体的73.88%.颗粒反应器内Chloroflexi菌门的相对丰度由37.98%下降至25.61%, Proteobacteria菌门的相对丰度由23.26%上升至34.98%, Bacteroidetes菌门的相对丰度由6.13%上升至13.36%, 三者相对丰度占总体的73.95%.由于磁分离出水中含有少量有机物, 体系异养菌大量增殖会抑制厌氧氨氧化菌的生长, 导致Chloroflexi、Planctomycetes等菌门的相对丰度下降.Proteobacteria菌门是活性污泥中最丰富的优势菌群(Han-Woong et al., 2002), Proteobacteria菌门相对丰度的升高导致反应器中异养反硝化过程的发生.另外, 两反应器中的Bacteroidetes菌门相对丰度也有显著提高.Bacteroidetes菌门大部分为厌氧杆菌, 可以存在于缺氧和低氧条件下, 并广泛分布于土壤、沉积物等多种环境中, 从活性污泥均可分离获得, 属于污水处理工艺的常见菌种.研究表明, Bacteroidetes菌门可起到构建颗粒污泥骨架、水解污泥、固定生物膜的作用(Xia et al., 2008; Luo et al., 2013; Lu et al., 2014).由于进水有机物的作用导致Proteobacteria和Bacteroidetes等反硝化菌门相对丰度不断上升, Chloroflexi菌门可利用的有机物减少, 相对丰度下降.从两反应器运行情况可以看出, 虽然磁分离出水导致了异养菌的生长, 但反应器内的优势菌群可基本维持稳定, 并且可以相互协同脱氮.另外, 对比两个反应器的运行效果发现, 颗粒反应器中Proteobacteria菌门相对丰度可稳定维持在34%左右.固定生物膜反应器所受影响较大, Proteobacteria菌门相对丰度逐渐上升至38.45%, 并且有持续上升的趋势.由于颗粒反应器的颗粒污泥存在于反应器底部, 有机物进入反应器后与颗粒污泥的接触时间较短, 所以对AnAOB的影响较小;并且颗粒污泥处于絮聚状态, 生物量较大, 抗冲击能力也较强.
3.3.2 微生物属水平群落结构分析表 5表示不同阶段固定生物膜与颗粒反应器中微生物属水平的群落结构, 将微生物相对丰度>0.5%的菌属作为主要菌属.启动阶段, 固定生物膜反应器中检出的厌氧氨氧化菌为Candidatus Kuenenia, 相对丰度仅为3.95%, 颗粒反应器中检出的厌氧氨氧化菌包括Pirellula、Candidatus Brocadia、Candidatus Kuenenia, 相对丰度分别为1.94%、1.73%、0.97%, 占总体的4.64%.模拟配水结束后, 固定生物膜反应器中的优势菌属主要包括norank_o__SBR1031(22.66%)、Limnobacter (7.67%)、norank_c__OLB14(3.31%)、norank_f__A4b (1.31%)Candidatus_Brocadia (0.89%)、Candidatus_Jettenia (0.63%).其中, 厌氧氨氧化菌属Candidatus_Brocadia、Candidatus_Jettenia的相对丰度仅占总体的1.52%.颗粒反应器主要包括norank_o__SBR1031(16.69%)、Candidatus_Brocadia(8.79%)、norank_f__A4b(6.70%)、Denitratisoma(3.98%)、Limnobacter(3.42%)、Candidatus_Jettenia(2.92%), 厌氧氨氧化菌属的相对丰度占总体的11.71%.两反应器启动阶段的厌氧氨氧化菌Candidatus Kuenenia消失, Candidatus_Brocadia、Candidatus_Jettenia在系统中出现.之前有文献(Star et al., 2008)表明, Candidatus Kuenenia适合生长于低基质浓度的条件下, 而Candidatus_Brocadia适合生长于高基质条件下.自配水基质浓度较低, 该结果与之前研究不符.可能是由于实验是在恒温(35 ℃)下进行, 厌氧氨氧化各菌属适宜的生长环境不仅与基质浓度有关, 还受到温度等因素影响.norank_o__SBR1031、norank_f__A4b属于Chloroflexi菌门, 能够进行多种糖酵解途径.Limnobacter属于异养菌, 研究发现Limnobacter可与AnAOB共生, 并且可以保护AnAOB免受外界的干扰(Wang et al., 2018).
表 5(Table 5)
| 表 5 不同阶段固定生物膜及颗粒厌氧氨氧化反应器属水平微生物群落结构变化及占比 Table 5 The microbial community and the proportion for genus level of fixed biofilm and granule Anammox systems under different HRT | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 5 不同阶段固定生物膜及颗粒厌氧氨氧化反应器属水平微生物群落结构变化及占比 Table 5 The microbial community and the proportion for genus level of fixed biofilm and granule Anammox systems under different HRT
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
磁分离出水阶段, 微生物群落结构发生显著改变, 固定生物膜和颗粒反应器中norank_o__SBR1031菌属相对丰度不断下降, 分别由22.66%和16.69%下降至2.76%和2.32%, norank_c__OLB14成为两个反应器中的优势菌属, 相对丰度分别上升至12.21%和15.75%.并且随着反应器的运行, 两反应器Candidatus Kuenenia、Candidatus_Brocadia、Candidatus_Jettenia的相对丰度明显下降, 但可稳定维持在0.71%左右.norank_c__OLB14菌属于Chloroflexi菌门, 为厌氧消化的核心菌属, 磁分离出水中含有的少量有机物促进了norank_c__OLB14菌属的生长.norank_o__SBR1031和norank_f__A4b菌属同属于厌氧消化菌属范畴, 但两者相对丰度不断下降, 由于进水有机物负荷较低, norank_c__OLB14菌属相对于norank_o__SBR1031和norank_f__A4b菌属更适合在低基质负荷条件下生存.因此, 虽然磁分离出水中含有的少量有机物造成了异养菌的增殖, 并在一定程度上抑制了AnAOB的生长, 但两反应器对TN仍有较好的去除效果.说明在低碳源磁分离出水中, 异养反硝化菌和AnAOB可发挥耦合脱氮作用.
4 结论(Conclusions)1) 模拟配水阶段, 固定生物膜和颗粒反应器对NH4+-N和NO2--N的去除率均可达到90%以上, 化学计量比ΔNO2--N/ΔNH4+-N与ΔNO3--N/ΔNH4+-N接近理论值1.32和0.26.固定生物膜、颗粒反应器门水平最优势菌群分别由Proteobacteria、Bacteroidetes变为Chloroflexi(39.79%、37.98%).属水平上, 两反应器启动阶段的AnAOB菌Candidatus Kuenenia消失, 出现Candidatus_Brocadia、Candidatus_Jettenia菌, 并且颗粒反应器(8.79%和2.92%)中厌氧氨氧化菌的相对丰度远高于固定生物膜反应器(0.89%和0.63%).
2) 磁分离出水阶段, 固定生物膜反应器的生物量较低, 受到异养菌增殖的影响较大, 抗冲击负荷能力也相对较弱, 但两反应器在不同HRT条件下对NH4+-N和NO2--N的去除率也均可达到80%以上.两反应器门水平上的优势菌门由Chloroflexi菌门变为Proteobacteria菌门;属水平上, 厌氧氨氧化菌Candidatus Kuenenia、Candidatus_Brocadia、Candidatus_ Jettenia的相对丰度明显下降, 最终厌氧氨氧化菌Candidatus_Brocadia的相对丰度稳定维持在0.7%左右.因此, 两种形态的厌氧氨氧化菌对磁分离出水均表现出较好的脱氮效果, 可发挥高效率、低能耗的联合生物脱氮作用.
参考文献
| Cao Y, Loosdrecht M, Daigger G, et al. 2017. Mainstream partial nitritation-anammox in municipal wastewater treatment:status, bottlenecks, and further studies[J]. Applied Microbiology & Biotechnology, 101(4): 1365-1383. |
| Chen C, Huang X, Lei C, et al. 2013. Effect of organic matter strength on anammox for modified greenhouse turtle breeding wastewater treatment[J]. Bioresource Technology, 148: 172-179. DOI:10.1016/j.biortech.2013.08.132 |
| Dapena-Mora A, Fernández I, Campos J L, et al. 2006. Evaluation of activity and inhibition effects on Anammox process by batch tests based on the nitrogen gas production[J]. Enzyme & Microbial Technology, 40(4): 859-865. |
| Fux C, Siegrist H. 2004. Nitrogen removal from sludge digester liquids by nitrification/denitrification or partial nitritation/anammox:environmental and economical considerations[J]. Water Science & Technology, 50(10): 19-26. |
| Gao D, Wang X, Hong L, et al. 2018. Anaerobic ammonia oxidizing bacteria:Ecological distribution, metabolism, and microbial interactions[J]. Frontiers of Environmental Science and Engineering, 12(3): 10-25. DOI:10.1007/s11783-018-1035-x |
| Han Woong L, Soo Youn L, Jin Woo L, et al. 2002. Molecular characterization of microbial community in nitrate-removing activated sludge[J]. Fems Microbiology Ecology, 41(2): 85-94. DOI:10.1111/j.1574-6941.2002.tb00969.x |
| Jin R C, Yang G F, Yu J J, et al. 2012. The inhibition of the Anammox process:A review[J]. Chemical Engineering Journal, 197: 67-79. DOI:10.1016/j.cej.2012.05.014 |
| Boran K, De A N M, Maalcke W J, et al. 2013. How to make a living from anaerobic ammonium oxidation[J]. Fems Microbiology Reviews, 37(3): 428-461. DOI:10.1111/1574-6976.12014 |
| Kindaichi T, Yuri S, Ozaki N, et al. 2012. Ecophysiological role and function of uncultured Chloroflexi in an anammox reactor[J]. Water Science & Technology, 66(12): 2556-2561. |
| Laureni M, Weissbrodt D G, Szivák I, et al. 2015. Activity and growth of anammox biomass on aerobically pre-treated municipal wastewater[J]. Water Research, 80: 325-336. DOI:10.1016/j.watres.2015.04.026 |
| Li X R, Du B, Fu H X, et al. 2009. The bacterial diversity in an anaerobic ammonium-oxidizing (anammox) reactor community[J]. Systematic and Applied Microbiology, 32(4): 278-289. DOI:10.1016/j.syapm.2009.03.002 |
| Lu H, Chandran K, Stensel D. 2014. Microbial ecology of denitrification in biological wastewater treatment[J]. Water Research, 64(1): 237-254. |
| Luo J, Liang H, Yan L, et al. 2013. Microbial community structures in a closed raw water distribution system biofilm as revealed by 454-pyrosequencing analysis and the effect of microbial biofilm communities on raw water quality[J]. Bioresource Technology, 148: 189-195. DOI:10.1016/j.biortech.2013.08.109 |
| Star W R L V D, Miclea A I, Dongen U G J M V, et al. 2008. The membrane bioreactor:A novel tool to grow anammox bacteria as free cells[J]. Biotechnology & Bioengineering, 101(2): 286-294. |
| Strous M, Heijnen J J, Kuenen J G, et al. 1998. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms[J]. Applied Microbiology and Biotechnology, 50(5): 589-596. DOI:10.1007/s002530051340 |
| Tao W, Zhang H, Yang F, et al. 2009. Start-up of the Anammox process from the conventional activated sludge in a membrane bioreactor[J]. Bioresource Technology, 100(9): 2501-2506. DOI:10.1016/j.biortech.2008.12.011 |
| Tomaszewski M, Cema G, Ziembińska-Buczyńska A. 2017. Influence of temperature and pH on the anammox process:a review and meta-analysis[J]. Chemosphere, 182: 203-214. DOI:10.1016/j.chemosphere.2017.05.003 |
| Trigo C, Campos J L, Garrido J M, et al. 2006. Start-up of the Anammox process in a membrane bioreactor[J]. Journal of Biotechnology, 126(4): 475-487. DOI:10.1016/j.jbiotec.2006.05.008 |
| Wang C, Liu S T, XuX C, et al. 2018. Achieving mainstream nitrogen removal through simultaneous partial nitrification, anammox and denitrification process in an integrated fixed film activated sludge reactor[J]. Chemosphere Environmental Toxicology & Risk Assessment, 203: 457-466. |
| Xia Y, Kong Y, Thomsen T R, et al. 2008. Identification and ecophysiological characterization of epiphytic protein-hydrolyzing saprospiraceae ("Candidatus Epiflobacter" spp.) in activated sludge[J]. Applied Environmental Microbiology, 74(7): 2229-2238. DOI:10.1128/AEM.02502-07 |
| Yeshi C, Hong K B, van Loosdrecht M C, et al. 2016. Mainstream partial nitritation and anammox in a 200000 m3/day activated sludge process in Singapore:scale-down by using laboratory fed-batch reactor[J]. Water Science Technology, 74(1): 48-56. DOI:10.2166/wst.2016.116 |
| Zhu W, Zhang P, Dong H, et al. 2016. Effect of carbon source on nitrogen removal in anaerobic ammonium oxidation (anammox) process[J]. Journal of Bioscience & Bioengineering, 123(4): 497-504. |
