
 , 李耿贤1,2, 刘航1,2, 刘莹子3, 任宇铭3, 周煜杰3, 高凡3
, 李耿贤1,2, 刘航1,2, 刘莹子3, 任宇铭3, 周煜杰3, 高凡31. 中国科学院生态环境研究中心, 中国科学院饮用水科学与技术重点实验室, 北京 100085;
2. 中国科学院大学, 北京 100049;
3. 农业农村部华北都市农业重点实验室/北京农学院资源与环境系, 北京 102206
收稿日期: 2020-10-13; 修回日期: 2020-11-12; 录用日期: 2020-11-12
基金项目: 中国科学院饮用水科学与技术重点实验室专项经费(No.20Z01KLDWST);北京农学院2020年度"实培计划"项目
作者简介: 刘超(1983-), 男, 研究员(博士)
通讯作者(责任作者): 刘超(1983—), 男, 中国科学院生态环境研究中心研究员, 博士生导师, 美国克莱姆森大学兼职教授.研究兴趣包括复合水处理过程的机制探讨和技术研发、非传统水源水质净化、水消毒氧化与副产物控制、输配水水质保持.研究成果发表于Environmental Science & Technology、Water Research等权威刊物, 同时担任Journal of Environmental Chemical Engineering编委.E-mail:chaoliu@rcees.ac.cn
摘要:源水水质的恶化给传统的饮用水处理工艺带来了挑战.生物过滤是饮用水消毒输配之前管理、维护及增强颗粒滤料表面生物活性以去除有机和无机物的过程.由于具有高效、低成本等优点,生物过滤在饮用水深度处理工艺中逐渐得到广泛的应用.本文综述了生物过滤在饮用水处理过程中对水中溶解性有机质(消毒副产物前体物)的去除、微量污染物的削减、嗅味化合物及氨氮的去除等.此外,针对生物过滤在水深度处理过程中存在的问题,本文详细讨论了含氮消毒副产物前体物的生成、低温下生物过滤效能下降等挑战,并提出了今后需要研究的问题.
关键词:生物过滤水深度处理生物活性炭消毒副产物微量污染物
Applications of biologically active filtration in drinking water advanced treatment processes: Opportunities and challenges
LIU Chao1,2

 , LI Gengxian1,2, LIU Hang1,2, LIU Yingzi3, REN Yuming3, ZHOU Yujie3, GAO Fan3
, LI Gengxian1,2, LIU Hang1,2, LIU Yingzi3, REN Yuming3, ZHOU Yujie3, GAO Fan31. Key Laboratory of Drinking Water Science and Technology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085;
2. University of Chinese Academy of Sciences, Beijing 100049;
3. Key Laboratory for Northern Urban Agriculture of Ministry of Agriculture and Rural Affairs/Department of Resources and Environment, Beijing University of Agriculture, Beijing 102206
Received 13 October 2020; received in revised from 12 November 2020; accepted 12 November 2020
Abstract: The deteriorated source water quality results in great challenges for drinking water quality and treatment technologies. Biofiltration is an operational practice of managing,maintaining,and promoting biological activity on granular media in a filter to enhance the removal of organic and inorganic constituents in water prior to the final disinfection and introduction into the distribution system. Due to its high effectiveness and low cost,biofiltration has been increasingly used in drinking water advanced treatment processes worldwide. This paper reviews,in a comprehensive manner,the application of biofiltration in drinking water treatment,including the removal of dissolved organic matter serving as the precursors of disinfection byproducts (DBPs) in the downstream disinfection process,the abatement of micropollutants and taste and odor compounds,the nitrification of ammonia,etc. In addition,this critical review highlights the challenges during the applications of biofiltration,such as the formation of nitrogenous DBP precursors,decreases in performance of biofiltration at cold temperature,etc. This review also identifies several knowledge gaps that can be addressed in future.
Keywords: biofiltrationadvanced water treatmentbiological activated carbondisinfection byproductsmicropollutants
1 引言(Introduction)不断恶化的源水水质(农药对水源的微污染、工业废水和生活污水影响、湖泊蓝藻爆发)及多种水源的使用(污废水回用)给饮用水安全保障带来挑战.据环境保护部2011年对地级以上城市集中式饮用水水源环境状况调查显示, 约35.7亿m3水源水质不达标, 占总供水量的11.4%.Gao等(2009)于2003—2004年分析了我国地表水中600个点的样品, 检出6种有机磷农药, 其中敌敌畏的检出频率达89.1%, 最大浓度达1.552 μg·L-1.这些有毒、具有潜在致癌效应的微量污染物, 长期暴露会对人体健康造成危害.其次, 受工业废水与污水厂出水排放、雨水和农业面源污染影响, 以及富营养化导致的蓝藻水华释放藻源有机质, 使得水源中增加了许多新型有机质.其比天然有机质更亲水, 而饮用水常规混凝-沉淀-砂滤-消毒工艺对其处理效果较差, 因此, 水厂出水中这些有机质占总有机碳的比例将显著上升.饮用水源的微污染给饮用水安全保障带来挑战, 这要求水行业者必须提高处理工序的效能以保障饮用水安全.
生物过滤是饮用水消毒输配之前管理、维护及增强颗粒滤料表面生物活性以去除有机和无机物的过程(Evans et al., 2019).本文综述了生物过滤在饮用水深度处理工艺中的应用, 包括对水中溶解性有机质(消毒副产物前体物)的去除、微量污染物的削减、嗅味化合物的控制及氨氮的去除等.针对生物过滤在饮用水深度处理过程中存在的问题, 详细讨论了低温下生物过滤效能下降、含氮消毒副产物前体物的生成等挑战.最后, 探讨了当前研究中存在的不足并展望了今后值得深入研究的方向.
2 生物过滤过程简介(Biologically active filtration process)饮用水生物过滤是管理、维护及增强颗粒滤料表面生物活性以去除有机和无机污染物的过程(图 1)(Liu et al., 2017), 具备过滤、生物降解及吸附等多重功能, 可以去除颗粒物、有机物、氨氮及铁锰等(Basu et al., 2016).生物过滤工艺可采用砂砾、无烟煤及颗粒活性炭(GAC)等作为滤料, 其中, GAC由于其较大的比表面积与良好的吸附性能而成为生物过滤工艺的理想滤料(Evans et al., 2019).当前置臭氧(O3)氧化工艺时, 被称为臭氧生物活性炭(O3-BAC)工艺.臭氧可将大分子有机物氧化为小分子产物, 提高水体的可生化性.另外, O3在水中可分解为氧气, 从而提高水体的溶解氧, 促进生物吸附和降解.由于O3-BAC工艺突出的优点, 其在饮用水深度处理中的应用越来越广泛, 目前国内外已有上千座水厂采用该工艺(Brown et al., 2016).此外, 生物过滤工艺被认为是一种高效环保的绿色工艺, 在部分污水回用深度处理工艺中得到重视, 有望取代反渗透等高能耗的膜分离过程.
图 1(Fig. 1)
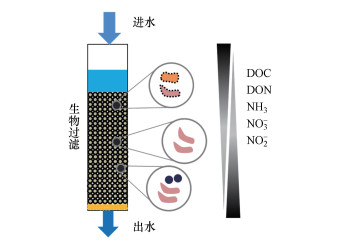 |
| 图 1 生物过滤过程示意图 (圆圈代表微生物群落) Fig. 1Diagram of biologically activate filtration process (circles represent microorganisms) |
3 生物过滤在饮用水深度处理过程中的应用(Applications of biologically activate filtration in drinking water advanced treatment processes)3.1 水中溶解有机质(消毒副产物前体物)的去除饮用水加氯消毒在灭活病原微生物的同时也会与水中有机质反应, 生成有毒的消毒副产物(DBPs)(Liu et al., 2016;Liu et al., 2018).三卤甲烷(THMs)和卤乙酸(HAAs)作为最早被发现的DBPs已被列入多种饮用水法规中.近年来, 由于水源中含氮物质浓度的增加及氯胺等替代消毒剂的使用, 以含氮物质作为前体物的N-DBPs日益引起水处理行业的关注.这些N-DBPs包括卤乙腈(HANs)、卤乙酰胺(HAcAms)、卤硝基甲烷(HNMs)及亚硝胺(NAs)(Shah et al., 2012).尽管N-DBPs在饮用水中的浓度低于列入饮用水法规的THMs, 但其细胞和遗传毒性比后者高2~4个数量级(Wagner et al., 2017).因此, 目前多国的卫生环保部门都在考虑将N-DBPs列入饮用水污染物清单或进一步降低其限值.
由于水厂出水需要加氯(胺)消毒进入输配系统, 所以生物过滤等处理工序对水中溶解有机质的去除效能决定了后续消毒工艺中DBPs的生成与控制.表 1显示了前置臭氧化和生物过滤去除DBP前体物的效能.自20世纪90年代始, 已有中试研究表明生物过滤可有效去除20%~30%的THMs和HAAs的前体物, 在前置臭氧工艺时, 其处理效果更佳(Price et al., 1993).
表 1(Table 1)
| 表 1 前置臭氧化和生物过滤去除DBP前体物效能 Table 1 Removal of DBP precursors in biofiltration with pre-ozonation | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 前置臭氧化和生物过滤去除DBP前体物效能 Table 1 Removal of DBP precursors in biofiltration with pre-ozonation
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Chaiket等(2001)针对美国印第安纳波利斯白河水(溶解性有机碳(DOC):2.5~3.0 mg·L-1, 254 nm下标准吸光值(SUVA254):2.5 L·mg-1·m-1), 选择O3和生物过滤联用工艺(O3剂量:0.3~1.0 (O3/DOC, 质量比); 无烟煤和GAC滤料高度:51 cm; 空床接触时间(EBCT):5 min)进行处理, 结果显示, 该工艺对THMs和HAAs生成势的去除率为16%~25%, 显著高于单独臭氧化(Chaiket et al., 2002).在另外一项中试研究中, Ko等(2007)以韩国首尔Tukdo水作为待处理水体, 探讨了生物过滤([O3]/[DOC]=0.75;GAC床高度:2 m; 底层砂床高度:20 cm; 直径:5 cm; EBCT:5~20 min)对DOC和DBP的控制效能, 结果表明, 臭氧和生物过滤对DOC的去除率为13%~25%, 相应地, THM生成势去除率为20%~33%, 活性炭表面生物膜中的主要微生物种群为Clavibactor和Corynebacterium.
在北美的饮用水厂水质调查报告中, Mitch等(2009)发现生物过滤工艺可有效去除水中25%的DOC和18%的溶解有机氮(DON), 但对SUVA254的去除率仅为12%, 因此, 对THM前体物的去除率仅为3%.Mitch等(2009)发现尽管前置臭氧化增强了三氯乙醛和HNM的前体物(以生成势FP表征)生成, 但后续的生物过滤可以去除55%和75%的前体物, 而对NAs的前体物去除率为67%.
研究发现, O3-BAC工艺较单独的GAC吸附对黄河水THM前体物的去除效率更佳, 这是由于前置的臭氧氧化可将大分子量的DOM组分氧化为低分子量的可生化的DOM, 从而被BAC生物降解(Yan et al., 2010).Chu等(2012)发现, 尽管臭氧化(1.5~2.0 mg·L-1, 30 min)增强了三氯硝基甲烷(TCNM)的生成势, 但后续的生物过滤对二氯乙腈(DCAN)、TCNM及二氯乙酰胺(DCAcAm)生成势的去除率分别为50%、82%和60%.Liao等(2014)搭建了中试O3-BAC系统(O3剂量:0.5~1.5 mg·L-1, 反应时间:7.5 min, 滤池直径:40 cm, GAC填料高度:100 cm, EBCT:15 min), 并研究其对9种NAs前体物的去除效率, 结果发现, 系统运行初始对N-二甲基亚硝胺(NDMA)的去除效率为88%, 但经过13个月运行后由于活性炭吸附性能的下降, 其效率降低至59%.生物吸附只贡献了约10%的去除效率, 生物降解占主导地位, 但其去除速率较低(Liao et al., 2015).Selbes等(2017)研究发现, 生物过滤中试装置(O3剂量:1.0~2.2 mg·L-1; EBCT:5.1~8.8 min)对THMs、HAAs、HNMs、HANs及NDMA前体物的去除效率分别为13%~45%、18%~57%、25%~48%、15%~20%及34%~50%, 并且磷酸盐投加策略(投加量:0~0.21 mg·L-1)对生物过滤效能无明显提升.Fu等(2017)研究了串联的砂/无烟煤生物过滤(EBCT:7.5 min)和GAC过滤(EBCT:7.5 min)中试装置对36种DBPs前体物的去除效率, 结果表明, 生物过滤可提供25.9%的DBPs前体物去除率, 其中后续的GAC生物过滤贡献了60.6%的去除率.
此外, 也有研究表明生物过滤可有效去除污废水处理系统出水中的THMs和HAAs前体物(Farré et al., 2011;Chuang et al., 2017).例如, Farré等(2011)发现中试BAC装置(O3剂量:5 mg·L-1, EBCT:60 min)在污水回用系统中可将THMs和HAAs前体物分别从240和260 μg·L-1削减至140和135 μg·L-1, 该BAC装置对NDMA前体物的去除率为80%(从250 ng·L-1降至50 ng·L-1).Chuang等(2017)以生活污水厂出水作为研究对象, 发现O3-BAC(O3剂量:0.7 mg·mg-1 DOC, EBCT:15 min)对THMs前体物的去除率为78%±4.9%, 而对HAAs前体物的去除率为83%±3.6%;此外, 对TCNM、HAcAms及HANs的去除率在80%以上, 然而对NAs的去除率则差异较大(-19%~84%).
3.2 微量污染物的削减与水中的溶解性有机质(mg·L-1级别)相比, 微量污染物的浓度一般处于ng·L-1或μg·L-1范围.这些微量的有机物通过饮用水的长期暴露可能会危害人体健康.表 2显示了生物过滤去除微量污染物的效能.
表 2(Table 2)
| 表 2 生物过滤去除微量污染物效能 Table 2 Removal of micropollutants in biofiltration | ||||||||||||||||||||||||||||||||||||||||||||||||
表 2 生物过滤去除微量污染物效能 Table 2 Removal of micropollutants in biofiltration
| ||||||||||||||||||||||||||||||||||||||||||||||||
Zearley和Summers(2012)考察了砂填料生物过滤装置对34种微量污染物(农药、药物与个人护理品)的去除, 这些微量污染物具有不同的化学结构、吸附能力及生物降解速率, 结果表明:13种化合物的去除率低于15%, 属于难降解物质, 这些物质大部分属于农药, 如阿特拉津、乙草胺、西马津、甲萘威、二嗪农、敌草隆、扑灭通、灭多威、异丙甲草胺; 此外, 碘普罗胺在EBCT为15.8 min时的去除率仅为3%;与此相反, 有19种物质可被完全去除, 其降解符合一级反应动力学, 反应速率为0.02~0.37 min-1.Halle等(2015)搭建2座无烟煤填料生物过滤装置(EBCT分别为5和14 min), 考察其对微量污染物(卡马西平、阿特拉津、N、N-二乙基间甲苯胺、萘普生、布洛芬, 浓度为0.5~5 μg·L-1)的去除率, 结果表明, 卡马西平和阿特拉津难以生物降解, 而N、N-二乙基间甲苯胺、萘普生和布洛芬的去除率相对较高.McKie等(2016)以安大略河水作为研究对象, 考察了O3-生物过滤过程(O3剂量1 mg·L-1, O3/DOC=1:2, 接触时间8 min, EBCT为16 min)对水中投加的9种药物和2种甜味剂的去除效率, 结果发现, 生物过滤对9种药物的平均去除率为39%, 加入0.8 mg·L-1 PACl可将去除率提高到70%;而对2种甜味剂的去除率为19%, 提高PACl剂量可提升去除率至30%以上.
Greenstein等(2018)运行了250 d的GAC/砂双层生物过滤中试装置, 进水为预臭氧化的科罗拉多河水, 水中含有约100 ng·L-1的微量污染物, 在开始的140 d, 咖啡因等污染物的去除率逐步降低, 这表明污染物的去除途径正在由吸附向生物降解转移; 140 d后该装置可稳定去除水中的微量污染物, 对乙酰氨基酚和磺胺甲恶唑的去除率较为稳定, 其中对乙酰氨基酚可被完全去除; 16S rRNA测序结果表明与无烟煤相比, BAC表面的微生物群落结构更加丰富.Ma等(2018)比较了GAC/砂双层生物过滤与无烟煤/砂双层生物过滤中试装置去除水中8种典型微量污染物(阿替洛尔、阿特拉津、卡马西平、氟西汀、吉非罗齐、异丙甲草胺、磺胺甲恶唑和磷酸三(2-氯乙基)酯(TCEP))的效能, 结果发现:微量污染物可通过吸附和生物降解途径去除, 前者表现出较高的去除率(平均值为49.1%~94.4%), 而后者的平均去除率为0~66.1%, 说明大部分有机物通过吸附途径得到去除; 而对氟西汀, 生物降解是主要的去除方式; 污染物的生物降解速率、EBCT、污染物初始浓度及进水DOC浓度是影响污染物去除的主要因素.Fu等(2019)研究了串联的砂/无烟煤生物过滤(EBCT:7.5 min)和GAC过滤(EBCT:7.5 min)中试装置对30种药物和个人护理品(PPCPs)的去除效率, 结果表明:生物过滤对PPCPs的平均去除率为53.4%, 其中后续的GAC生物过滤贡献了48.1%的去除率; 在这些PPCPs中, 分子量较低且结构简单的化合物易被去除.
此外, 也有研究表明生物过滤可有效去除污水厂出水中的微量污染物(Andersson et al., 2001;Reungoat et al., 2011).Paredes等(2016)以污水厂出水作为待处理水体, 探讨了砂和GAC作为滤料的生物过滤装置对水中18种微量污染物的去除, 结果发现:只有4种微量污染物可被吸附在砂的表面, 因此, 生物降解是这些物质的主要去除途径; 与砂相比, GAC表现出较好的去除率; EBCT与污染物的去除之间无线性关系.
3.3 嗅味物质的控制土臭素和2-甲基异茨醇(MIB)是饮用水中常见的引起嗅味的化合物(Srinivasan et al., 2011).土臭素和MIB的阈值浓度极低(分别约为4和9 ng·L-1), 并且常规的饮用水处理工序难以有效去除这些物质(Young et al., 1996).表 3所示为生物过滤工艺去除水中土臭素和MIB等嗅味物质的效能.
表 3(Table 3)
| 表 3 生物过滤工艺去除水中土臭素和MIB的效能 Table 3 Removal of geosmin and MIB from water in biofiltration | ||||||||||||||||||||||||||||||||||||
表 3 生物过滤工艺去除水中土臭素和MIB的效能 Table 3 Removal of geosmin and MIB from water in biofiltration
| ||||||||||||||||||||||||||||||||||||
Elhadi等(2004)研究了生物过滤(滤料:GAC; 高度:2 m; EBCT=5.6 min; GAC深度:50 cm; 砂深度:25 cm)去除土臭素和MIB(目标浓度为100 ng·L-1)的效率, 结果发现:在最初的7 d中, 由于新GAC的吸附能力, GAC几乎完全去除土臭素和MIB; 在随后3周的静置时间段, 土臭素的去除率下降为83%(下降了13%), 而MIB的去除率下降到52%(下降了37%); 在第55 d, GAC对土臭素和MIB的去除率分别恢复到87%和63%, 这表明滤料表面生成了稳定的生物膜.考虑到生物滤池实际运行过程中外部环境因素会对土臭素和MIB去除率产生影响, Elhadi等(2006)分别考察了低温(8 ℃)和高温(20 ℃)、土臭素和MIB浓度、介质类型及可生物降解的有机物(BOM)含量等因素对生物过滤去除土臭素和MIB的影响, 其中, 生物过滤装置的填料介质分别为无烟煤/砂和GAC/砂, 无烟煤和GAC层的厚度为50 cm, 砂层厚度为25 cm.实验结果表明:随着温度降低, 土臭素和MIB的去除率降低; 当BOM含量较低及在20 ℃时, GAC生物过滤对土臭素的去除率为58%, 无烟煤生物过滤的去除率则降至14%;在8 ℃时, GAC生物过滤对MIB的去除率为14%, 无烟煤生物过滤的去除率则降至1%;此外, 与土臭素相比, MIB的去除率较低.
Persson等(2007)发现除生物降解外, 生物吸附也可导致土臭素和MIB的去除, 在添加叠氮化物抑制微生物活性后, GAC仍可去除土臭素和MIB(MIB的去除率略有下降).此外, 有研究表明, 生物过滤进水含有驯化的土臭素降解菌可将土臭素的降解率从25%提升到75%(McDowall et al., 2009).Beniwal等(2018)考察了中试规模的前置臭氧化(O3)和高级氧化(H2O2/O3)结合生物过滤装置(填料介质为GAC和砂, 厚度均为50 cm, 砂有效粒径为0.5 cm, GAC有效粒径为0.8 cm, EBCT=10 min)去除嗅味物质的效能, 结果显示:在较温暖的水温条件(22 ℃)下土臭素和MIB(目标浓度为100 ng·L-1)去除率较高(>80%), 但在低温(16 ℃和10 ℃)下处理效果较差(去除率<60%); 但如果BAC装置前置O3预氧化, 在低温下BAC仍可将土臭素浓度降低至10 ng·L-1以下.
3.4 氨氮的去除Andersson等(2001)研究了进水温度对生物过滤中试装置(填料:GAC; EBCT:3.6 min)对氨氮(初始浓度0.4 mg·L-1)去除的影响, 结果显示:当温度>10 ℃时, 氨氮去除效率为40%~90%;当温度在4~10 ℃时, 氨氮去除效率降至10%~40%;而当温度在4 ℃以下时, 氨氮去除率皆在30%以下.这表明在冬季水温较低时, 原水中高浓度的氨氮将给后续水处理工序带来挑战.
原水中溴离子浓度较高时, 水中加入额外的氨氮是常用的后续臭氧化过程中的溴酸盐控制策略之一(Buffle et al., 2004).Wert等(2008)针对臭氧化过程中水中额外添加的氨氮(0.1~0.5 mg·L-1), 考察了生物过滤中试装置(砂/无烟煤填料; EBCT:3.2~25 min)对水中氨氮的去除效率, 结果表明:生物过滤(无烟煤滤层高度:183 cm; 砂滤层高度:20 cm; EBCT:8.3 min)经过290 d的运行后可将氨氮转化为50%的亚硝酸盐和50%的硝酸盐; 然而, 滤层较低的生物过滤装置(无烟煤滤层高度:53 cm; 砂滤层高度:25 cm; EBCT:9.7 min)经过99 d的运行后即可完全去除氨氮.在另外一项研究中, Greenstein等(2018)运行了250 d的GAC/砂双层生物过滤中试装置, 进水为预臭氧化的科罗拉多河水, 水中含有0.4 mg·L-1的氨氮, 该装置在113 d可以实现完全硝化.
4 生物过滤在饮用水深度处理应用中存在的挑战(Challenges during the applications of biologically active filtration in drinking water advanced treatment processes)尽管上述研究显示生物过滤过程可有效去除水中的无机及有机污染物, 如可生物降解的有机质、微量污染物、嗅味物质及氨氮等, 但生物过滤在饮用水深度处理过程中也存在一些值得关注的问题.
近年来有研究表明, 生物过滤出水中N-DBPs前体物浓度升高(Chu et al., 2015;Krasner et al., 2015;Krasner et al., 2016).例如, Chu等(2015)搭建了2套平行的O3-BAC系统(高度:4.0 m, 滤床高度:1.6 m, 直径:0.3 m)以对比连续和间歇前置臭氧化对3种卤代N-DBPs的控制效率, 结果发现:连续臭氧化时, 生物过滤对HANs、HNMs和HAcAms的去除效率分别为63%~89%、52%~70%及68%~89%;但在间歇臭氧氧化时, 其生成势分别增长了20%~21%、30%~36%及34%~54%.这说明生物过滤过程中释放了大量的N-DBPs前体物(可能是溶解性微生物质).在2012年对北美饮用水厂水质的调研中, Krasner等(2015)发现在14个水样中, 有9个样品生物过滤出水NDMA的FP增长了2.7~29 ng·L-1.后续的NDMA浓度调研同样证实了部分水厂生物过滤出水NDMA的FP升高, 而这可能与生物膜释放的胞外聚合物(EPS)或者胞内有机物(IOM)有关(Krasner et al., 2016).Di Tommaso等(2019)从水厂提取的生物过滤生物膜EPS的NDMA和DCAN产率分别为(0.80±0.27)和(18.7±3.3) ng·g-1生物质.进水中含氮物质在生物代谢后可能转化为NDMA的前体物, 从而导致出水消毒后NDMA的生成(Zhang et al., 2019).例如, 通常氨基酸经过氯胺消毒后生成的NDMA浓度很低(Mitch et al., 2004), 但Bei等(2020)发现氨基酸等含氮物质经过微生物代谢后可作为NDMA的前体物.这些结果表明生物过滤过程中有机氮的转化可导致出水中含氮DBP前体物浓度升高.
温度对生物过滤过程中的微生物活性影响显著.温度较低(< 5 ℃)时生物膜对有机质的去除率显著降低, 低温也可能导致微生物种群结构改变, 从而降低其效能(Moll et al., 1999; Liu et al., 2001).此外, 低温时生物过滤对氨氮的硝化反应速率明显下降(Andersson et al., 2001).因此, 在冬季水温较低时, 维护生物过滤工艺的效能将是巨大的挑战.
生物过滤出水的微生物种群结构和丰度通常决定输配水的微生态(Pinto et al., 2012).因此, 生物过滤出水的微生物安全性是另外值得关注的问题, 特别是当水中含有对氯类消毒剂产生抗性的病原微生物时(如贾第鞭毛虫(Giardia)和隐孢子虫(Cryptosporidium)).因此, 采用替代消毒方式(如紫外线等), 提高后续消毒工序的效能对微生物学上安全的饮用水保障至关重要.
5 结论与展望(Conclusions and prospects)本文综述了生物过滤在饮用水深度处理过程中的应用及存在的问题.生物过滤过程(特别前置臭氧化工艺时)可有效去除水中部分无机及有机污染物, 如可生物降解的有机质、微量污染物、嗅味化合物及氨氮等.在混凝-沉淀等常规水处理工序的基础上, 后置的生物过滤工艺可额外提供约20%的DOC去除率.该组分属于亲水性并且可生化的DOC, 进而可以控制THMs及HAAs等DBPs浓度低于饮用水标准.尽管生物过滤对水中农药类微量污染物的去除效率较低, 但对于大部分药物、个人护理品及内分泌干扰物等微量污染物的去除率在50%以上.此外, 生物过滤对水中的嗅味化合物和氨氮(< 0.5 mg·L-1)也有较好的去除效果.在滤料的选择上, GAC由于其较大的比表面积, 性能优于无烟煤及砂等滤料.一般来说, 在装置运行前期, 污染物的去除主要通过吸附途径实现, 而当生物过滤反应器进入稳定运行期间, 生物降解对污染物去除的贡献显著.温度会显著影响生物过滤工艺的效能, 其在高温时的效能较低温时更佳.同时, 前置的臭氧化可提高水体的可生化性, 从而提升生物过滤的效能.
本文同时综述了生物过滤在饮用水深度处理过程中存在的问题.生物过滤过程对于N-DBPs去除效率差异较大, 甚至部分文献报道了出水中含氮DBPs前体物浓度升高的结果.这可能与生物的多种形态氮的转化及非生物的物化反应相关.但具体的转化机制亟待证实, 各种反应途径的贡献尚需阐明.生物过滤工艺在低温条件下性能的下降将给水处理工艺带来挑战.此外, 生物过滤工艺的滤料表面富含大量的微生物(可能包括病原微生物), 为了保障出水的微生物安全性, 需要关注后续消毒工艺的选择与效能.
目前生物过滤工艺的运行和维护还属于“黑箱”状态, 各项运行参数(滤料、EBCT、反冲洗方式及化学物添加等)影响生物过滤性能的方式和机制尚不明确.例如, 尽管通常来说GAC作为滤料时, 性能较其他材料更佳, 但GAC的寿命通常在5~8年, 开发其它价格低廉、性能良好的滤料有着重要意义.由于污染物的微生物代谢与反应时间相关, 延长EBCT通常可提高污染物去除效率, 但延长EBCT会降低水处理能力并增加运行费用, 因此, 需要优化EBCT以实现能效比最高的污染物去除.反冲洗对于防止生物过滤装置阻塞, 降低水头损失具有重要的意义, 但反冲洗也可能导致生物膜的脱落, 降低对污染物去除效率; 甚至, 释放的生物质可作为后续消毒工艺中DBPs的前体物.此外, 需要探索铝盐或者营养元素投加是否对生物过滤效能提升有益, 但需确保不会危害后续出水的生物稳定性.最后, 目前大部分的研究都集中在中试规模, 研究结果仍需在饮用水厂验证, 并针对原水水质及时空变化, 修正结果, 以期提出最优的生物过滤工艺参数和水质调控策略.
参考文献
| Andersson A, Laurent P, Kihn A, et al. 2001. Impact of temperature on nitrification in biological activated carbon (BAC) filters used for drinking water treatment[J]. Water Research, 35(12): 2923-2934. DOI:10.1016/S0043-1354(00)00579-0 |
| Basu O D, Dhawan S, Black K. 2016. Applications of biofiltration in drinking water treatment:a review[J]. Journal of Chemical Technology & Biotechnology, 91(3): 585-595. |
| Bei E, Li X, Wu F, et al. 2020. Formation of N-nitrosodimethylamine precursors through the microbiological metabolism of nitrogenous substrates in water[J]. Water Research, 183: 116055. DOI:10.1016/j.watres.2020.116055 |
| Beniwal D, Taylor-Edmonds L, Armour J, et al. 2018. Ozone/peroxide advanced oxidation in combination with biofiltration for taste and odour control and organics removal[J]. Chemosphere, 212: 272-281. DOI:10.1016/j.chemosphere.2018.08.015 |
| Brown J, Upadhyaya G, Carter J, et al.2016.North American Biofiltration Knowledge Base[R].#4459. Denver, Colorado: Water Research Foundation.1-9 |
| Buffle M O, Galli S, von Gunten U. 2004. Enhanced bromate control during ozonation:The chlorine-ammonia process[J]. Environmental Science & Technology, 38(19): 5187-5195. |
| Chaiket T, Singer P C, Miles A, et al. 2002. Effectiveness of coagulation, ozonation, and biofiltration in controlling DBPs[J]. Journal of American Water Works Association, 94(12): 81-95. DOI:10.1002/j.1551-8833.2002.tb10251.x |
| Chu W, Gao N, Yin D, et al. 2012. Ozone-biological activated carbon integrated treatment for removal of precursors of halogenated nitrogenous disinfection by-products[J]. Chemosphere, 86(11): 1087-1091. DOI:10.1016/j.chemosphere.2011.11.070 |
| Chu W, Li C, Gao N, et al. 2015. Terminating pre-ozonation prior to biological activated carbon filtration results in increased formation of nitrogenous disinfection by-products upon subsequent chlorination[J]. Chemosphere, 121: 33-38. DOI:10.1016/j.chemosphere.2014.10.059 |
| Chuang Y H, Mitch W A. 2017. Effect of Ozonation and biological activated carbon treatment of wastewater effluents on formation of N-nitrosamines and halogenated disinfection byproducts[J]. Environmental Science & Technology, 51(4): 2329-2338. |
| Di Tommaso C, Taylor-Edmonds L, Andrews S A, et al. 2019. The contribution of biofilm to nitrogenous disinfection by-product formation in full-scale cyclically-operated drinking water biofilters[J]. Water Research, 155: 403-409. DOI:10.1016/j.watres.2019.02.025 |
| Elhadi S, Huck P, Slawson R. 2004. Removal of geosmin and 2-methylisoborneol by biological filtration[J]. Water Science and Technology, 49(9): 273-280. DOI:10.2166/wst.2004.0586 |
| Elhadi S L N, Huck P M, Slawson R M. 2006. Factors affecting the removal of geosmin and MIB in drinking water biofilters[J]. Journal AWWA, 98(8): 108-119. DOI:10.1002/j.1551-8833.2006.tb07738.x |
| Evans A N, Carter J T, Brown J, et al. 2019. North American biofiltration practices[J]. AWWA Water Science, 1(4): e1152. |
| Farré M J, Reungoat J, Argaud F X, et al. 2011. Fate of N-nitrosodimethylamine, trihalomethane and haloacetic acid precursors in tertiary treatment including biofiltration[J]. Water Research, 45(17): 5695-5704. DOI:10.1016/j.watres.2011.08.033 |
| Fu J, Lee W N, Coleman C, et al. 2017. Removal of disinfection byproduct (DBP) precursors in water by two-stage biofiltration treatment[J]. Water Research, 123: 224-235. DOI:10.1016/j.watres.2017.06.073 |
| Fu J, Lee W N, Coleman C, et al. 2019. Removal of pharmaceuticals and personal care products by two-stage biofiltration for drinking water treatment[J]. Science of the Total Environment, 664: 240-248. DOI:10.1016/j.scitotenv.2019.02.026 |
| Gao J, Liu L, Liu X, et al. 2009. The occurrence and spatial distribution of organophosphorous pesticides in Chinese surface water[J]. Bulletin of Environmental Contamination & Toxicology, 82: 223-229. |
| Greenstein K E, Lew J, Dickenson E R V, et al. 2018. Investigation of biotransformation, sorption, and desorption of multiple chemical contaminants in pilot-scale drinking water biofilters[J]. Chemosphere, 200: 248-256. DOI:10.1016/j.chemosphere.2018.02.107 |
| Hallé C, Huck P M, Peldszus S. 2015. Emerging contaminant removal by biofiltration:Temperature, concentration, and EBCT impacts[J]. Journal AWWA, 107(7): E364-E379. DOI:10.5942/jawwa.2015.107.0086 |
| Ko Y S, Lee Y J, Nam S H. 2007. Evaluation of a pilot scale dual media biological activated carbon process for drinking water[J]. Korean Journal of Chemical Engineering, 24(2): 253-260. DOI:10.1007/s11814-007-5038-8 |
| Krasner S W, Leavey S, Qian Y, et al.2016.Nitrosamine occurrence survey[R].#4461.Denver, Colorado: Water Research Foundation.32-33 |
| Krasner S W, Shirkhani R, Westerhoff P, et al.2015.Controlling the formation of nitrosamines during water treatment[R]. #4370. Denver, Colorado: Water Research Foundation. 37-39 |
| Liao X, Chen C, Xie S, et al. 2015. Nitrosamine precursor removal by BAC:A case study of adsorption versus biotreatment[J]. Journal of American Water Works Association, 107(9): E454-E463. DOI:10.5942/jawwa.2015.107.0123 |
| Liao X, Wang C, Wang J, et al. 2014. Nitrosamine precursor and DOM control in an effluent-affected drinking water[J]. Journal of American Water Works Association, 106(7): E307-E318. DOI:10.5942/jawwa.2014.106.0052 |
| Liu C, Croue J P. 2016. Formation of bromate and halogenated disinfection byproducts during chlorination of bromide-containing waters in the presence of dissolved organic matter and CuO[J]. Environmental Science & Technology, 50(1): 135-144. |
| Liu C, Ersan M S, Plewa M J, et al. 2018. Formation of regulated and unregulated disinfection byproducts during chlorination of algal organic matter extracted from freshwater and marine algae[J]. Water Research, 142: 313-324. DOI:10.1016/j.watres.2018.05.051 |
| Liu C, Olivares C I, Pinto A J, et al. 2017. The control of disinfection byproducts and their precursors in biologically active filtration processes[J]. Water Research, 124: 630-653. DOI:10.1016/j.watres.2017.07.080 |
| Liu X, Huck P M, Slawson R M. 2001. Factors affecting drinking water biofiltration[J]. Journal of American Water Works Association, 93(12): 90-101. DOI:10.1002/j.1551-8833.2001.tb09358.x |
| Ma B, Arnold W A, Hozalski R M. 2018. The relative roles of sorption and biodegradation in the removal of contaminants of emerging concern (CECs) in GAC-sand biofilters[J]. Water Research, 146: 67-76. DOI:10.1016/j.watres.2018.09.023 |
| McDowall B, Hoefel D, Newcombe G, et al. 2009. Enhancing the biofiltration of geosmin by seeding sand filter columns with a consortium of geosmin-degrading bacteria[J]. Water Research, 43(2): 433-440. DOI:10.1016/j.watres.2008.10.044 |
| McKie M J, Andrews S A, Andrews R C. 2016. Conventional drinking water treatment and direct biofiltration for the removal of pharmaceuticals and artificial sweeteners:A pilot-scale approach[J]. Science of the Total Environment, 544: 10-17. DOI:10.1016/j.scitotenv.2015.11.145 |
| Mitch W A, Krasner S W, Westerhoff P, et al.2009.Occurrence and Formation of Nitrogenous Disinfection.By-Products[R].# 3014. Denver, Colorado: Water Research Foundation. 113-122 |
| Mitch W A, Sedlak D L. 2004. Characterization and Fate of N-Nitrosodimethylamine precursors in municipal wastewater treatment plants[J]. Environmental Science & Technology, 38(5): 1445-1454. |
| Moll D M, Summers R S, Fonseca A C, et al. 1999. Impact of temperature on drinking water biofilter performance and microbial community structure[J]. Environmental Science & Technology, 33(14): 2377-2382. |
| Paredes L, Fernandez-Fontaina E, Lema J M, et al. 2016. Understanding the fate of organic micropollutants in sand and granular activated carbon biofiltration systems[J]. Science of the Total Environment, 551-552: 640-648. DOI:10.1016/j.scitotenv.2016.02.008 |
| Persson F, Heinicke G, Hedberg T, et al. 2007. Removal of geosmin and MIB by biofiltration-an investigation discriminating between adsorption and biodegradation[J]. Environmental Technology, 28(1): 95-104. DOI:10.1080/09593332808618770 |
| Pinto A J, Xi C, Raskin L. 2012. Bacterial community structure in the drinking water microbiome is governed by filtration processes[J]. Environmental Science & Technology, 46(16): 8851-8859. |
| Price M L, Bailey R W, Enos A K, et al. 1993. Evaluation of ozone/biological treatment for disinfection byproducts control and biologically stable water[J]. Ozone:Science & Engineering, 15(2): 95-130. |
| Reungoat J, Escher B I, Macova M, et al. 2011. Biofiltration of wastewater treatment plant effluent:Effective removal of pharmaceuticals and personal care products and reduction of toxicity[J]. Water Research, 45(9): 2751-2762. DOI:10.1016/j.watres.2011.02.013 |
| Selbes M, Brown J, Lauderdale C, et al. 2017. Removal of selected C-and N-DBP Precursors in Biologically Active Filters[J]. Journal of American Water Works Association, 109(3): E73-E84. DOI:10.1002/j.1551-8833.2017.tb00005.x |
| Shah A D, Mitch W A. 2012. Halonitroalkanes, halonitriles, haloamides, and N-Nitrosamines:A critical review of nitrogenous disinfection byproduct formation pathways[J]. Environmental Science & Technology, 46(1): 119-131. |
| Srinivasan R, Sorial G A. 2011. Treatment of taste and odor causing compounds 2-methyl isoborneol and geosmin in drinking water:A critical review[J]. Journal of Environmental Sciences, 23(1): 1-13. |
| Wagner E D, Plewa M J. 2017. CHO cell cytotoxicity and genotoxicity analyses of disinfection by-products:An updated review[J]. Journal of Environmental Sciences, 58: 64-76. DOI:10.1016/j.jes.2017.04.021 |
| Wert E C, Neemann J J, Rexing D J, et al. 2008. Biofiltration for removal of BOM and residual ammonia following control of bromate formation[J]. Water Research, 42(1): 372-378. |
| Yan M, Wang D, Ma X, et al. 2010. THMs precursor removal by an integrated process of ozonation and biological granular activated carbon for typical Northern China water[J]. Separation And Purification Technology, 72(3): 263-268. DOI:10.1016/j.seppur.2010.02.015 |
| Young W F, Horth H, Crane R, et al. 1996. Taste and odour threshold concentrations of potential potable water contaminants[J]. Water Research, 30(2): 331-340. DOI:10.1016/0043-1354(95)00173-5 |
| Zearley T L, Summers R S. 2012. Removal of trace organic micropollutants by drinking water biological filters[J]. Environmental Science & Technology, 46(17): 9412-9419. |
| Zhang Z, Ma B, Hozalski R M, et al. 2019. Bench-scale column evaluation of factors associated with changes in N-nitrosodimethylamine (NDMA) precursor concentrations during drinking water biofiltration[J]. Water Research, 167: 115103. DOI:10.1016/j.watres.2019.115103 |
