 , 李晓敏1,3, 丁龙君1
, 李晓敏1,3, 丁龙君1

1. 中国科学院生态环境研究中心城市与区域生态国家重点实验室, 北京 100085;
2. 中国农业大学生物学院, 北京 100193;
3. 中国科学院大学, 北京 100049
收稿日期: 2020-07-03; 修回日期: 2020-08-23; 录用日期: 2020-08-23
基金项目: 中国科学院大学生创新实践训练计划项目(No.20184001544);国家自然科学基金项目(No.41977036);中国科学院青年创新促进会人才项目;中国农业大学生命科学实验教学示范中心探索项目(No.20190101)
作者简介: 周栀子(2002-), 女, E-mail:2017306100606@cau.edu.cn
通讯作者(责任作者): 丁龙君, E-mail:ljding@rcees.ac.cn
摘要:室内空气中过高浓度的生物粒子有害人体健康.空气中的微生物通常与灰尘结合在一起,然而目前对家庭室内灰尘微生物多样性及其随季节变化特征的报道较少.本研究在北京市选择1户家庭,在夏季和秋季定期采集灰尘样品,通过高通量测序研究细菌和真菌群落组成及多样性,并分析细菌-真菌的网络互作特征.结果显示,室内灰尘细菌和真菌群落Shannon指数及Chao1指数夏季均显著高于秋季(p < 0.05).此外,室内灰尘细菌群落结构夏季与秋季无显著差异(p>0.05),主要类群为假单胞菌属(Pseudomonas)、考克氏菌属(Kocuria)和芽孢杆菌属(Bacillus);真菌群落结构夏季与秋季则明显不同(p < 0.05),夏季优势类群为曲霉属(Aspergillus)、链格孢属(Alternaria)和裂褶菌属(Schizophyllum),而秋季曲霉属占绝对主导地位.室内灰尘微生物网络互作具有明显的季节特征,夏季微生物互作主要为细菌-细菌,以及细菌-真菌的正相互作用;而秋季微生物互作比夏季更紧密,以细菌-细菌的正相互作用为主.这些结果可为构建健康的居家环境提供参考依据.
关键词:微生物多样性细菌真菌变化特征室内灰尘
Characteristics of microbial diversity in indoor air of Beijing city in summer and autumn
ZHOU Zhizi1,2
 , LI Xiaomin1,3, DING Longjun1
, LI Xiaomin1,3, DING Longjun1

1. State Key Lab of Urban and Regional Ecology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085;
2. College of Biological Sciences, China Agriculture University, Beijing 100193;
3. University of Chinese Academy of Sciences, Beijing 100049
Received 3 July 2020; received in revised from 23 August 2020; accepted 23 August 2020
Abstract: Excessive microbial particles in indoor air exerts negative effects on human health. Airborne microbes often bind with dust, however, microbial diversity in household dust and its changes with seasonal variation have been rarely reported. In this study, we explored the diversity and composition of bacterial and fungal communities, and characteristics of microbial interaction network in settled dust periodically collected in summer and autumn from a household in Beijng city, using the high-throughput sequencing technique. Shannon and Chao1 indices of bacterial and fungal communities in the indoor dust samples in summer were significantly (p < 0.05) higher than those in autumn. Furthermore, there was no significant (p>0.05) difference in the bacterial community structure in the indoor dust samples between summer and autumn. The dominant bacterial populations were Pseudomonas, Kocuria and Bacillus in both seasons. By contrast, significant (p < 0.05) difference was detected in the fungal community structure in the indoor dust samples between summer and autumn. In summer, fungal community in the indoor dust samples was mostly composed of Aspergillus, Alternaria and Schizophyllum in genera, while in autumn, Aspergillus was the most predominant fungal genera. In addition, there were obvious seasonal characteristics in the microbial interaction network for the indoor dust samples. In summer, the microbial interaction relationships were mainly comprised of positive correlations between bacteria populations, and between bacteria and fungi. Compared with summer, the associations among microbes in autumn became closer, and the microbial interaction network was dominated by positive correlations between bacteria. These findings could provide a theoretical basis for establishing a healthy household environment.
Keywords: microbial diversitybacteriafungivariation characteristicsindoor dust
1 引言(Introduction)随着城市化进程的加快, 人们在室内停留的时间越来越长.有统计表明, 成年人约80%的时间是在室内度过的, 而行动不便的老人或婴幼儿甚至超过95%的时间生活在室内(Ding et al., 2020).居家环境是室内环境的典型代表.居家环境质量, 尤其是空气质量与人群健康密切相关(方治国等, 2013).世界卫生组织2002年公告中指出, 空气中过高浓度的生物粒子如细菌、真菌及孢子、病毒和花粉等能够增加呼吸道疾病和感染等的发病概率(Schwela et al., 2002).因此, 了解家庭室内空气生物多样性, 尤其是微生物多样性对于改善居住环境具有重要意义(Gilbert et al., 2018).
空气中的微生物通常与空气中的颗粒物如灰尘结合在一起, 以气溶胶的形式漂浮于空气中, 因此以沉降的灰尘为对象已经广泛应用于空气微生物的研究中(Rintala et al., 2012).家庭室内灰尘微生物组(指所有微生物的集合)被认为是一个复杂的微生物生态系统, 它受很多因素的影响, 包括居住者(如人和宠物)携带的微生物、居住者生活方式造成的选择性压力、住宅设计以及室外微生物的扩散等(Gilbert et al., 2018).目前, 针对家庭室内灰尘微生物, 国内外已开展了一些研究(Dunn et al., 2013;Barberán et al., 2015a; 2015b;Dannemiller et al., 2016;Ding et al., 2020).比如, Barberán等(2015a)研究了美国1200户家庭室内外灰尘微生物多样性, 发现室内和室外灰尘细菌多样性明显不同, 而真菌多样性无明显差异.然而, 已有的研究大多集中于家庭室内灰尘微生物多样性及其影响因素上, 很少有研究探索微生物物种之间(比如细菌vs真菌)的相互作用, 而对于复杂生态系统的功能而言, 物种间的相互作用可能比物种多样性起着更重要的作用(Zhou et al., 2010).此外, 关于家庭室内灰尘微生物多样性如何随季节变化也少见报道.
本研究以北京市为例, 在城区选择1个家庭, 在7—11月期间定期采集家庭中5个不同位点(窗台、门框、厨房、枕套和厕所)的灰尘, 采用基于细菌16S rRNA基因和真菌rRNA操纵子的高通量测序技术, 研究了其中细菌和真菌群落组成及α多样性, 分析了细菌和真菌的分子生态网络, 并进一步揭示了微生物多样性的时间变化特征, 以及细菌-真菌的网络互作特征, 以期为了解家庭室内空气质量提供微生物学数据, 为构建健康的居家环境提供参考依据.
2 材料与方法(Materials and methods)2.1 灰尘样品采集在北京市城区选取家庭住宅1户(东经116°28′, 北纬40°01′).该家庭位于5楼, 建筑户型为两室一厅, 房屋面积108 m2, 近3年未装修, 室内无肉眼可见的霉菌, 无明显的霉味, 且不存在漏水等影响房屋湿度的情况.在2018年7—11月期间, 志愿者每隔15~20 d采集家中5个典型位点的灰尘, 包括窗台、门框、厨房、枕套和厕所.将7—8月的样品归为夏季样品, 9—11月的样品归为秋季样品, 具体采样信息表请见表 1.采样当天避免接待大量访客等异常情况.采样步骤参照Fierer等(2008)的报道.采样时, 先将无菌棉签浸泡在无菌采样溶液(同时含有0.15 mol · L-1 NaCl和0.1%吐温20)中约30 s, 然后取出棉签按竖直方向以中等力度擦拭位点的表面.擦拭过程中不断旋转棉签, 使棉签顶端的棉花均匀沾满灰尘.每根棉签采样面积约为100 cm2.采集完后将棉签立即放入10 mL无菌离心管中, 密封, 放置于超低温冰盒上尽快寄回实验室进行DNA提取.整个采样过程戴无菌乳胶手套以及口罩操作, 避免污染样品.
表 1(Table 1)
| 表 1 家庭灰尘样品采集信息表 Table 1 Information of the household dust samples collected in this study | ||||||||||||||||||||||||||||||
表 1 家庭灰尘样品采集信息表 Table 1 Information of the household dust samples collected in this study
| ||||||||||||||||||||||||||||||
2.2 灰尘DNA提取、高通量测序及测序数据处理采用灭菌的剪刀将棉签顶端的棉花剪成小段, 放入2 mL裂解管中, 采用FastDNA Spin Kit for Soil试剂盒(MP Biomedicals, 美国)提取灰尘样品中的总DNA(Ding et al., 2020).同时, 将未使用的无菌棉签作为对照, 按相同的步骤提取DNA, 并进行后续PCR扩增.
采用引物515F/806R以及ITS1F/ITS2分别对细菌16S rRNA基因的V4高变区以及真菌rRNA操纵子的第1内转录间隔区(Internal Transcribed Spacer, ITS)进行PCR扩增(Barberán et al., 2015b).PCR体系组成和热力学条件参考Ding等(2020).应用AxyPrep DNA Gel Extraction Kit试剂盒(Axygen Biosciences, 美国)对PCR产物进行切胶纯化, 然后将含有不同Tag标签的纯化产物等量混合, 送至上海美吉生物医药科技有限公司, 采用Illumina Miseq PE300平台进行测序.值得注意的是, 从部分采样位点提取的灰尘DNA量过少, 未扩增成功而未能成功测序, 测序成功的样品请见表 1.此外, 从对照(即未使用的无菌棉签)提取的DNA样品也未扩增成功, 表明采样的棉签未被污染.
原始测序序列使用Trimmomatic软件进行质控(Bartram et al., 2011), 使用FLASH软件进行拼接, 然后采用QIIME 2.0(Quantitative Insights into Microbial Ecology)进行后续处理(Caporaso et al., 2010), 处理步骤参考Ding等(2017).简单地说, 将得到的高质量序列在97%的相似性水平上进行可操作分类单元(Operational Taxonomic Unit, OTU)聚类, 并在聚类过程中去除单序列和嵌合体.在每个OTU中挑选相对丰度最高的序列作为代表性序列, 利用RDP classifier(http://rdp.cme.msu.edu/)的Silva 128 16S rRNA数据库对细菌序列进行物种分类注释, 利用RDP classifier的UNITE 6.0 ITS数据库对真菌序列进行物种分类注释(Barberán et al., 2015b), 最小置信度阈值均设置为70%.对于细菌序列, 删除线粒体和叶绿体后再进行后续分析.
2.3 统计分析对获得的细菌和真菌群落的OTU表进行抽平之后, 采用美吉生物云平台(https://cloud.majorbio.com/)进行进一步的统计分析.分别以不同采样位点或不同季节作为组间处理, 对灰尘细菌和真菌群落的Shannon指数和Chao1指数进行基于Kruskal-Wallis秩检验(对于不同采样位点)或Student-T检验(对于不同季节)的组间差异显著性检验.此外, 对不同采样位点或不同季节的灰尘细菌和真菌群落基于Bray-Curtis算法矩阵进行Anosim/Adonis分析, 并对不同季节灰尘细菌和真菌群落结构进行主坐标分析(Principal Coordinate Analysis, PCoA).采用Lefse分析对细菌和真菌群落在门水平上的相对丰度差异进行显著性检验.此外, 通过网络分析显示不同季节灰尘细菌与真菌的相互作用关系.使用R语言的Pheatmap 1.0.12对细菌和真菌进行成对Spearman相关性分析, 获得相关性矩阵.为减少假阳性结果, 对p值进行错误发现率(False Discovery Rate, FDR)校正(Benjamini et al., 1995).在p < 0.01水平上挑选相关性系数r ≥ 0.7和r ≤ -0.7的相关性矩阵分别定义为强烈的正相互作用和负相互作用(Ding et al., 2020).应用Gephi 0.9.2版本将细菌和真菌的相互作用关系可视化, 并获得网络拓扑性质.
3 结果与分析(Results and analysis)3.1 不同季节家庭室内灰尘细菌和真菌群落α多样性测序结果显示, 从20个样品中分别获得了631726和1368473条高质量的细菌和真菌序列, 这些序列分别被聚类为2384和1552个细菌和真菌OTU.本研究采用Shannon指数(反映群落多样性)和Chao1指数(反映群落丰富度)以衡量灰尘微生物群落α多样性(图 1).所有采样位点的灰尘样品中细菌群落的这两个α多样性指数夏季均显著(p < 0.05)高于秋季(图 1a).真菌群落也呈现出相同的趋势(图 1b).这些结果表明家庭室内灰尘微生物群落α多样性夏季远高于秋季.此外, 本研究还分析了不同采样位点之间灰尘微生物群落α多样性差异, 发现对于夏季和秋季而言, 不同位点之间细菌或真菌群落α多样性均无显著差异(p>0.05, 数据未显示).
图 1(Fig. 1)
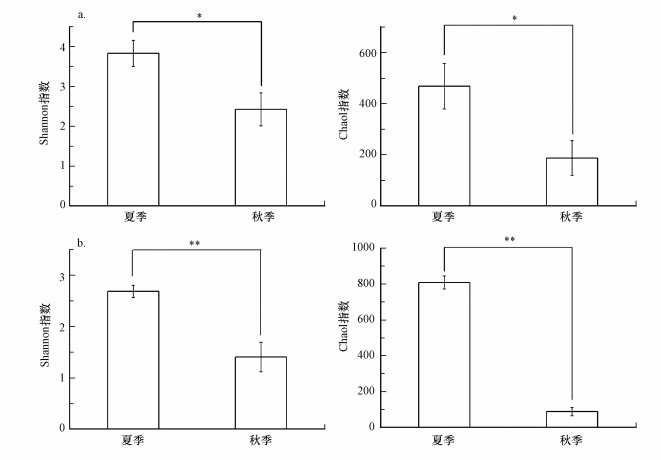 |
| 图 1 不同季节家庭灰尘样品细菌(a)和真菌(b)群落Shannon指数和Chao1指数 (数值为同一季节内所有测序成功的采样位点的均值, 对于夏季, n=10, 对于秋季, n=10, 误差线表示标准偏差, * p < 0.05, ** p < 0.01, 下同) Fig. 1Shannon and Chao1 indices of bacterial community (a) and fungal community (b) in household dust samples collected from different seasons |
3.2 不同季节家庭室内灰尘细菌和真菌群落结构基于Bray-Curtis算法矩阵的PCoA结果显示, 对于所有采样位点而言, 夏季与秋季之间灰尘细菌群落主要被PCo2轴分开, 而不同季节之间灰尘真菌群落主要在PCo1轴上相隔较远(图 2).Anosim和Adonis检验结果进一步显示(表 2), 对于所有采样位点而言, 夏季与秋季之间灰尘细菌群落结构不存在显著差异(p>0.05), 然而不同季节之间真菌群落结构显著不同(p < 0.05, 表 2).此外, 对于夏季和秋季而言, 不同采样位点之间灰尘细菌或真菌群落结构均无显著差异(p>0.05).结合上述微生物群落α多样性的结果, 在接下来的分析中只考虑不同季节的影响.
图 2(Fig. 2)
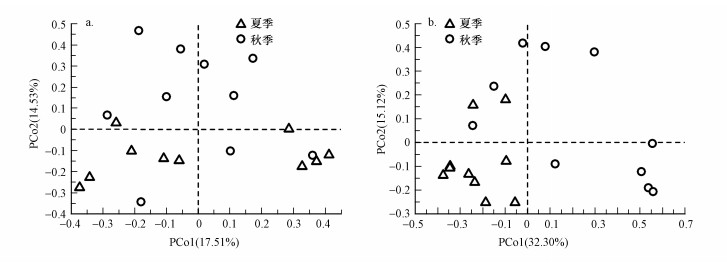 |
| 图 2 不同季节家庭灰尘样品细菌(a)和真菌(b)群落结构的主坐标分析 Fig. 2Principal coordinates analysis (PCoA) of bacterial community (a) and fungal community structure (b) in household dust samples collected from different seasons |
表 2(Table 2)
| 表 2 家庭灰尘样品细菌和真菌群落结构的Anosim和Adonis分析 Table 2 Anosim and Adonis analyses of bacterial community and fungal community structure in household dust samples | ||||||||||||||||||||||||||||||||||||||
表 2 家庭灰尘样品细菌和真菌群落结构的Anosim和Adonis分析 Table 2 Anosim and Adonis analyses of bacterial community and fungal community structure in household dust samples
| ||||||||||||||||||||||||||||||||||||||
在门水平上, 夏季与秋季之间灰尘细菌群落组成差异不明显(图 3a).不同季节灰尘细菌群落主要组分均为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和厚壁菌门(Firmicutes), 三者平均相对丰度总和超过90%.与细菌不同, 不同季节之间灰尘真菌群落组成在门水平上具有明显差异(图 3b).夏季灰尘真菌群落中子囊菌门(Ascomycota)和担子菌门(Basidiomycota)均占据较重要的地位, 平均相对丰度分别为69.1%和30.7%;而秋季灰尘真菌群落几乎完全被子囊菌门(Ascomycota)占据, 其平均相对丰度达到了98.1%.
图 3(Fig. 3)
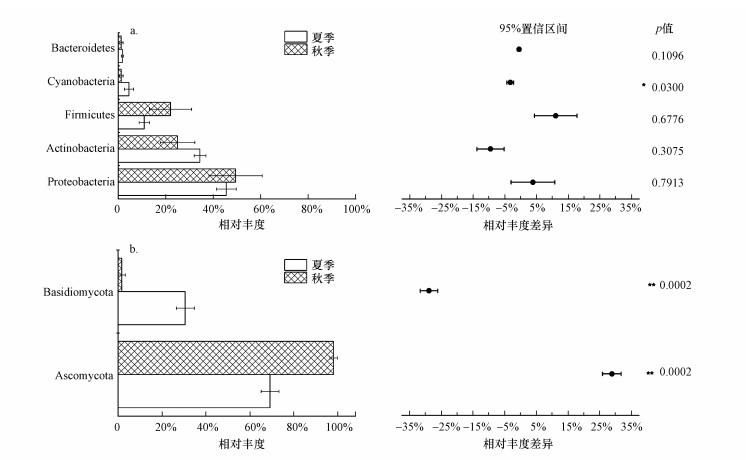 |
| 图 3 不同季节家庭灰尘样品细菌(a)和真菌群落(b)在门水平上的相对丰度差异 Fig. 3Differences in the relative abundances of bacterial phyla (a) and fungal phyla (b) in household dust samples collected from different seasons |
进一步在属水平上分析发现, 夏季灰尘细菌群落中前3种优势类群为考克氏菌属(Kocuria, 属于放线菌门)、假单胞菌属(Pseudomonas, 属于变形菌门)和栖水菌属(Enhydrobacter, 属于变形菌门), 平均相对丰度分别为12.3%、8.28%和6.70%(图 4a).随着时间的变化, 考克氏菌属和栖水菌属的平均相对丰度在秋季灰尘样品中均大幅度下降, 而假单胞菌属的相对丰度则有所增加, 从夏季的8.28%增加至秋季的12.9%.此外, 芽孢杆菌属(Bacillus, 属于厚壁菌门)和泛菌属(Pantoea, 属于变形菌门)逐渐成为秋季灰尘细菌群落的优势类群, 平均相对丰度分别由夏季的3.87%和3.26%增加至秋季的12.8%和8.63%.对于真菌群落而言, 在夏季灰尘样品中, 曲霉属(Aspergillus, 属于子囊菌门)、链格孢属(Alternaria, 属于子囊菌门)和裂褶菌属(Schizophyllum, 属于担子菌门)是前3种最丰富的类群, 平均相对丰度总和占到了61.1%(图 4b).与夏季比较, 秋季灰尘样品中曲霉属的平均相对丰度显著增加, 从夏季的16.6%增加到秋季的47.3%;而链格孢属和裂褶菌属的平均相对丰度均明显下降, 分别从夏季的26.4%和18.2%降低到秋季的6.82%和0.01%.此外, 脉孢菌属(Neurospora, 属于子囊菌门)在秋季灰尘真菌群落中的平均相对丰度(4.71%)显著(p < 0.05)高于其在夏季灰尘中(1.08%).
图 4(Fig. 4)
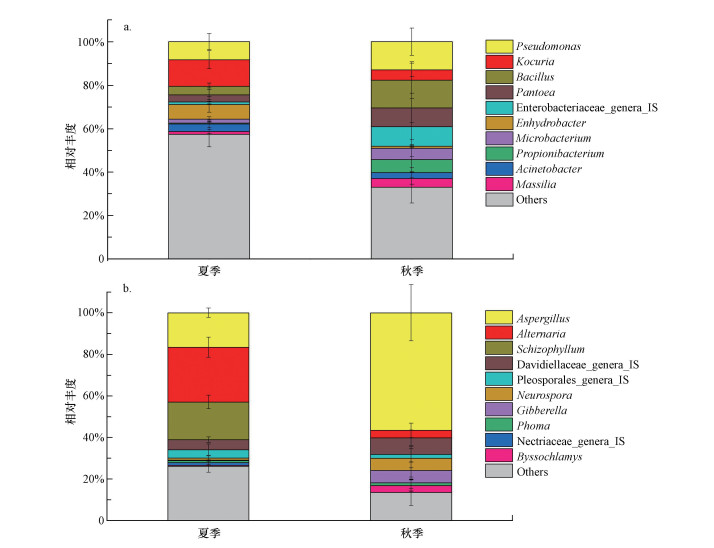 |
| 图 4 不同季节家庭灰尘样品灰尘细菌(a)和真菌群落(b)在属水平上的组成 (Enterobacteriaceae_genera_IS为Enterobacteriaceae_genera_incertae_sedis的缩写, 表示Enterobacteriaceae科中未鉴别的一个属, 下同) Fig. 4Composition of bacterial community (a) and fungal community (b) at the genus level in household dust samples collected from different seasons |
3.3 不同季节家庭室内灰尘细菌和真菌网络互作关系本研究基于显著相关性(p < 0.01, Spearman相关系数r ≥ 0.7和r ≤ -0.7)构建了不同季节灰尘细菌-真菌群落互作网络, 并使用Gephi软件计算了微生物互作网络拓扑性质(表 3).从表 3中可以看出, 夏季灰尘微生物互作网络的平均邻居数和网络密度均明显低于秋季的互作网络, 而平均路径长度和网络节点数均明显高于秋季的互作网络.这表明秋季家庭室内灰尘微生物之间的互作比夏季的更为紧密.
表 3(Table 3)
| 表 3 不同季节家庭灰尘样品微生物互作网络拓扑性质 Table 3 Topological properties of microbial interactions network in household dust samples collected from different seasons | |||||||||||||||||||||||||||
表 3 不同季节家庭灰尘样品微生物互作网络拓扑性质 Table 3 Topological properties of microbial interactions network in household dust samples collected from different seasons
| |||||||||||||||||||||||||||
不同季节灰尘微生物互作网络图显示(图 5a), 夏季微生物互作关系主要为细菌-细菌, 以及细菌-真菌之间的相互作用;而秋季微生物的互作主要为细菌-细菌之间的相互作用.微生物互作网络在门水平的弦图显示(图 5b), 在夏季, 变形菌门(Proteobacteria)与放线菌门(Actinobacteria)之间的互作是细菌-细菌相互作用的主要门类;子囊菌门(Ascomycota)与担子菌门(Basidiomycota)之间的互作是真菌-真菌相互作用的主要门类;变形菌门(Proteobacteria)与子囊菌门(Ascomycota)之间的互作则是细菌-真菌相互作用的主要门类.在秋季, 细菌-细菌的相互作用明显增加, 细菌群落界内互作的主要门类仍为变形菌门与放线菌门;而真菌-真菌的相互作用明显减少, 子囊菌门(Ascomycota)的自相互作用是真菌群落界内互作的主要门类;此外, 细菌-真菌的相互作用以放线菌门与子囊菌门之间的互作为主.
图 5(Fig. 5)
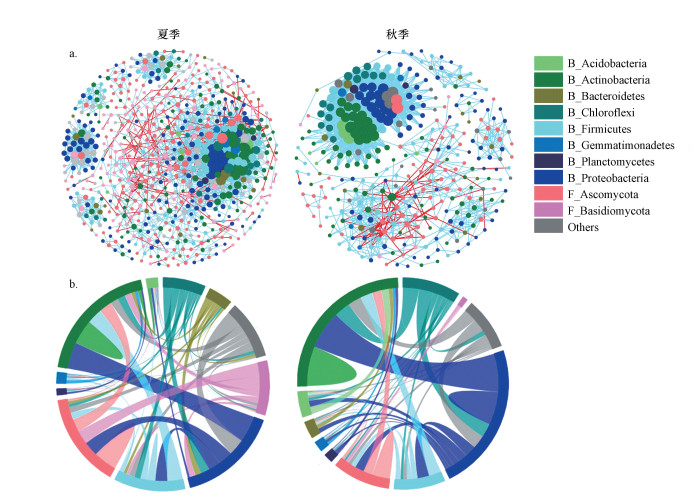 |
| 图 5 不同季节家庭灰尘样品微生物互作网络图(a)和互作网络在门水平的弦图(b) (图a中每个节点代表科水平的微生物, 节点大小与连接数呈正比, 节点颜色与右侧相同颜色门水平对应, 节点与节点之间蓝色的边表示正相互作用, 红色的边表示负相互作用, 边的粗细代表两个科之间显著性相关系数的大小, B_Acidobacteria表示属于细菌的酸杆菌门, F_Ascomycota表示属于真菌的子囊菌门) Fig. 5Microbial interaction network (a) and interaction chord diagram at the phylum level (b) in household dust samples collected from different seasons |
微生物互作网络中相互作用关系分布图进一步显示(图 6), 夏季灰尘细菌-细菌、真菌-真菌和细菌-真菌相互作用连接数分别占微生物互作网络总连接数的63.4%、24.8%和11.8%, 且均以正相互作用为主.与夏季比较, 秋季灰尘细菌-细菌相互作用, 尤其是正相互作用连接数占网络总连接数的比例明显增加(增至81.7%), 而真菌-真菌相互作用连接数占总连接数的比例大幅度下降(降至5.0%), 细菌-真菌相互作用连接数占总连接数的比例(12.9%)则基本保持不变.
图 6(Fig. 6)
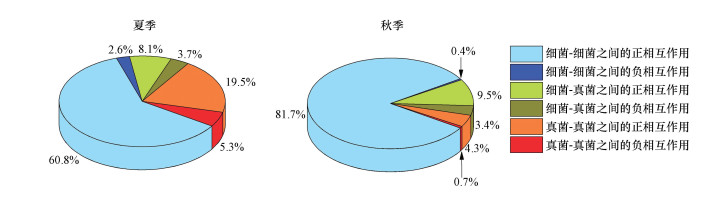 |
| 图 6 不同季节家庭灰尘样品微生物互作网络中相互作用关系分布图 Fig. 6Distribution of interaction relationships in microbial interaction network in household dust samples collected from different seasons |
4 讨论(Discussion)4.1 夏秋季节家庭室内灰尘细菌和真菌群落α多样性的变化特征在本研究中, 北京市家庭室内灰尘细菌和真菌群落的α多样性夏季明显高于秋季.这可能是由于夏季温度较高, 以及降雨较多造成空气湿度较高, 这些均有利于微生物的生长繁殖, 从而可能导致较高的微生物群落多样性.相似地, Li等(2019)研究发现城区和郊区空气细菌群落α多样性夏季明显高于春季.此外, 对于灰尘真菌而言, 其孢子主要来源于植被(Adams et al., 2013), 而夏季植物生长茂盛, 叶原基有利于真菌生长繁殖(方治国等, 2013), 因此可能造成夏季室外空气真菌多样性较高, 从而通过扩散间接提高了家庭室内灰尘真菌多样性.
4.2 夏秋季节家庭室内灰尘细菌和真菌群落结构的变化特征北京市家庭室内灰尘细菌群落结构夏季与秋季之间无明显差异, 而真菌群落结构夏季与秋季明显不同.以往的研究表明, 家庭室内灰尘细菌群落主要受居住者相关因素的影响(比如人和宠物的数量及性别), 而真菌群落主要由房屋附近的外部环境因素决定(比如气候和植物多样性)(Barberán et al., 2015a;Ding et al., 2020).这在一定程度上可以解释本研究结果, 因为在整个采样周期内, 所研究家庭中与居住者相关的因素并无变化, 从而可能导致不同季节之间灰尘细菌群落结构无明显变化;而不同季节之间真菌群落结构的差异可能是由季节变化引起的气候变化造成的.
在本研究中, 夏季和秋季灰尘细菌群落中的主要类群为假单胞菌属(Pseudomonas)、考克氏菌属(Kocuria)和芽孢杆菌属(Bacillus).假单胞菌属和芽孢杆菌属广泛分布于土壤、空气及正常人皮肤、肠道和呼吸道, 以非致病菌为主, 但一些菌种(比如Pseudomonas fluorescens和Bacillus cereus)在特定的条件下能够导致人类过敏反应或引起疾病(Dunn et al., 2013;Barberán et al., 2015a;Chen et al., 2016).考克氏菌属(Kocuria)则被认为是定殖于人类和其他哺乳动物皮肤上的常见菌群(Ma et al., 2005), 可以通过皮肤细胞代谢而脱落, 从而传播至灰尘.这些结果说明家庭室内灰尘细菌的主要来源可能为人类皮肤.Ding等(2020)的研究结果也支持了这一推测.
对于灰尘真菌群落而言, 优势物种由夏季的曲霉属(Aspergillus)、链格孢属(Alternaria)和裂褶菌属(Schizophyllum)逐步转变为秋季的曲霉属.曲霉属和链格孢属均为家庭室内环境中常见的霉菌(Barberán et al., 2015a), 但主要来源于室外环境, 被认为是寄生于土壤或植物的腐生菌(Esch et al., 2001).这两个属中的很多菌种均具有较强的致病性或致敏性, 例如Aspergillus flavus能够产生有毒的代谢产物, 从而引起食物中毒(Rudramurthy et al., 2019);而链格孢属的一些菌种, 例如Alternaria alternata是已知的致敏菌, 能够诱发哮喘(Salo et al., 2006).这些结果表明家庭室内环境中潜在的病原菌和致敏菌不容忽视, 建议居民定期打扫房屋卫生(如清除灰尘), 并注意个人卫生.此外, 鉴于家庭周围的室外环境也能影响室内微生物群落, 特别是真菌群落, 建议居民对于居住小区及附近的环境也要保持良好的卫生条件.
4.3 夏秋季节家庭室内灰尘微生物互作网络的变化特征北京市家庭室内灰尘微生物的网络互作关系具有明显的季节特征, 秋季灰尘微生物的互作比夏季更紧密, 且以细菌-细菌间的互作为主.这可能是由于秋季家庭室内空气湿度通常比夏季低, 较低的空气湿度有利于微生物的传播扩散, 导致灰尘微生物之间的相互作用较夏季更为紧密.此外, 秋季家庭室内较低的空气湿度可能不利于霉菌的存活(Adams et al., 2013), 导致微生物网络互作以细菌群落界内的互作为主.此外, 在本研究中, 不论夏季还是秋季, 灰尘微生物的互作关系, 包括细菌、真菌群落界内的互作以及细菌-真菌群落界间的互作都以正相互作用, 即互惠作用为主.这可能是由于不同季节家庭室内环境中有机物(如脱落的人体皮肤细胞和厨余垃圾)等养分充足, 微生物不需要激烈的竞争即可获得足够的碳源和能源, 因此主要通过互惠作用进行网络互作.Banerjee等(2016)针对耕地土壤细菌和真菌之间网络互作关系的研究结果也表明, 在有机物和营养物充足的条件下, 微生物互作网络以正相互作用, 即互惠作用为主.
5 结论(Conclusions)1) 北京市家庭室内灰尘细菌和真菌群落α多样性夏季均明显高于秋季.
2) 北京市家庭室内灰尘细菌群落结构夏季与秋季之间无明显差异, 主要类群为假单胞菌属(Pseudomonas, 属于变形菌门)、考克氏菌属(Kocuria, 属于放线菌门)和芽孢杆菌属(Bacillus, 属于厚壁菌门).而室内灰尘真菌群落结构夏季与秋季明显不同, 夏季主要类群为曲霉属(Aspergillus, 属于子囊菌门)、链格孢属(Alternaria, 属于子囊菌门)和裂褶菌属(Schizophyllum, 属于担子菌门), 而秋季曲霉属占据绝对主导地位.
3) 北京市家庭室内灰尘微生物的网络互作关系具有明显的季节特征.夏季空气微生物互作关系主要为细菌群落界内, 以及细菌-真菌群落界间的相互作用.而秋季空气微生物的互作比夏季更紧密, 且以细菌群落界内的相互作用为主, 特别是变形菌门与放线菌门之间的互惠作用.
参考文献
| Adams R I, Miletto M, Taylor J W, et al. 2013. Dispersal in microbes:fungi in indoor air are dominated by outdoor air and show dispersal limitation at short distances[J]. ISME Journal, 7(7): 1262-1273. DOI:10.1038/ismej.2013.28 |
| Banerjee S, Kirkby C A, Schmutter D, et al. 2016. Network analysis reveals functional redundancy and keystone taxa amongst bacterial and fungal communities during organic matter decomposition in an arable soil[J]. Soil Biology and Biochemistry, 97: 188-198. DOI:10.1016/j.soilbio.2016.03.017 |
| Barberán A, Dunn R R, Reich B J, et al. 2015a. The ecology of microscopic life in household dust[J]. Proceedings of the Royal Society B-Biological Sciences, 282(1814): 212-220. |
| Barberán A, Ladau J, Leff J W, et al. 2015b. Continental-scale distributions of dust-associated bacteria and fungi[J]. Proceedings of the National Academy of Sciences of the United States of America, 112(18): 5756-5761. DOI:10.1073/pnas.1420815112 |
| Bartram A K, Lynch M D J, Stearns J C, et al. 2011. Generation of multimillion-sequence 16S rRNA gene libraries from complex microbial communities by assembling paired-end Illumina reads[J]. Applied and Environmental Microbiology, 77(11): 3846-3852. DOI:10.1128/AEM.02772-10 |
| Benjamini Y, Hochberg Y. 1995. Controlling the false discovery rate:a practical and powerful approach to multiple testing[J]. Journal of the Royal Statistical Society Series B-Statistical Methodology, 57(1): 289-300. |
| Caporaso J G, Kuczynski J, Stombaugh J, et al. 2010. QIIME allows analysis of highthroughput community sequencing data[J]. Nature Methods, 7: 335-336. DOI:10.1038/nmeth.f.303 |
| Chen Q, An X, Li H, et al. 2016. Long-term field application of sewage sludge increases the abundance of antibiotic resistance genes in soil[J]. Environment International, 92-93: 1-10. DOI:10.1016/j.envint.2016.03.026 |
| Dannemiller K C, Gent J F, Leaderer B P, et al. 2016. Influence of housing characteristics on bacterial and fungal communities in homes of asthmatic children[J]. Indoor Air, 26(2): 179-192. DOI:10.1111/ina.12205 |
| Ding L J, Su J Q, Li H, et al. 2017. Bacterial succession along a long-term chronosequence of paddy soil in the Yangtze River Delta, China[J]. Soil Biology & Biochemistry, 104: 59-67. |
| Ding L J, Zhou X Y, Zhu Y G. 2020. Microbiome and antibiotic resistome in household dust from Beijing, China[J]. Environment International, 139: 105702. DOI:10.1016/j.envint.2020.105702 |
| Dunn R R, Fierer N, Henley J B, et al. 2013. Home life:factors structuring the bacterial diversity found within and between homes[J]. PLoS One, 8(5): e64133. DOI:10.1371/journal.pone.0064133 |
| Esch R E, Hartsell C J, Crenshaw R, et al. 2001. Common allergenic pollens, fungi, animals, and arthropods[J]. Clinical Reviews in Allergy and Immunology, 21(2/3): 261-292. |
| Fierer N, Hamady M, Lauber C L, et al. 2008. The influence of sex, handedness, and washing on the diversity of hand surface bacteria[J]. Proceedings of the National Academy of Sciences of the United States of America, 105(46): 17994-17999. DOI:10.1073/pnas.0807920105 |
| 方治国, 欧阳志云, 刘芃, 等. 2013. 北京市居家空气微生物污染特征[J]. 环境科学学报, 33(4): 1166-1172. |
| Gilbert J A, Stephens B. 2018. Microbiology of the built environment[J]. Nature Reviews Microbiology, 16: 661-670. DOI:10.1038/s41579-018-0065-5 |
| Li H, Zhou X Y, Yang X R, et al. 2019. Spatial and seasonal variation of the airborne microbiome in a rapidly developing city of China[J]. Science of the Total Environment, 665: 61-68. DOI:10.1016/j.scitotenv.2019.01.367 |
| Ma E S K, Wong C L P, Lai K T W, et al. 2005. Kocuria kristinae infection associated with acute cholecystitis[J]. BMC Infectious Diseases, 5: 60. DOI:10.1186/1471-2334-5-60 |
| Rintala H, Pitkaranta M, Taubel M. 2012. Microbial communities associated with house dust[J]. Advances in Applied Microbiology, 78: 75-120. DOI:10.1016/B978-0-12-394805-2.00004-X |
| Rudramurthy S M, Paul R A, Chakrabarti A, et al. 2019. Invasive aspergillosis by Aspergillus flavus:epidemiology, diagnosis, antifungal resistance, and management[J]. Journal of Fungi, 5(3): 55. |
| Salo P M, Arbes S J, Sever M, et al. 2006. Exposure to Alternaria alternata in US homes is associated with asthma symptoms[J]. Journal of Allergy and Clinical Immunology, 118(4): 892-898. DOI:10.1016/j.jaci.2006.07.037 |
| Schwela D, Moawska L, Kotzias D. 2002. Guidelines for concentration and exposure-response measurements of fine and ultra fine particulate matter for use in epidemiological studies[R]. Geneva: World Health Organization, 4-26 |
| Zhou J Z, Deng Y, Luo F, et al. 2010. Functional molecular ecological networks[J]. mBio, 1(4): 1592-1601. |
