 , 郑毅1
, 郑毅1
 , 王晓彤1, 许旭萍1, 陈桂香2,3, 王维奇2,3
, 王晓彤1, 许旭萍1, 陈桂香2,3, 王维奇2,3

1. 福建师范大学生命科学学院, 福州 350117;
2. 福建师范大学地理研究所, 福州 350007;
3. 福建师范大学湿润亚热带生态地理过程教育部重点实验室, 福州 350007
收稿日期: 2020-04-20; 修回日期: 2020-06-04; 录用日期: 2020-06-04
基金项目: 国家自然科学基金(No.41571287,42077086);福建省高校****科研人才培育计划2017
作者简介: 陈钰(1992-), 女, E-mail:cy03261748@163.com
通讯作者(责任作者): 郑毅, E-mail:eyizheng@fjnu.edu.cn
王维奇, E-mail:wangweiqi@finu.edu.cn
摘要:互花米草是河口湿地典型的入侵物种,为了探究互花米草入侵对河口湿地铁还原菌群落结构及多样性影响,以闽江口秋茄湿地、闽江口芦苇湿地和漳江口白骨壤湿地3个典型的湿地为研究对象,分别对互花米草入侵前后土壤铁还原菌群落进行测定与分析.结果表明:①互花米草入侵使白骨壤湿地和芦苇湿地土壤铁还原菌多样性升高,使秋茄湿地铁还原菌多样性降低;②互花米草入侵白骨壤湿地后拟杆菌门(Bacteroidetes)相对丰度显著降低,变形菌门(Proteobacteria)铁还原菌的相对丰度显著提高(p < 0.05);③互花米草入侵使湿地土壤铁还原菌的优势菌属发生演替.互花米草入侵后,秋茄湿地中优势菌属除硫单胞菌(Desulfuromonas)的丰度显著降低成为非优势菌属,而厌氧粘细菌(Anaeromyxobacter)的丰度显著提高成为第三优势菌属;白骨壤湿地中互花米草入侵后拟杆菌属(Bacteroides)的丰度显著降低成为非优势菌属;④环境因子及碳组分影响湿地土壤铁还原菌的相对丰度,Geobacter的相对丰度与可溶性有机碳、土壤微生物量碳均呈显著负相关(p < 0.01),Halothiobacillus的相对丰度与土壤总有机碳(SOC)呈显著正相关(p < 0.05),与土壤微生物量碳(MBC)呈显著负相关(p < 0.05).研究结果可为治理互花米草过程中微生物多样性的恢复提供科学依据.
关键词:互花米草入侵铁还原菌群落结构多样性河口湿地
Effects of Spartina alterniflora invasion on iron-reducing bacteria community structure and diversity in estuarine wetland
CHEN Yu1
 , ZHENG Yi1
, ZHENG Yi1
 , WANG Xiaotong1, XU Xuping1, CHEN Guixiang2,3, WANG Weiqi2,3
, WANG Xiaotong1, XU Xuping1, CHEN Guixiang2,3, WANG Weiqi2,3

1. College of Life Science, Fujian Normal University, Fuzhou 350117;
2. Institute of Geography, Fujian Normal University, Fuzhou 350007;
3. Key Laboratory of Humid Sub-tropical Eco-geographical Process of Ministry of Education, Fujian Normal University, Fuzhou 350007
Received 20 April 2020; received in revised from 4 June 2020; accepted 4 June 2020
Abstract: In order to explore the effects of Spartina alterniflora invasion on iron-reducing bacteria community structure and diversity in wetland,the soils were collected from typical wetland of Kandelia candel wetland,Phragmite australis wetland and Avicennia marina wetland,and the iron-reducing bacteria communities were determined and analyzed before and after the Spartina alterniflora invation. The results showed that: ①Iron-reducing bacteria diversity was increased in Avicennia marina wetland and Phragmite australis wetland,while the invasion reduced the diversity of iron-reducing bacteria in Kandelia candel wetland. ② The relative abundance of Bacteroidetes was significantly decreased,however,iron-reducing bacteria of Proteobacteria was significantly increased in the Avicennia marina wetland after Spartina alterniflora invasion(p < 0.05). ③ Spartina alterniflora invasion caused the succession of the dominant genus of iron-reducing bacteria in wetland soil. The abundance of Desulfuromonas was significantly reduced and became the non-dominant genus,while the abundance of Anaeromyxobacter was significantly increased and became the third dominant genus after Spartina alterniflora invasion. The abundance of Bacteroides was significantly decreased and became the non-dominant genus in Phragmite australis wetland after Spartina alterniflora invasion.④The relative abundance of iron-reducing bacteria was affected by the environmental factors and organic carbon fractions in wetland soils. The relative abundance of Geobacter was significantly and negatively correlated with soil dissolved organic carbon,soil microbial biomass carbon and soil pH (p < 0.01). The relative abundance of Halothiobacillus was significantly and positively correlated with soil total organic carbon (p < 0.05) and significantly and negatively correlated with soil microbial biomass carbon (p < 0.05). The results of this study could provide scientific basis for the restoration of microbial diversity in the process of Spartina alterniflora treating.
Keywords: Spartina alterniflora invasionIron-reducing bacteriacommunity structurediversityestuarine wetland
1 引言(Introduction)河口湿地是湿地的一个重要类型, 是河流、海洋和陆地交互作用而成的生态系统(Matthew et al., 2016), 包括河口三角洲、沙洲、沙岛、水域和潮间沼泽等湿地类型.在区域气候调节, 以及缓解城市热岛效应等方面起到重要作用(Natuhara, 2013).然而, 湿地却是我国, 也是全球生物多样性受破坏最严重的生态系统类型之一(Jiang et al., 2015).
植物入侵是生态系统面临的环境问题之一(Kueffer, 2017), 植物入侵不但会显著影响土著生态系统的物种组成, 还会改变土壤性质以及土壤微生物群落结构等(Vilà et al., 2011).互花米草(Spartina alterniflora)自1979年引入我国后, 虽在促淤、护滩和保堤方面发挥了一定的作用, 但其迅速扩散, 成为中国湿地生态系统中最典型的入侵植物之一(Zhang et al., 2017), 对我国滨海湿地生态系统造成了诸多影响(Cao et al., 2012).互花米草入侵使河口湿地的土壤理化性质发生改变(Vilà et al., 2011), 并进一步影响土壤元素循环及其相关微生物群落.已有的研究中, 开展了一些互花米草入侵对土壤微生物多样性(周虹霞等, 2005)、群落结构(左平等, 2014)的研究;但从研究的微生物种类来看, 主要包括氨氧化细菌(Zhang et al., 2011)、产甲烷菌和硫酸盐还原菌(Zeleke et al., 2013;Cui et al., 2017), 而互花米草入侵对铁还原菌群落结构与多样性影响如何, 尚鲜有报道.
铁还原菌是一类能异化还原Fe(Ⅲ)并从中获取能量用于自身生长的微生物(Lovley, 2004), 其介导的铁还原过程存在于自然界的厌氧环境(孙丽蓉等, 2013), 能够在还原铁氧化的同时直接或者间接促进有机污染物的降解以及生源要素循环(Li et al., 2009).如抑制甲烷气体的产生与排放, 减少温室效应(王晓彤等, 2019), 降解石油烃, 减少环境污染(Zhang et al., 2013).为此, 本研究以福建省闽江河口秋茄湿地、芦苇湿地, 漳江口白骨壤湿地作为研究对象, 借助高通量测序手段探究互花米草入侵对河口湿地铁还原菌群落的影响, 这对全面评价互花米草入侵对我国河口地区的影响具有重要意义, 为基于微生物多样性恢复视角的互花米草治理提供理论依据, 促进河口湿地的保育与可持续管理.
2 研究区与研究方法(Study area and methods)2.1 研究区与采样点本研究土壤分别采于闽江口秋茄湿地, 闽江口芦苇湿地和漳江口白骨壤湿地入侵种互花米草与土著种样地.闽江口湿地地理坐标为119°34′12″~119°41′40″ E, 26°00′36″~26°03′42″ N, 位于福建省长乐市潭头镇和梅花镇闽江入海口, 该区属亚热带季风气候, 年降水量为1346 mm, 年均温为19.6 ℃.天然植被类型主要有秋茄、芦苇、短叶茳芏以及近年来入侵的互花米草等(刘剑秋等, 2006;陈桂香等, 2017).漳江口湿地地理位置为23°53′~23°58′ N, 117°23′~117°32′E, 位于福建省漳州市云霄县漳江入海口, 该区气候属亚热带海洋性季风气候, 年降水量为1871.2 mm, 年均温为21.2 ℃(陈志杰等, 2016).该区主要植被类型为白骨壤和秋茄, 以及入侵植物互花米草等(陈志杰等, 2016;冯建祥等, 2017).
2.2 样品采集与处理于2015年6—8月, 在闽江口, 漳江口的互花米草入侵秋茄、芦苇、白骨壤的3个典型样地中, 在遵循样品采集和样地布设典型性和代表性的原则下, 在涨潮前用取样器分别采集各研究区互花米草和优势土著植物表层0~10 cm的土壤, 每个样地随机取3个重复土样, 共计18个土壤样品.将土样迅速装入自封袋编号并带回实验室, 并将每个样品分成3份, 4 ℃冰箱保存用于微生物生物量碳等测定, -20 ℃冰箱保存用于土壤微生物基因组的提取与分析, 另一部分自然风干、研磨过筛后, 用于土壤理化指标测定.
本研究的铁还原菌门、属的分类数据是通过对实验项目的土壤样品基因组16S RNA细菌高通量测序, 再与NCBI数据库进行比对, 从中筛选出已知的铁还原菌(王晓彤, 2019), 对闽江口秋茄湿地、闽江口互花米草入侵秋茄湿地、闽江口芦苇湿地、闽江口互花米草入侵芦苇湿地、漳江口白骨壤湿地和漳江口互花米草入侵白骨壤湿地样本中挑出的铁还原菌进行重分析, 得到铁还原菌的多样性和群落结构组成结果.
2.3 土壤铁还原菌群落结构及多样性分析——高通量测序技术2.3.1 基因组DNA的提取和PCR扩增采用CTAB方法提取河口湿地土壤样品的基因组DNA(刘璐等, 2015;丁新景等, 2018), 然后通过琼脂糖凝胶电泳检测DNA的大小和完整性(张智猛等, 2017), 取适量的DNA用无菌水稀释至1 ng·μL-1.用稀释后的基因组DNA作为模板, 使用带Barcode的特异引物, New England Biolabs公司的Phusion? High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶进行PCR, New England Biolabs公司的Phusion? High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶进行PCR, 以保证扩增效率和准确性.扩增体系为30 μL, 2×Taq PCR mix 4 μL, Prime F(10 μmol·L-1)1 μL, Prime R(10 μmol·L-1)1 μL, 模板DNA 2.5 μL, 超纯水(ddH2O)2.5 μL.V3~V4可变区域的扩增引物序列是341F(CCTAY GGGRBGCASCAG)和806R(GGACTACNNGGG TATCTAAT).PCR扩增程序为:95 ℃变性50 min、94 ℃变性1 min、57 ℃退火45 s、72 ℃延伸1 min.循环34次后72 ℃延伸10 min, 16 ℃延伸5 min.每个样本重复3次.
2.3.2 PCR产物的混样和纯化PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测40 min, 根据PCR产物浓度进行等量混样, 充分混匀后使用1×TAE浓度2%的琼脂糖凝胶电泳纯化PCR产物, 剪切回收目标条带.产物纯化试剂盒使用的是(Thermo Scientific公司GeneJET胶回收试剂盒)回收产物.
2.3.3 文库构建和上机测序使用Thermofisher公司的Ion Plus Fragment Library Kit 48rxns建库试剂盒进行文库的构建, 构建好的文库经过Qubit定量, 检测合格后使用Thermofisher的Life Ion S5TM进行上机测序.
2.4 土壤理化性质以及土壤碳组分的测定土壤容重采用环刀法测定(鲁如坤, 1999), 含水量采用烘干法测定;土壤pH和盐度(以电导率表征盐度)分别用pH计(Starter 300, 美国)和电导仪(2265FS, 美国)测定.土壤SOC采用土壤碳氮元素分析仪(Elementar Vario MAX CN, 德国)测定, 土壤易分解有机碳(LOC)、土壤微生物量碳(MBC)、土壤可溶性有机碳(DOC)分别用高锰酸钾氧化法、氯仿熏蒸浸提法和去离子水浸提法测定(Murphy et al., 2000).
2.5 数据处理应用Excel2016以及SPSS23.0统计分析软件对结果数据进行整理, 用Origin2018进行绘图.为了研究不同条件下土壤铁还原菌群落结构的多样性, 对所有处理的Cleanreads进行聚类, 以97%的一致性将序列聚类成为OTU操作单元, 然后对OTUs的代表序列进行物种注释;利用QIIME软件(Version 1.7.0)计算土壤样品的细菌多样性.使用canoco4.5绘制PCA图, 分析各土壤样品OTUs相似性.结合物种组成信息得到土壤样品中细菌物种丰度.铁还原菌相对丰度与环境影响因子、碳组分的关系采用Spearman相关性分析.
3 结果分析(Results and analysis)3.1 互花米草入侵前后铁还原菌生物多样性分析如表 1所示, 6个样品文库的覆盖率为98.7%~99.5%, 说明土样中基因序列被检出的概率较高, 本次测序结果能够反映湿地铁还原菌群落的真实情况.闽江口秋茄湿地和闽江口互花米草入侵秋茄湿地可以得到铁还原菌的有效OUTs数目分别为77、81个;漳江口白骨壤湿地和漳江口互花米草入侵白骨壤湿地可以得到铁还原菌的有效OTUs是数目分别为116、113个;闽江口芦苇湿地和闽江口互花米草湿地可以得到铁还原菌的有效OTUs分别为98、86个.由Shannon指数可知, 互花米草入侵闽江口秋茄湿地后降低了铁还原菌的多样性, 而互花米草入侵漳江口白骨壤湿地和闽江口芦苇湿地后显著提高了铁还原菌的多样性.Chao1指数是估算群落OTUs数目的指数, 可用来评估样品中微生物群落的群落丰度.从Chao1指数来看, 互花米草入侵闽江口秋茄湿地后降低了铁还原菌群落的群落丰度, 而互花米草入侵漳江口白骨壤湿地和闽江口芦苇湿地后提高了铁还原菌群落的群落丰度.
表 1(Table 1)
| 表 1 互花米草入侵前后湿地土壤铁还原菌的α多样性指数 Table 1 Alpha diversity index of wetland soil Iron-reducing bacteria before and after the invasion of Spartina alterniflora | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 互花米草入侵前后湿地土壤铁还原菌的α多样性指数 Table 1 Alpha diversity index of wetland soil Iron-reducing bacteria before and after the invasion of Spartina alterniflora
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2 互花米草入侵前后铁还原菌OTUs分布将互花米草入侵前后的铁还原菌作为一个整体绘制花瓣图(图 1), 闽江口秋茄、闽江口米草、漳江口白骨壤、闽江口米草、闽江口芦苇、闽江口米草特有的OTUs分别为0、1、13、6、1、3个;其共有的铁还原菌的OTUs数目为56个.由此可见, 闽江口米草入侵后, 出现了新的种类, 漳江口米草入侵降低了特有铁还原菌的多样性.
图 1(Fig. 1)
 |
| 图 1 互花米草入侵前后土壤铁还原菌OTUs花瓣分布 Fig. 1Petal map of wetland soil Iron-reducing bacteria OTUs distribution before and after the invasion of Spartina alterniflora |
3.3 互花米草入侵前后湿地铁还原菌群落群落结构分析3.3.1 土壤铁还原菌16S rRNA基因序列属的系统发育分析如图 2所示通过系统发育树及进化关系的比对, 可以发现在属水平上, 系统进化过程主要分为3部分, 检测出的25个铁还原菌属有硫杆菌属(Thiobacillus)、拟杆菌属(Bacteroides)、地杆菌属(Geobacter)、除硫单胞菌(Desulfuromonas)、厌氧粘细菌属(Anaeromyxobacter)、脱硫叶菌属(Desulfobulbus)、地温杆菌(Geothermobacter)、地发菌属(Geothrix)、磺酸菌属(Sulfitobacter)、假单胞菌属(Pseudomonas)脱硫弧菌属(Desulfovibrio)、单胞菌属(Ferrimonas)、红细菌属(Rhodobacter)、希瓦氏菌属(Shewanella)等.其中有几组菌属的铁还原菌, 如变形菌门(Proteobacteria)的Thiobacillus与Shewanella、Desulfuromusa与GeopsychrobacterL、Loktanella与Sulfitobacter、Halodesulfovibrio与Desulfocurvus、Desulfomicrobium与Desulfovibrio在系统发育上具有相近的亲缘关系.
图 2(Fig. 2)
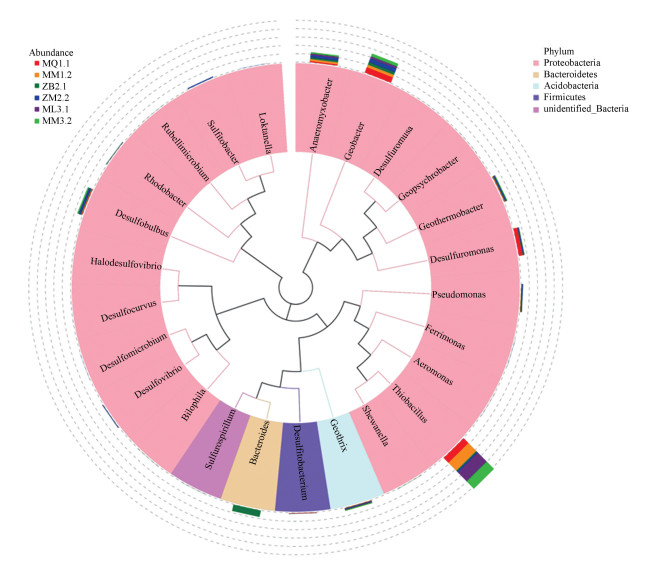 |
| 图 2 土壤铁还原菌16S rRNA基因序列属的系统发育树 Fig. 2Phylogenetic tree of the genus 16S rRNA gene sequence of soil iron-reducing bacteria |
3.3.2 门水平的铁还原菌群落组成结构互花米草入侵前后的6个湿地铁还原菌门水平的群落组成如图 2所示, 共鉴定出5个门分别为变形菌门(Proteobacteria);拟杆菌门(Bacteroidetes);酸杆菌门(Acidobacteria);厚壁菌门(Firmicutes)0.16%~1.66%和unidentified_Bacteria.其中变形菌门(Proteobacteria)铁还原菌在互花米草入侵前后占绝对优势.互花米草入侵后变形菌门(Proteobacteria)铁还原菌相对丰度均提高, 其中漳江口白骨壤湿地在米草入侵后相对丰度从64.18%提高到97.20%, 拟杆菌门(Bacteroidetes)的相对丰度从33.16%降低到0.05%, 而闽江口秋茄湿地和闽江口芦苇湿地在米草入侵前后均无拟杆菌门.闽江口秋茄湿地在米草入侵后, 厚壁菌门相对丰度降低, 酸杆菌门相对丰度升高.闽江口芦苇湿地在互花米草入侵后出现了新的未知的铁还原菌门unidentified_Bacteria.
3.3.3 属水平的铁还原菌群落组成结构互花米草入侵前后湿地铁还原菌属水平的群落组成如图 3所示, 互花米草入侵前后6个湿地土壤中相对丰度排列前10的属占比为64.34%~ 96.51%.分别为:硫杆菌属(Thiobacillus)、拟杆菌属(Bacteroides)、地杆菌属(Geobacter)、除硫单胞菌(Desulfuromonas)、厌氧粘细菌属(Anaeromyxobacter)、脱硫叶菌属(Desulfobulbus)、地温杆菌(Geothermobacter)、地发菌属(Geothrix)、磺酸菌属(Sulfitobacter)、假单胞菌属(Pseudomonas).闽江口湿地在互花米草入侵前后硫杆菌属、拟杆菌属是优势菌属.互花米草入侵对湿地铁还原菌属群落组成影响较大, 闽江口和漳江口湿地在互花米草入侵后有出现新的铁还原菌属, 也有铁还原菌属的消失.尤其硫杆菌属、拟杆菌属、地杆菌属3个菌属的的相对群落相对丰度变化明显.
图 3(Fig. 3)
 |
| 图 3 互花米草入侵前后湿地土壤铁还原菌门(a)和属(b)水平群落组成 Fig. 3Composition of Iron-reducing bacteria at phylum(a) and genus(b) level community in wetland soil before and after Spartina alterniflora |
3.4 互花米草入侵前后土壤铁还原菌属水平分布热图为了更进一步探究互花米草入侵前后各湿地土壤中铁还原菌优势菌属的差异, 将已鉴定出的26个铁还原菌属根据其在每个样品中的丰度信息, 从物种和样品两个层面进行聚类绘制成聚类热图(图 5).如图 5所示, 闽江口秋茄湿地(MQ1)的优势菌属为Geobacter、Desulfuromonas和Desulfobulbus;米草入侵秋茄湿地(MM2)的优势菌属为Thiobacillus和Anaeromyxobacter.漳江口白骨壤湿地(ZB2)的优势菌属为Rubellimicrobium、Bilophila、Bacteroides、Shewanella、Halodesulfovibrio;米草入侵白骨壤湿地(ZM2)的优势菌属为Alkaliphilus、Desulfocurvus、Sulfitobacter等.闽江口芦苇湿地(ML3)的优势菌属为Geobacter、Thiobacillus、Aeromonas等;米草入侵芦苇湿地(MM3)的优势菌属为Geobacter和Rhodobacter.可以看出, 铁还原菌在属水平上, 不同菌属在不同样品中的相对丰度存在一定的差异, 各样品中的优势菌属均不相同, 说明互花米草入侵改变了土壤微生物的生存环境, 进而导致优势菌属有所改变.
图 4(Fig. 4)
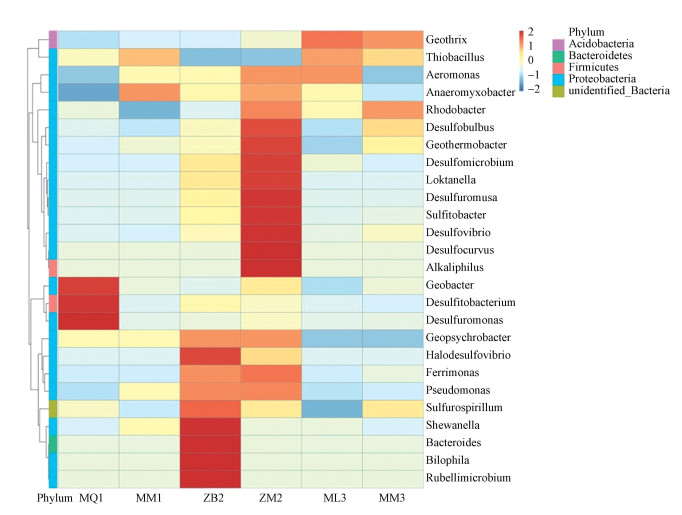 |
| 图 4 互花米草入侵前后湿地土壤铁还原菌丰度聚类热图 Fig. 4Cluster heat map of relative abundance of soil iron-reducing bacteria in wetland before and after Spartina alterniflora invasion |
图 5(Fig. 5)
 |
| 图 5 互花米草入侵前后湿地铁还原菌群落结构PCA分析 Fig. 5PCA analysis of soil iron-reducing bacteria community structure in wetland before and after the invasion of Spartina alterniflora |
3.5 互花米草入侵前后土壤铁还原菌群落组成的主成分分析为了更直观的分析互花米草入侵对土壤铁还原菌群落结构的影响, 绘制了PCA分析图.如图 6所示, PCA分析共提取2个主成分(PC1和PC2)进行分析, 第1主成分特征值的贡献率为46.69%, 第2主成分特征值的贡献率为22.00%, PC1和PC2占总变异的68.69%, 说明这两个主成分是造成互花米草入侵前后土壤铁还原菌群落差异的主要因素.由图可知, 不同类型土壤在PC轴上分布出现了差异, 闽江口秋茄湿地(MQ1)与互花米草入侵秋茄湿地(MM1), 闽江口芦苇湿地(ML3)与互花米草入侵芦苇(MM3)在主成分1轴(PC1)和2轴(PC2)都有一定距离;漳江口白骨壤湿地(ZB2)和互花米草入侵白骨壤湿地(ZM2)在主成分1轴(PC1)分别分布在主成分2轴(PC2)正方向上和负方向上, 且距离较远.PCA分析结果表明, 互花米草入侵可以改变湿地铁还原菌群落的组成结构, 白骨壤湿地在互花米草入侵前后土壤铁还原菌群落结构的变化受到这两个主成分的影响较大.
图 6(Fig. 6)
 |
| 图 6 湿地铁还原菌群落结构与环境因子CCA分析 (SOC:土壤有机碳, LOC:土壤易氧化态碳, MBC:土壤微生物量碳DOC:可溶性有机碳, SL:盐度, WC:含水量BW:容重, 下同) Fig. 6CCA analysis of soil Iron-reducing bacteria community structure and environmental factors in wetland |
3.6 土壤环境因子及其与铁还原菌群落结构相关性分析土壤环境因子的变化具体详见尹晓雷等(2020)和林少颖(2020), 总体变化为互花米草入侵秋茄湿地、白骨壤湿地和芦苇湿地后土壤盐度均增加, MBC含量均降低, 而土壤pH、含水量、容重、SOC含量、DOC含量等对互花米草入侵的响应有所差别.
3.6.1 铁还原菌优势群落与环境因子之间的关系绘制了CCA图, 由CCA图可知, Desulfobulbus、Geothrix、Geobacter、Anaeromyxobacter、Pseudomonas 5个铁还原菌菌属与土壤微生物量碳(MBC)值和土壤可溶性有机碳(DOC)值的角度呈锐角, 与土壤易氧化态碳(LOC)值和土壤有机碳(SOC)值呈钝角, 说明这5个菌属群落丰度与环境因子MBC值和DOC值呈正相关, 与环境因子LOC值和SOC值呈负相关.而Desulfuromonas、和Thiobacillus两个铁还原菌属与LOC值和SOC值呈锐角, 与MBC值和DOC值的角度呈钝角, 说明这两个菌属群落丰度与环境因子LOC值和SOC值呈正相关, 与MBC值和DOC值呈负相关.Rhodobacter、Thiobacillus、Dyella、Candidatus Nitrotoga、Sulfuriferula 5个菌属与土壤容重(BW)值的角度呈锐角, 与土壤pH、土壤盐度(SL)值的角度呈钝角, 说明这5个菌属群落丰度与环境因子BW值呈正相关, 与pH、SL值呈负相关.Sulfurimonas与土壤含水量(WC)值的角度呈锐角, 与pH、SL值、BW值的角度呈钝角, 说明Sulfurimonas群落丰度与环境因子WC呈正相关, 与环境因子pH、SL和BW呈正相关.Blautia的相对丰度与pH呈正相关.CCA结果表明, 互花米草入侵导致的湿地土壤环境因子的变化能够改变土壤铁还原菌优势菌群落结构.
3.6.2 铁还原菌丰度与环境因子Spearman相关性分析由图 7可知, 湿地土壤铁还原菌不同属群落丰度与土壤pH、盐度、含水量、容重以及土壤碳组分存在相关性.Sulfuriferula的相对丰度与土壤总有机碳(SOC)呈显著正相关(p<0.01), 与盐度(SL)呈显著负相关(p<0.05);Geobacter的相对丰度与DOC、MBC、pH均呈显著负相关(p<0.01);Halothiobacillus的相对丰度与土壤总有机碳(SOC)呈显著正相关(p<0.05), 与土壤微生物量碳(MBC)呈显著负相关(p<0.05);Sideroxydans的相对丰度与土壤易氧化态碳(LOC)呈显著正相关(p<0.01), 与土壤盐度(SL)呈显著负相关(p <0.01);Anaeromyxobacter的相对丰度与土壤含水量(WC)呈显著负相关(p<0.05).
图 7(Fig. 7)
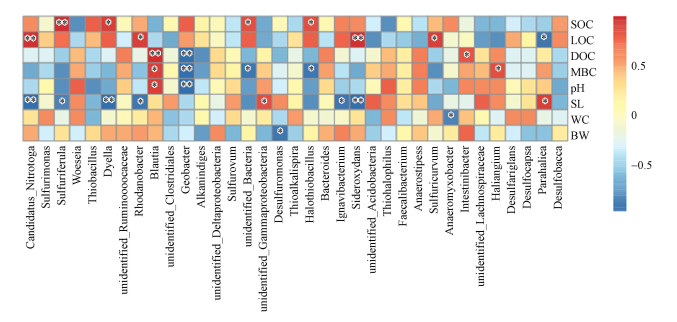 |
| 图 7 湿地土壤铁还原菌群落结构与环境因子相关性 (横向为物种信息, 纵向为样品信息, 标注*表示显著性检验p<0.05;**p<0.01) Fig. 7Correlation between soil Iron-reducing bacteria community structure and environmental factors in wetland |
4 讨论(Discussion)4.1 互花米草入侵对河口湿地铁还原菌多样性及群落结构的影响互花米草入侵会对土壤环境和微生物群落产生重要影响(Vilà et al., 2011;陈爱辉等, 2013), 其中互花米草入侵导致的土壤理化性质的改变是影响土壤微生物多样性和群落结构的重要因素(侯栋梁等, 2015;林耀奔等, 2019).本研究发现, 3种不同植被类型的湿地中铁还原菌对互花米草入侵的响应不同.漳江口白骨壤湿地和闽江口芦苇湿地受互花米草入侵后, 由表 1中Chao1指数和Shannon指数可知铁还原菌群落丰度和多样性均提高, 这与已有的研究结果一致(周虹霞等, 2005;赵紫檀等, 2017).互花米草入侵白骨壤湿地可能使其中的有机碳酵解产酸产氢作用加强, 使土壤体系pH下降(Herbert et al., 2002), 酵解产物被铁还原菌利用(李金珠等, 2014), 其含水量显著提高(p<0.05), 体系缓冲容量提高, 也是微生物适宜繁殖和生长的条件之一.互花米草与芦苇相比, 芦苇为C3植物, 而互花米草则为C4植物, 具有较高净光合速率(林培治等, 2012)、耐淹能力和耐盐能力(Hellings et al., 1992)等, 在本研究中互花米草入侵后盐度升高和含水量变化可能并未对铁还原菌的多样性产生明显变化, 反而互花米草较高的光合速率会间接影响铁还原菌的微环境, 使其丰富度增加.并且有研究表明电子受体可能是提高铁还原菌多样性的主要因素(由焦化等, 2011;覃海华等, 2018).由此分析可知, 可能是因为互花米草入侵芦苇湿地后改变了湿地土壤有机质、pH值、盐度、含水量、电子受体数量等性质(Ahn et al., 2009; Wang et al., 2013;王晓彤等, 2019), 使土壤中铁还原菌生存的条件接近或达到最适条件, 刺激微生物的繁殖和生长, 从而使铁还原菌群落丰度提高、生物多样性增加(张磊等, 2009).闽江口秋茄湿地被互花米草入侵后铁还原菌多样性和群落丰度均降低, 一方面, 可能是因为互花米草入侵后土壤pH升高, 不同铁还原菌具有各自最佳的生长pH, 且每种铁还原菌的生长pH范围很窄(Kusel et al., 1999), 所以pH变化对土壤铁还原菌有重要影响;另一方面, 有研究表明, 互花米草入侵秋茄湿地后, 提高了土壤过氧化氢酶的活性, 降低了蔗糖酶的活性(白静等, 2017), 过氧化氢酶促进土壤中H2O2分解成H2O和O2, 蔗糖酶可使土壤中易溶性营养物质增加, 通过改变过氧化氢酶和蔗糖酶含量影响土壤含氧量和营养物质, 使土壤铁还原菌的丰度降低.综合本研究结果, 不同植被类型的河口湿地对互花米草入侵响应不同, 进一步说明互花米草入侵机制的复杂性和研究互花米草入侵机制的必要性.
4.2 互花米草入侵对河口湿地铁还原菌优势菌群的影响互花米草入侵本地滨海湿地植物可以直接造成土壤微生物生态系统的改变(曾艳等, 2011;彭鑫怡等, 2019), 本研究结果显示, 在门水平上, 河口湿地受到互花米草入侵前后, 铁还原菌混合菌群中绝对优势菌门依然是变形菌门(Proteobacteria).闽江口秋茄湿地和闽江口芦苇湿地铁还原菌门水平群落混合菌群优势菌大致不变, 主要原因可能是因为不同覆被条件下土壤中用于铁还原菌利用的电子受体浓度趋于相对稳定(Wang et al., 2013), 使土壤铁还原菌在门水平上群落组成相似.而漳江口白骨壤湿地在米草入侵后变形菌门(Proteobacteria)铁还原菌的相对丰度显著提高, 拟杆菌门(Bacteroidetes)的铁还原菌作为次优势菌门的相对丰度显著降低, 有研究证实, 营养丰富的环境适合变形菌门的快速生长(Johnston et al., 2013), 说明互花米草入侵白骨壤湿地后土壤养分变得更充足, 而这种铁还原菌混合菌群中优势菌属演变的原因可能是由繁殖竞争和生存竞争导致的(Rui et al., 2009).另一方面可能是因为互花米草入侵改变了土壤理化性质, 从而影响了土壤微生物在门水平上的群落结构特征(贾远航等, 2019).但不同分类水平的铁还原菌对互花米草入侵的响应不同, 在属水平上, 互花米草入侵使秋茄湿地优势菌属除硫单胞菌(Desulfuromonas)的丰度显著降低, 而厌氧粘细菌属(Anaeromyxobacter)的丰度显著提高成为优势菌属, 有研究发现, 优势类型比例下降, 原因可能是以某种碳源为优势碳源的铁还原菌生长受到抑制(易维杰等, 2010).由CCA图可知, 除硫单胞菌(Desulfuromonas)与MBC值和DOC值呈负相关, 厌氧粘细菌属(Anaeromyxobacter)与环境因子土壤微生物量碳(MBC)和土壤可溶性有机碳(DOC)呈正相关, 本研究中秋茄湿地和白骨壤湿地被互花米草入侵后除硫单胞菌(Desulfuromonas)群落丰度降低, 厌氧粘细菌属(Anaeromyxobacter)群落丰度升高, 这与潘婷等(2015)研究认为互花米草入侵秋茄湿地后土壤微生物量碳(MBC)和土壤可溶性有机碳(DOC)均增加的结果一致.而互花米草入侵芦苇湿地后, 硫杆菌属(Thiobacillus)群落丰度降低, CCA图中, Thiobacillus与土壤pH和土壤盐度呈负相关, 这是因为互花米草入侵芦苇湿地后, pH和土壤盐度增大, 盐胁迫作用显著降低了盐敏感微生物的丰度(莫俊杰等, 2016).
5 结论(Conclusions)1) 互花米草入侵使白骨壤湿地和芦苇湿地土壤铁还原菌多样性升高, 使秋茄湿地铁还原菌多样性降低.
2) 互花米草入侵白骨壤湿地后拟杆菌门(Bacteroidetes)铁还原菌的相对丰度显著降低, 变形菌门(Proteobacteria)铁还原菌的相对丰度显著提高(p<0.05).
3) 互花米草入侵使湿地土壤铁还原菌的优势菌属发生演替.互花米草入侵后, 秋茄湿地中优势菌属除硫单胞菌(Desulfuromonas)的丰度显著降低成为非优势菌属, 而厌氧粘细菌(Anaeromyxobacter)的丰度显著提高成为第三优势菌属;白骨壤湿地中互花米草入侵后拟杆菌属(Bacteroides)的丰度显著降低成为非优势菌属.
4) 环境因子及碳组分能够影响湿地土壤铁还原菌的相对丰度, Geobacter的相对丰度与可溶性有机碳、土壤微生物量碳、pH均呈极显著负相关(p<0.01), Halothiobacillus的相对丰度与土壤总有机碳(SOC)呈显著正相关(p<0.05), 与土壤微生物量碳(MBC)呈显著负相关(p<0.05).
参考文献
| Ahn C W, Rita M P. 2009. Soil bacterial community structure and physicochemical properties in mitigation wetlands created in the Piedmont region of Virginia (USA)[J]. Ecological Engineering, 35(7): 1036-1042. DOI:10.1016/j.ecoleng.2009.03.005 |
| 白静, 严锦钰, 何东进, 等. 2017. 互花米草入侵对闽东滨海湿地红树林土壤理化性质和酶活性的影响[J]. 北京林业大学学报, 39(1): 70-77. |
| Cao Z N, Liu Y X, Zhang X Y, et al. 2012. Short-term effects of diesel fuel on rhizosphere microbial community 0.0structure of native plants in Yangtze estuarine wetland[J]. Environmental Science and Pollution Research International, 19(6): 2179-2185. DOI:10.1007/s11356-011-0720-0 |
| 曾艳, 田广红, 陈蕾伊, 等. 2011. 互花米草入侵对土壤生态系统的影响[J]. 生态学杂志, 30(9): 2080-2087. |
| 陈爱辉, 梁慧星, 李朝霞. 2013. 互花米草入侵对湿地土壤微生物群落的影响[J]. 湖北农业科学, 52(20): 4908-4911+4916. |
| 陈桂香, 高灯州, 陈刚, 等. 2017. 互花米草入侵对我国红树林湿地土壤碳组分的影响[J]. 水土保持学报, 31(6): 249-256. |
| 陈志杰, 韩士杰, 张军辉. 2016. 土地利用变化对漳江口红树林土壤有机碳组分的影响[J]. 生态学杂志, 35(9): 2379-2385. |
| Cui J, Chen X P, Nie M, et al. 2017. Effects of Spartina alterniflora invasion on the abundance, diversity, and community structure of sulfate reducing bacteria along a successional gradient of coastal salt marshes in China[J]. Wetlands, 37(2): 221-232. DOI:10.1007/s13157-016-0860-6 |
| 丁新景, 敬如岩, 黄雅丽, 等. 2018. 基于高通量测序的4种不同树种人工林根际土壤细菌结构及多样性[J]. 林业科学, 54(1): 81-89. |
| Fang H H P, Liu H. 2002. Effect of pH on hydrogen production from glucose by a mixed culture[J]. Bioresource Technology, 82(1): 87-93. DOI:10.1016/S0960-8524(01)00110-9 |
| 冯建祥, 宁存鑫, 朱小山, 等. 2017. 福建漳江口本土红树植物秋茄替代互花米草生态修复效果定量评价[J]. 海洋与湖沼, 48(2): 266-275. |
| Hellings S E, Gallagher J L. 1992. The effects of salinity and flooding on Phragmites australis[J]. Journal of Applied Ecology, 29(1): 41-49. DOI:10.2307/2404345 |
| 侯栋梁, 何东进, 洪伟, 等. 2015. 入侵种互花米草影响我国滨海湿地土壤生态系统的研究进展[J]. 湿地科学与管理, 11(4): 67-72. |
| 贾远航, 靳振江, 袁武, 等. 2019. 会仙岩溶湿地、稻田与旱地土壤细菌群落结构特征比较[J]. 环境科学, 40(7): 3313-3323. |
| Jiang T T, Pan J F, Pu X M, et al. 2015. Current status of coastal wetlands in China:Degradation, restoration, and future management[J]. Estuarine, Coastal and Shelf Science, 164: 265-267. DOI:10.1016/j.ecss.2015.07.046 |
| Johnston M D, Lundberg D S, Lazaro V G, et al. 2016. Bacterial population in juvenile maize rhizospheres originate from both seed and soil[J]. Plant and Soil, 405: 337-355. DOI:10.1007/s11104-016-2826-0 |
| Kueffer C. 2017. Plant invasions in the Anthropocene[J]. Science, 358(6364): 724-725. DOI:10.1126/science.aao6371 |
| Kusel K, Dorsch T, Acker G, et al. 1999. Microbial reduction of Fe(Ⅲ) in acidic sediments:Isolation of Acidiphilium cryptum JF-5 capable of coupling the reduction of Fe(Ⅲ)to the oxidation of glucose[J]. Applied and Environmental Microbiology, 65: 3633-3640. DOI:10.1128/AEM.65.8.3633-3640.1999 |
| 李金珠, 王旭刚, 袁雪红, 等. 2014. pH与石灰性水稻土铁氧化还原过程的关系[J]. 土壤学报, 51(1): 143-149. |
| Li X M, Zhou S G, Li F B, et al. 2009. Fe(III)oxide reduction and carbon tetrachloride dechlorination by a newly isolated Klebsiella pneumoniaestrain L17[J]. Journal of Applied Microbiology, 106(1): 130-139. DOI:10.1111/j.1365-2672.2008.03985.x |
| Li X, Li Y, Li F, et al. 2009. Interactively interfacial reaction of iron-reducing bacterium and goethite for reductive dechlorination of chlorinated organic compounds[J]. Chinese Science Bulletin, 54(16): 2800-2804. |
| 林培治, 李守中, 赵颖, 等. 2012. 闽江河口湿地互花米草与芦苇光合特性及适应性研究[J]. 湿地科学与管理, 8(4): 45-48. |
| 林少颖, 陈桂香, 刘旭阳, 等. 2020. 互花米草入侵对河口湿地土壤细菌群落结构及多样性影响[J]. 环境科学学报. DOI:10.13671/j.hjkxxb.2020.0141 |
| 林耀奔, 叶艳妹, 杨建辉, 等. 2019. 土地整治对土壤微生物多样性的影响分析[J]. 环境科学学报, 39(8): 2644-2653. |
| 刘剑秋, 曾从盛, 陈宁. 2006. 闽江河口湿地研究[M]. 北京: 科学出版社. |
| 刘璐, 何寻阳, 谢强, 等. 2015. 桂西北喀什特常见豆科植物根瘤菌的遗传多样性[J]. 应用生态学报, 26(12): 3663-3669. |
| Lovley D R, Holmes D E, Nevin K P. 2004. Dissimilatory Fe(Ⅲ)and Mn(IV)reduction[C].Advances in Microbial Physiology, Amsterdam: Elsevier: 219-286 |
| 鲁如坤. 1999. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社. |
| Matthew M A, Mores R, Farfan M A, et al. 2016. Invasive plants have different effects on trophic structure of green and brown food webs in terrestrial ecosystems:a meta-analysis[J]. Ecology Letters, 19(3): 328-335. DOI:10.1111/ele.12562 |
| 莫俊杰, 彭诗春, 叶昌辉, 等. 2016. 盐胁迫下甘蔗根际土壤微生物量及其酶活性的效应分析[J]. 广东农业科学, 43(6): 103-108. |
| Murphy D V, Macdonald A J, Stockdale E A, et al. 2000. Soluble organic nitrogen in agricultural soils[J]. Biology and Fertility of Soils, 30(5): 374-387. |
| Natuhara Y. 2013. Ecosystem services by paddy fields as substitutes of natural wetlands in Japan[J]. Ecological Engineering, 56: 97-106. DOI:10.1016/j.ecoleng.2012.04.026 |
| 潘婷, 曾六福, 曾从盛, 等. 2015. 互花米草入侵对闽江河口裸滩湿地土壤有机碳的影响[J]. 中国水土保持科学, 13(1): 84-90. |
| 彭鑫怡, 李永春, 王秀玲, 等. 2019. 植物入侵对土壤微生物的影响[J]. 浙江农林大学学报, 36(5): 1019-1027. |
| Rui J, Peng J, Lu Y. 2009. Succession of bacterial populations during plant residue decomposition in rice field soil[J]. Applied and Environmental Microbiology, 75: 4879-4886. DOI:10.1128/AEM.00702-09 |
| 孙丽蓉, 王旭刚, 郭大勇, 等. 2013. 旱作褐土中铁氧化物的厌氧还原动力学特征[J]. 土壤学报, 50(1): 106-112. |
| 覃海华, 忻宏蔚, 刘洪艳. 2018. 不同电子受体下铁还原细菌异化还原Fe(Ⅲ)性质及菌群特征[J]. 生态学杂志, 7(6): 1759-1764. |
| Vilà M, Espinar J L, Hejda M, et al. 2011. Ecological impacts of invasive alien plants:a meta-analysis of their effects on species, communities and ecosystems[J]. Ecology Letters, 14(7): 702-708. DOI:10.1111/j.1461-0248.2011.01628.x |
| Wang S, Fu B J, Gao G Y, et al. 2013. Responses of soil moisture in different land cover types to rainfall events in a re-vegetation catchment area of the Loess Plateau, China[J]. Catena, 101: 122-128. DOI:10.1016/j.catena.2012.10.006 |
| 王晓彤, 许旭萍, 王维奇. 2019. 炉渣与生物炭施加对稻田土壤铁还原菌群落结构及甲烷排放影响[J]. 中国环境科学, 39(6): 2495-2505. |
| 易维洁, 曲东, 黄婉玉, 等. 2010. 淹水培养时间对水稻土中Fe(Ⅲ)异化还原能力的影响[J]. 农业环境科学学报, 29(9): 1723-1729. |
| 尹晓雷, 陈桂香, 王纯, 等. 2020. 互花米草入侵对河口湿地土壤真菌群落结构及多样性影响[J]. 环境科学学报. DOI:10.13671/j.hjkxxb.2020.0039 |
| 由焦化, 夏淑红, 王保莉, 等. 2011. 淹水时间对水稻土中地杆菌科群落结构及丰度的影响[J]. 微生物学报, 51(6): 796-804. |
| Zeleke J, Sheng Q, Wang J G, et al. 2013. Effects of Spartina alterniflora invasion on the communities of methanogens and sulfate-reducing bacteria in estuarine marsh sediments[J]. Frontiers in Microbiology, 4: 243. |
| Zhang D H, Hu Y M, Liu M, et al. 2017. Introduction and spread of an exotic plant, Spartina alterniflora, along coastal marshes of China[J]. Wetlands, 37(6): 1181-1193. DOI:10.1007/s13157-017-0950-0 |
| 张磊, 曲东, 易维洁, 等. 2009. 纤维素作为电子供体对异化铁还原过程的影响[J]. 西北农林科技大学学报(自然科学版), 37(4): 121-127. |
| Zhang Q F, Peng J J, Chen Q, et al. 2011. Impacts of Spartina alterniflora invasion on abundance and composition of ammonia oxidizers in estuarine sediment[J]. Journal of Soils and Sediments, 11(6): 1020-1031. DOI:10.1007/s11368-011-0369-9 |
| Zhang T, Tremblay P L, Chaurasia A K, et al. 2013. Anaerobic benzene oxidation via phenol in Geobacter metallireducens[J]. Applied and Environmental Microbiology, 79(24): 7800-7806. DOI:10.1128/AEM.03134-13 |
| 张智猛, 慈敦伟, 张冠初, 等. 2017. 山东地区盐碱土花生种子际土壤微生物群落结构的研究[J]. 微生物学报, 7(4): 582-596. |
| 赵紫檀, 郑洁, 吴则焰, 等. 2017. 互花米草入侵下红树林土壤微生物群落特征[J]. 森林与环境学报, 37(2): 169-173. |
| 周虹霞, 刘金娥, 钦佩. 2005. 外来种互花米草对盐沼土壤微生物多样性的影响——以江苏滨海为例[J]. 生态学报, 25(9): 2304-2311. |
| 左平, 欧志吉, 姜启吴, 等. 2014. 江苏盐城原生滨海湿地土壤中的微生物群落功能多样性分析[J]. 南京大学学报(自然科学), 50(5): 715-722. |
