 , 冯磊1
, 冯磊1
 , 甄箫斐2
, 甄箫斐21. 沈阳航空航天大学能源与环境学院, 沈阳 110136;
2. 兰州交通大学新能源与动力工程学院, 兰州 730070
收稿日期: 2020-04-06; 修回日期: 2020-04-30; 录用日期: 2020-04-30
基金项目: 辽宁省2018年度省自然科学基金(No.20180550129)
作者简介: 于钦(1995-), 男, E-mail:yuqin0902@163.com
通讯作者(责任作者): 冯磊, E-mail:fl_iceee@163.com
摘要:基于太阳能辅热厌氧消化反应器进行餐厨垃圾半连续发酵试验,探究了温度波动和有机负荷调控(OLR=2.0、4.0、6.0、7.0 kg·m-3·d-1)对甲烷产量、酶活性变化和微生物群落结构的影响.结果表明,反应器可以在OLR为2.0 kg·m-3·d-1下稳定运行并在6.0 kg·m-3·d-1时实现最佳甲烷生产效率,虽然太阳能组比电能组减少了4倍能耗,但热辐射不稳定导致太阳能组发酵温度波动,甲烷平均产量比电能组减少21%.此外,蛋白酶在温度波动环境下表现出较高活性,但脂肪酶和淀粉酶活性却受到抑制.高通测序结果表明,低OLR阶段乙酸型产甲烷菌Methanosaeta活性较强,随着OLR递增氢营养型产甲烷菌Methanoregula和Methanospirillum相对丰度逐渐提高,而试验全过程中水解细菌Firmicutes相对丰度维持在62%~95%,占据主导地位.
关键词:餐厨垃圾有机负荷调控温度波动酶活性微生物群落结构
Effects of organic load and temperature fluctuation on anaerobic microbial community and enzyme activity
YU Qin1
 , FENG Lei1
, FENG Lei1
 , ZHEN Xiaofei2
, ZHEN Xiaofei21. College of Energy and Environment, Shenyang Aerospace University, Shenyang 110136;
2. School of New Energy and Power Engineering, Lanzhou Jiaotong University, Lanzhou 730070
Received 6 April 2020; received in revised from 30 April 2020; accepted 30 April 2020
Abstract: The semi-continuous fermentation experiment of food waste was carried out based on solar assisted heat anaerobic digestion reactor. The effects of temperature fluctuation and organic load regulation (OLR of 2.0,4.0,6.0,7.0 kg·m-3·d-1) on methane production,enzyme activity and microbial community structure were studied.. The results show that the reactor can operate stably under the OLR of 2.0 kg·m-3·d-1 and achieve the best methane production efficiency at 6.0 kg·m-3·d-1. Although the energy consumption of solar energy group is 4 times lower than that of electric energy group,the instability of thermal radiation leads to the fluctuation of fermentation temperature of solar energy group,and the average yield of methane is 21% lower than that of electric energy group. In addition,protease showed high activity in the environment of temperature fluctuation,but the activities of lipase and amylase were inhibited. High-throughput test results showed that Methanosaeta in the low OLR stage had strong activity as an acetic acid methanogen,and the increase of OLR promoted the relative abundance of hydrogen trophic methanogenic bacteria Methanoregula and Methanospirillum,while the relative abundance of hydrolytic bacteria Firmicutes was maintained at 62%~95%,occupying a dominant position.
Keywords: food wasteorganic load rate regulationtemperature fluctuationenzyme activitymicrobial community structure
1 引言(Introduction)2018年中国餐厨垃圾产量达到1.03亿t(Braguglia et al., 2018), 对于食物垃圾年产量不断增长而言, 有效的管理显得尤为重要.丰富的有机物含量和良好的生物降解性决定了厌氧消化技术是处理餐厨垃圾的最佳手段(Duan et al., 2019).餐厨垃圾厌氧消化一般由水解、产酸、产乙酸、产甲烷4个生物转化阶段组成(Karthikeyan et al., 2018; Zhao et al., 2019), 复杂的生化过程易受多种因素影响, 其中, 有机负荷率(OLR)和温度变化直接影响到厌氧消化反应器的运行进程.Guo等(2014)研究发现, OLR为5 g·L-1·d-1时消化反应器中甲烷生产效率最佳, 进一步提升OLR反应器会出现酸败现象.虽然低OLR利于反应器稳定运行, 但较差的有机质利用率增加了沼气工程运行成本, 降低了经济效益, 而过高的OLR冲击会破坏反应器内微生物群落结构平衡进而导致运行失败.因此, 通过逐步提高OLR探索餐厨垃圾厌氧消化反应器所能承受的极限OLR至关重要.
温度是影响厌氧消化运行效率和微生物活性的重要因素之一.Kim等(2011)通过恒定温度和阶梯性温度反应器对比试验指出恒温反应器中甲烷生产效率可达到0.40 L·g-1, 而温度分段反应器仅为0.25 L·g-1, 且反应器在高温条件下运行比中低温具有更高的有机废弃物处理能力.但目前传统沼气工程为维持发酵温度均使用电能作为额外的能源供应, 增加了化石能源使用并导致污染环境(Liu et al., 2019).而太阳能作为取之不尽的清洁能源在新能源开发中具有独特优势, 本试验拟将太阳能系统与厌氧消化工艺相结合, 以提高沼气工程经济效益.但目前关于太阳能热利用的研究主要集中在海水淡化等领域, 且太阳能辐射受气候等因素影响, 不稳定的热辐射导致反应器实际运行温度出现波动现象.Weatherford等(2015)通过实验和模拟相结合研究了反应器内发酵液温度, 发现在太阳能热辐射加热下大部分区域的温度都小于35 ℃.而Alcaraz等(2018)研究发现, 利用太阳能集热器可以有效提高发酵内部温度, 同时发酵液中固体颗粒的存在可以提高集热效率, 说明太阳能辅热发酵技术具有可行性且适当增加反应器内OLR可以提高餐厨垃圾储热能力.
为了评估太阳能辅热系统引起的温度波动对餐厨垃圾处理效率的影响, 本研究选择与恒温电能消化反应器进行对照, 分析温度波动和OLR变化对甲烷产量、酶活性和微生物群落结构的影响, 以期得到餐厨垃圾厌氧消化的最佳OLR和太阳能辐热系统在实际沼气工程中应用价值.
2 材料与方法(Materials and methods)2.1 试验材料餐厨垃圾取自辽宁省沈阳市沈阳航空航天大学北生活区食堂, 将餐厨垃圾中难降解的废弃物(骨头、餐巾纸和蛋壳)挑选除去后经粉碎机(HX-J3022)粉碎成粒径小于5 mm的泥浆状物质, 放入-5 ℃的冰箱中真空封装贮存备用.活性污泥取自辽宁省沈阳市北部污水处理厂污泥浓缩池, 使用上述餐厨垃圾驯化7~10 d(污泥和餐厨垃圾以3:1质量比添加, 温度维持在(37±0.5) ℃).餐厨垃圾与驯化污泥基本参数如表 1所示.
表 1(Table 1)
| 表 1 餐厨垃圾与驯化污泥基本性质 Table 1 Characteristics of food waste and inoculum in the study | ||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 餐厨垃圾与驯化污泥基本性质 Table 1 Characteristics of food waste and inoculum in the study
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
2.2 试验装置试验进行日期为7月1日—8月31日, 试验设计基于实际的太阳能沼气工程项目, 具体试验装置如图 1所示.太阳能系统包括4个部分:太阳辐射系统、智能控制系统、循环恒温水箱和厌氧消化系统.太阳能装置和恒温水箱用于维持消厌氧消化系统温度环境.当温度高于或低于设定温度时, 智能控制系统根据温度探头反馈而自动添加冷水和热水维持发酵水温在(37±0.5) ℃.
图 1(Fig. 1)
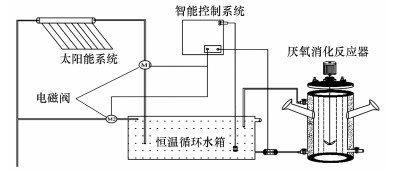 |
| 图 1 太阳能厌氧消化试验系统 Fig. 1Experimental system of anaerobic digestion for solar heating |
受天气影响, 太阳能辐射不足导致发酵系统实际运行中温度波动.根据水温变化将7月和8月分为4个时间段, 同时将每日时间分成3个阶段, 并记录每个阶段的水温波动范围, 水箱内水温随每日时间和月变化如表 2所示.同时, 建立了一套用电加热的循环水浴发酵设备与太阳能系统进行对照分析.
表 2(Table 2)
| 表 2 太阳能系统中温度随时间变化 Table 2 The change of temperature in the solar reactor with time ? | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 太阳能系统中温度随时间变化 Table 2 The change of temperature in the solar reactor with time ?
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
厌氧消化系统采用自制的完全混合式厌氧消化反应器(Continuous Stirred Tank Reactor CSTR), 材质为聚甲基丙烯酸甲酯(PMMA), 容积为12 L, 有效容积为8 L, 反应器顶部采用U型水封结构封盖, 确保试验期间装置气密性良好.采用齿轮电动机(51K40RGN-C)进行间歇式搅拌, 转速设置为80 r·min-1, 每隔2 h搅拌5 min, 试验采用下进上出的内部循环水浴加热形式, 设定循环水浴锅(XT5618-GP)出水温度为(37±0.5) ℃;反应器盖装有排气阀, 沼气通过气体流量计记录.
2.3 试验启动和运行试验选择湿发酵启动.初始阶段, 将3 kg餐厨垃圾与3 L驯化污泥添加到反应器中, 并添加去离子水至8 L, 使用氮气吹脱5min排除空气.每天上午9:00测量反应器内参数信息, 微生物取样时间为每OLR阶段最后一天(第10、30、45、60 d);酶活取样时间间隔为每10 d一次.具体试验条件如表 3所示.
表 3(Table 3)
| 表 3 半连续发酵试验条件 Table 3 Experimental conditions in semi-continuous tests | |||||||||||||||||||||||||
表 3 半连续发酵试验条件 Table 3 Experimental conditions in semi-continuous tests
| |||||||||||||||||||||||||
2.4 常规参数分析方法TS、VS、NH4+-N和溶解性化学需氧量(SCOD)通过国际标准方法确定(APHA, 2005).沼气采用湿气流量计(LML-1)测量.甲烷浓度通过在线甲烷分析仪(PNT400-CH4)测量.pH测量使用便携式pH计(PHSJ-5), 总挥发性脂肪酸(TVFA)按照标准方法测定(吴淑岱, 1998), 电能消耗通过单相电表(DDS606)记录.酶活测定根据土壤酶及其研究法中提出的方法(关松荫, 1983).
2.5 微生物群落分析方法采用CTAB方法对样本DNA进行提取, 之后利用琼脂糖凝胶电泳检测DNA的纯度和浓度, 取适量的样本DNA于离心管中, 使用无菌水稀释样本至1 ng·μL-1.以稀释后的基因组DNA为模板, 使用带Barcode的特异引物、New England Biolabs公司的Phusion? High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶进行PCR扩增.使用16S V4区引物鉴定细菌多样性, 16S V8区引物鉴定古菌多样性.根据PCR产物浓度使用1×TAE浓度2%的琼脂糖胶电泳纯化PCR产物, 剪切回收目标条带.使用Thermo Scientific公司GeneJET胶回收试剂盒回收产物, 并使用Ion Plus Fragment Library Kit 48 rxns建库试剂盒进行文库构建, 构建好的文库使用Ion S5TMXL进行上机测序.数据处理所使用的生物分析软件见文献(Rognes et al., 2016).
3 结果与讨论(Results and discussion)3.1 温度波动和OLR变化对甲烷日产量的影响甲烷产量作为厌氧消化中最重要的参数, 其数值变化可以直观地反映沼气工程运行效率与状态.如图 2所示, OLR为2.0和4.0 kg·m-3·d-1时, 两组反应器中甲烷日产量随发酵底物添加呈上下波动变化状态, 直到OLR提升至6.0 kg·m-3·d-1时波动状态才解除, 此阶段太阳能组和电能组甲烷产量大幅上升并维持动态平衡, 平均产量分别达到34.42 L·d-1和42.26 L·d-1.但进一步提升OLR至7.0 kg·m-3·d-1, 两组试验中甲烷产量出现骤减现象, 反应器无法承受过高的有机质冲击而运行失败.以上结果表明, 当消化反应器以较低的OLR(≤4.0 kg·m-3·d-1)运行时, 低浓度的餐厨垃圾添加无法充分供给微生物生长繁殖, 导致产甲烷菌处于饥饿状态, 虽然反应器可以启动运行, 但发酵效率偏低.董滨等(2012)研究发现, 维持反应器OLR在0.7~1.5 kg·m-3·d-1会导致产甲烷菌营养供给不足并使甲烷产量出现波动, 仅当OLR提升至2.5 kg·m-3·d-1时低营养抑制状态才得以消除, 与本试验中OLR为2.0 kg·m-3·d-1时的结论相一致, 而在OLR为4.0 kg·m-3·d-1时未出现此现象可能是湿法与干法启动对有机质利用效率不同所导致.而试验发现OLR为6.0 kg·m-3·d-1是餐厨垃圾厌氧消化的极限浓度, 此阶段反应器运行表现出了稳定而高效的生产效率.
图 2(Fig. 2)
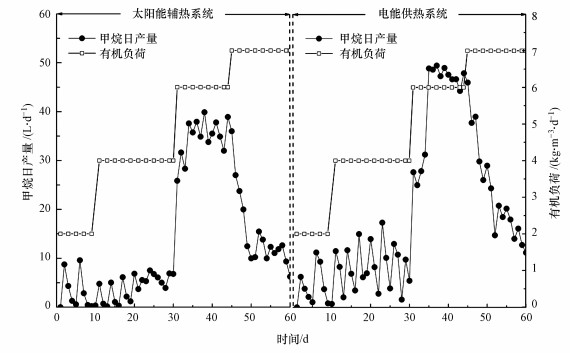 |
| 图 2 甲烷日产量随发酵温度波动和OLR变化的关系 Fig. 2The relationship of daily methane yield with the fluctuation of fermentation temperature and OLR |
此外, OLR为4.0 kg·m-3·d-1时电能组中甲烷产量比太阳能组表现出更为剧烈的波动变化, 且平均甲烷产量也高于太阳能组, 说明与波动的发酵温度相比, 产甲烷菌在恒定温度下表现出更优的有机质利用效率, OLR为6.0 kg·m-3·d-1阶段电能组中甲烷累积产量比太阳能组高出22.4%同样说明不稳定的发酵温度抑制了产甲烷菌活性.
3.2 温度波动和OLR变化对pH变化的影响pH是衡量厌氧消化系统稳定性的重要指标, 研究发现, 控制pH为6.5~7.5时最有利于产甲烷菌生长(Liu et al., 2007).如图 3所示, 两组试验初始pH约为6.52, 但电能组pH仅维持1 d后迅速下降到5.24, 而太阳能组pH先保持稳定, 随后降至5.53.其原因可能如下:一方面, 与温度波动条件相比, 发酵基质在平稳温度下更易水解酸化;另一方面, 太阳能组水解酸化出现滞后性, 可能是由于污泥驯化过程中使用了恒温条件使微生物群落适应了稳定的温度环境, 导致试验初期温度波动抑制了微生物活性, 发酵效率受到影响.当OLR从2.0 kg·m-3·d-1增至4.0 kg·m-3·d-1时, pH呈上升趋势并保持在6.94~7.23, 反应器运行稳定.以上结果表明, 反应器以较低OLR(≤4.0 kg·m-3·d-1)运行时, 厌氧消化系统具有良好的维持反应稳定运行能力.但OLR为6.0 kg·m-3·d-1时, 两组反应器pH均出现骤降, 由于pH低至不利产甲烷菌生存范围, 通过添加适量NaOH溶液(2 mol·L-1)进行人工调控, pH随碱液加入逐渐恢复, 反应器仍保持较高的甲烷产量.当OLR进一步增加到7.0 kg·m-3·d-1时, 太阳能组和电能组甲烷产量急剧下降, pH分别降至4.98和5.07, 为了缓解酸抑制而添加大量碱液后pH仍无法维持稳定, 反应器运行失败.说明OLR为6.0 kg·m-3·d-1是食物垃圾厌氧发酵最大承载力, 此阶段反应器运行会发生酸抑制, 但可以通过人工调控维持稳定运行, 而进一步提升OLR, VFAs积累会对反应器产生不可逆影响, 外部调控不能改变反应机理.同时, 根据甲烷产量和pH变化可以预测OLR在4.0~6.0 kg·m-3·d-1之间存在不会引起酸败现象并能实现餐厨垃圾产甲烷最大化的最佳OLR, 这与Guo等(2014)的研究发现相符.此外, 与太阳能组相比, 电能组中OLR在6.0和7.0 kg·m-3·d-1阶段pH降至最低发生的时间均有所滞后, 表明反应器在稳定温度比温度波动下具有更优承载力.
图 3(Fig. 3)
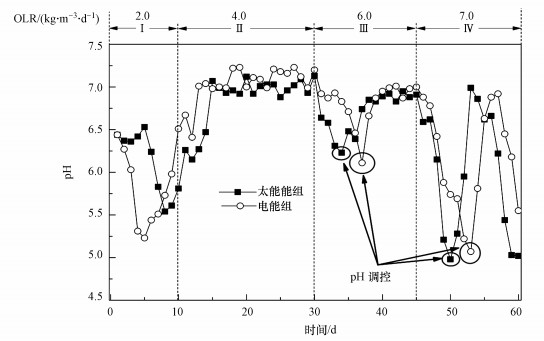 |
| 图 3 pH随发酵温度波动和OLR变化的关系 Fig. 3The relationship of pH with the fluctuation of fermentation temperature and OLR |
3.3 温度波动和OLR变化对酶活性的影响厌氧消化进程中微生物分泌胞外酶进行的酶促反应可以有效降解餐厨垃圾中的大分子有机物, 提高消化反应器运行效率(Weide et al., 2020).图 4所示为不同种类酶活随OLR和发酵温度波动变化关系.由图可知, 随着发酵反应持续进行, 水解细菌逐渐适应生存环境, 生物酶活性随OLR阶段性递增逐渐增强, 其中, 蛋白酶、淀粉酶和脂肪酶在OLR为6.0 kg·m-3·d-1时表达最佳活性, 继续增加OLR至7 kg·m-3·d-1时酶活性均出现抑制现象, 但纤维素酶活性在此OLR阶段却实现最高降解效率.木质纤维素结构复杂, 对微生物和酶的侵袭具有较强抵抗力, 吸收利用木质素和纤维素的水解细菌需要更长时间适应发酵环境, 导致纤维素酶活性变化出现明显滞后性(Qing et al., 2011).而其余酶活受到抑制说明过高的OLR会破坏厌氧消化体系内水解菌与产甲烷菌之间的协同作用, 导致反应器运行失衡.
图 4(Fig. 4)
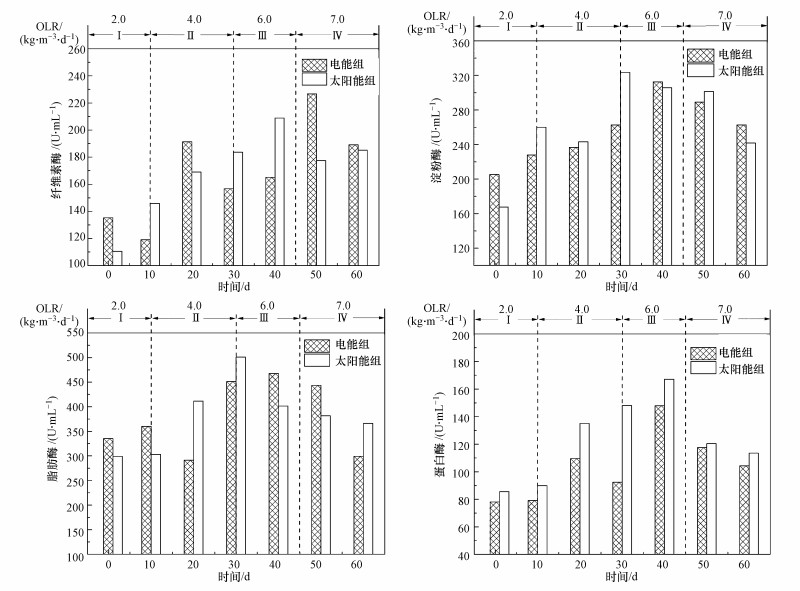 |
| 图 4 不同种类酶活随发酵温度波动和OLR变化的关系 Fig. 4The relationship between the activities of different kinds of enzymes with the fluctuation of fermentation temperature and OLR |
此外, OLR为2 kg·m-3·d-1时淀粉酶和脂肪酶在太阳能组中的活性分别为167.62 U·mL-1和299.17 U·mL-1, 而在电能组中活性更强, 分别为205.21 U·mL-1和335.14 U·mL-1, 此现象在OLR为6 kg·m-3·d-1时也同样发生.淀粉酶和脂肪酶可以催化淀粉和脂质等有机物转化为单糖、二聚糖和脂肪酸等可溶性小分子有机物, 说明淀粉酶和脂肪酶在恒定的发酵温度下具有较强的有机质催化利用性, 且与纤维素酶和蛋白酶相比, 淀粉酶和脂肪酶在初始阶段就有较高的活性, 表明淀粉和脂肪比纤维素和蛋白质更易被生物降解, 为试验初期微生物生存所需营养物质的主要来源.试验全过程太阳能组蛋白酶活性均优于同时期电能组, 说明蛋白酶具有更优的温度耐受性, 这与徐智等(2013)发现堆肥过程中温度增加至高温期蛋白酶仍保持良好活性的结论一致.此外, Müller等(2016)通过半连续试验发现, 较高的蛋白酶含量会抑制沼气生成, 意味着太阳能组甲烷产量低也受到蛋白酶含量影响.
3.4 温度波动和OLR变化对微生物群落的影响3.4.1 细菌门水平群落结构变化微生物群落演替可以从微观角度分析温度波动和OLR变化对厌氧消化稳定性的影响, 其中, 水解酸化作为厌氧消化体系的限速阶段受细菌丰富度与活性影响, 而古菌则隶属于产甲烷阶段.试验期间分别将电能组和太阳能组按OLR从2.0~7.0 kg·m-3·d-1四阶段变化划分为E1~E4和S1~S4, 其中, 微生物取样时间为每OLR阶段最后一天.图 5a的高通量测序门水平结果表明, 全过程中Firmicutes(厚壁菌门)占据主导地位, E1和S1作为厌氧消化初始阶段Firmicutes的相对丰度超过95%.研究表明, Firmicutes可以广泛利用发酵底物, 分泌蛋白酶等多种水解酶提高餐厨垃圾中大分子有机物降解速率, 同时负责挥发性脂肪酸(VFA)的生成, 并与嗜氢产甲烷菌发生互营联合反应, 在提高反应器甲烷产量方面起到关键作用, 是厌氧消化中优势的水解产酸菌(李玥等, 2018; Kurade et al., 2020).随着OLR增至4.0 kg·m-3·d-1, 细菌群落结构在两组反应器中表现出明显差异性, E2中Firmicutes相对丰度降低至68%, 而Actinobacteria(放线菌门)和Bacteroidetes(拟杆菌门)相对丰度大幅提高, 研究发现, Actinobacteria和Bacteroidetes可以通过降解蛋白质、脂质和复杂有机物来提高发酵液中VFA含量(Zhou et al., 2016).但S2中细菌相对丰度与S1中相似无明显变化, 说明Actinobacteria与Bacteroidetes对环境温度变化敏感, 发酵温度骤减会抑制自身生长繁殖, 之前研究发现Bacteroidetes更易在较高发酵温度下与Methanobacteriaceae(甲烷杆菌科)和Methanosarcinaceae(甲烷八叠球菌科)保持正相关性(Lv et al., 2019).随着OLR进一步增长, Firmicutes相对丰度降低的现象同样在S3中出现, 而Proteobacteria(变形菌门)在E3和S3中的相对丰度分别提升18%和7%, Proteobacteria在厌氧消化中主要通过降解氨基酸为消化反应提供氮源, 并在蛋白质和多糖水解中起关键作用.更多的发酵底物添加促进了Proteobacteria繁殖, 说明相较于低OLR, Proteobacteria在较高的OLR下表现出优异的生物活性, 而Firmicutes更易在低OLR阶段表现出高聚集性, Mahdy等(2020)在探究OLR对鸡粪厌氧消化过程中细菌群落变化时也得出了相同结论.
图 5(Fig. 5)
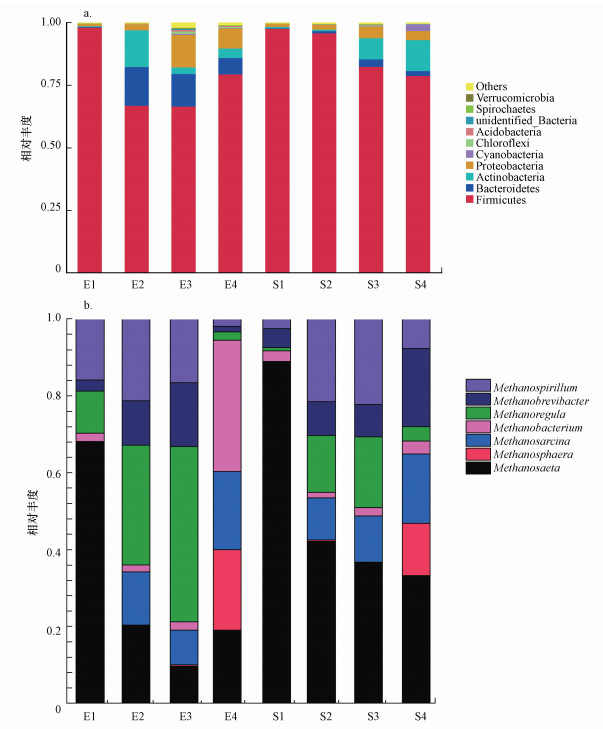 |
| 图 5 细菌群落结构(a)及古菌群落结构(b)随发酵温度波动和OLR变化的关系 Fig. 5Relationship of bacterial community structure(a) and archaea community structure(b) with fermentation temperature fluctuation and OLR |
Alpha Diversity分析指数可以直观的地统计出细菌群落多样性随温度波动和OLR变化的情况, 不同样本在97%一致性阈值下的Alpha Diversity分析指数如表 4所示.Chao1和Ace指数变化可反映消化液中细菌群落丰富度变化情况, 数值越大, 细菌群落丰富度越高.维持消化反应器内OLR低于6.0 kg·m-3·d-1时, Chao1和Ace指数均随OLR增加呈递增趋势, 进一步提高OLR至7.0 kg·m-3·d-1时, 丰富度下降情况在两组反应器中均发生.结合图 5a说明提高营养物质供给可以有效促进微生物群落的生长繁殖从而提高群落丰度, 而在较低OLR阶段, 营养物质会被特定细菌集中利用, 导致水解酸化进程仅由少部分专性细菌完成, 群落结构表现出高集中性和较差的丰富度.Shannon和Simpson主要反映微生物群落多样性和复杂度变化, 数值越大寿命群落所含的信息量和物种分配越高.Shannon和Simpson指数变化趋势与Chao1指数类似, 均随OLR递增呈“上升-下降”两阶段变化, OLR为6.0 kg·m-3·d-1作为微生物群落演替转折点表明此时细菌活性最佳.此外, 从E3和S3到E4和S4阶段Chao1和Ace指数均有所下降也说明OLR超过6.0 kg·m-3·d-1会导致消化液中微生物群落结构发生大规模演替并破坏群落平衡, 影响反应器运行性能.此外, 各OLR阶段中电能组细菌群落多样性指数均高于太阳能组, 说明与波动的发酵温度相比, 微生物系统在稳定温度环境更易生存繁殖.
表 4(Table 4)
| 表 4 细菌Alpha Diversity分析指数 Table 4 Bacterial AlphaDiversity analysis index | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 4 细菌Alpha Diversity分析指数 Table 4 Bacterial AlphaDiversity analysis index
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.4.2 古菌群落结构变化分析广古菌门(Euryarchaeota)下属水平相对丰度发现, 古菌群落结构变化趋势与细菌类似, 即在低OLR表现出功能高度集中性和较差的物种多样性, 随着OLR逐级递增, 群落多样性逐渐丰富.试验初期两组反应器内古菌构成差异较大, 可能是在污泥驯化时期采用恒温条件, 产甲烷菌适应了稳定的温度环境, 当添加到太阳能反应器中, 微生物无法承受温度波动变化导致活性出现差异.如图 5b所示, E1和S1中Methanosaeta(甲烷丝状菌)相对丰度分别达到68.0%和88.5%, Methanosaeta作为专性乙酸型产甲烷菌, 可以利用发酵液内乙酸生产CH4和CO2.但随着OLR逐步提升, Methanosaeta含量在太阳能组和电能组分别骤减52.1%和58.4%, 而Methanoregula和Methanospirillum(甲烷螺菌属)相对丰度逐渐提高, 甚至在E3中Methanoregula相对丰度从最初的10.9%增加至45.7%, 替代了Methanosaeta成为此阶段优势产甲烷菌.Methanoregula和Methanospirillum均属于氢营养型产甲烷菌, 主要利用H2和CO2生产甲烷(Xu et al., 2019).以上结果表明乙酸型产甲烷菌更易在低OLR下表达较高活性, 而随着OLR递增, 反应器内H2和CO2浓度的增加激发了氢营养型产甲烷菌繁殖速度.此外, 太阳能反应器中S2和S3阶段Methanoregula相对丰度比E2和E3阶段分别低16.3%和27.2%, 说明Methanoregula对环境适应性较差, 在不稳定的发酵温度条件下受抑制明显.当OLR进一步增加到7.0 kg·m-3·d-1, 太阳能组和电能组中古菌群落结构发生大幅变化, Methanosarcina(甲烷八叠球菌)相对丰度分别达到20.4%和18.1%.研究发现, Methanosarcina作为乙酸型产甲烷菌在更易在高浓度的乙酸环境表达活性(乔玮等, 2019), 由于Methanosarcina比Methanosaeta的乙酸利用率低, Methanosarcina相对丰度提高往往伴随着厌氧消化反应器内生物稳定性波动现象, 影响乙酸利用效率, 最终VFA产生与消耗无法维持动态平衡导致反应器酸积累运行失败.图 2中此OLR下甲烷产量严重降低也可以说明相较于温度波动影响, 过高的OLR冲击对反应器稳定运行的影响更为显著.
3.4.3 温度波动对最佳产甲烷阶段微生物群落结构的影响针对OLR在6.0 kg·m-3·d-1时甲烷生产效率最佳, 进一步研究温度波动对此阶段微生物群落属水平结构影响差异.如图 6所示, 此阶段广古菌门(Euryarchaeota)表现出极高的生物活性, 其次为Firmicutes门下的Lactobabacillus(乳酸杆菌属), 但其相对丰度仅占约15%.说明较低的OLR阶段(≤4.0 kg·m-3·d-1)厌氧消化系统内主要进行水解酸化反应, 餐厨垃圾的添加大多被水解酸化细菌分解利用, 为产甲烷菌生长繁殖提供充足的营养物质.试验进行至中后期时, 厌氧消化系统中古菌群落已经建立并适应了生态系统环境, 餐厨垃圾的大量投加诱导产甲烷菌对有机质的高效利用, 产甲烷菌达到最大活性使得OLR为6.0 kg·m-3·d-1时甲烷产量显著提高.此外, 虽然太阳能组和电能组中产甲烷菌在此阶段均占据主导地位, 但太阳能组中Lactobabacillus的相对丰度比电能组高约2.5倍, 是S3阶段Firmicutes相对丰度高于E3的主要因素.说明Lactobabacillus具有较强的环境适应性, 在不稳定的发酵温度环境下表现出更强的微生物活性, 但Lactobabacillus作为产氢乳酸菌在厌氧消化体系内可以产生乳酸、乙酸、CO2和H2等物质, Lactobabacillus活性富集会导致乳酸积累, 从而影响胞内外酶活性, 最终影响甲烷生产效率(刘爽, 2013), 虽然Megasphaera能够利用乳酸生成丁酸, 有效缓解乳酸抑制, 但其过低的活性表达无法与Lactobabacillus维持动态平衡, 这也可能为是反应器随着OLR进一步提升而运行失败的原因之一.
图 6(Fig. 6)
 |
| 图 6 温度波动对最佳产甲烷阶段微生物活性影响 Fig. 6Effect of temperature fluctuation on microbial activity in the optimal methanogenic stage |
3.5 太阳能系统与电能系统能耗对比分析与展望为了探索太阳能辅热与厌氧消化工艺结合的经济效益, 对试验期间太阳能组和电能组分别进行能耗监控.如图 7所示, 在本研究中电能组中每阶段平均甲烷日产量均优于太阳能组, 但这导致了大量的能量输入, 在整个试验期间电能组为维持稳定的发酵温度而比太阳能组多消耗了约4倍电能, 这在实际应用中有一定的局限性.因此, 给太阳能系统中恒温水箱、消化反应器等设备合理添加保温材料可以有效减少热量损失, 从而减少温度波动对餐厨垃圾厌氧消化稳定运行的影响, 具有长期的应用价值.
图 7(Fig. 7)
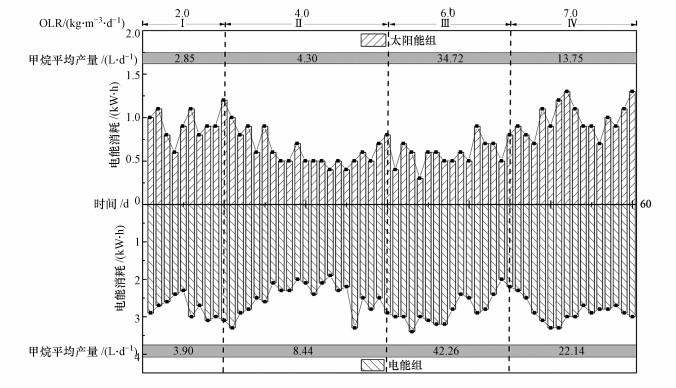 |
| 图 7 太阳能与电能反应器能耗对比分析 Fig. 7Comparative analysis of energy consumption of solar reactor and electric energy reactor |
另外, 太阳能组能耗变化可以间接反映太阳热辐射情况, 电能消耗呈现先减小后增大趋势可能是因为中国北方地区7月下旬和8月上旬温度较高, 太阳辐射较强, 额外的电能消费较低.因此, 对于寒冷地区, 超高热损失和低太阳辐射是阻碍沼气工程发展的重要因素, 有必要进一步研究太阳能辅热系统在极寒天气下对厌氧消化进程的影响.
4 结论(Conclusions)1) 6.0 kg·m-3·d-1作为餐厨垃圾厌氧消化的极限OLR在两组反应器中均实现了最佳甲烷产量.发酵温度波动导致太阳能组甲烷平均产量比电能组低约21%, 但节省了约4倍的电能消耗.
2) 淀粉酶和脂肪酶是反应初期微生物生长繁殖所需营养物质的主要催化剂, 并在稳定的温度下活性较强, 而蛋白酶更易在波动发酵温度下表达活性.
3) 微生物在低OLR下表现出高度的功能集中性和较差群落丰富性, 提高OLR可促进微生物丰富度.不稳定的发酵温度会抑制微生物活性, 但试验全过程Firmicutes作为水解细菌在两组反应器中占据主导地位.此外, 乙酸型产甲烷菌Methanosaeta在低OLR阶段相对丰度较大, 而氢营养型产甲烷菌Methanoregula和Methanospirillum在较高OLR阶段表现出高活性.
4) 反应器无法承受7.0 kg·m-3·d-1的OLR冲击, 并导致微生物结构失衡, 发酵进程运行失败.
参考文献
| Alcaraz A, Montala M, Valderrama C, et al. 2018. Increasing the storage capacity of a solar pond by using solar thermal collectors:Heat extraction and heat supply pro-cesses using in-pond heat exchangers[J]. Solar, 171: 112-121. |
| APHA.2005.Standard Methods for the Examination of Water and Wastewater[M].Washington DC: Public Health Association |
| Braguglia C M, Gallipoli A, Gianico A, et al. 2018. Anaerobic bioconversion of food waste into energy:A critical review[J]. Bioresource Technology, 248(A): 37-56. |
| 董滨, 王凯丽, 段妮娜, 等. 2012. 餐厨垃圾中温干法厌氧消化快速启动实验研究[J]. 环境科学学报, 32(10): 2584-2590. |
| Duan N, Zhang D J, Lin C, et al. 2019. Effect of organic loading rate on anaerobic digestion of pig manure:Methane production, mass flow, reactor scale and heating scenarios[J]. Journal of Environmental Management, 231(1): 646-652. |
| 关松荫. 1983. 土壤酶及其研究法[M]. 北京: 中国农业出版社. |
| Gou C, Yang Z, Huang J, et al. 2014. Effects of temperature and organic loading rate on the performance and microbial community of anaerobic co-digestion of waste activated sludge and food waste[J]. Chemosphere, 105(3): 146-151. |
| Kim H M, Nam J Y, Shin H S. 2011. A comparison study on the high-rate co-digestion of sewage sludge and food waste using a temperature-phased anaerobic sequencing batch reactor system[J]. Bioresource Technology, 102(15): 7272-7279. |
| Kurade M B, Saha S, Kim J R, et al. 2020. Microbial community acclimatization for enhancement in the methane productivity of anaerobic co-digestion of fats, oil, and grease[J]. Bioresource Technology, 296: 122294. |
| Karthikeyan O P, Trably E, Mehariya S, et al. 2018. Pretreatment of food waste for methane and hydrogen recovery:a review[J]. Bioresource Technology, 249: 1025-1039. |
| Liu C F, Yuan X Z, Zeng G M, et al. 2007. Prediction of methane yield at optimum pH for anaerobic digestion of organic fraction of municipal solid waste[J]. Bioresource Technology, 99(4): 882-888. |
| Liu C Y, Sun Y. 2019. Impact of temperature fluctuation on anaerobic fermentation process of upgrading bioreactor under solar radiant heating[J]. Applied Thermal Engineering, 156(25): 382-391. |
| Lv Z P, Wu X Y, Zhou B Q, et al. 2019. Effect of one step temperature increment from mesophilic to thermophilic anaerobic digestion on the linked pattern between bacterial and methanogenic communities[J]. Bioresource Technology, 292: 121968. |
| 李玥, 胡奇, 高大文. 2018. 温度对一体式厌氧流化床膜生物反应器运行效能及微生物群落结构的影响[J]. 环境科学, 39(4): 1731-1738. |
| 刘爽.2013.混合原料厌氧发酵产氢产甲烷技术研究[D].哈尔滨: 东北农业大学 |
| Mahdy A, Bi S J, Song Y L, et al. 2020. Overcome inhibition of anaerobic digestion of chicken manure under ammonia-stressed condition by lowering the organic loading rate[J]. Bioresource Technology Reports, 9: 100359. |
| Müller L, Kretzschmar J, Pr?ter J, et al. 2016. Does the addition of proteases affect the biogas yield from organic material in anaerobic digestion?[J]. Bioresource Technology, 203: 267-271. |
| Qing Q, Wyman C E. 2011. Hydrolysis of different chain length xylooliogmers by cellulase and hemicellulase[J]. Bioresource Technology, 102(2): 1359-1366. |
| 乔玮, 尹冬敏, 刘月玲, 等. 2019. HRT对餐厨垃圾与秸秆混合高温厌氧发酵的影响[J]. 中国环境科学, 37(12): 4596-4604. |
| Rognes T, Flouri T, Nichols B, et al. 2016. VSEARCH:a versatile open source tool for metagenomics[J]. PeerJ, 4(10): e2584. |
| 吴淑岱. 1997. 国家环境保护局水和废水监测分析方法[M]. 第3版. 北京: 中国环境科学出版社. |
| Weide T., Baquero C D., Schomaker M., et al. 2020. Effects of enzyme addition on biogas and methane yields in the batch anaerobic digestion of agricultural waste (silage, straw, and animal manure)[J]. Biomass and Bioenergy, 132: 105442. |
| Weatherford V C, Zhai Z Q. 2015. Affordable solar-assisted biogas digesters for coldclimates:experiment, model, verification and analysis[J]. Applied Energy, 146: 209-216. |
| Xu R, Xu S N. 2019. Enhancing blackwater methane production by enriching hydrogenotrophic methanogens through hydrogen supplementation[J]. Bioresource Technology, 278: 481-485. |
| 徐智, 李季. 2013. 2种微生物菌剂对堆肥过程中酶变化的影响研究[J]. 中国农学通报, 29(8): 175-179. |
| Zhao J W, Jing Y M, Zhang J, et al. 2019. Aged refuse enhances anaerobic fermentation of food waste to produce short-chain fatty acids[J]. Bioresource Technology, 289: 121547. |
| Zhou S, Nikolausz M, Zhang J N, et al. 2016. Variation of the microbial community in thermophilic anaerobic digestion of pig manure mixed with different ratios of rice straw[J]. Journal of Bioscience & Bioengineering, 122(3): 334-340. |
