 , 钱新
, 钱新
 , 刘彤, 李小龙, 范一凡, 陆昊, 袁俣
, 刘彤, 李小龙, 范一凡, 陆昊, 袁俣南京大学环境学院, 污染控制与资源化研究国家重点实验室, 南京 210023
收稿日期: 2019-08-29; 修回日期: 2019-10-06; 录用日期: 2019-10-06
基金项目: 国家水体污染控制与治理科技重大专项(No.2017ZX07204004)
作者简介: 谢孟星(1996—), 男, E-mail:437969959@qq.com
通讯作者(责任作者): 钱新, E-mail:xqian@nju.edu.cn
摘要:生物完整性指数(Index of biotic integrity,IBI)被广泛运用于河流的健康评价.然而,随着人类活动对河流影响的增加,传统指示生物多样性的损失降低了评价的准确性.在高度受影响的水体环境中,微生物群落被证明是更敏感的生态健康指标.本研究采用Illumina高通量测序技术,于2018年冬季和2019年春季对无锡市境内8条河流的微生物群落组成进行了分析,从群落组成/相对丰度、丰富度/多样性、敏感性/耐受性3个角度确定了候选指标.并对传统的核心指标筛选方法进行了改进,通过差异性分析、箱线图检验、Speraman相关性分析,建立了冬、春两季的微生物生物完整性指标框架.评价结果表明,M-IBI能有效区分不同程度的受损位点,且与水质状况和物理生境存在显著的相关性.总体而言,M-IBI为城市河流生态状况提供了一种新的评价工具.
关键词:城市河流生物完整性指数(IBI)生态系统健康评价微生物完整性指数(M-IBI)
River health assessment based on M-IBI index: Taking Wuxi as an example
XIE Mengxing
 , QIAN Xin
, QIAN Xin
 , LIU Tong, LI Xiaolong, FAN Yifan, LU Hao, YUAN Yu
, LIU Tong, LI Xiaolong, FAN Yifan, LU Hao, YUAN YuState Key Laboratory of Pollution Control and Resources Reuse, School of Environment, Nanjing University, Nanjing 210023
Received 29 August 2019; received in revised from 6 October 2019; accepted 6 October 2019
Abstract: Index of biotic integrity (IBI) has been widely applied in health assessment of rivers. However, with the increasing anthropic impact on urban rivers, the biodiversity losses of local macroorganism species reduced the accuracy of bioassessment. Microbial communities thus have been proved to be more sensitive indicators of ecological health in highly impacted aquatic environment. This study applied illumina high-throughput DNA sequencing technique to analyze the microbial community diversity and composition of the selected 8 urban rivers in Wuxi city in winter 2018 and spring 2019. A dataset of candidate metrics was first compiled, and classified into three categories:composition/abundance, richness/diversity, and sensitivity/tolerance. This study improved the traditional candidate indicator screening method, conducted difference analysis, boxplot test, and Speraman correlation, and ultimately developed the microbial biological integrity index (M-IBI) framework for habitat evaluation in winter and spring. The results showed that M-IBI was able to effectively discriminate different impaired site groups, and had a good correlation with the index of water quality and the physical habitat index, indicating that the M-IBI is a reliable and novel assessment tool for assessing the ecological health status of urban rivers.
Keywords: urban riversindex of biotic integrity(IBI)ecosystem health assessmentmicrobiome index of biotic integrity (M-IBI)
1 引言(Introduction)河流生态系统在人类生活中提供了诸多的服务功能, 如灌溉、饮用水供应、渔业、交通和娱乐等, 在区域可持续发展中发挥着至关重要的作用(Jia et al., 2013).然而, 随着城市化的快速发展, 大量的废水和污水排入河流, 严重破坏了河流的生态系统功能.因此, 开展河流生态系统监测与评价工作十分必要, 这有助于我们识别人类活动对淡水生态系统产生的影响, 从而更好地开展河流管理与保护工作.
目前, 科研人员已发展出物理、化学、生物学的指标来衡量生态系统状况的变化(Aazami et al., 2015).其中, 生物完整性指数法(IBI)由Karr等于1981年首次提出(Karr et al., 1981), 现已被广泛应用于水生生态系统的生物评价、恢复和保护过程中.在评价体系方面, 已发展出不同生物类群的完整性指数, 如鱼类、大型底栖动物、硅藻、水生大型植物、浮游动物和浮游植物等.研究表明, IBI是一种非常有效的评价方法, 它可以有效区分不同程度的受损位点(Wu et al., 2012).但随着研究的深入, 人们发现现行的IBI仍存在许多局限, 特别是在一些严重退化的生态系统, 如城市河流, 传统指示生物由于大量的物种缺失, 导致生物多样性显著降低, 这大大降低了评价的功能和准确性(McKinney, 2002).此外, 相对于分子学的鉴定方法, 大量样本的形态学鉴定不仅费时还容易出错(Haase et al., 2010).
微生物是水生态系统中数量最大和功能最多的群体, 且处于河流食物网的基础营养级, 因此, 有潜力在较高营养水平的生物体(即宏观生物体)作出反应之前, 提供生态系统变化的早期指示(Pernthaler, 2013).此外, 在受人类活动影响较大的区域, 微生物群落组成虽然发生改变, 但没有出现明显的多样性损失(Lau et al., 2015).这些研究结果表明微生物在高度退化的河流生态系统中有作为指示生物的潜力.考虑到水柱中生物体的可移动性和瞬时性, 选择相对固着的底栖微生物群落更能反映当地的生态情况.2015年Lau等首次利用底栖微生物群落, 构建了一种评估河流健康状况的方法, 近一年的监测数据表明微生物与水质指标、大型底栖无脊椎动物、生态系统功能和流域土地利用数据显著相关, 其能解释10个常见生态参数35%的变化, 说明河流微生物群落可以反映河流生态系统的综合情况(Lau et al., 2015).随后, 安新丽等(2016)、Li等(2017)和Niu等(2018)、苏瑶等(2019)通过Illumina高通量测序技术, 构建了微生物生物完整性指数(Microbe-index of biological integrity, M-IBI)的指标体系, 成功应用在地下水、城市河流的健康状况评价.
这些研究表明微生物在水生态系统健康评价中有着极大的潜力, 但相关研究仍十分缺乏, 且现行的评价方法也存在一定的不足:评价数据多采用单次监测数据, 缺少长期监测研究的经验和数据积累.此前已有研究指出, 季节变化会影响细菌的群落结构(Olapade et al., 2015).这对指标体系的构建结果是否会产生影响?在微生物活性相对较弱的冬季, 这套评价方法是否适用?为此, 本研究以无锡市的8条河流为研究对象, 首先, 对现有核心指标的筛选方法进行改良, 进一步提高指标的灵敏度及其与赋分方法的一致性; 其次, 在冬、春两季分别构建M-IBI评价指标体系, 探究季节因素对于M-IBI在城市河流生态系统健康评价中的影响.
2 材料与方法(Materials and methods)2.1 研究区域研究区域位于无锡市望虞河西岸, 京杭大运河东部, 面积约500 km2, 该区域人口密集, 经济发达, 处于太湖流域河网地带, 汇入支流较多, 主要支流大部分存在氮、磷超标现象, 生态系统脆弱, 水生态状况不容乐观.
在研究区域内选择了8条代表性的河流, 基本覆盖了整个无锡市境内.其中, 新兴塘河自西向东流经人类活动密集的市区;芙蓉河、九里河、徐冲桥港位于郊区, 向东汇入宛山荡, 而2018年完工的宛山荡湿地是当地最大的水生态修复工程;夹蠡河自北向南汇入伯渎港, 沿岸集聚大量工业企业;伯渎港流经无锡城区, 上游污染较为严重, 同时也是无锡洪水东排的主干道之一;京杭运河无锡段全长40.8 km, 为无锡境内主要航道, 流向自北向南;望虞河是太湖洪水主要泄洪通道之一, 也是太湖流域现状唯一由长江直接向太湖引水的骨干河道, 具有防洪、排涝、引水、航运等综合功能.在这8条河流上一共设置15个采样点, 具体见图 1.
图 1(Fig. 1)
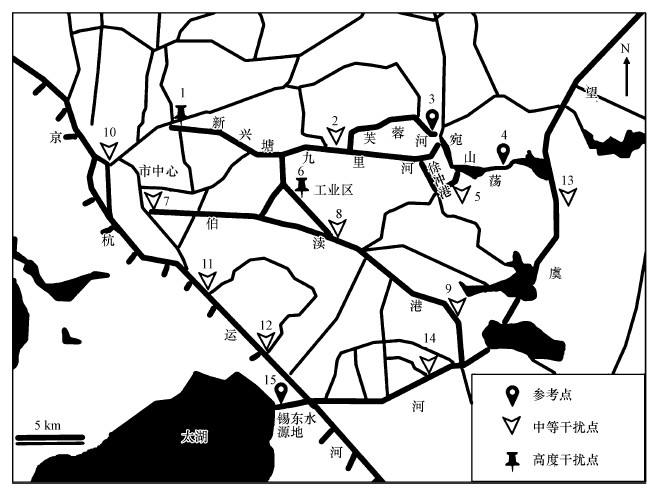 |
| 图 1 研究区域及采样点 Fig. 1Study area and sampling points |
2.2 样品采集与分析于2018年12月和2019年3月, 使用彼德逊采泥器在每个采样点位收集3份沉积物样本, 各点位样本混合均匀后转移至15 mL康宁离心管中.水样(1 L)由采水器收集后, 转移至玻璃瓶中, 带回实验室测定氨氮(NH3+-N)、总氮(TN)、总磷(TP)、高锰酸盐指数(CODMn), 测定方法参照国家环境保护总局出版的《水和废水监测分析方法(第四版)》.水深、溶解氧、温度、电导率、叶绿素、氧化还原电位、pH和浊度使用多参数水质仪AAQ PRO2原位测定.
沉积物样品DNA按照Fast DNA@SPIN Kit For Soil试剂盒说明书进行DNA抽提, DNA浓度和纯度利用NanoDrop2000进行检测, 并采用1%琼脂糖凝胶电泳检测DNA提取质量.PCR扩增选用515F_907R引物对细菌16S rRNA基因Ⅴ4~Ⅴ5区进行扩增, 并在上海美吉生物公司的Illumina Miseq PE300(Illumina, San Diego, USA)平台进行测序.原始测序序列使用Trimmomatic软件质控, 使用FLASH软件进行拼接.在对原始数据进行拼接、质控过滤等处理后, 将所有高质量序列按照操作分类单元(Operational Taxonomic Units, OTU)序列相似度97%进行聚类, 并在聚类的过程中去除单序列和嵌合体.分析前, 先对所有样本按照最小样本序列数进行抽平处理, 以保证后续结果的一致性.物种分类注释, 比对Silva 128/16s_bacteria数据库, 设置比对阈值为70%.
2.3 M-IBI评价体系的构建2.3.1 参考点的选择基于《地表水环境质量标准》(GB 3838-2002)对水样DO、pH、NH3-N、TN、TP、CODMn这6项因子进行赋分, 即达到Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ类水标准, 分别记为5、4、3、2、1分, 未达Ⅴ类水标准, 计为0分, 各指标相加即可得到该点水质总体得分.水质总分大于90%分位数的点为参考点, 其他采样点为受人类影响较大的干扰位点.其中, 水质总分小于10%分位数的点为高度受干扰位点, 10%分位数和90%分位数之间的是中度受干扰位点.
2.3.2 候选指标的筛选从群落组成/相对丰度、丰富度/多样性、敏感性/耐受性3个角度确定候选指标.群落组成/相对丰度指标基于不同分类等级物种的相对丰度; 丰富度/多样性指标基于OTU的生物多样性; 敏感性/耐受性指标基于对单一压力源敏感或耐受OTU的相对丰度(Li et al., 2017; Niu et al., 2018).
候选指标的筛选参考文献(安新丽等, 2016; Li et al., 2017; Niu et al., 2018)方法, 并在此基础上有所优化, 具体步骤如下:首先通过K-W检验, 挑选出在参考位点、中等干扰位点、高度干扰位点中存在显著差异的指标(p < 0.05);接着通过比较各指标在箱线图中的分布情况, 挑选随着人为干扰程度的增加呈现单调变化趋势的指标;最后在相关性分析中对候选指标进行Sperman相关性分析, 若两参数的相关系数|r|≥0.75且p < 0. 01, 表明二者所反映的信息重叠性较大, 保留在箱线图检验中区分不同程度受损位点能力较强的参数用于构建M-IBI的核心评价体系.
2.3.3 核心指标赋分及评价标准的建立对核心指标按照式(1)或(2)方法进行赋分.对于将每个地点各核心指标分数相加即可得到该点M-IBI总分.总分通过3等份法分成3个等级:较好、中等、较差.
对于指标值随着人类干扰减少的指标:
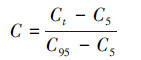 | (1) |
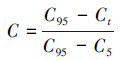 | (2) |
2.3.4 指标体系的验证通过观察箱线图能否有效区分参考位点、中度受干扰地点和高度受干扰地点, 检验M-IBI的灵敏性(Jun et al., 2012).指标体系的代表性通过M-IBI与水质综合得分及物理生境得分的相关性分析加以验证.物理生境主要考虑了采样点周边的土地利用类型, 根据实际情况分成以下3类:湿地、乡村居民用地、城镇用地(胡和兵等, 2013).从湿地到城镇用地, 人类活动干扰程度递增, 分别赋予3、2、1分的分值.
3 结果与讨论(Results and discussion)3.1 参考点的选择生物学评价中, 参考位点的选择是一项关键过程, 因为它为受损情况提供了比较的基准.从理论上讲, 参考点应处于完好无损的状态, 但在现状条件下, 由于受到人类活动的干扰, 很难找到这种“原始点”.在这种情况下, 现有的研究选择受损程度较小的位点作为参考位点.同时, 为了避免在选择参考点时受到主观影响, 国内大部分相关研究依据《地表水环境质量标准》(GB 3838-2002), 对不同地点水质状况进行评分, 来作为选取参考位点的依据(安新丽等, 2016; Li et al., 2017; Niu et al., 2018; 苏瑶等, 2019).
由于水质指标只能反映瞬时的水质情况, 所以在参考点的选择过程中, 将2018年12月和2019年3月各采样点水质指标值取平均, 从而更好地反映采样点的常规水质情况, 指标测定值及得分结果如表 1所示.
表 1(Table 1)
| 表 1 各采样点水质指标得分情况 Table 1 Physiochemical variables scores of each sampling point | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 各采样点水质指标得分情况 Table 1 Physiochemical variables scores of each sampling point
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
15个采样点水质综合得分在8~23之间波动, 10%和90%分位数分别为21.0和12.8.因此, 水质综合得分>21的芙蓉河、宛山荡和望虞河3采样点为参考点;水质得分 < 12.8的夹蠡河、新兴塘采样点为高度受干扰地点;其余采样点均为中等受干扰地点.
3.2 核心指标的筛选从30个样本中共得到有效序列数1131152条, 抽平后每个样本包含序列数30622条.12月的序列分为52个门、121个纲、245个目、424科、781属, 3月的序列分为52个门、121个纲、245个目、427科、784属.在此基础上, 12月和3月群落组成/相对丰度角度上的候选指标分别有1623个和1629个.
丰富度/多样性指标有16个, 包括Sobs、Chao、Ace、Jack、Bootstrap、Simpsoneven、Shannoneven、Heip、Smithwilson、Bergerparker、Shannon、Simpson、Invsimpson、Qatat、PD、Coverage.
敏感性/耐受性有8个, 包括:对DO/COD敏感/耐受OTU的相对丰度, 它们反映水体受有机污染的程度;对TN/TP敏感/耐受OTU的相对丰度, 它们反映水体富营养化的程度(Niu et al., 2018).
基于K-W检验, 12月和3月分别有1565个和1599个指标被剔除, 因为它们在参考点、中等干扰点、高度干扰点之间不存在显著差异.箱线图检验中分别保留了6个和11个候选指标(IQ>2).在相关性分析中, 筛选出了r≥0.75且p < 0.01的指标.对这些存在信息冗余的指标, 基于它们在箱线图中的表现, 只保留鉴别能力最强的指标.最终得到以下核心指标, 它们的鉴别能力很强, 均能有效区分参考点、中度干扰位点和高度干扰位点, 具体如图 2、图 3所示.12月的微生物核心指标有:Chromatiaceae相对丰度、Ideonella相对丰度、Acinetobacter相对丰度、与DO正相关的OTU相对丰度.3月的微生物核心指标有:SubsectionI相对丰度、Simplicispira相对丰度、Lautropia相对丰度、Hydrogenophaga相对丰度.
图 2(Fig. 2)
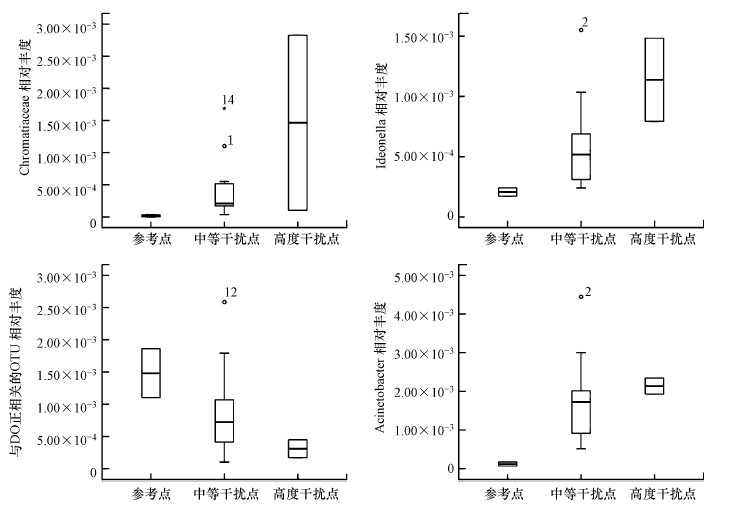 |
| 图 2 12月核心指标箱线图 Fig. 2Boxplots of core indicators for December |
图 3(Fig. 3)
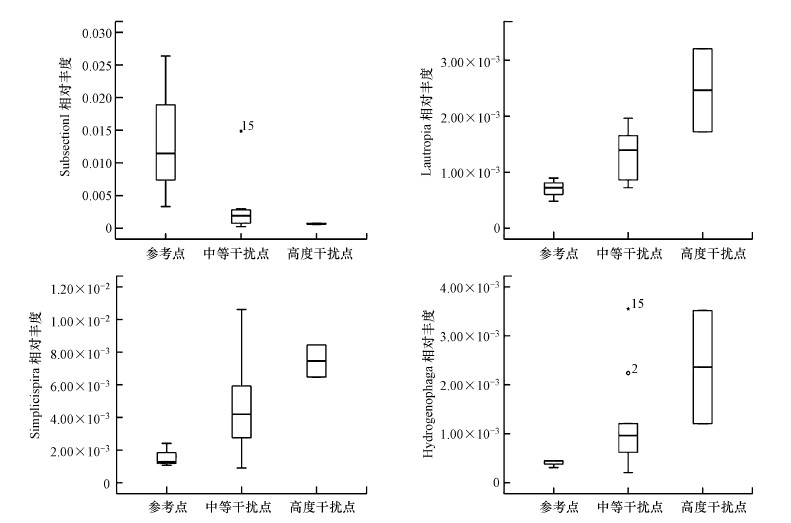 |
| 图 3 3月核心指标箱线图 Fig. 3Boxplots of core indicators for March |
3.3 核心指标赋分及评价结果对12月和3月的核心指标进行赋分, 计算出的M-IBI结果如表 2、表 3所示.冬季33.3%的样点为“较差”等级, 40%的样点为“中等”等级, 26.7%的样点为“较好”等级.春季13.3%的样点为“较差”等级, 66.7%的样点为“中等”等级, 20%的样点为“较好”等级.总体来看, 新兴塘河、夹蠡河、伯渎港一带河流健康状况较差, 九里河、芙蓉河、宛山荡、望虞河一带河流健康状况较好, 京杭运河健康状况一般.
表 2(Table 2)
| 表 2 各采样点12月的M-IBI法评价结果 Table 2 M-IBI evaluation for each sampling point in December | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 各采样点12月的M-IBI法评价结果 Table 2 M-IBI evaluation for each sampling point in December
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3(Table 3)
| 表 3 各采样点3月的M-IBI法评价结果 Table 3 M-IBI evaluation for each sampling point in March | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 各采样点3月的M-IBI法评价结果 Table 3 M-IBI evaluation for each sampling point in March
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.4 指标体系的验证通过箱线图(图 4)可以看出, M-IBI区分参考点和干扰点的能力很强.Sperman相关性分析表明, M-IBI与单次水质、综合水质和土地利用类型(12月:r=0.908, p < 0.01;3月:r=0.720, p < 0.01)均有着显著的相关性, 这说明M-IBI是一种较为可靠的生物学评价方法.
图 4(Fig. 4)
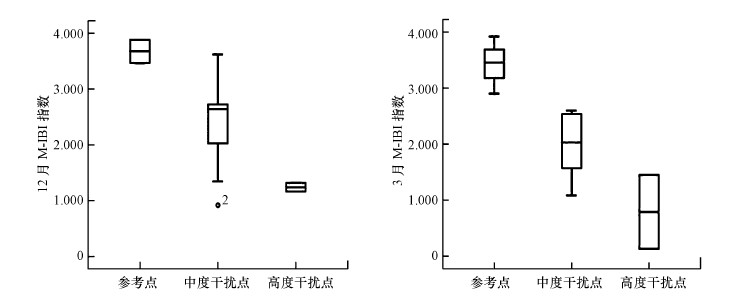 |
| 图 4 M-IBI区分参考点和干扰点的灵敏性 Fig. 4Sensitivity analysis of M-IBI between reference and impaired points |
图 5(Fig. 5)
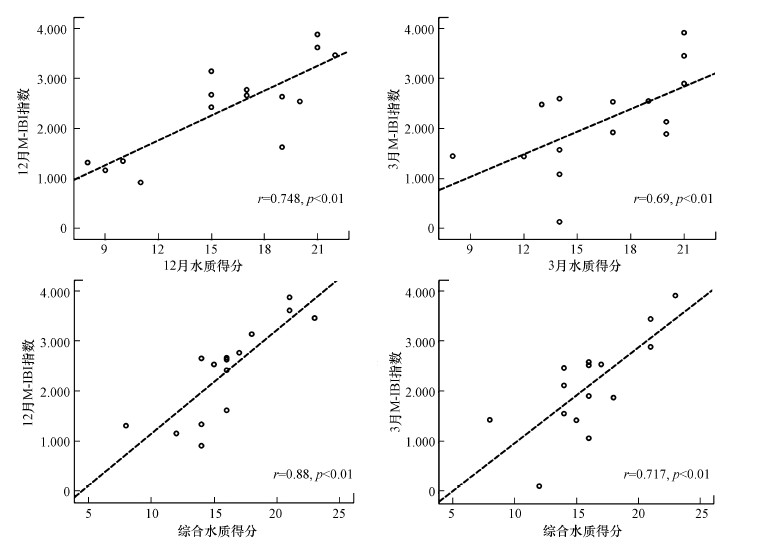 |
| 图 5 M-IBI指数与水质得分的相关分析 Fig. 5Correlation relationship between M-IBI and water quality score |
3.5 核心指标的筛选核心指标的筛选是构建M-IBI指数的关键步骤.之前的研究方法首先根据候选指标在参考点和干扰点之间是否存在显著差异进行初筛, 再根据箱线图的鉴别能力进行第二次筛选.本文尝试运用以上方法构建指标体系, 但发现在最终M-IBI指数的箱线图检验中并不能有效区分中等干扰位点和高度干扰位点, 与水质得分的相关性也很差.原因在于筛选出的核心指标虽然能有效区分参考点和干扰点, 但不能有效区分中等干扰位点和高度干扰位点;其次, 筛选出的指标不能保证满足单调变化的趋势.如图 6所示, 物种在参考点的相对丰度高于干扰点, 但在高度干扰点相对丰度却高于中度干扰点.本文对核心指标筛选过程进行了优化, 挑选出了随着人为干扰程度的增加呈现单调变化趋势的指标.
图 6(Fig. 6)
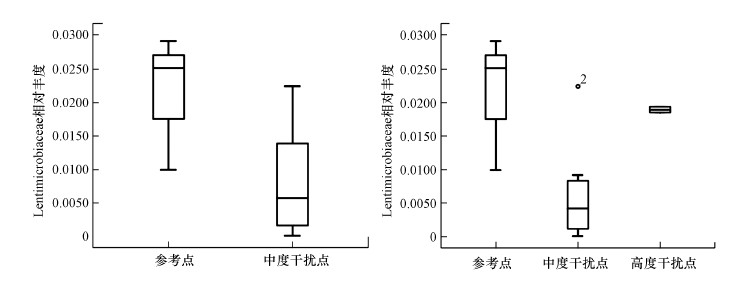 |
| 图 6 传统核心指标筛选方法的缺陷 Fig. 6Defects of traditional core index screening method |
3.6 季节因素对M-IBI指数构建的影响相对于传统的指示生物, 由于底栖微生物对环境变化反应灵敏, 被人们看作是监测城市水环境功能特性的理想候选对象(Lear et al., 2009).正因如此, 底栖微生物群落在面对环境刺激时, 其组成在时间上和空间上可能会发生明显的改变(Paerl et al., 2019).本研究在冬、春两季M-IBI的核心指标筛选中, 筛选出的核心指标均不相同, 这说明冬、春两季季节变化对微生物群落的影响较大.因此, 在利用M-IBI进行生态系统健康评价时, 核心指标的筛选是必不可少的步骤.对于同一时期的评价结果, 可以横向比较生态状况的优劣; 对于不同时期的评价结果, 可通过区域内M-IBI得分排名的变化, 反映这段时期内生态状况是否有所改观.此外, 即使在微生物活性相对较弱的冬季, 也没有影响其作为指示生物的功能, 这说明M-IBI指数法具有较广的适用性.
3.7 微生物作为指示生物的潜力在M-IBI指标体系的建立过程中, 通过分析微生物群落组成与水质之间的关系, 筛选出了对环境变化极为敏感的清洁种和耐污种, 其中, 着色菌科(Chromatiaceae)是一种厌氧光合细菌, 生长在氧气几乎消失、硫化氢丰富、有足够光穿透的环境中(Nuria et al., 1992), 且被证明是棕榈油厂废水排放的可靠生物指标(Diana et al., 2018); 艾德昂菌属(Ideonella)不仅是一种固氮微生物(谭志远等, 2009), 且在PET环境中生长时可以产生两种酶并逐步分解PET塑料, 最终产生二氧化碳和水; 不动杆菌属(Acinetobacter)是一种有机物降解微生物(陆开宏等, 2010); Simplicispira属和噬氢菌属(Hydrogenophaga)既是一种反硝化细菌, 且能有效降解苯酚等有机污染物(郝春博等, 2009; 芦燕等, 2019); Lautropia属含有氮转换过程中hao、pmoA-amoC、nirK、narGZHY等功能基因, 被认为是氮代谢过程的潜在参与者(Sun et al., 2018).这些研究表明微生物对多种环境因子存在指示作用.随着研究的深入, 或许在不久的将来能为每种环境因子找到对应的指示微生物, 从而只需通过微生物群落就可以对环境中的多种污染组分起到半定量的指示作用.
4 结论(Conclusions)本文在传统M-IBI构建的基础上, 改进了核心指标的筛选方法, 通过差异性分析、箱线图检验、Speraman相关性分析, 对无锡境内8条河流冬、春两季的生境状况进行了评价.结果表明, 改进后的M-IBI指数能够在污染程度严重的城市河网区对不同程度的受损位点进行更好的鉴别, 具有较高的灵敏性.此外, 微生物能够在活性相对较弱的冬季仍然发挥其指示生物的功能, 这说明M-IBI具有较广的适用性.但仍存在一些不足, 首先本研究只关注了水环境质量、土地利用类型与微生物群落组成的关系, 尚不能全面反映河流健康状况.其次, 区域性的研究结果会给全国性M-IBI模型的建立和结果解释带来困难.因此, 需要在今后的研究中开展大规模的重复调查和实地验证, 进一步提高该指数的适用性.而随着分子生物技术的快速发展, M-IBI或将成为河流健康评估的有效工具.
参考文献
| Aazami J, Sari A E, Abdoli A, et al. 2015. Assessment of ecological quality of the Tajan River in Iran using a multimetric macroinvertebrate index and species traits[J]. Environmental Management, 56: 260-269. DOI:10.1007/s00267-015-0489-x |
| 安新丽, 陈廷廷, 赵晗, 等. 2016. 基于微生物生物完整性指数的地下水生态系统健康评价:以包钢稀土尾矿周边地下水生态系统为例[J]. 环境科学, 37(9): 3413-3422. |
| Diana M N, Norhayati R, Suhailah S S, et al. 2018. Alcaligenaceae and Chromatiaceae as reliable bioindicators present in palm oil mill effluent final discharge treated by different biotreatment processes[J]. Ecological Indicators, 95: 468-473. DOI:10.1016/j.ecolind.2018.08.007 |
| Haase P, Pauls S U, Schindehütte K, et al. 2010. First audit of macroinvertebrate samples from an EU Water Framework Directive monitoring program:human error greatly lowers precision of assessment results[J]. Journal of the North American Benthological Society, 29(4): 1279-1291. DOI:10.1899/09-183.1 |
| 郝春博, 王广才, 董建楠, 等. 2009. 石油污染地下水中细菌分子生态学研究[J]. 地学前缘, 16(4): 389-400. DOI:10.3321/j.issn:1005-2321.2009.04.039 |
| 胡和兵.2013.城市化背景下流域土地利用变化及其对河流水质影响研究[D].南京: 南京师范大学 http://cdmd.cnki.com.cn/Article/CDMD-10319-1013339389.htm |
| Jia Y T, Chen Y F. 2013. River health assessment in a large river:Bioindicators of fish population[J]. Ecological Indicators, 26: 24-32. DOI:10.1016/j.ecolind.2012.10.011 |
| Jun Y C, Won D H, Lee S H, et al. 2012. A Multimetric benthic macroinvertebrate index for the assessment of stream biotic integrity in Korea[J]. International Journal of Environmental Research and Public Health, 9(12): 3599-3628. |
| Karr J R. 1981. Assessment of biotic integrity using fish communities[J]. Fisheries, 6(6): 21-27. DOI:10.1577/1548-8446(1981)006<0021:AOBIUF>2.0.CO;2 |
| Lear G, Boothroyd I K G, Turner S J, et al. 2009. A comparison of bacteria and benthic invertebrates as indicators of ecological health in streams[J]. Freshwater Biology, 54(7): 1532-1543. DOI:10.1111/j.1365-2427.2009.02190.x |
| Li J, Li Y, Qian B, et al. 2017. Development and validation of a bacteria-based index of biotic integrity for assessing the ecological status of urban rivers:A case study of Qinhuai River basin in Nanjing, China[J]. Journal of Environmental Management, 196: 161-167. DOI:10.1016/j.jenvman.2017.03.003 |
| Lau K E M, Washington V J, Fan V, et al. 2015. A novel bacterial community index to assess stream ecological health[J]. Freshw Biol, 60: 1988e2002. |
| 陆开宏, 胡智勇, 梁晶晶, 等. 2010. 富营养水体中2种水生植物的根际微生物群落特征[J]. 中国环境科学, 30(11): 1508-1515. |
| 芦燕, 曾静, 赵吉, 等. 2019. 典型草原区不同生境反硝化菌群的空间特征[J]. 微生物学通报, 46(4): 707-720. |
| Mckinney M L. 2002. Urbanization, Biodiversity, and Conservation[J]. Bio Science, 52(10): 883-890. |
| Niu L H, Li Y, Wang P F, et al. 2018. Development of a microbial community-based index of biotic integrity (MC-IBI) for the assessment of ecological status of rivers in the Taihu Basin, China[J]. Ecological Indicators, 85: 204-213. DOI:10.1016/j.ecolind.2017.10.051 |
| Gaju N, Esteve I, Guerrero R. 1992. Distribution of predatory bacteria that attack Chromatiaceae in sulfurous lake[J]. Microbial Ecology, 24(2): 171-179. |
| Olapade O A, Leff L G. 2005. Seasonal response of stream biofilm communities to dissolved organic matter and nutrient enrichments[J]. Applied and Environmental Microbiology, 71(5): 2278-2287. DOI:10.1128/AEM.71.5.2278-2287.2005 |
| Paerl H W, Hall N S, Peierls B L, et al. 2014. Hydrologic variability and its control of phytoplankton community structure and function in two shallow, coastal, lagoonal ecosystems:The Neuse and New River Estuaries, North Carolina, USA[J]. Estuaries and Coasts, 37(1 Supplement): 31-45. |
| Pernthaler J. 2013. Freshwater Microbial Communities[M]. Berlin Heidelberg: Springer. |
| 苏瑶, 许育新, 安文浩, 等. 2019. 基于微生物生物完整性指数的城市河道生态系统健康评价[J]. 环境科学, 40(3): 1270-1279. |
| Sun Y, Guan Y, Zeng D, et al. 2018. Metagenomics-based interpretation of AHLs-mediated quorum sensing in Anammox biofilm reactors for low-strength wastewater treatment[J]. Chemical Engineering Journal, 344: 42-52. DOI:10.1016/j.cej.2018.03.047 |
| 谭志远, 彭桂香, 徐培智, 等. 2009. 普通野生稻(Oryza rufipogon)内生固氮菌多样性及高固氮酶活性[J]. 科学通报, 54(13): 1885-1893. |
| Wu N, Schmalz B, Fohrer N. 2012. Development and testing of a phytoplankton index of biotic integrity (P-IBI) for a German lowland river[J]. Ecological Indicators, 13(1): 158-167. DOI:10.1016/j.ecolind.2011.05.022 |
