 , 李建龙1,2, 吴英璀1,2, 单体兴3, 张洪海1,2
, 李建龙1,2, 吴英璀1,2, 单体兴3, 张洪海1,2
 , 杨桂朋1,2
, 杨桂朋1,21. 海洋化学理论与工程技术教育部重点实验室/海洋高等研究院, 中国海洋大学, 青岛 266100;
2. 青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室, 青岛 266237;
3. 潍坊市环境保护局滨海区分局, 潍坊 262737
收稿日期: 2018-12-19; 修回日期: 2019-01-24; 录用日期: 2019-01-24
基金项目: 国家自然科学基金(No.41876082);青岛海洋科学与技术试点国家海洋生态与环境科学功能实验室青年人才培育项目(No.LMEES-YTSP-2018-02-08);中央高校基本科研业务费项目(No.201762030)
作者简介: 王健(1995-), 男, E-mail:oucwangjian@sina.com
通讯作者(责任作者): 张洪海, E-mail:honghaizhang@ouc.edu.cn
摘要: 于2014年2月(枯水季)和7月(丰水季)对长江口及其邻近海域海水中异戊二烯的浓度分布、季节变化及影响因素进行了研究,并计算了其海-气释放通量.分析结果表明:枯水季和丰水季表层海水中异戊二烯平均浓度(范围)分别为(6.28±2.33)((2.96~13.68))和(57.01±80.60)((6.82~432.6))pmol·L-1,季节变化明显,但两个季节浓度高值均出现在长江口东侧及浙江东南部海域.丰水季异戊二烯在不同盐度梯度的浓度分布表明,海水中异戊二烯主要来源于浮游植物的原位生产,而不是直接由陆源输入.相关性分析中,仅发现枯水季温度与异戊二烯浓度存在一定的相关性.此外,枯水季和丰水季异戊二烯海-气通量平均值(范围)分别为(3.82±5.29)(0.07~27.18)和(12.29±16.61)(0.08~61.14)nmol·m-2·d-1,表明长江口海域是大气中异戊二烯的源.
关键词:异戊二烯分布海-气通量长江口
Concentration variation and sea-to-air flux of isoprene in the Yangtze River Estuary and the adjacent East China Sea
WANG Jian1,2
 , LI Jianlong1,2, WU Yingcui1,2, SHAN Tixing3, ZHANG Honghai1,2
, LI Jianlong1,2, WU Yingcui1,2, SHAN Tixing3, ZHANG Honghai1,2
 , YANG Guipeng1,2
, YANG Guipeng1,2 1. Key Laboratory of Marine Chemistry Theory and Technology, Ministry of Education/Institute for Advanced Ocean Study, Ocean University of China, Qingdao 266100;
2. Laboratory for Marine Ecology and Environmental Science, Qindao National Laboratory for Marine Science and Technology, Qingdao 266237;
3. Binhai Branch, Weifang Environmental Protection Bureau, Weifang 262737
Received 19 December 2018; received in revised from 24 January 2019; accepted 24 January 2019
Abstract: Spatial distribution, seasonal variation and influencing factors of isoprene were investigated in the Yangtze River Estuary and the adjacent East China Sea during the wet and dry seasons in 2014. The sea-to-air flux of isoprene was also estimated. The results showed that the mean isoprene concentrations in surface water were (6.28±2.33) ((2.96~13.68)) and (57.01±80.60) ((6.82~432.54)) pmol·L-1 during the dry and wet seasons, with an obvious seasonal variation. The high concentration values of isoprene occurred in the east of the Yangtze River Estuary and the southeast coastal sea area of Zhejiang in the both seasons. The concentration distribution of isoprene along the salinity-gradient transect in wet season indicated that the main source of isoprene in seawater was in situ production of phytoplankton rather than the direct runoff input. A positive correlation was found between temperature and isoprene in the dry season. In addition, the sea-to-air fluxes of isoprene were estimated to be (3.82±5.29) ((0.07~27.18)) and (12.29±16.61) ((0.08~61.14)) nmol·m-2·d-1 during the dry and wet seasons, indicating the Yangtze River Estuary and the adjacent East China Sea is a source of atmosphere isoprene.
Keywords: isoprenedistributionsea-to-air fluxYangtze River Estuary
1 引言(Introduction)生源挥发性有机化合物(BVOCs)在大气化学和全球碳循环中发挥着重要的作用, 对环境和气候变化具有重要的影响.异戊二烯是全球最重要的BVOCs之一, 并以类似CH4的速率排放到大气中(Pacifico et al., 2009).由于异戊二烯CC双键的存在, 它在大气中具有高度活性, 容易与羟基自由基(OH)、氮氧自由基(NOx)、臭氧(O3)等反应(Noone et al., 1998), 增加大气中温室气体的停留时间(Poisson et al., 2000).大气中的异戊二烯除了对大气对流层中O3和CH4浓度有重要调节作用外, 对二次有机气溶胶(SOA)的形成也具有重要贡献(Kiendlerscharr et al., 2009; Nakayama et al., 2018).
尽管大气中异戊二烯主要来源于陆地植被生产释放, 海洋也是异戊二烯重要的释放源, 经估算其年平均释放量可达1.2 Tg·a-1(Bonsang et al., 1992).海水中的异戊二烯主要来源于浮游植物光合作用, 研究发现很多的海洋光养生物都被证明产生异戊二烯(Exton et al., 2013).异戊二烯在细胞内具有一系列的生理功能, 其中最显著的是对热应激的耐受力(Velikova et al., 2006)以及具有抗氧化剂的能力(Loreto et al., 2001).除此之外, 细菌代谢以及有机物的光化学降解(Druffel et al., 1992; Kuzma et al., 1995; Carpenter et al., 2012)也能产生异戊二烯.海水中异戊二烯的消除途径主要包括微生物降解、水化学作用, 以及占主导作用的海-气交换(Donahue et al., 1990).
目前关于海洋中异戊二烯的研究多集中于大洋(Yokouchi et al., 2010; Anttila et al., 2010; Matsunaga et al., 2012), 近岸陆架海域的研究报道较少, 特别是河口海域鲜有报道.此外, 我国海洋异戊二烯研究也仅限于黄、渤海(李建龙等, 2015; 吴英璀等, 2018)以及东海海域(Li et al., 2017)的调查研究.长江口是世界上最具代表性的大型河口海区之一, 受人为活动、工业生产和陆源输入影响严重, 大量的长江径流与陆架环流相互作用, 物理、化学和生物环境十分复杂, 可能对该海区内异戊二烯的产生来源及浓度分布产生重要的影响.因此, 本文基于两个典型季节的现场调查, 对长江口及其邻近海域异戊二烯的浓度分布特征、影响因素及海-气通量进行了研究, 对于丰富和认识我国近海异戊二烯时空分布及生物地球化学循环过程具有重要的研究意义.
2 材料与方法(Materials and methods)2.1 仪器与试剂气相色谱-质谱联用仪(GC-MSD):GC-7890A气相色谱仪(美国Agilent公司), 配有MSD-5975检测器(配电子轰击EI源和四级杆质量分析器);毛细管分离柱(Rt-Alumina BOND/KCI, 30 m×0.32 mm×5 μm, 美国RESTEK公司);吹扫捕集预浓缩系统(实验室自行设计);分子荧光光度计(F-4500型, 日本日立公司).
异戊二烯标准品, 色谱级, 纯度为99.9% (美国Sigma-Aldrich公司);无水MgClO4, 分析纯(国药集团化学试剂有限公司);NaOH, 分析纯(国药集团化学试剂有限公司);甲醇, 色谱级, 纯度99.8% (德国Merck公司);液氮、高纯He(青岛天源配气有限公司).
2.2 采样站位于2014年2月19日—3月11日(枯水季)和7月11—20日(丰水季), 搭乘“润江1号”海洋调查船, 对长江口及邻近海域进行了现场调查.枯水季和丰水季的调查海域及站位如图 1所示, 分别设置61和52个站位采集海水表层样品.现场海洋环境参数由直读式温盐深仪CTD(Seabird 911, 美国General Oceanics公司)测定.现场气温、风速等气象参数由船载气象仪(美国RM. Young公司)测定, 营养盐与溶解氧数据由华东师范大学提供.
图 1(Fig. 1)
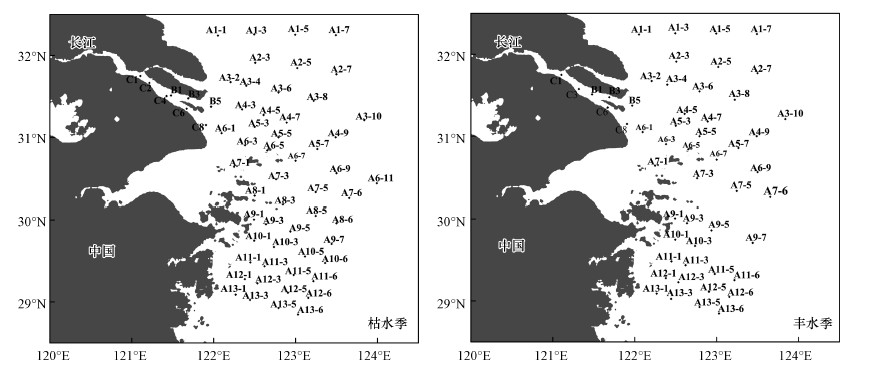 |
| 图 1 枯水季和丰水季长江口及邻近海域采样站位图 Fig. 1Location of the sampling stations in the Yangtze River Estuary and the adjacent East China Sea during the dry and wet seasons |
2.3 样品采集现场采用12 L Niskin采水器采集海水样品, 水样用硅胶管引入120 mL棕色玻璃瓶中, 润洗2~3次, 注入过程避免气泡和涡流, 待水满溢出瓶体积的1/2后, 滴加2滴饱和HgCl2作为固定剂, 抑制生物活动和潜在的降解作用(Kurihara et al., 2012), 压盖密封、避光冷藏保存, 运回陆地实验室后立即进行测定.
海水中异戊二烯浓度测定采用吹扫捕集-气质联用技术(张洪海等, 2015).用气密性良好的玻璃注射器取100 mL海水样品注入气提室中, 通入50 mL·min-1高纯N2进行吹扫, 将样品中的异戊二烯鼓泡吹出后, 经过无水MgClO4干燥、NaOH除CO2后, 进入1/16的进口不锈钢捕集管, 在液氮浴(-196 ℃)中超低温浓缩捕集16 min.捕集结束后, 关闭吹扫气, 将捕集管迅速浸入沸水(100 ℃)中进行热解析, 并同时以高纯He作为载气将异戊二烯送入GC-MSD分析测定.
对于叶绿素a(Chl-a)样品, 海上现场使用孔径0.70 μm的Whatman GF/F玻璃纤维滤膜低压(< 15 kPa)过滤300 mL海水样品, 将滤膜对折并用锡纸包好, 冷冻(-20 ℃)保存, 带回陆地实验室采用分子荧光法测定.
2.4 海-气通量的计算异戊二烯海-气通量计算公式如下所示:
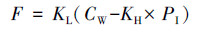 | (1) |
KL根据Wanninkhof模型(Wanninkhof, 1992)计算:
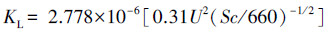 | (2) |
Sc根据Palmer等(2005)计算:
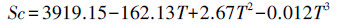 | (3) |
由于两个航次未能同时采集测定大气中异戊二烯的含量, 因此本文中采用2015年2月和8月搭载长江口共享航次在相同海域测定的大气中异戊二烯的浓度平均值(枯水季:1.55×10-10, 丰水季:7.9×10-11), 来计算异戊二烯的海-气通量.其中枯水季采集10个异戊二烯大气样品, 丰水季采集7个异戊二烯大气样品.
3 结果与讨论(Results and discussion)3.1 枯水季表层海水中异戊二烯的浓度分布枯水季长江口及邻近海域表层海水的温度、盐度、Chl-a以及异戊二烯浓度分布如图 2所示.受长江径流的影响, 表层海水的温度、盐度表现出从入海口到远海逐渐升高的趋势, 形成了明显的温盐梯度.枯水季长江口海域海水中Chl-a浓度较低, 在0.01~1.13 μg·L-1之间, 平均值仅为(0.38±0.24) μg·L-1.这是由于该季节海水温度较低, 而且上下水体垂直混合比较剧烈, 不利于浮游植物的生长.从Chl-a的水平分布上看, 两个浓度高值分别出现在长江口外的B-5站位以及舟山群岛东南海域的A10-3站位.
图 2(Fig. 2)
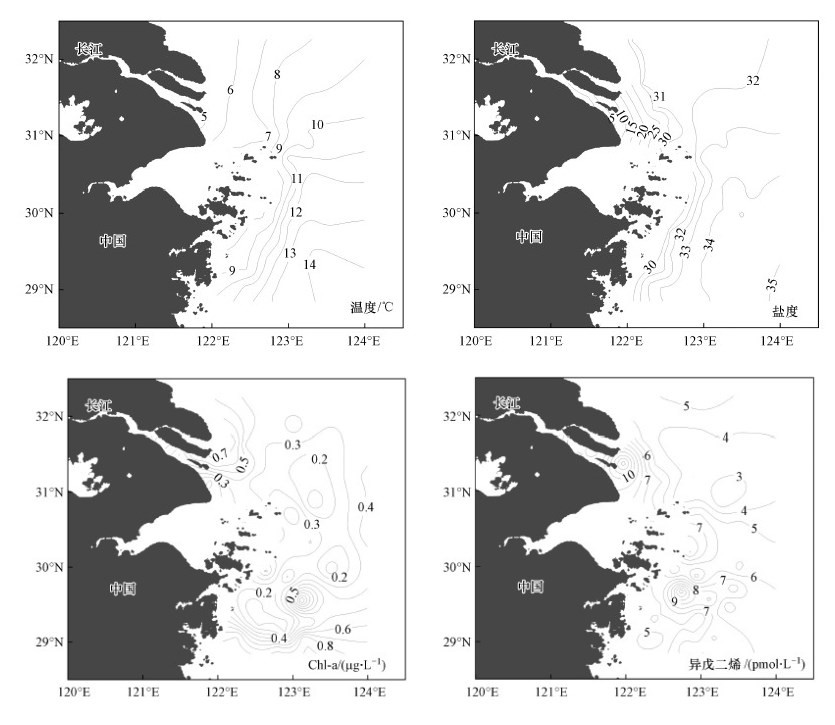 |
| 图 2 枯水季长江口及邻近海域表层海水温度、盐度、Chl-a和异戊二烯的水平分布 Fig. 2Horizontal distributions of temperature, salinity, Chl-a and isoprene in the surface water of the Yangtze River Estuary and the adjacent East China Sea during the dry season |
枯水季表层海水中异戊二烯的浓度变化范围在2.96~13.68 pmol·L-1之间, 平均浓度为(6.28±2.33) pmol·L-1.从图 2可以看出, 异戊二烯的浓度高值与Chl-a的高值相对应, 同样出现在长江口外附近海域与舟山群岛东南海域.在长江径流淡水端元和海水端元交汇作用下, 易将海底分解再生的营养盐带到表层海水中, 充足的营养盐适宜浮游植物的生长, 进而促进异戊二烯的生产释放.此外, 枯水季长江冲淡水会沿岸南下, 成为江浙沿岸流的主要组成部分, 舟山群岛东南附近海域受苏中沿岸流以及台湾暖流的影响, 营养盐含量丰富, 温度适宜, 浮游植物生长相对旺盛, Chl-a与异戊二烯的含量也相对较高.
3.2 丰水季表层海水中异戊二烯的分布特征丰水季长江口及邻近海域表层海水温度、盐度、Chl-a以及异戊二烯浓度的分布如图 3所示.丰水季长江淡水端元温度高于海水端元温度, 呈现出从近岸入海口向远海降低的趋势.由于夏季长江径流量增大, 冲淡水对海水的稀释作用明显加强, 导致盐度变化更加明显, 存在从口门向外海的水舌状分布.丰水季长江口附近海域表层海水中Chl-a含量相对较高, 浓度变化范围较大, 在0.04~6.15 μg·L-1之间, 平均值为(1.52±1.57) μg·L-1.Chl-a浓度存在两个高值区, 一个出现在长江口东侧盐度为27的淡水端元与海水端元混合区域;另一个高值区出现在浙江东侧近岸海域, 与夏季东海赤潮高发区相对应(徐韧等, 1994).
图 3(Fig. 3)
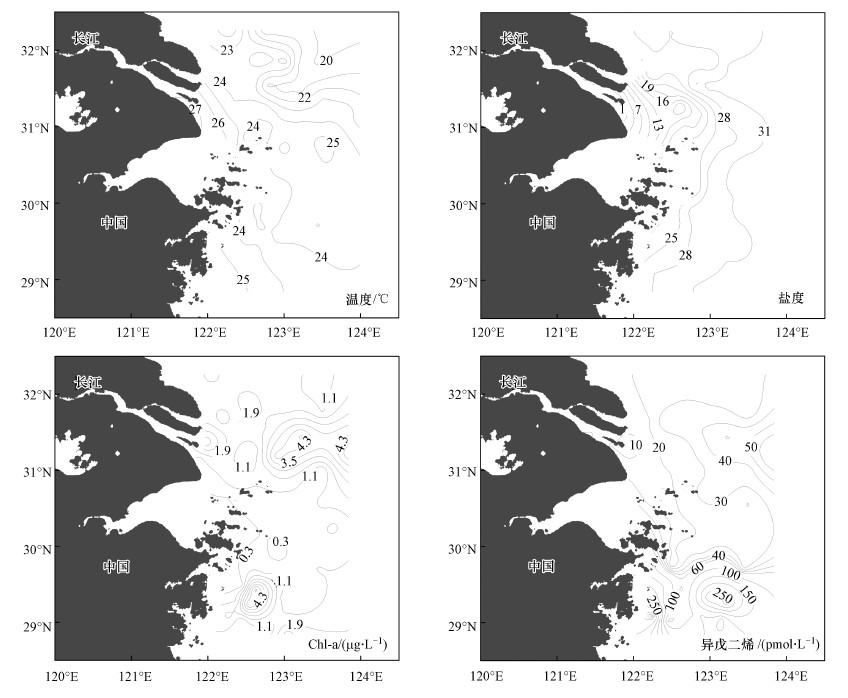 |
| 图 3 丰水季长江口及邻近海域表层海水温度、盐度、Chl-a和异戊二烯的水平分布 Fig. 3Horizontal distributions of temperature, salinity, Chl-a and isoprene in the surface water of the Yangtze River Estuary and the adjacent East China Sea during the wet season |
丰水季表层海水中异戊二烯浓度远高于枯水季, 而且浓度变化范围更大, 在6.82~432.6 pmol·L-1之间, 平均值(57.01±80.60) pmol·L-1.异戊二烯的一个高值区出现在123.5°E、31°N附近海域.夏季长江冲淡水能够携带大量的营养盐输送到该海域, 而且此区域水体透明度大, 光照充足, 浮游植物得以大量生长繁殖, 贡献出该海域较高的异戊二烯浓度.另一个异戊二烯的高值区出现在浙江近岸海域.多项调查结果表明, 在30 °N、122.5 °E附近海域常年存在一上升流(赵保仁等, 2001; 吕新刚等, 2007), 这是台湾暖流在北上过程中, 受海底地形的影响被迫抬升, 形成的上升流将海底循环再生的营养盐带到表层海水中.同航次营养盐分析结果显示, 此区域表层海水中无机氮的平均浓度为(26.46±4.32) μmol·L-1, 高于周围海域表层海水中无机氮平均浓度((15.18±6.22) μmol·L-1).较为充足的营养盐促进了浮游植物的生长, 从而释放到海水中较多的异戊二烯.开阔大洋海域的异戊二烯浓度一般为1~50 pmol·L-1(Matsunaga et al., 2002), 而研究海域的异戊二烯浓度远高于此, 最高值达到432.54 pmol·L-1, 显示出人为活动对近海生态环境及异戊二烯生产分布的影响显著.
在C-A4断面的表层海水中, 异戊二烯在淡水端元(盐度 < 2)、混合区域(盐度2~25)以及海水端元(盐度>25)的平均浓度分别为(14.79±3.04)、(29.13±13.00)和(52.87±21.26) pmol·L-1, 随盐度增加而逐渐升高, 这表明海水中的异戊二烯不是直接来源于陆源输入, 而是海水中浮游植物的原位生产.此外, 由枯水季和丰水季的数据可以看出, 表层海水中异戊二烯的浓度呈现明显的季节差异, 丰水季异戊二烯平均浓度约为枯水季的9倍.海水中的异戊二烯主要来源于海洋浮游植物的生产释放, 因此, 海水中异戊二烯浓度的季节变化与浮游植物种群构成、生物量及其季节性生长有着直接关系.Chl-a作为浮游植物生物量的重要指标能够直观地反映该调查海域的初级生产力水平.丰水季Chl-a的平均浓度约为枯水季的4倍, 这可能也是长江口海域异戊二烯浓度存在明显季节差异的重要原因.
3.3 异戊二烯与环境因子之间的关系为探究长江口海域海水中异戊二烯分布的影响因素, 对同航次测定的异戊二烯浓度与各环境因子之间进行相关性分析, 结果列于表 1中.研究发现, 枯水季异戊二烯浓度与温度存在一定的相关性, 这可能是由于枯水季水温较低(5.59~14.11 ℃), 抑制了藻类细胞的生物活性, 因此水温成为异戊二烯生产释放量的限制性因素.丰水季期间水温整体较高(19.73~27.17 ℃), 温度对藻类产生释放异戊二烯的限制作用不明显.海水中异戊二烯主要来源于浮游植物的生产释放, 其在海水中的浓度与浮游植物的生物量和种类具有密切的联系.此前研究(Li et al., 2017)表明东海海域异戊二烯与Chl-a之间存在较好的相关性, 但在本研究中并未发现异戊二烯与Chl-a存在明显的相关性.有研究表明, Chl-a并不能很好地指示浮游植物的生物量(Breton et al., 2000), 而且较高的浮游植物生物量也不一定能贡献出较高的异戊二烯浓度, 因为不同藻类对异戊二烯的生产释放速率存在较大差异(Milne et al., 1995; Shaw et al., 2003; Moore et al., 2013).尽管研究海域范围较小, 但同时存在淡水、海水、淡咸水混合以及上升流等复杂的水团运动, 导致浮游植物组成可能不同.相同季节相同站位的调查研究表明, 长江口及其邻近海域浮游植物的群落结构及丰度受温度、盐度、浊度以及营养盐等多个环境因子的影响而存在明显差异(李照等, 2017), 呈现区块化分布特征, 这也是异戊二烯和Chl-a没有相关性的重要原因.
表 1(Table 1)
| 表 1 异戊二烯与环境因子的相关性分析 Table 1 Correlation between isoprene and environmental parameters | |||||||||||||||||||||||||||
表 1 异戊二烯与环境因子的相关性分析 Table 1 Correlation between isoprene and environmental parameters
| |||||||||||||||||||||||||||
3.4 长江口及邻近海域异戊二烯的海-气通量计算结果表明, 枯水季长江口及邻近海域异戊二烯的海-气通量范围为0.07~7.18 nmol·m-2·d-1, 平均值为(3.82±5.29) nmol·m-2·d-1, 丰水季异戊二烯的海-气通量范围为0.08~61.14 nmol·m-2·d-1, 平均值为(12.29±16.61) nmol·m-2·d-1.枯水季通量的最大值出现在风速(10.5 m·s-1)最大站位A9-1, 通量的最小值(0.07 nmol·m-2·d-1)出现在风速(0.7 m·s-1)和异戊二烯浓度(4.11 pmol·L-1)均较小站位A3-2.两个航次调查期间风速变化不大, 但丰水季异戊二烯的浓度远高于枯水季, 导致丰水季异戊二烯的海-气通量明显高于枯水季, 丰水季通量平均值约为枯水季的3倍.从图 4中可以看出, 海水中异戊二烯浓度和风速的差异都会对异戊二烯海-气通量带来较大的影响, 在异戊二烯浓度变化不大的情况下, 通量的大小主要由风速的大小决定.
图 4(Fig. 4)
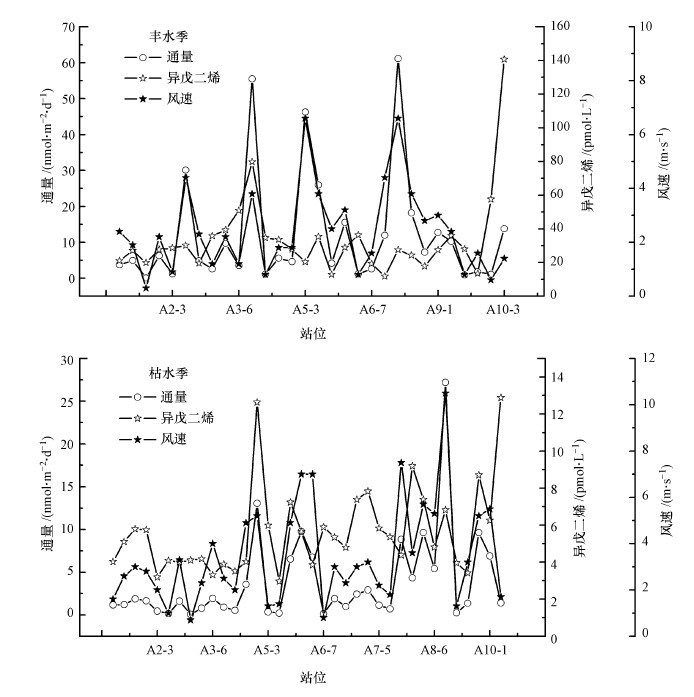 |
| 图 4 海-气通量与风速、异戊二烯浓度之间的关系 Fig. 4Correlations between sea-air flux, wind speed and isoprene concentration |
表 2列出了不同近岸海域异戊二烯海-气通量的调查结果.本航次调查中, 异戊二烯的海-气通量低于其他近岸海域, 这可能是由于调查期间风速较低, 枯水季和丰水季的平均风速分别只有3.5和2.4 m·s-1, 限制了海水和大气之间的交换作用.尽管本次调查中该海域异戊二烯的海-气通量较低, 但各个站位的通量均为正值, 说明长江口海域是大气异戊二烯的净源.此外, 其他近海海域的调查结果表明, 近海陆架海域由于其较高的生产力水平, 可能贡献出较大的异戊二烯海-气通量.
表 2(Table 2)
| 表 2 不同海域异戊二烯的海-气通量 Table 2 Sea-to-air fluxes of isoprene in different sea areas | ||||||||||||||||||||||||||||||||
表 2 不同海域异戊二烯的海-气通量 Table 2 Sea-to-air fluxes of isoprene in different sea areas
| ||||||||||||||||||||||||||||||||
4 结论(Conclusions)1) 丰水季长江口海域异戊二烯的浓度显著高于枯水季, 存在明显的季节差异;但两个季节的水平分布特征相似, 高值区均出现在长江口口门外和浙江东南海域.
2) 丰水季不同盐度梯度下, 表层海水异戊二烯浓度随盐度增加而升高, 表明海水中异戊二烯的主要来源不是陆源输入, 而是海水中浮游植物的原位生产.异戊二烯与Chl-a的相关性并不显著, 这与研究海域内复杂的浮游植物群落结构及丰度有关.此外, 研究发现枯水季异戊二烯浓度和海水温度存在一定的相关性.
3) 由于海水中较高的异戊二烯浓度的贡献, 导致丰水季海-气通量高于枯水季, 不同季节的调查结果表明河口近岸海域是大气中异戊二烯重要的源.
参考文献
| Anttila T, Langmann B, Varghese S, et al. 2010. Contribution of isoprene oxidation products to marine aerosol over the North-East Atlantic[J]. Advances in Meteorology(11): 185–194. |
| Baker A R, Turner S M, Broadgate W J, et al. 2000. Distribution and sea-air fluxes of biogenic trace gases in the eastern Atlantic Ocean[J]. Global Biogeochemical Cycles, 14(3): 871–886.DOI:10.1029/1999GB001219 |
| Bonsang B, Polle C, Lambert G. 1992. Evidence for marine production of isoprene[J]. Geophysical Research Letters, 19(11): 1129–1132.DOI:10.1029/92GL00083 |
| Breton E, Brunet C, Sautour B, et al. 2000. Annual variations of phytoplankton biomass in the Eastern English Channel:comparison by pigment signatures and microscopic counts[J]. Journal of Plankton Research, 22(8): 1423–1440.DOI:10.1093/plankt/22.8.1423 |
| Broadgate W J, Malin G, Küpper F C, et al. 2004. Isoprene and other non-methane hydrocarbons from seaweeds:a source of reactive hydrocarbons to the atmosphere[J]. Marine Chemistry, 88(1): 61–73. |
| Carpenter L J, Archer S D, Beale R. 2012. Ocean-atmosphere trace gas exchange[J]. The Royal of society of Chemistry, 41: 6473–6506.DOI:10.1039/c2cs35121h |
| Donahue N M, Prinn R G. 1990. Non-methane hydrocarbon chemistry in the remote marine boundary layer[J]. Journal of Geophysical Research, 95: 18387–18411.DOI:10.1029/JD095iD11p18387 |
| Druffel E R M, Williams P M, Bauer J E, et al. 1992. Cycling of dissolved and particulate organic matter in the open ocean[J]. Journal of Geophysical Research, 97: 15639–15659.DOI:10.1029/92JC01511 |
| Exton D A, Suggett D J, Mcgenity T J, et al. 2013. Chlorophyll-normalized isoprene production in laboratory cultures of marine microalgae and implications for global models[J]. Limnology & Oceanography, 58(4): 1301–1311. |
| Kiendlerscharr A, Wildt J, Maso M D, et al. 2009. New particle formation in forests inhibited by isoprene emissions[J]. Nature, 461(7262): 381.DOI:10.1038/nature08292 |
| Kurihara M, Iseda M, Ioriya T, et al. 2012. Brominated methane compounds and isoprene in surface seawater of Sagami Bay:Concentrations, fluxes, and relationships with phytoplankton assemblages[J]. Marine Chemistry, 134-135(8): 71–79. |
| Kuzma J, Nemecek-Marshall M, Pollock W H, et al. 1995. Bacteria produce the volatile hydrocarbon isoprene[J]. Current Microbiology, 30: 97–103.DOI:10.1007/BF00294190 |
| Li J L, Zhang H H, Yang G P. 2017. Distribution and sea-to-air flux of isoprene in the East China Sea and the South Yellow Sea during summer[J]. Chemosphere, 178: 291–300.DOI:10.1016/j.chemosphere.2017.03.037 |
| 李建龙, 周立敏, 张洪海, 等. 2015. 秋季黄海与渤海异戊二烯含量的分布及海-气通量[J]. 环境科学研究, 2015, 28(7): 1062–1068. |
| 李照, 宋书群, 李才文, 等. 2017. 丰、枯水期长江口邻近海域浮游植物群落结构特征及其环境影响初探[J]. 海洋学报(中文版), 2017, 39(10): 124–144.DOI:10.3969/j.issn.0253-4193.2017.10.011 |
| Loreto F, Velikova V. 2001. Isoprene produced by leaves protects the photosynthetic apparatus against ozone damage, quenches ozone products, and reduces lipid peroxidation of cellular membranes[J]. Plant Physiology, 127(4): 1781–1787.DOI:10.1104/pp.010497 |
| 吕新刚, 乔方利, 夏长水, 等. 2007. 长江口外及浙江沿岸夏季上升流的潮生机制[J]. 中国科学D辑, 2007, 37(1): 133–144. |
| Matsunaga S, Mochida M, Saito T, et al. 2002. In situ measurement of isoprene in the marine air and surface seawater from the western North Pacific[J]. Atmospheric Environment, 36(39): 6051–6057. |
| Moore R M, Oram D E, Penkett S A. 2013. Production of isoprene by marine phytoplankton cultures[J]. Geophysical Research Letters, 21(23): 2507–2510. |
| Nakayama T, Sato K, Imamura T, et al. 2018. Effect of oxidation process on complex refractive index of secondary organic aerosol generated from isoprene[J]. Environmental Science & Technology, 52(5): 2566–2574. |
| Noone K. 1998. Effect of Oxidation Process on Complex Refractive Index of Secondary Organic Aerosol Generated from Isoprene[J]. Physics Today, 51(10): 88–90.DOI:10.1063/1.882420 |
| Pacifico F, Harrison S P, Jones C D, et al. 2009. Isoprene emissions and climate[J]. Atmospheric Environment, 43(39): 6121–6135.DOI:10.1016/j.atmosenv.2009.09.002 |
| Palmer P I, Shaw S L. 2005. Quantifying global marine isoprene fluxes using MODIS chlorophyll observations[J]. Geophysical Research Letters, 32(9): 302–317. |
| Peter J. Milne, Daniel D. Riemer, Rod. G. Zika, et al. 1995. Measurement of vertical distribution of isoprene in surface seawater, its chemical fate, and its emission from several phytoplankton monocultures[J]. Marine Chemistry, 48(3/4): 237–244. |
| Poisson N, Kanakidou M, Crutzen P J. 2000. Impact of non-methane hydrocarbons on tropospheric chemistry and the oxidizing power of the global troposphere:3-Dimensional modelling results[J]. Journal of Atmospheric Chemistry, 36(2): 157–230.DOI:10.1023/A:1006300616544 |
| Shaw S L, Chisholm S W, Prinn R G. 2003. Isoprene production by Prochlorococcus, a marine cyanobacterium, and other phytoplankton[J]. Marine Chemistry, 80(4): 227–245.DOI:10.1016/S0304-4203(02)00101-9 |
| Velikova V, Loreto F, Tsonev T, et al. 2006. Isoprene prevents the negative consequences of high temperature stress in Platanus orientalis leaves[J]. Functional Plant Biology, 33(10): 931–940.DOI:10.1071/FP06058 |
| Wanninkhof R. 1992. Relationship between wind speed and gas exchange over the ocean[J]. Journal of Geophysical Research Oceans, 97(C5): 7373–7382.DOI:10.1029/92JC00188 |
| 吴英璀, 李建龙, 王健, 等. 2018. 春季黄、渤海中异戊二烯的浓度空间分布与海-气通量[J]. 中国环境科学, 2018, 38(3): 893–899.DOI:10.3969/j.issn.1000-6923.2018.03.011 |
| 徐韧, 洪君超, 王桂兰, 等. 1994. 长江口及其邻近海域的赤潮现象[J]. 海洋通报, 1994(5): 25–29. |
| Yokouchi Y, Li H J, Machida T, et al. 1999. Isoprene in the marine boundary layer (southeast Asian Sea, eastern Indian Ocean, and Southern Ocean):Comparison with dimethyl sulfide and bromoform[J]. Journal of Geophysical Research Atmospheres, 104(D7): 8067–8076.DOI:10.1029/1998JD100013 |
| 张洪海, 李建龙, 杨桂朋, 等. 2015. 吹扫捕集-气相色谱-质谱联用测定天然水体中异戊二烯的研究[J]. 分析化学, 2015, 43(3): 333–337. |
| 赵保仁, 任广法, 曹德明, 等. 2001. 长江口上升流海区的生态环境特征[J]. 海洋与湖沼, 2001, 32(3): 327–333.DOI:10.3321/j.issn:0029-814X.2001.03.014 |
