 , 黄清辉1
, 黄清辉1
 , 许宜平2, 周轶慧3, 仇雁翎3
, 许宜平2, 周轶慧3, 仇雁翎31. 同济大学环境科学与工程学院, 长江水环境教育部重点实验室, 上海 200092;
2. 中国科学院生态环境研究中心, 环境水质学国家重点实验室, 北京 100085;
3. 同济大学环境科学与工程学院, 污染控制与资源化研究国家重点实验室, 上海 200092
收稿日期: 2018-11-07; 修回日期: 2018-12-28; 录用日期: 2018-12-28
基金项目: 瑞典研究理事会瑞中国际合作重大项目(CHEMSTRRES-YRD,No.2013-6913)
作者简介: 魏莱(1994-), 女, E-mail:weilai94@sina.cn
通讯作者(责任作者): 黄清辉(1977—), 男, 博士, 副教授.研究领域为环境污染过程与生态效应, 主持和承担国家级和省部级科研项目任务近10项, 以第一作者和通讯作者发表学术论文40余篇.E-mail:qhhuang@tongji.edu.cn
摘要: 鸟卵可用于环境质量的生物监测.从崇明岛东部若干林地采集小白鹭(Egretta garzetta)卵样品10个,用液相色谱-串联质谱联用仪(LC-MS/MS)测定了样品中10种常见有机磷阻燃剂(OPFRs)的含量,分析了其分布特征和来源.结果表明,除三辛基磷酸酯(TEHP)和三氯乙基磷酸酯(TCEP)外,其余8种OPFRs在小白鹭卵中均有检出,OPFRs的总含量为49.5~142.8 ng·g-1(以湿重计,下同),均值为78.6 ng·g-1;其中,三丁基磷酸酯(TNBP)、三异丁基磷酸酯(TIBP)和三邻甲苯磷酸酯(TMPP)含量较为丰富,分别为(26.3±10.1)、(20.9±9.44)和(19.0±15.6)ng·g-1.不同鸟卵中OPFRs的赋存特征差异较大,主要受其环境含量水平、生物积累和放大能力及代谢能力的影响.崇明小白鹭卵样品中存在具有胚胎发育毒性的TMPP、三(1-氯-2-丙基)磷酸酯(TCIPP)、三丁氧基乙基磷酸酯(TBOEP)等,可能对其繁殖具有潜在影响,值得关注.
关键词:有机磷阻燃剂鹭类鸟卵生物积累胚胎毒性
Occurrence of organophosphorus flame retardants in little egret eggs from Chongming Island
WEI Lai1
 , HUANG Qinghui1
, HUANG Qinghui1
 , XU Yiping2, ZHOU Yihui3, QIU Yanling3
, XU Yiping2, ZHOU Yihui3, QIU Yanling3 1. Key Laboratory of Yangtze River Water Environment of the Ministry of Education, College of Environmental Science and Engineering, Tongji University, Shanghai 200092;
2. State Key Laboratory of Environmental Aquatic Chemistry, Research Center for Eco-Environmental Science, Chinese Academy of Sciences, Beijing 100085;
3. State Key Laboratory of Pollution Control and Resources Reuse, College of Environmental Science and Engineering, Tongji University, Shanghai 200092
Received 7 November 2018; received in revised from 28 December 2018; accepted 28 December 2018
Abstract: Bird egg can be used for biological monitoring of environmental quality. In this study, organophosphorus flame retardants (OPFRs) in 10 little egret egg samples collected from forests in the east of Chongming Island were analyzed using liquid chromatography with tandem mass spectrometry (LC-MS/MS). The results show that 8 OPFRs were detected except tris (2-ethylhexyl) phosphate (TEHP) and tris (2-chloroethyl) phosphate (TCEP). Total concentration of OPFRs (ΣOPFRs) in heron eggs ranged from 49.5 to 142.8 ng·g-1 wet weight, and average concentration was 78.6 ng·g-1. Concentrations of tri-n-butyl phosphate (TNBP), tris (isobutyl) phosphate (TIBP) and tri-2-methylphenyl phosphate (TMPP), as dominant OPFRs, were (26.3±10.1), (20.9±9.44) and (19.0±15.6) ng·g-1, respectively. The occurrence of OPFRs was different in egg individuals, and was probably controlled by their environmental level, bioaccumulation, biomagnification, and metabolic capability. Owing to the embryonic developmental toxicity and potential effects on reproduction of the OPFRs detected in this study, including TMPP, tris (1-chloro-2-propyl) phosphate (TCIPP), and tris (2-butoxyethyl) phosphate (TBOEP), their occurrence should be extensively concerned in heron eggs from Chongming Island.
Keywords: OPFRsheronsbird eggsbioaccumulationembryo toxicity
1 引言(Introduction)有机磷阻燃剂(OPFRs)是一类具有较好阻燃性能的有机磷酸酯, 大部分还具有增塑性能.随着溴系阻燃剂(BFRs)被限制使用, OPFRs作为其替代品被逐步广泛生产和使用(de Wit, 2002; Chen et al., 2010; Wiseman et al., 2011; Veen et al., 2012; Hou et al., 2016).近年来有研究表明, 一部分OPFRs具有持久性、生物积累性及神经、生殖与致癌等毒性(de Wit, 2002; Evenset et al., 2009; Veen et al., 2012), 因此, OPFRs的环境污染问题备受关注.
鸟类是食物链中的高级消费者, 受环境中污染物的影响更加明显(李峰等, 2007), 可作为OPFRs的早期指示生物(Chen et al., 2010; Eulaers et al., 2014).目前, 已有研究在北欧和北美地区的野生鸟类皮毛、血浆及鸟卵等生物组织中检出了多种OPFRs, 在我国一些电子废弃物处置场地等地区的家禽肌肉和蛋样中也有检出报道(Evenset et al., 2009; Chen et al., 2012; Ma et al., 2013; Greaves et al., 2016; Zheng et al., 2016).实验表明, 在鸡蛋和银鸥鸟卵孵化过程中OPFRs可降低胚胎肝细胞的生存率(Porter et al., 2014).OPFRs不仅具有细胞毒性, 还有研究发现其可导致鸡蛋胚胎畸形, 并可改变相关基因的表达水平(Crump et al., 2012; Crump et al., 2014).显然, 鸟类吸收入体内的OPFRs可以通过排卵传递给后代, 并可能影响鸟卵胚胎发育(Greaves et al., 2014), 进而影响繁殖.
长江河口湿地是全球50个生态敏感区之一(莫英敏等, 2017), 建有崇明东滩湿地鸟类国家级自然保护区.据调查显示, 保护区内水鸟的种类和数量在2012—2016年间均呈下降趋势, 生境变化可能对迁徙路线、水鸟数量变化影响较大(吴巍, 2017), 但人们很少关注鸟卵中赋存的污染物(如OPFRs)对胚胎发育和繁殖的影响.小白鹭(Egretta garzetta)是崇明东滩湿地中数量超过1000只次的11种水鸟之一(吴巍, 2017), 大部分属留鸟(曹垒等, 2003), 数量多, 活动频繁.为探究崇明东滩湿地OPFRs在水禽卵中的赋存情况, 本研究以小白鹭为代表, 通过检测崇明小白鹭鸟卵样品体内OPFRs的含量水平, 探讨OPFRs的赋存特征, 并对OPFRs的来源进行分析.
2 材料与方法(Materials and methods)2.1 实验材料与样品采集标准品:三丁基磷酸酯(TNBP)、三异丁基磷酸酯(TIBP)、三辛基磷酸酯(TEHP)、三丁氧基乙基磷酸酯(TBOEP)、三邻甲苯磷酸酯(TMPP)、三苯基磷酸酯(TPHP)、2-乙基己基二苯基磷酸酯(EHDPHP)、三(1-氯-2-丙基)磷酸酯(TCIPP)、三(1, 3-二氯-2-丙基)磷酸酯(TDCIPP)、三氯乙基磷酸酯(TCEP)这10种OPFRs目标物单标及回收率指示物TCEP-d12和内标TNBP-d27均购于上海安谱实验科技有限公司; 正己烷、二氯甲烷、丙酮、甲醇均为色谱纯级, 购于国药集团化学试剂有限公司.
从同济大学长江环境样品库(YESB)中取出10份鸟卵样品和3份淡水鱼样品用于OPFRs分析.鸟卵为2015年7月于崇明岛东部若干小树林(采样点位置见图 1)中采集到的小白鹭卵样品.用超纯水清洗蛋壳表面, 随后在蛋壳表面打一小洞, 将蛋液吹出匀浆并进行均质化, 分装于玻璃小瓶中, 在-80 ℃条件下冷冻保存备用, 并于2018年8月测定了样品中全部10种OPFRs的含量.淡水鱼是小白鹭的重要食物来源(朱曦等, 2001), 于2015年在上海的河道及湿地中采集泥鳅(Misgurnus anguillicaudatus)、鲫鱼(Carassius auratus)和麦穗鱼(Pseudorasbora parva)等淡水鱼的肌肉组织样品, 并于2016年8月测定了样品中的TNBP、TEHP、TBOEP、TPHP、EHDPHP、TCIPP、TDCIPP和TCEP.地表水采集于2015年8月, 包括邻近水库和淀山湖两个采样点, 于2015年10月在瑞典斯德哥尔摩大学测定了样品中的TNBP、TIBP、TPHP、TCIPP、TDCIPP和TCEP(Huang et al., 2017).
图 1(Fig. 1)
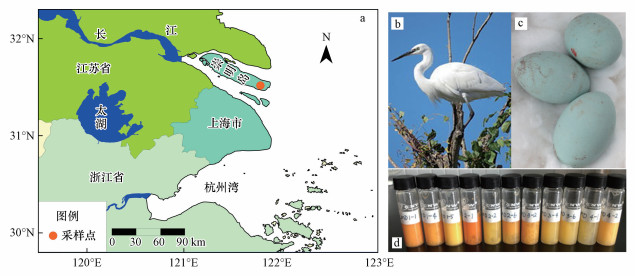 |
| 图 1 崇明小白鹭卵采样点 (a.采样点位置; b.小白鹭; c.小白鹭卵; d.匀浆蛋液样品) Fig. 1Sampling site of little egret eggs in Chongming (a. sampling site; b. little egret; c. eggs of little egret; d. homogenized egg samples) |
2.2 样品前处理准确称取1 g匀浆蛋液, 加入50 ng回收率指示物TCEP-d12, 用4 mL正己烷:二氯甲烷1:1(V/V)萃取, 涡旋30 s后加入0.2 g无水氯化钠和0.8 g无水硫酸镁用以除水, 混匀后超声10 min, 以3000 r·min-1转速离心5 min, 将上清液全部转出, 重复提取3次.合并后的提取液用NH2固相萃取柱(1 g/6 mL, CNW)进行净化(Hou et al., 2017).NH2柱用5 mL二氯甲烷:正己烷1:4(V/V)进行清洗和活化.上样完成后的NH2柱依次用3 mL二氯甲烷:正己烷1:4(V/V)、8 mL二氯甲烷和4 mL二氯甲烷:甲醇9:1(V/V)洗脱.洗脱液氮吹至0.2 mL后加入10 ng内标TNBP-d27, 用甲醇定容至1 mL, 经0.2 μm滤膜(SCAA-114, 上海安谱实验科技有限公司)过滤后转移至进样瓶.
2.3 仪器分析10种OPFRs的定性和定量分析采用液相色谱-串联质谱联用仪(Thermo Fisher Scientific TSQ Quantum, Thermo Fisher公司).所用色谱柱为Waters BEH C18色谱柱(100 mm×2.1 mm, 3.5 μm), 流动相为含有0.1%甲酸的超纯水(A)和甲醇(B), 流速设置为0.2 mL·min-1, 进样量为10 μL, 洗脱梯度如下:0~1.5 min 40%B, 1.5~8 min 65%B, 9 min增至100%B, 9~16 min保持100%B, 16.1 min降至40%B, 继续保持至17 min(Hou et al., 2018).
质谱采用正极电喷雾离子源(ESI+), 分析物以选择反应监测(SRM)模式分析, 喷雾电压4000 V, 入口温度110 ℃, 离子源温度400 ℃, 优化后各化合物的SRM通道及碰撞电压等参数如表 1所示.
表 1(Table 1)
| 表 1 仪器分析参数和质量保证与质量控制数据 Table 1 Instrumental analysis parameters and QA/QC data | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 仪器分析参数和质量保证与质量控制数据 Table 1 Instrumental analysis parameters and QA/QC data
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
2.4 质量保证与质量控制(QA/QC)每6个样品为同一批次进行处理, 同时测定一个空白样品进行校正.检出限(LOD)以3倍背景信噪比得出(表 1).为检验实验准确度, 以50 ng TCEP-d12作为回收率指示物, 其回收率可达80%~132%(均值为106%±20%), 各目标物的回收率参见表 1.另外, 以50 ng·mL-1标准溶液连续5次进样所得浓度的相对标准偏差(RSD)来评估精密度, 如表 1所示, 本研究方法的准确性和精密性均较好.同时, 本研究还评估了分析过程的基质效应, 100 ng·mL-1下OPFRs基质加标样品的基质效应范围为56%~145%.除TCEP、TEHP、TDCIPP的检出限(4.0~5.0 ng·g-1)相对较高之外, 其余化合物的检出限均在0.2~0.4 ng·g-1范围之内.
2.5 数据分析生物浓缩指污染物通过呼吸、皮肤接触等途径从周围环境进入生物体, 一般用生物浓缩系数(BCF)表示其强弱, 可在实验室严格控制无污染物食物摄取途径的条件下测得; 生物积累指污染物通过各种暴露途径被吸收进入生物体, 可用生物积累系数(BAF)来衡量; 生物放大系数(BMF)指污染物在一个特定的营养级生物体内的浓度与较低营养级生物体内浓度的比值, 可用于表示污染物沿食物链的生物放大能力(Arnot et al., 2006).本文中OPFRs的BCF数据来源于参考文献(Bergman et al., 2012), 而BAF与BMF则分别由公式(1)和(2)计算所得(Arnot et al., 2006):
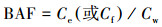 | (1) |
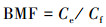 | (2) |
3 结果与讨论(Results and discussion)3.1 鸟卵中OPFRs的赋存特征崇明小白鹭卵中10种OPFRs目标化合物的含量水平如表 2所示.其中, TNBP、TIBP、TCIPP与TBOEP的检出率为100%, TMPP和TPHP的检出率为80%, EHDPHP和TDCIPP的检出率不高于20%, TCEP与TEHP无检出.在所有鸟卵样品中, OPFRs总含量变化范围是49.5~142.8 ng·g-1, 均值为78.6 ng·g-1.图 2显示了鸟卵样品中可检出的8种OPFRs含量的百分比分布, 其中赋存最多的OPFRs是TNBP, 其含量为(26.3±10.1) ng·g-1, 其次是TIBP和TMPP, 含量分别为(20.9±9.44) ng·g-1和(19.0±15.6) ng·g-1.泥鳅、鲫鱼和麦穗鱼肌肉组织中TNBP和TCIPP都有检出且含量较高, 而TIBP和TMPP未作为目标物检测, 其余6种OPFRs的含量水平相对较低.周边水体中含量较高的TCEP在鸟卵中无检出, 但TNBP、TIBP、TPHP、TCIPP和TDCIPP在水体和鸟卵中均有检出.
表 2(Table 2)
| 表 2 小白鹭卵、淡水鱼及地表水体中OPFRs含量 Table 2 Concentrations of OPFRs in little egret eggs, freshwater fishes and surface waters | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 小白鹭卵、淡水鱼及地表水体中OPFRs含量 Table 2 Concentrations of OPFRs in little egret eggs, freshwater fishes and surface waters
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
图 2(Fig. 2)
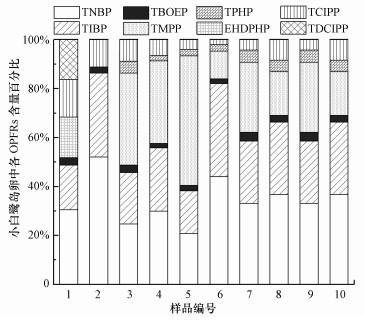 |
| 图 2 崇明小白鹭卵样品(n=10)中各OPFRs含量百分比分布 Fig. 2Percentage distributions of OPFRs concentrations in Chongming little egret eggs(n=10) |
3.2 OPFRs的生物积累与生物放大崇明小白鹭卵中检测到的8种OPFRs分别按式(2)计算其BMF(表 3), 发现TNBP、TCIPP和TPHP表现出了比较明显的生物放大现象.对小白鹭卵和淡水鱼样分别按式(1)计算BAF值(表 3), 发现TNBP、TCIPP和TPHP同样也表现出较强的生物积累能力.这说明OPFRs在小白鹭卵中的赋存可能与污染物的生物积累和放大能力有关.水体中含量较高的TCEP在生物体中未检出, 可能与TCEP的BCF值较低, 生物积累和放大能力也较弱, 而且能在生物体内发生代谢(Sasaki et al., 1984; Burka et al., 1991)有关.
表 3(Table 3)
| 表 3 小白鹭卵、淡水鱼样中OPFRs的生物浓缩系数(BCF)、生物积累系数(BAF)和生物放大系数(BMF) Table 3 Bioconcentration factor (BCF), bioaccumulation factor (BAF) and biomagnification factor (BMF) of OPFRs in little egret eggs and fishes | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 小白鹭卵、淡水鱼样中OPFRs的生物浓缩系数(BCF)、生物积累系数(BAF)和生物放大系数(BMF) Table 3 Bioconcentration factor (BCF), bioaccumulation factor (BAF) and biomagnification factor (BMF) of OPFRs in little egret eggs and fishes
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.3 鸟卵OPFRs污染状况分析比较崇明岛小白鹭卵样品中OPFRs以TNBP、TIBP和TMPP为主要特征性污染物, 这与国内外其它野生鸟类和养殖禽类卵样中OPFRs的赋存特征存在差异(表 4).小白鹭卵的总OPFRs(ΣOPFRs)含量水平较其他研究偏高, 可能因为小白鹭卵中含量较高的TIBP和TMPP在很多研究中并未作为目标物(Chen et al., 2012; Chu et al., 2015; Xu et al., 2015; Zheng et al., 2016).
表 4(Table 4)
| 表 4 国内外鸟卵样品有机磷阻燃剂检出情况比较 Table 4 Comparison of detection of OPFRs in bird eggs at different places | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 4 国内外鸟卵样品有机磷阻燃剂检出情况比较 Table 4 Comparison of detection of OPFRs in bird eggs at different places
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
国外野生鸟卵体内赋存较多的烷基OPFRs是TBOEP和TEHP, 但总体含量水平较低(Leonards et al., 2011; Chen et al., 2012; Chu et al., 2015; Hallanger et al., 2015; Greaves et al., 2016).其中, TBOEP在崇明小白鹭卵中有检出, TEHP未检出, 这可能与当地的环境含量水平有关.芳基OPFRs在国外其它野生鸟卵和养殖禽类卵样中以TPHP为主要污染物, 在崇明小白鹭卵中也有较高的检出率.氯代OPFRs中TCIPP是国外其它野生鸟卵中主要的污染物, 在小白鹭卵中含量水平也较高, 分析发现其BAF和BMF值较高(表 3), 表现出了生物积累和生物放大效应.另外, 毒性较强的TCEP在国外野生鸟卵中仅有少量检出, 除在氯代OPFRs含量均较高的电子废弃物回收区外(Zheng et al., 2016), TCEP在鸟卵中的总体含量水平较低, 与小白鹭卵中TCEP未检出的情况基本一致.这与TCEP的生物积累能力弱且易降解(Sasaki et al., 1984; Burka et al., 1991)有关.因此, 生物体内OPFRs赋存主要受其环境含量水平、生物积累和放大能力及代谢能力的影响.
相关研究发现, TBOEP、TMPP、TDCIPP和TCIPP可降低鸡蛋和银鸥卵胚胎肝细胞的生存率, 导致胚胎畸形(Crump et al., 2012; Porter et al., 2014).这些OPFRs在本研究的小白鹭鸟卵中均有检出, 因此, OPFRs对白鹭卵胚胎发育的影响不容忽视.其中, TBOEP和TMPP等非氯代OPFRs可添加于PVC和液压油中作为阻燃剂, 也可用于增塑剂(Andresen et al., 2004); TDCIPP和TCIPP等氯代OPFRs主要用作阻燃剂, 广泛应用于塑料制品、电子设备和建筑及装饰材料中(Andresen et al., 2004; 史莉等, 2018).
4 结论(Conclusions)1) 崇明小白鹭卵存在一定的OPFRs污染, 并以TNBP、TIBP和TMPP等为主, TCEP和TEHP未检出.
2) 多种具有胚胎发育毒性的OPFRs在小白鹭卵中有检出, 其中, TMPP含量较高, 对胚胎发育的影响不容忽视.
3) TNBP、TCIPP和TPHP表现出了较强的生物积累和生物放大能力, TCEP的生物积累能力较弱.
4) OPFRs的环境浓度水平、生物积累和放大能力及代谢能力可能是生物体内OPFRs赋存的主要影响因素.
参考文献
| Andresen J A, Grundmann A, Bester K. 2004. Organophosphorus flame retardants and plasticisers in surface waters[J]. Science of the Total Environment, 332(1/3): 155–166. |
| Arnot J A, Gobas F A. 2006. A review of bioconcentration factor (BCF) and bioaccumulation factor (BAF) assessments for organic chemicals in aquatic organisms[J]. Environmental Reviews, 14(4): 257–297.DOI:10.1139/a06-005 |
| Bergman ?, Rydén A, Law R J, et al. 2012. A novel abbreviation standard for organobromine, organochlorine and organophosphorus flame retardants and some characteristics of the chemicals[J]. Environment International, 49: 57–82.DOI:10.1016/j.envint.2012.08.003 |
| Burka L T, Sanders J M, Herr D W, et al. 1991. Metabolism of tris(2-chloroethyl) phosphate in rats and mice[J]. Drug Metabolism & Disposition, 19(2): 443–447. |
| Chen D, Hale R C. 2010. A global review of polybrominated diphenyl ether flame retardant contamination in birds[J]. Environment International, 36(7): 800–811.DOI:10.1016/j.envint.2010.05.013 |
| Chen D, Letcher R J, Chu S. 2012. Determination of non-halogenated, chlorinated and brominated organophosphate flame retardants in herring gull eggs based on liquid chromatography-tandem quadrupole mass spectrometry[J]. Journal of Chromatography A, 1220: 169–174.DOI:10.1016/j.chroma.2011.11.046 |
| Chu S, Letcher R J. 2015. Determination of organophosphate flame retardants and plasticizers in lipid-rich matrices using dispersive solid-phase extraction as a sample cleanup step and ultra-high performance liquid chromatography with atmospheric pressure chemical ionization mass spectrometry[J]. Analytica Chimica Acta, 885: 183–190.DOI:10.1016/j.aca.2015.05.024 |
| Crump D, Chiu S, Kennedy S W. 2012. Effects of tris(1, 3-dichloro-2-propyl) phosphate and tris(1-chloropropyl) phosphate on cytotoxicity and mRNA expression in primary cultures of avian hepatocytes and neuronal cells[J]. Toxicological Sciences, 126(1): 140–148.DOI:10.1093/toxsci/kfs015 |
| Crump D, Porter E, Egloff C, et al. 2014. 1, 2-Dibromo-4-(1, 2-dibromoethyl)-cyclohexane and tris(methylphenyl) phosphate cause significant effects on development, mRNA expression, and circulating bile acid concentrations in chicken embryos[J]. Toxicology and Applied Pharmacology, 277(3): 279–287.DOI:10.1016/j.taap.2014.03.028 |
| 曹垒, 杨捷频. 2003. 校园观鸟手册[M]. 合肥: 中国科学技术大学出版社: 32. |
| de Wit C A. 2002. An overview of brominated flame retardants in the environment[J]. Chemosphere, 46(5): 583–624.DOI:10.1016/S0045-6535(01)00225-9 |
| Eulaers I, Jaspers V L B, Halley D J, et al. 2014. Brominated and phosphorus flame retardants in white-tailed eagle Haliaeetus albicilla nestlings:bioaccumulation and associations with dietary proxies (δ13C, δ15N and δ34S)[J]. Science of the Total Environment, 478: 48–57.DOI:10.1016/j.scitotenv.2014.01.051 |
| Evenset A, Leknes H, Christensen G N, et al.2009.Screening of new contaminants in samples from the Norwegian Arctic: Silver, platinum, sucralose, bisphenol a, tetrabrombisphenol a, siloxanes, phtalates (DEHP), phosphororganic flame retardants[R].1049/2009.Norge: Norwegian Pollution Control Authority.30-34https://brage.bibsys.no/xmlui/handle/11250/173176 |
| Greaves A K, Letcher R J. 2014. Comparative body compartment composition and in ovo transfer of organophosphate flame retardants in North American Great Lakes Herring Gulls[J]. Environmental Science and Technology, 48(14): 7942–7950.DOI:10.1021/es501334w |
| Greaves A K, Letcher R J, Chen D, et al. 2016. Retrospective analysis of organophosphate flame retardants in herring gull eggs and relation to the aquatic food web in the Laurentian Great Lakes of North America[J]. Environmental Research, 150: 255–263.DOI:10.1016/j.envres.2016.06.006 |
| Hallanger I G, Sagerup K, Evenset A, et al. 2015. Organophosphorous flame retardants in biota from Svalbard, Norway[J]. Marine Pollution Bulletin, 101(1): 442–447.DOI:10.1016/j.marpolbul.2015.09.049 |
| Hou R, Xu Y, Wang Z. 2016. Review of OPFRs in animals and humans:Absorption, bioaccumulation, metabolism, and internal exposure research[J]. Chemosphere, 153: 78–90.DOI:10.1016/j.chemosphere.2016.03.003 |
| Hou R, Liu C, Gao X, et al. 2017. Accumulation and distribution of organophosphate flame retardants (PFRs) and their di-alkyl phosphates (DAPs) metabolites in different freshwater fish from locations around Beijing, China[J]. Environmental Pollution, 229: 548–556.DOI:10.1016/j.envpol.2017.06.097 |
| Hou R, Huang C, Rao K, et al. 2018. Characterized in vitro metabolism kinetics of alkyl organophosphate esters in fish liver and intestinal microsomes[J]. Environmental Science and Technology, 52(5): 3202–3210.DOI:10.1021/acs.est.7b05825 |
| Huang Q H, Zhu Z L, Bergman A, et al.2017.Chapter 3.4 Dringking Water Contaminants: A Screening Project//Bergman ?, Bignert A, Qiu Y L, et al.Chemical Pollution Challenges in the Yangtze River Delta, China: A 2017 Sino-Swedish Research Report[M].Stockholm: Stockholm University.65-69 |
| Leonards P S E, van der Veen I, Berg V, et al.2011 Screening of organophosphorus flame retardants 2010[R].SPFO-report 1091/2011.Norway: Norwegian Climate and Pollution Agency |
| 李峰, 丁长青. 2007. 重金属污染对鸟类的影响[J]. 生态学报, 2007, 27(1): 296–303.DOI:10.3321/j.issn:1000-0933.2007.01.035 |
| Ma Y, Cui K, Zeng F, et al. 2013. Microwave-assisted extraction combined with gel permeation chromatography and silica gel cleanup followed by gas chromatography-mass spectrometry for the determination of organophosphorus flame retardants and plasticizers in biological samples[J]. Analytica Chimica Acta, 786: 47–53.DOI:10.1016/j.aca.2013.04.062 |
| 莫英敏, 谢汉宾, 李贲, 等. 2017. 崇明东滩冬季不同管理模式下水稻田水鸟群落特征及其生境分析[J]. 动物学杂志, 2017, 52(4): 583–591. |
| Porter E, Crump D, Egloff C, et al. 2014. Use of an avian hepatocyte assay and the avian toxchip polymerse chain reaction array for testing prioritization of 16 organic flame retardants[J]. Environmental Toxicology and Chemistry, 33(3): 573–582.DOI:10.1002/etc.v33.3 |
| Sasaki K, Suzuki T, Takeda M, et al. 1984. Metabolism of phosphoric acid triesters by rat liver homogenate[J]. Bulletin of Environmental Contamination and Toxicology, 33(1): 281–288.DOI:10.1007/BF01625544 |
| 史莉, 范红伟, 吴婷桦, 等. 2018. 聚氨酯泡沫中3种有机磷阻燃剂检测方法及其迁移规律研究[J]. 分析仪器, 2018(1): 7–11.DOI:10.3969/j.issn.1001-232x.2018.01.002 |
| Veen I V D, Boer J D. 2012. Phosphorus flame retardants:Properties, production, environmental occurrence, toxicity and analysis[J]. Chemosphere, 88(10): 1119–1153.DOI:10.1016/j.chemosphere.2012.03.067 |
| Wiseman S B, Wang Y, Chang H, et al. 2011. Polybrominated diphenyl ethers and their hydroxylated/methoxylated analogs:environmental sources, metabolic relationships, and relative toxicities[J]. Marine Pollution Bulletin, 63(5/12): 179–188. |
| 吴巍. 2017. 上海崇明东滩湿地的栖息地重建对水鸟的作用[J]. 生物学通报, 2017, 52(10): 7–11.DOI:10.3969/j.issn.0006-3193.2017.10.003 |
| Xu F, Garcia-Bermejo A, Malarvannan G, et al. 2015. Multi-contaminant analysis of organophosphate and halogenated flame retardants in food matrices using ultrasonication and vacuum assisted extraction, multi-stage cleanup and gas chromatography-mass spectrometry[J]. Journal of Chromatography A, 1401: 33–41.DOI:10.1016/j.chroma.2015.05.001 |
| Zheng X, Xu F, Luo X, et al. 2016. Phosphate flame retardants and novel brominated flame retardants in home-produced eggs from an e-waste recycling region in China[J]. Chemosphere, 150: 545–550.DOI:10.1016/j.chemosphere.2015.09.098 |
| 朱曦, 邹小平. 2001. 中国鹭类[M]. 北京: 中国林业出版社: 201. |
