 , 马晓妍
, 马晓妍
 , 郝丽伟, 王晓昌, 金鹏康, 杨文博
, 郝丽伟, 王晓昌, 金鹏康, 杨文博西安建筑科技大学, 西北水资源与环境生态教育部重点实验室, 国家城市非传统水资源开发利用国际科技合作基地, 陕西省环境工程重点实验室, 西安 710055
收稿日期: 2018-08-31; 修回日期: 2018-11-11; 录用日期: 2018-11-11
基金项目: 国家自然科学基金(No.51508449,51778522);陕西省教育厅科研计划项目(No.18JK0468)
作者简介: 郑凯(1993-), 男, E-mail:15664671786@163.com
通讯作者(责任作者): 马晓妍, E-mail:maxiaoyan@xauat.edu.cn
摘要: 应用新型大面积调制叶绿素荧光成像系统(Maxi-Imaging-PAM),以蛋白核小球藻作为指示生物,以典型的光合作用抑制剂敌草隆和莠灭净为测试物质,建立了微孔板式藻毒性检测方法,确定了实验参数对结果的影响,并将该方法应用于检测石油废水的藻毒性.结果表明,最适实验条件为:藻细胞的暴露浓度在3.45×106~5.28×106 cell·mL-1范围内,暴露时间为2 h时,毒性检测最灵敏,获得的敌草隆和莠灭净的半最大效应浓度(EC50)分别为(4.33±0.38)μg·L-1和(3.87±0.27)μg·L-1.将该方法成功应用于某石油废水的藻毒性检测,确定其EC50值为1.03%±0.07%(稀释百分数),相当于414.96 μg·L-1的敌草隆的毒性.本研究建立的微孔板式藻毒性检测方法具有灵敏度高、所需样品量少、可大批量测试等优点,对毒理学发展具有重要意义.
关键词:叶绿素荧光成像技术藻毒性敌草隆莠灭净荧光量子产率
The establishment of algal toxicity detection method based on chlorophyll fluorescence imaging and its application in environmental monitoring
ZHENG Kai
 , MA Xiaoyan
, MA Xiaoyan
 , HAO Liwei, WANG Xiaochang, JIN Pengkang, YANG Wenbo
, HAO Liwei, WANG Xiaochang, JIN Pengkang, YANG Wenbo Key Laboratory of Northwest Water Resources and Environmental Ecology, Ministry of Education, International Science & Technology Cooperation Center for Urban Alternative Water Resources Development, Key Lab of Environmental Engineering, Shaanxi Province, Xi'an University of Architecture and Technology, Xi'an 710055
Received 31 August 2018; received in revised from 11 November 2018; accepted 11 November 2018
Abstract: Using a novel large-area modulating chlorophyll fluorescence imaging system (Maxi-Imaging-PAM), a method for algae toxicity test was developed and optimized based on microplate. In this method, Chlorella pyrenoidosa was the testing organism, and typical photosynthesis inhibitors diuron and ametryn were chosen as testing substances. The influence of the experimental parameters on the results were discussed in this study. Finally, this developed method was applied on the algae toxicity test of petroleum wastewater. The results showed that when the concentration of the algal solution was 3.45×106~5.28×106 cells·mL-1 and exposure time was 2 hours, the method displayed a good testing property. At this condition, the concentration of 50% maximal effect (EC50) of diuron and ametryn were (4.33±0.38) μg·L-1 and (3.87±0.27) μg·L-1, respectively. The method was successfully applied to the algae toxicity test of petroleum wastewater, and its EC50 value was 1.03%±0.07% (dilution percentage), which is equivalent to 414.96 μg·L-1 diuron. The established microplate algae toxicity detection method has the advantages of high sensitivity, less sample volume demanded, and large batch test. This has great significance for the development of toxicology.
Keywords: chlorophyll fluorescence imaging technologyalgae toxicitydiuronametrynfluorescence quantum yield
1 引言(Introduction)除草剂由于具有高水溶性和低吸附系数的特点, 可以快速进入到靶标植物体内发生效用(Hasenbein et al., 2017), 但除草剂对非靶标生物也有影响(虞龙等, 2010).未进入靶标植物体内的除草剂, 残留在土壤或漂浮在空气中, 通过淋溶、流域排水和降雨等作用, 直接或间接地污染地表水和地下水(Meyer et al., 2012).目前, 多个国家和地区已在地表水和地下水等水体中检测出多种除草剂, 严重影响了水生生态系统, 尤其是水生植物(严登华等, 2005; Focazio et al., 2008; Fait et al., 2010; Hillebrand et al., 2014; 刘威, 2015).
由于藻类个体小、世代周期短、易于培养, 且对除草剂尤为敏感, 因此, 藻类常被用于检测水体受农药污染的程度(杜丽娜等, 2014; 葛会林等, 2014).目前, 国内外****已建立了众多以藻类为指示生物的毒性测试方法(Ma et al., 2002; 史媛等, 2013).在1967年, 美国提出了“暂行藻类测试程序”(Provisional Algal Assay Procedure, PAAP)(钱海丰等, 2017).随后, 在1981年, 美国提出了“藻类生长抑制方法”(Alga Growth Inhibition Test, AGIT).在2008年, 我国也发布了“化学品藻类生长抑制试验”(GB/T21805—2008)标准方法(王丽等, 2008).
不过, 这些传统的实验方法是对藻类进行实验室培养后, 通过测定光密度、细胞数、细胞干重等生物量上的变化来表征除草剂对于藻类的影响程度, 具有实验工作量大、测试周期较长、所需样品量多等缺点(丛佳, 2017; Forsberg, 1972).随着叶绿素荧光技术的发展, 使得通过测定暴露中的藻细胞光合作用参数来建立藻毒性检测方法成为可能.WALZ公司首席科学家、德国乌兹堡大学教授Ulrich Schreiber利用调制技术和饱和脉冲技术, 设计制造了采用脉冲-振幅-调制技术来测量叶绿素荧光产量的IMAGING-PAM系列荧光仪(叶丹等, 2014; Sjollema et al., 2014).随着人们对快速、灵敏的藻毒性检测方法的需求, 该技术逐渐被应用于已知毒物或受污染水体的藻类生物效应的评价中(Sjollema et al., 2014; 黄飞羽等, 2017).其原理是毒物通过阻断光合作用的电子传递链导致叶绿素荧光增加, PSII的实际量子产量降低, 其降低幅度与毒性的大小有关, 毒性越大, 实际量子产量降低越明显.因此, 可通过测量藻细胞叶绿素荧光强度的变化来评价待测样品的毒性效应的大小(Cedergreen et al., 2007).
虽然叶绿素荧光技术已在藻毒性检测中有所应用, 但目前仍没有标准的实验方法, 具体的实验参数对毒性结果的影响仍不明确, 这导致不同的研究者之间的数据可比性较差(Muller et al., 2008).因此, 本研究利用新型大面积调制叶绿素荧光成像系统(Maxi-Imaging-PAM), 以蛋白核小球藻作为指示生物, 以取代脲类除草剂敌草隆和三嗪类除草剂莠灭净作为标准测试物质, 探讨实验参数对毒性结果的影响, 最终建立并优化基于微孔板式叶绿素荧光检测的藻毒性评价方法, 并将其应用于实际环境样品的藻毒性测试中, 以校验方法的可靠性.
2 材料、仪器与方法(Materials, instrumentand methods)2.1 试验材料与试剂蛋白核小球藻(Chlorella pyrenoidesa)购于中国科学院野生生物种质库-淡水藻种库(FACHB-1227), 除草剂敌草隆(Diuron)和莠灭净(Ametryn)母液用二甲基亚砜(DMSO)配制, 最终测试时的除草剂溶剂中含有1% DMSO.藻类毒性测试在96孔平底黑色聚苯乙烯微板(美国Corning公司)上进行.石油废水取自中石油长庆油田采油厂.
2.2 调制叶绿素荧光成像系统IMAGING-PAM仪器参数设定大面积叶绿素荧光仪是由德国WALZ公司生产的M系列调制叶绿素荧光成像系统(Maxi-Imaging-PAM).参考Schreiber等对Maxi-Imaging-PAM系统的详细介绍及参数调整方法(史媛等, 2013).脉冲调制测量光强度(Measuring Light, ML)的设置根据各感兴趣区域的实时荧光值(Ft)进行调整, 保证Ft值在0.01~0.02范围内, 此时该仪器达到最佳测量状态(史媛等, 2013; Schreiber et al., 2002).本实验将ML在测量光脉冲频率(Measuring Frequency, MF)为4时设定为20, 光化光(Actinic Light, AL)设置为0, 增益(Gain)不能太大, 设置为3, 在此参数下的光合有效辐射(PAR)值是3.给每一个样品施加3次饱和脉冲(Saturation Pulse, SP), 时间间隔为90 s.在此参数下, 通过测量蛋白核小球藻叶绿素a荧光产量(F)和最大荧光产量(Fm)两个值, 表征PSII的荧光量子产率Y(Ⅱ), 并保证Y(Ⅱ)≥0.5, 具体如方程(1)所示.
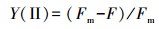 | (1) |
2.3.2 藻毒性测定方法暴露试验前3 d, 转接适量的处于对数生长期的藻种至新鲜已灭菌的培养基培养.实验时, 先利用细胞计数分析仪(Cellometer? AutoT4, Nexcelom, 美国)确定细胞浓度.每种除草剂按照2倍的系数设置10个浓度梯度, 每个浓度梯度设置3个平行.敌草隆和莠灭净浓度范围分别为0.4~200 μg·L-1和2.0~1000 μg·L-1.1% DMSO作为溶剂对照(3个平行), 超纯水作为阳性对照(3个平行).检测过程中, 将50 μL样品暴露于300 μL一定细胞浓度的藻液中, 一定暴露时间之后, 在Maxi-Imaging-PAM上测定Y(Ⅱ)值.为了避免溶液挥发造成的误差, 暴露过程中96孔板加透明盖.
对于石油废水的藻毒性检测, 将石油废水按照2倍的系数进行逐级稀释, 共10个浓度梯度(0.2%~100%, 以稀释百分数表示), 每个浓度梯度设置3个平行, 以敌草隆作为阳性对照, 1% DMSO作为溶剂对照, 超纯水作为阴性对照.在确定了暴露时的藻细胞浓度和暴露时间后, 按照上述方法进行毒性检测.
2.3.3 分析方法基于测定的Y (Ⅱ)值, 利用公式(2)计算不同浓度除草剂对藻类荧光量子产量的抑制率R.根据不同浓度的敌草隆和莠灭净引起的藻类光量子产量的抑制率变化作图, 用Origin 2017 64Bit绘制拟合曲线并得到拟合方程.不同毒物对藻类影响的最大效应(即抑制率)是不同的.本研究中, 半最大效应浓度(Concentration for 50% of maximal effect, EC50)定义为最高抑制率的50%对应的除草剂浓度.在公式(3)中, 令R=0.5, 所求C值即为EC50值.
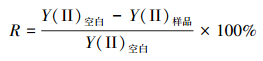 | (2) |
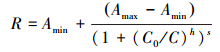 | (3) |
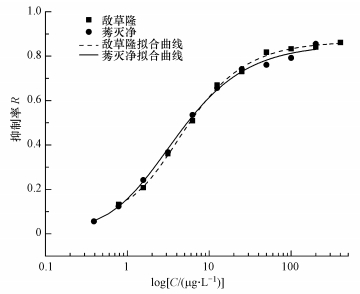 |
| 图 1 敌草隆和莠灭净剂量-效应曲线 Fig. 1Dose-effect curve of diuron and ametryn |
表 1(Table 1)
| 表 1 拟合曲线公式中各个参数值 Table 1 Parameters in the fitting curve formula | ||||||||||||||||||||||||||||
表 1 拟合曲线公式中各个参数值 Table 1 Parameters in the fitting curve formula
| ||||||||||||||||||||||||||||
从两种除草剂的剂量-效应曲线可以看出, 在低浓度时, 抑制率随敌草隆和莠灭净浓度的增加而成正比例地快速升高, 当敌草隆和莠灭净浓度达到25 μg·L-1左右时, 上升速率有所下降, 曲线趋于平缓.敌草隆的最大抑制率略高于莠灭净, 并且敌草隆和莠灭净的EC50都在几个μg·L-1的范围内.
3.2 暴露时间的确定除草剂对蛋白核小球藻的毒性测试结果受暴露时的藻细胞浓度及暴露时间的共同影响.本研究在藻细胞浓度分别为1.40×106、2.66×106、3.45×106、4.20×106、5.28×106和5.74×106 cell·mL-1条件下, 考察不同暴露时间(0.5、1、2、3、4、6 h)对敌草隆和莠灭净毒性结果的影响.在一定的藻细胞浓度下, 敌草隆和莠灭净的EC50值随着暴露时间的变化情况如图 2所示.
图 2(Fig. 2)
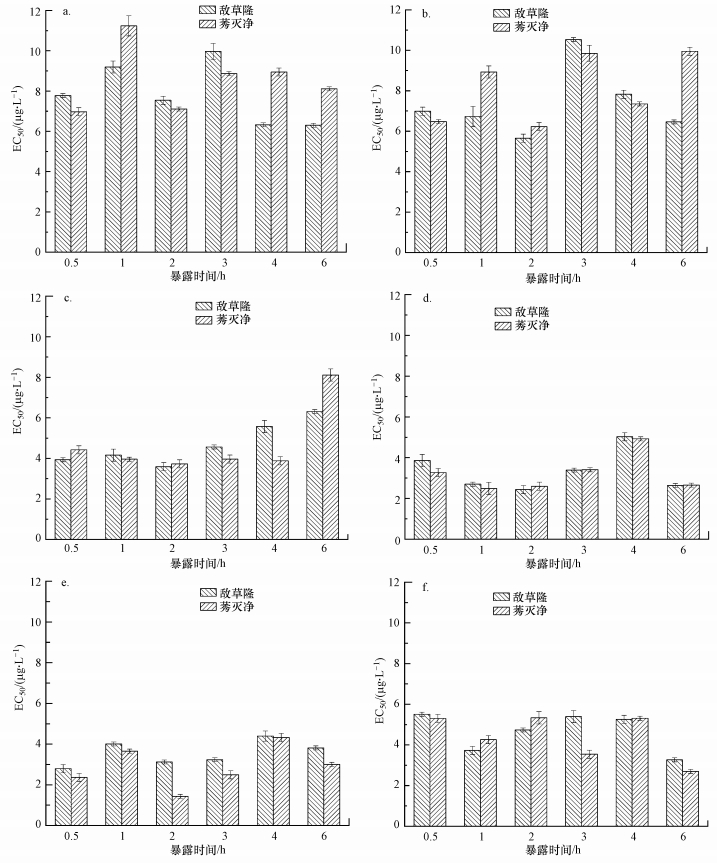 |
| 图 2 不同暴露时间下敌草隆和莠灭净的EC50值 (a.1.40×106 cell·mL-1; b.2.66×106 cell·mL-1; c.3.45×106 cell·mL-1; d. 4.20×106 cell·mL-1; e.5.28×106 cell·mL-1; f.5.74×106 cell·mL-1) Fig. 2The EC50 values of diuron and ametryn under different exposure time (a.1.40×106 cell·mL-1; b.2.66×106 cell·mL-1; c.3.45×106 cell·mL-1; d.4.20×106 cell·mL-1; e.5.28×106 cell·mL-1; f.5.74×106 cell·mL-1) |
当藻细胞浓度低于5.28×106 cell·mL-1时, 暴露时间为2 h时敌草隆和莠灭净的EC50值相对较小, 敌草隆EC50值在2.50~8.00 μg·L-1范围内波动, 莠灭净EC50值在1.50~7.50 μg·L-1范围内波动.并且在一定的藻细胞浓度下, 随着暴露时间的延长, 两种农药的EC50值有增大的趋势.但当藻细胞浓度高于5.28×106 cell·mL-1时, 暴露时间为6 h时两种农药的EC50值最低.这可能是由于在相同农药浓度下, 藻细胞浓度较高时, 单个藻细胞受到敌草隆胁迫的浓度较低, 所以需要较长的暴露时间才能显现出敌草隆对小球藻的影响.但暴露时间过长, 样品挥发量大, 很容易导致检测结果不准确.总之, 当藻细胞浓度低于5.28×106 cell·mL-1时, 2 h时对应的EC50值最低, 小球藻对于除草剂更加敏感.因此, 建议采纳暴露时间为2 h.
3.3 藻细胞浓度的确定当暴露时间为2 h时, 不同藻细胞浓度条件下对应的两种农药的EC50值如图 3所示.随着藻细胞浓度的增加, 两种农药的EC50值都呈先降低后增加的趋势.当藻细胞浓度在1.40×106~2.66×106 cell·mL-1范围内时, 敌草隆和莠灭净的EC50值高于7 μg·L-1, 相对于3.45×106 cell·mL-1时对应的EC50要高.这可能是由于藻细胞浓度过低, 蛋白核小球藻仍未进入对数期导致的.因此, 此浓度的藻液不适宜用作毒性测试.当藻细胞浓度为3.45×106 cell·mL-1时, 敌草隆和莠灭净的EC50值最低, 分别为(4.33±0.38) μg·L-1和(3.87±0.27) μg·L-1.当藻细胞浓度≥4.20×106 cell·mL-1时, 敌草隆和莠灭净的EC50值趋于稳定, 略有下降的趋势.除了莠灭净在藻细胞浓度为4.20×106 cell·mL-1时的半最大效应浓度略高于6 μg·L-1以外, 其他藻细胞浓度所对应的半最大效应浓度都低于6 μg·L-1.由此可知, 当藻细胞浓度≤2.66×106 cell·mL-1时, 小球藻对两种除草剂的毒性不敏感, 检测效果不准确, 当小球藻浓度≥3.45×106 cell·mL-1时, 半最大效应浓度值相对较低, 毒性检测灵敏, 结果准确.因此, 采用叶绿素荧光技术测试污染物的藻毒性时, 最适宜的藻细胞浓度在3.45×106~5.28×106 cell·mL-1, 藻细胞浓度过低对实验结果的影响较大.
图 3(Fig. 3)
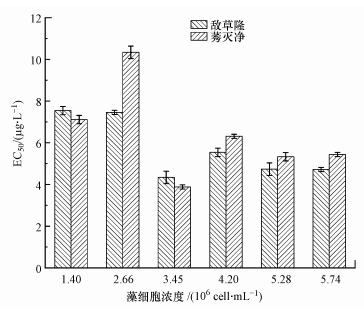 |
| 图 3 不同藻细胞浓度条件下对应的敌草隆和莠灭净的藻毒性测试结果 Fig. 3Results of algae toxicity test for diuron and ametria under different algal density |
在藻细胞浓度为3.45×106 cell·mL-1, 暴露时间为2 h时, 该方法检测的蛋白核小球藻对两种农药的灵敏度最高.该条件下检测的敌草隆和莠灭净的EC50值分别为(4.33±0.38) μg·L-1和(3.87±0.27) μg·L-1.为了将本研究建立的方法与传统的基于藻细胞计数的毒性检测方法进行比较, 利用USEPA ECOSAR软件预测暴露96 h时敌草隆和莠灭净对绿藻的EC50值分别为169 μg·L-1和50 μg·L-1, 这比本研究的检测结果高很多.Alexandre Camuel等(2017)通过记录藻生长浓度测得敌草隆96 h-EC50值为95.57 μg·L-1.Ma等(2003)使用UV-2401PC在680 nm处测绿藻浓度, 得到莠灭净96 h-EC50值为150 μg·L-1.与传统的检测方法相比, 本研究建立并优化的方法对除草剂更为灵敏, 并且该方法所需要的样品量只有50 μL, 检测时间也由传统的96 h缩短为2 h, 且采用微孔板可进行大批量检测.
3.4 石油废水检测将建立的藻毒性检测方法应用于某石油废水的藻毒性检测中, 按照优化的实验条件重复测定3次.由于该石油废水具有较高的植物毒性, 因此, 样品的浓度(C)以稀释百分数表示.石油废水的稀释百分数与抑制率之间的关系如图 4所示, 拟合曲线仍符合logit方程(R2=0.997).从图 4可以看出, 3次测量结果基本不变, 该石油废水的最高抑制率为80%, EC50值为1.03%±0.07%(稀释百分数).以敌草隆为阳性对照, 以EC50敌草隆/EC50样品公式计算出该石油废水的植物毒性相当于414.96 μg·L-1的敌草隆的毒性, 表明该石油废水具有极高的植物毒性.该方法适用于废水样品的毒性检测, 并表现出很好的重现性.
图 4(Fig. 4)
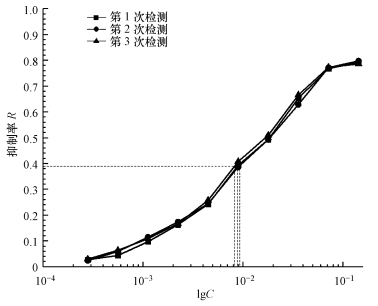 |
| 图 4 石油废水剂量效应曲线 Fig. 4Dose-effect curves of petroleum wastewater |
4 结论(Conclusions)1) 本研究确定的最适实验条件为:50 μL样品暴露于藻细胞密度为3.45×106~5.28×106 cell·mL-1的300 μL新鲜培养的藻液中, 暴露时间为2 h.该方法对实际废水的藻类毒性检测具有很好的可应用性.
2) 敌草隆和莠灭净的剂量-效应曲线符合logit方程, 在两种除草剂浓度较低时, 抑制率随着除草剂浓度的增加呈直线上升, 当除草剂浓度较高时, 抑制率升高趋于平缓, 并逐渐达到最大值.敌草隆和莠灭净的最高抑制率分别为93.99%和86.08%, 对应的EC50值分别为(4.33±0.38) μg·L-1和(3.87±0.27) μg·L-1.
3) 本研究方法具有灵敏度高、重现性好、测试时间短、可进行大批量测试等优点, 该方法的建立与优化可为基于叶绿素荧光技术的藻毒性标准方法的建立提供依据.
参考文献
| Alexandre Camuel A, Guieysse B, Cynthia Alcántara, et al. 2017. Fast algal eco-toxicity assessment:Influence of light intensity and exposure time on Chlorella vulgaris inhibition by atrazine and DCMU[J]. Ecotoxicology & Environmental Safety, 140: 141. |
| Cedergreen N, Kudsk P, Mathiassen S K, et al. 2007. Combination effects of herbicides on plants and algae:do species and test systems matter[J]. Pest Management Science, 63(3): 282–295.DOI:10.1002/(ISSN)1526-4998 |
| 丛佳.2017.污水处理厂二级出水回用于景观用水的生物安全性评价[D].天津: 天津理工大学http://cdmd.cnki.com.cn/Article/CDMD-10060-1017814783.htm |
| 杜丽娜, 曹宇, 穆玉峰, 等. 2014. 羊角月牙藻在制药废水毒性评价中的应用[J]. 环境科学研究, 2014, 27(12): 1525–1531. |
| Fait G, Balderacchi M, Ferrari F, et al. 2010. A field study of the impact of different irrigation practices on herbicide leaching[J]. European Journal of Agronomy, 32(4): 280–287.DOI:10.1016/j.eja.2010.02.001 |
| Focazio M J, Kolpin D W, Barnes K K, et al. 2008. A national reconnaissance for pharmaceuticals and other organic wastewater contaminants in the United States-Ⅱ) Untreated drinking water sources[J]. Science of the Total Environment, 402(2): 201–216. |
| Forsberg C G. 1972. Algal assay procedure[J]. Journal, 44(8): 1623–1628. |
| 葛会林, 刘树深, 苏冰霞. 2014. 通用浓度加和模型预测有机磷与三嗪农药对绿藻的联合毒性[J]. 中国环境科学, 2014, 34(9): 2413–2419. |
| 黄飞羽, 段招财, 林彦伶, 等. 2017. 饮用水的细菌及藻类检测与卫生调查[J]. 基层医学论坛, 2017, 21(25): 3437–3438. |
| Hasenbein S, Peralta J, Lawler S P, et al. 2017. Environmentally relevant concentrations of herbicides impact non-target species at multiple sublethal endpoints[J]. Science of the Total Environment, 607-608: 733–743.DOI:10.1016/j.scitotenv.2017.06.270 |
| Hillebrand O, N?dler K, Geyer T, et al. 2014. Investigating the dynamics of two herbicides at a karst spring in Germany:Consequences for sustainable raw water management[J]. Science of the Total Environment, 482-483(3): 193–200. |
| 刘威.2015.阿特拉津对地表饮用水源水质影响评价及毒理研究[D].长春: 东北师范大学http://cdmd.cnki.com.cn/Article/CDMD-10200-1015419185.htm |
| Ma J, Lin F, Wang S, et al. 2003. Toxicity of 21 herbicides to the green alga Scenedesmus quadricauda[J]. Bulletin of Environmental Contamination & Toxicology, 71(3): 594. |
| Ma J, Xu L, Wang S, et al. 2002. Toxicity of 40 herbicides to the green alga Chlorella vulgaris[J]. Ecotoxicology & Environmental Safety, 51(2): 128. |
| Meyer M T, Thurman E M. 2012. Herbicide metabolites in surface water and groundwater[J]. Organic Letters, 14(16): 4035–4037.DOI:10.1021/ol301932d |
| Muller R, Schreiber U, Escher B I, et al. 2008. Rapid exposure assessment of PSⅡ herbicides in surface water using a novel chlorophyll a, fluorescence imaging assay[J]. Science of the Total Environment, 401(1): 51–59. |
| 钱海丰, 陈思, 金瑜剑. 2017. 藻类在除草剂生物毒性安全评估中的应用[J]. 浙江工业大学学报, 2017, 45(1): 32–36.DOI:10.3969/j.issn.1006-4303.2017.01.007 |
| Schreiber U, Müller J F, Haugg A, et al. 2002. New type of dual-channel PAM chlorophyll fluorometer for highly sensitive water toxicity biotests[J]. Photosynthesis Research, 74(3): 317–330.DOI:10.1023/A:1021276003145 |
| Sjollema S B, van Beusekom S A, Hg V D G, et al. 2014. Laboratory algal bioassays using PAM fluorometry:Effects of test conditions on the determination of herbicide and field sample toxicity[J]. Environmental Toxicology & Chemistry, 33(5): 1017–1022. |
| 史媛, 王英才, 李晔, 等. 2013. 基于藻类荧光的毒性测试研究进展[J]. 环境科学与技术, 2013, 13(3): 59–64. |
| 王丽, 应波, 鄂学礼. 2008. 水中敌草隆的叶绿素荧光检测法[J]. 环境与健康杂志, 2008, 25(6): 539–541.DOI:10.3969/j.issn.1001-5914.2008.06.022 |
| 严登华, 何岩, 王浩. 2005. 东辽河流域地表水体中Atrazine的环境特征[J]. 环境科学, 2005, 26(3): 203–208.DOI:10.3321/j.issn:0250-3301.2005.03.041 |
| 叶丹, 陈洁, 袁琳, 等. 2014. 除草剂对3种绿藻的毒性测试研究[J]. 人民长江, 2014, 2014(18): 82–86. |
| 虞龙, 苗秀珍, 于洋, 等. 2010. 应用新型调制荧光成像系统(Imaging-PAM)原位评估底泥毒性的方法[J]. 环境化学, 2010, 29(6): 1116–1120. |
