 , 王泽夏2, 晏彪2
, 王泽夏2, 晏彪2

1. 湖北中医药大学检验学院, 武汉 430065;
2. 湖北科技学院基础医学研究中心, 咸宁 437100
收稿日期: 2018-06-26; 修回日期: 2018-07-19; 录用日期: 2018-07-19
基金项目: 湖北省卫生计生委面上项目(No.WJ2017M166);湖北省教育厅科学技术研究项目(No.B2018172)
作者简介: 梁冯(1982-), 女, E-mail:32182721@qq.com
通讯作者(责任作者): 晏彪(1988—),男,硕士,讲师,主要研究方向:环境医学和分子毒理学.E-mail:e21yanbiao@sina.cn
摘要: 为探究nuclear factor-κB(NF-κB)通路及其分子事件相关蛋白参与邻苯二甲酸二丁酯(dibutyl-phthalate,DBP)诱导神经毒性的作用机制,以人胶质瘤细胞U251为对象,设置6个实验组:Control组,Tween 80组(阳性对照组)、25 μmol·L-1 DBP组、100 μmol·L-1 DBP组、20 μmol·L-1维生素E(vitamin E,VE)组、100 μmol·L-1 DBP+20 μmol·L-1 VE组.U251细胞经不同处理组分别暴露12 h及24 h后,观察细胞形态学结晶紫染色结果,检测细胞活性(CCK-8)、活性氧(reactive oxygen species,ROS)、丙二醛(malondialdehyde,MDA)、氧化应激转录因子NF-κB,以及NF-κB通路相关蛋白钙调神经磷酸酶(calcineurin,CaN)、泛素特异性蛋白酶14(ubiquitin-specific protease 14,USP14)、胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor,GDNF)的表达水平.与对照组相比,100 μmol·L-1 DBP组U251细胞的数量降低,细胞损伤,CCK-8降低,ROS、MDA含量显著升高,NF-κB水平显著升高,CaN、USP14表达均升高,GDNF表达降低,差异均有统计学意义(p < 0.05,p < 0.01);加入抗氧化剂VE处理后,与100 μmol·L-1 DBP组相比,100 μmol·L-1 DBP+20 μmol·L-1 M VE组U251细胞的数量增多,细胞损伤得到缓解,CCK-8上升,ROS、MDA含量显著降低,NF-κB水平显著降低,CaN、USP14表达均降低,GDNF表达增加,差异均有统计学意义(p < 0.05,p < 0.01).NF-κB和NF-κB通路相关蛋白的水平或含量变化表明,NF-κB作为氧化应激转录因子参与DBP诱导的U251细胞毒性作用;VE作为抗氧化剂可阻断ROS的生成从而抑制NF-κB的活化,提示VE在体外对DBP介导的神经毒性具有一定的保护作用.
关键词:邻苯二甲酸二丁酯U251细胞氧化应激NF-κB神经毒性
Role of the NF-κB pathway in dibutyl phthalate mediated effects in U251 cells
LIANG Feng1
 , WANG Zexia2, YAN Biao2
, WANG Zexia2, YAN Biao2

1. School Laboratory Medicine, Hubei University of Chinese Medicine, Wuhan 430065;
2. Research Center of Basic Medical Sciences, Hubei University of Science and Technology, Xianning 437100
Received 26 June 2018; received in revised from 19 July 2018; accepted 19 July 2018
Abstract: To investigate the role of nuclear factor-κB (NF-κB) pathway and its related proteins involved in dibutyl-phthalate (DBP) induced neurotoxicity in U251 glioma cells. Six experimental groups were treated as follows:control group, Tween 80 group, 25 μmol·L-1 DBP group, 100 μmol·L-1 DBP, 20 μmol·L-1 vitamin E (VE), and 100 μmol·L-1 DBP combined with after-treatment of VE group. U251 cells were exposed to different treatment groups for 12 h and 24 h, respectively. The morphological changes of U251 cells were observed by crystal violet staining. The expression levels of CCK-8, reactive oxygen species (ROS), malondialdehyde (MDA), NF-κB (an oxidative stress transcription factor), calcineurin (CaN), ubiquitin-specific protease 14 (USP14) and glial cell line-derived neurotrophic factor (GDNF) were detected. Compared with the control group, the number of U251 cells in 100 μmol·L-1 DBP group was decreased, the contents of ROS and MDA were significantly increased (p < 0.05, p < 0.01), the expression of CaN and USP14 were significantly increased (p < 0.05, p < 0.01), and the expression of GDNF was decreased (p < 0.05, p < 0.01), respectively. After the antioxidant VE was added to the treatment, compared with the100 μmol·L-1 DBP group, the number of U251 cells in 100 μmol·L-1 DBP + 20 μmol·L-1 VE group was increased, the cell damage was alleviated, the content of ROS and MDA were significantly decreased (p < 0.05, p < 0.01), and the expression of CaN and USP14 were decreased significantly (p < 0.05, p < 0.01), and the expression of GDNF was increased (p < 0.05, p < 0.01). The changes of NF-κB and NF-κB pathway related proteins suggest that NF-κB, as an oxidative stress transcription factor, is associated with the cytotoxicity of U251 cells induced by DBP. And VE can inhibit the activation of NF-κB by blocking the production of ROS, suggesting that VE has a protective effect on neurotoxicity mediated by DBP in vitro.
Keywords: dibutyl phthalateU251 cellsoxidative stressnuclear factor-κBneurotoxicity
1 引言(Introduction)据报道,环境污染物可影响人类的神经行为,并诱导相关的神经疾病(Kobrosly et al., 2014).特别对婴幼儿这类人群而言,他们的大脑尚未完全发育成熟,因而对暴露物更加敏感,增加了罹患神经疾病的风险(Miodovnik, 2011).邻苯二甲酸酯(phthalates, PAEs)是一类典型的人工合成化学品,是重要的塑料添加剂,广泛应用于日常生活用品,包括食品包装和医疗应用材料(Sathyanarayana et al., 2008).然而,PAEs往往易从使用、加工过程中溢出到环境中(Xu et al., 2009),婴幼儿通过日常饮食、吸入和皮肤接触PAEs可能导致一些健康问题,其中就包括神经毒性(Shea, 2003; Miodovnik et al., 2014).Cho等(2010)的研究表明,PAEs的暴露可以显著降低小学生的学习成绩和智商测量值.李桉琪等(2013)报道,淮河流域沙颍河段PAEs污染区儿童智力低于未污染区儿童的平均水平.
作为PAEs的一类主要物质,邻苯二甲酸二丁酯(dibutyl phthalate, DBP)在日常生活中也是普遍存在的环境污染物(Koch et al., 2003),其潜在的脑神经毒性最近受到越来越多的关注.最新研究表明(Wojtowicz et al., 2017),DBP可以通过胎盘和血脑屏障而作用于脑组织.此外,胶质瘤细胞在人类神经系统中特别容易受到外源性刺激,易致肿瘤或发育神经毒性(Huang et al., 1993; Li and Rossman, 2001),然而有关DBP对胶质瘤细胞的作用研究还相对较少,DBP在神经系统中的作用机制尚不清楚.
大量研究表明(Li et al., 2013; Yan et al., 2016),氧化应激在DBP诱导实验动物的神经毒性中发挥关键的作用.核因子κB(NF-κB)是一种氧化应激转录因子,具有广泛的生物学活性,参与细胞增殖和凋亡的多种生理和病理过程(Schieber and Chandel, 2014),提示NF-κB途径很有可能参与DBP诱导的神经毒性.为此,本研究以人胶质瘤细胞U251为对象,检测DBP对U251细胞的毒性、氧化损伤水平及NF-κB通路相关蛋白,包括钙调神经磷酸酶(calcineurin, CaN)、泛素特异性蛋白酶14(ubiquitin-specific protease 14, USP14)、胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor, GDNF),以探究NF-κB途径及其分子事件相关蛋白参与DBP诱导神经毒性的作用机制.
2 材料和方法(Materials and methods)2.1 主要仪器与试剂CO2培养箱(美国Thermo),SWCJ2D超净工作台(苏州净化),Eclipse TE2000-S倒置显微镜(日本尼康), ELX 800酶标仪(美国Bio-Teck),Hide Chameleon V荧光酶标仪(芬兰Hidex).DBP(≥99%,CAS:84-74-2)、维生素E(Vitamin E, VE)、2′, 7′-二氯二氢荧光素二乙酸酯(DCFH-DA)、2-硫代巴比妥酸(TBA)购于美国Sigma公司,Tween-80 (CAS: 9005-65-6)购于美国Amresco公司,DMEM培养基、胎牛血清购于美国Gibco公司,CaN和USP14人源性ELISA试剂盒购于上海Blue Gene公司,GDNF和NF-κB人源性ELISA试剂盒购于美国eBioscience公司.
2.2 细胞与细胞培养人胶质瘤细胞系U251,购于武汉大学中国典型培养物保藏中心.U251细胞在含10%胎牛血清的DMEM培养基中分别培养12 h和24 h(培养条件为37 ℃、5%CO2).采用常规胰酶消化法制备U251细胞悬液,以1×104 cells·孔-1密度置于96孔板中,然后检测细胞活性和相关指标.
2.3 实验分组根据Zhang等(2016)的研究,选择DBP的暴露剂量为25、100 μmol·L-1.根据Johnson等(2017)的研究,选择VE的剂量为20 μmol·L-1.实验分组为:a: Control; b: Tween 80; c: 25 μmol·L-1 DBP; d: 100 μmol·L-1 DBP; e: 20 μmol·L-1 VE; f: 20 μmol·L-1 VE + 100 μmol·L-1 DBP.DBP溶解于Tween 80中,然后以1:1体积比用无血清培养基稀释至不同实验浓度(25 μmol·L-1、100 μmol·L-1),Dimitrov等(2011)已证明Tween 80是惰性的.VE用无血清培养基稀释至20 μmol·L-1,作为抗氧化剂,在混合组中,经DBP暴露30 min后再加入VE处理细胞.
2.4 实验指标测定2.4.1 细胞活性检测Cell Counting Kit-8简称CCK-8,是一种基于WST-8的广泛应用于细胞增殖和细胞毒性的快速高灵敏度检测试剂盒,间接反映活细胞数量.将不同处理组的U251细胞分别置于96孔板中培养12 h和24 h,然后添加10 μL CCK-8试剂(10 μL CCK-8溶于90 μL PBS)在黑暗条件下孵育2 h,酶标仪测定波长450 nm时的吸光度.
2.4.2 细胞形态学检查将U251细胞与上述不同处理组共培养,细胞分别暴露12、24 h后,用PBS快速洗涤两次,去除悬浮物,室温下用4%多聚甲醛固定1 h,然后用结晶紫染色(Chiba et al., 1998),最后用倒置显微镜观察细胞形态.
2.4.3 细胞氧化应激水平检测细胞内ROS水平通过与2′, 7′-二氯荧光素(DCF)反应的荧光强度来测定,将不同处理组的U251细胞分别置于96孔板中培养12 h和24 h,吸弃染毒液,用PBS重悬.将10 mmol·L-1的DCFH-DA荧光染料用PBS缓冲液稀释1000倍,加入100 μL待测细胞重悬液混匀,37 ℃避光孵育5 min,用荧光酶标仪检测485 nm激发光、528 nm发射光的荧光强度,以相对荧光单位(RFU)表示荧光强度.MDA可与2-硫代巴比妥酸(TBA)在高温(90~100 ℃)下形成稳定的显色产物而被测定,简言之,取0.5 mL细胞上清液于10 mL离心管中,加入0.6%TBA溶液沸水浴15 min,冷却后取1 mL,10000 g离心10 min,取上清液100 μL于酶标板中测其在450、532、600 nm的OD值(OD450、OD532、OD600).MDA含量(μmol·mg-1)=[6.45(OD532-OD600)-0.56OD600](μmol·L-1)×样本稀释倍数/待测匀浆蛋白浓度(mg·mL-1),Folin-酚法测定蛋白质含量.上述检测方法参照Yan等(2016)的方法进行.
2.4.4 NF-κB通路相关蛋白的测定严格按照ELISA试剂盒说明,检测细胞上清中NF-κB浓度、CAN活性、USP14活性和GDNF浓度,其灵敏度分别为100~2000 ng·L-1、2.5~85 IU·L-1、10 ~400 IU·L-1、10 pg·mL-1.
2.5 统计学分析实验数据均为x±s,采用GraphPad Prism 5.02 (GraphPadSoftwareInc.,CA,USA)软件进行数据处理,采用单因素方差分析(ANOVA)和LSD-t检验分析两组间的差异,p<0.05,表示差异有统计学意义.
3 结果(Results)3.1 DBP降低U251细胞活性CCK-8测定结果显示不同处理组U251细胞活性的影响,如图 1所示.与对照组相比,12 h与24 h 100 μmol·L-1 DBP暴露组的细胞活性降低,差异均有统计学意义(p<0.01), 表明此浓度下的DBP对U251细胞活性有抑制作用.加入VE处理后,与100 μmol·L-1 DBP组比较,100 μmol·L-1 DBP+20 μmol·L-1 VE组细胞活力明显增高,差异均有统计学意义(p<0.01,p<0.05),表明抗氧化剂VE对DBP诱导的细胞毒性有保护作用.
图 1(Fig. 1)
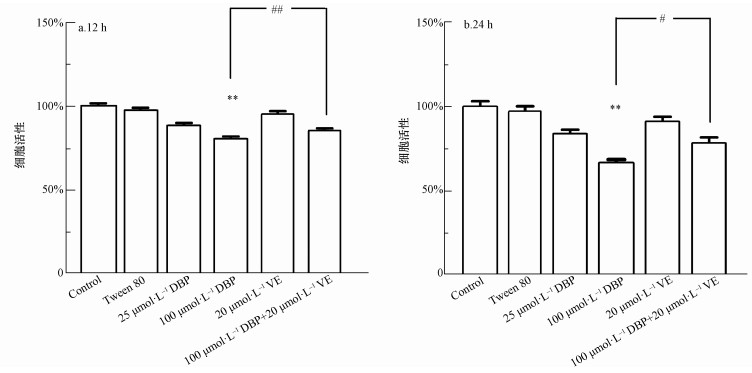 |
| 图 1 不同处理组U251细胞活性的影响(n=6)(a.暴露12 h;b.暴露24 h) 注:100 μmol·L-1 DBP暴露组与对照组比较,** p<0.01, ##p <0.01;与100 μmol·L-1 DBP+20 μmol·L-1 VE组比较,** p<0.01, # p<0.05,下同. Fig. 1The viability of U251 cells in different treatment groups (n=6) (a. 12 h, b. 24 h) Note: 100 μmol·L-1 DBP exposure group compared with control group, ** p < 0.01, ##p < 0.01; compared with 100 μmol·L-1 DBP + 20 μmol·L-1 VE group, ** p < 0.01, # p < 0.05, the same below. |
3.2 DBP诱导U251细胞损伤U251细胞经不同处理组24 h暴露后的形态学观察结果如图 2所示.对照组U251细胞的形态结构基本正常,树突形态未发生变化(图 2a);随着DBP暴露浓度的增加,U251细胞的树突形态发生显著变化(图 2b,2c),100 μmol·L-1 DBP组部分U251细胞核固缩明显,且细胞数量减少(图 2c);加入VE处理后,与100 μmol·L-1 DBP组比较,100 μmol·L-1 DBP+20 μmol·L-1 VE组U251细胞的形态基本正常,且细胞数量有所增加.以上结果表明,DBP暴露可致U251细胞的形态学改变和损伤,抗氧化剂VE对DBP介导的细胞损伤具有一定的保护作用.
图 2(Fig. 2)
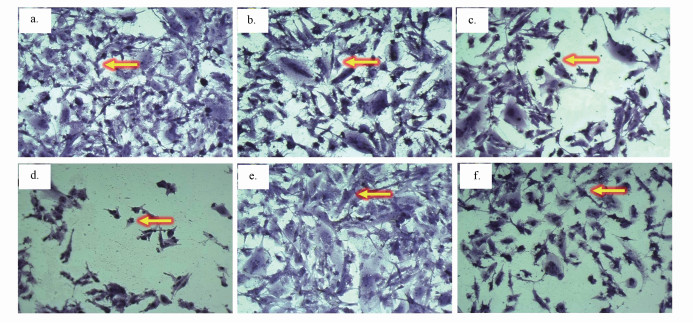 |
| 图 2 24 h后不同处理组U251细胞结晶紫染色结果(X 40)(黄色箭头表示U251细胞)(a. Control; b. Tween 80; c. 25 μmol·L-1 DBP; d.100 μmol·L-1 DBP; e. 20 μmol·L-1 VE; f. 20 μmol·L-1 VE + 100 μmol·L-1 DBP) Fig. 2Crystal violet staining results of U251 cells in different treatment groups for 24 h (X 40), (a. Control; b. Tween 80; c. 25 μmol·L-1 DBP) (d.100 μmol·L-1 DBP; e. 20 μmol·L-1 VE; f. 20 μmol·L-1 VE + 100 μmol·L-1 DBP. Yellow arrows : U251 cells) |
3.3 DBP诱导U251细胞ROS产生及脂质过氧化ROS是氧化应激最重要的生物标志物,不同处理组U251细胞ROS生成的结果如图 3所示.12 h与24 h DBP组ROS水平随DBP暴露剂量的增加而升高,与对照组比较,100 μmol·L-1 DBP组ROS含量显著升高,差异有统计学意义(p<0.05,p<0.01),表明较高剂量的DBP能造成U251细胞ROS含量的上升.经加入抗氧化剂VE处理后,与100 μmol·L-1 DBP组比较,100 μmol·L-1 DBP+20 μmol·L-1 VE组ROS相对荧光强度明显降低(p<0.01,p<0.01),表明抗氧化剂VE能降低DBP诱导U251细胞过量产生ROS.过量的活性氧引起的另一个主要结果是脂质过氧化,MDA是过氧化的最终产物,MDA含量可以反映脂质过氧化反应损伤程度.由图 4可知,U251细胞中MDA水平与DBP暴露剂量呈正相关.12 h与24 h 100 μmol·L-1 DBP组,与对照组比较,MDA含量显著升高,差异均有统计学意义(p<0.05,p<0.01);加入VE处理后,与100 μmol·L-1 DBP组比较,100 μmol·L-1 DBP+20 μmol·L-1 VE组MDA含量明显降低(p<0.01,p<0.05).以上结果表明,较高剂量的DBP可使U251细胞MDA含量明显上升,抗氧化剂VE能降低DBP诱导U251细胞过量产生MDA.
图 3(Fig. 3)
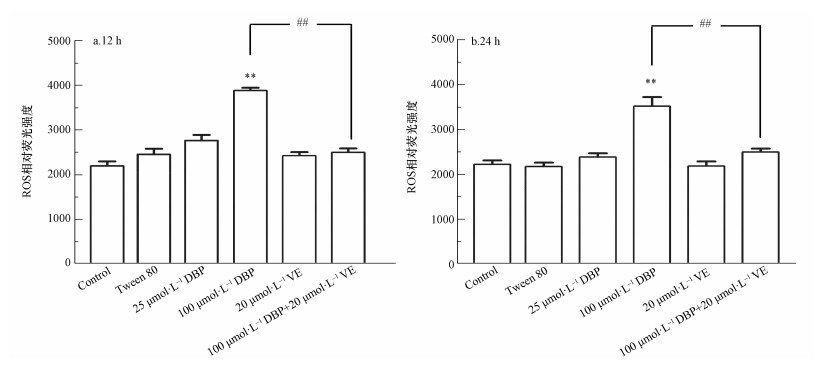 |
| 图 3 不同处理组U251细胞ROS含量的变化(n=6)(a.暴露12 h;b.暴露24 h) Fig. 3ROS content of U251 cells in different treatment groups (n=6) (a. 12 h, b. 24 h) |
图 4(Fig. 4)
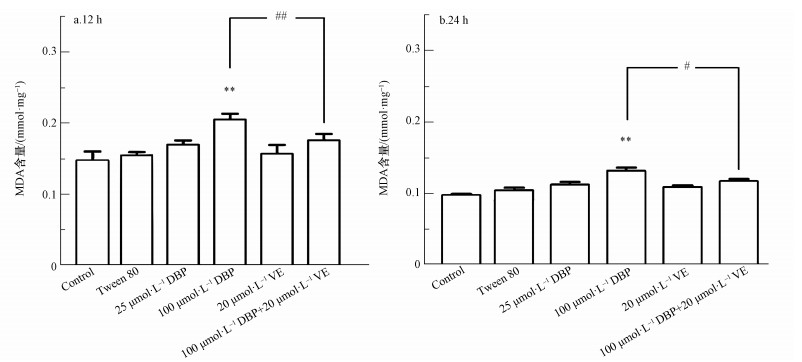 |
| 图 4 不同处理组U251细胞MDA含量的变化(n=6)(a.暴露12 h, b. 24 h) Fig. 4MDA content of U251 cells in different treatment groups (n=6) (a. 12 h, b. 24 h) |
3.4 DBP可能通过氧化应激途径激活NF-κB不同处理组U251细胞的NF-κB水平变化结果如图 5所示.12 h与24 h 100 μmol·L-1 DBP组,与对照组比较,NF-κB含量显著增加,差异均有统计学意义(p<0.01,p<0.01);加入VE处理后,与100 μmol·L-1 DBP组比较,100 μmol·L-1 DBP+20 μmol·L-1 VE组NF-κB含量明显降低(p<0.05,p<0.05).以上结果表明,NF-κB的含量与不同浓度的DBP之间存在一定的剂量依赖关系,提示DBP可能诱导NF-κB的活化;抗氧化剂VE可以降低DBP介导的NF-κB活化.
图 5(Fig. 5)
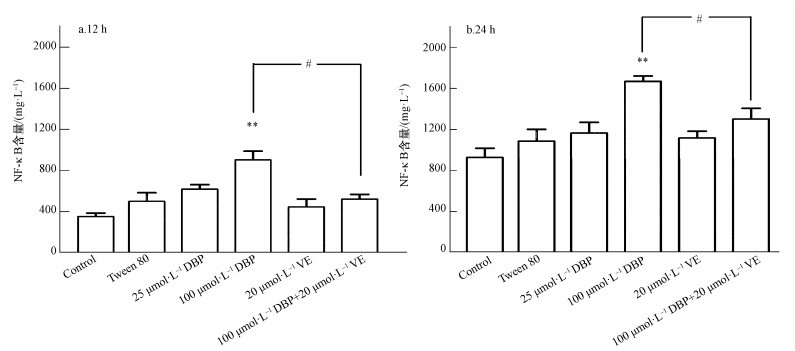 |
| 图 5 不同处理组U251细胞NF-κB水平的变化(n=6)(a.暴露12 h, b.暴露24 h) Fig. 5NF-κB level of U251 cells in different treatment groups (n=6) (a. 12 h, b. 24 h) |
3.5 CaN、USP 14参与DBP诱导的NF-κB活化不同处理组U251细胞的CaN活性变化结果如图 6所示.12 h与24 h 100 μmol·L-1 DBP组,与对照组比较,CaN活性显著升高,差异均有统计学意义(p<0.05,p<0.01);加入VE处理后,与100 μmol·L-1 DBP组比较,100 μmol·L-1 DBP+20 μmol·L-1 VE组CaN活性明显降低(p<0.01,p<0.05).以上结果表明,不同DBP浓度与CaN活性变化有一定的关系,抗氧化剂VE可以降低DBP介导的CaN活性.
图 6(Fig. 6)
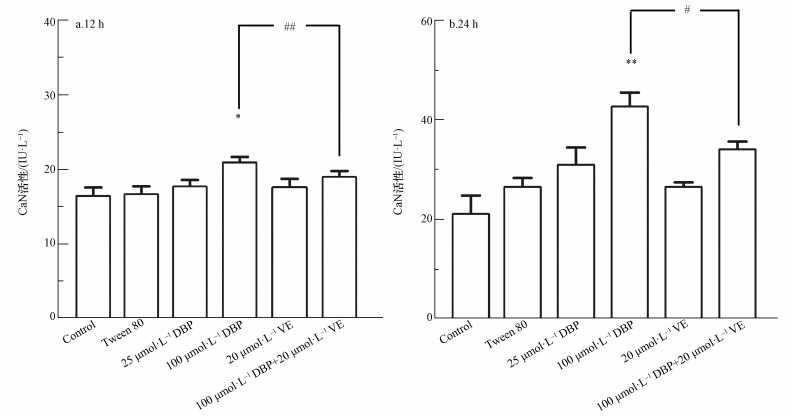 |
| 图 6 不同处理组U251细胞CaN活性的变化(n=6)(a.暴露12 h, b.暴露24 h) Fig. 6CaN activity of U251 cells in different treatment groups (n=6) (a. 12 h, b. 24 h) |
不同处理组U251细胞的USP14活性变化结果如图 7所示.12 h与24 h 100 μmol·L-1 DBP组,与对照组比较,USP14活性显著升高,差异均有统计学意义(p<0.05,p<0.01);加入VE处理后,与100 μmol·L-1 DBP组比较,100 μmol·L-1 DBP+20 μmol·L-1 VE组USP14活性明显降低(p<0.05,p<0.05).以上结果表明,不同DBP浓度与USP14活性变化有一定的关系,抗氧化剂VE可以降低DBP介导的USP14活性.
图 7(Fig. 7)
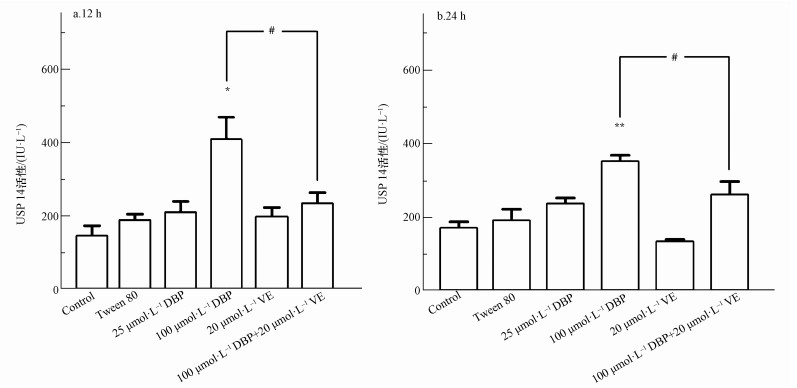 |
| 图 7 不同处理组U251细胞USP14活性的变化结果(n=6)(a.暴露12 h, b.暴露24 h) Fig. 7USP14 activity of U251 cells in different treatment groups (n=6) (a. 12 h, b. 24 h) |
3.6 DBP诱导NF-κB活化释放GDNF不同处理组U251细胞的GDNF水平变化结果如图 8所示.12 h与24 h 100 μmol·L-1 DBP组,与对照组比较,GDNF含量显著降低,差异均有统计学意义(p<0.01,p<0.01);加入VE处理后,与100 μmol·L-1 DBP组比较,100 μmol·L-1 DBP+20 μmol·L-1 VE组GDNF含量明显降低(p<0.05,p<0.05).以上结果表明,GDNF的含量与不同浓度的DBP之间存在一定的剂量依赖关系,提示DBP可介导GDNF的释放;抗氧化剂VE可以抑制DBP介导的GDNF释放.
图 8(Fig. 8)
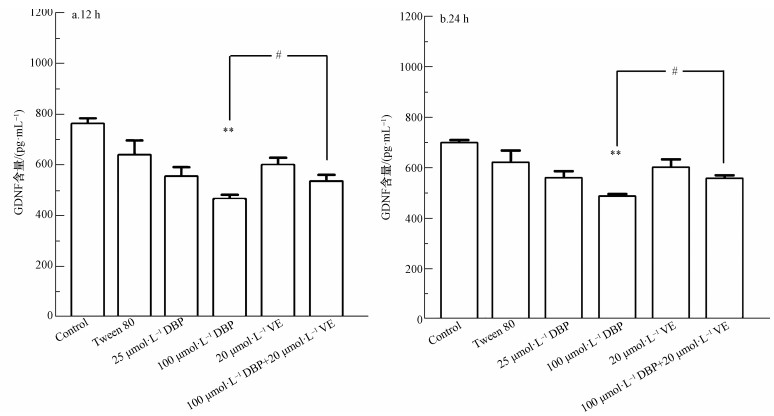 |
| 图 8 不同处理组U251细胞GDNF水平的变化(n=6)(a.暴露12 h, b.暴露24 h) Fig. 8GDNF level of U251 cells in different treatment groups (n=6) (a. 12 h, b. 24 h) |
4 讨论(Discussion)一些流行病学调查显示,人类暴露于DBP可导致潜在的神经疾病风险,如智力障碍、神经行为变化和神经内分泌紊乱等(Cho et al., 2010; Kobrosly et al., 2014; Miodovnik et al., 2014),部分动物实验数据也支持上述观点,Li等(2013)的研究表明,围产期暴露DBP可通过诱导脑海马细胞凋亡、突触丢失和突触功能障碍而导致新生和未成熟仔鼠出现神经毒性,但当前DBP的神经毒性机制有待进一步阐明.基于前期的研究(Yan et al., 2016),我们报道了较高剂量(25或125 mg·kg-1·d-1)的DBP可介导氧化应激对小鼠神经行为产生影响,而中枢神经系统的损伤是DBP暴露的终点效应之一.其他研究也报道(Wojtowicz et al., 2017),氧化应激在DBP介导的神经毒性中起着至关重要的作用,而NF-kB作为一种重要的氧化应激反应转录因子,是否有可能参与其过程,目前尚未得到研究证实.故本实验首次探究不同剂量DBP暴露下对U251细胞的影响,为揭示NF-κB途径及其分子事件相关蛋白参与DBP诱导神经毒性的作用机制提供实验依据.
根据我们的实验结果,经DBP暴露后,U251细胞内ROS水平和MDA含量升高,且有一定剂量效应,提示DBP诱导U251细胞出现氧化应激反应.氧化应激过程是由DBP引起的一种上游毒性事件,伴有ROS的过量产生,对包括脂质、细胞膜、蛋白质和DNA在内的细胞结构造成损伤.ROS的积累加剧了氧化应激,最终可能导致病理变化并导致细胞功能障碍(Ma et al., 2014; Wu et al., 2017).
其损伤机制与氧化应激反应转录因子有关.NF-κB在神经细胞的增殖过程中起着重要的作用,参与了神经细胞的多种病理状态(Morgan and Liu, 2011).一些研究表明(O′Neill et al., 1997),NF-κB是ROS对胶质细胞功能的重要靶点,NF-κB的激活可由ROS和钙信号等多种因素引起(Schreck et al., 1991).本实验结果表明,DBP刺激U251细胞使ROS水平升高,导致细胞内NF-κB水平显著升高,但加入抗氧化剂VE后,胞内NF-κB水平显著下降,提示DBP可能通过ROS激活NF-κB通路.在非刺激细胞中,NF-κB与胞质中抑制剂I-κB紧密结合而不发挥活性.然而,当DBP作为外源性刺激使NF-κB从I-κB中分离出来,使NF-κB转移到细胞核,并通过不同的胞内级联反应调控基因表达,从而引起下游分子事件的改变;一旦NF-κB通路被激活,这种导致核转位和抗凋亡基因表达调控的神经退行性疾病就会发生(Mincheva-Tasheva and Soler, 2013).
钙调神经磷酸酶(CaN)是一种Ca2+/钙调蛋白依赖性蛋白磷酸酶,主要分布于神经组织,并在许多调节蛋白、信号通路中发挥作用(J?rgensen et al., 2003).有研究表明(Wang et al., 1999; Xin et al., 2017),CaN参与了NF-κB的激活过程,高活性的CaN可诱导细胞凋亡.本实验结果表明,DBP可导致U251细胞内CaN活性显著增高,但加入抗氧化剂VE后,胞内CaN活性显著下降,提示CaN可能参与了神经胶质细胞NF-κB被DBP激活的过程.泛素特异性蛋白酶14(USP14)是一种参与维持正常神经功能和氧化应激反应的脱泛素酶,调节细胞增殖和凋亡以及NF-κB信号的激活,USP14通过脱泛素调节靶蛋白的降解,并通过NF-κB途径对肿瘤和神经系统疾病的发生和发展产生影响(Lee et al., 2009).本实验结果表明,DBP暴露组USP14的活性明显升高,这一趋势与氧化应激的增加以及NF-κB的激活相一致.Mialki等(2013)提出,USP14蛋白酶的过度表达降低了I-κB蛋白水平,增加了细胞因子在肺上皮细胞中的释放.这提示,USP14可能参与了DBP激活NF-κB的过程.其他研究也指出(Tanaka et al., 2008),胶质细胞源性神经营养因子(GDNF)与原代大鼠胶质细胞NF-κB通路有关,提示NF-κB的激活伴有GDNF的释放.本实验结果表明,DBP可使U251细胞内NF-κB水平显著增高,导致细胞内GDNF含量的显著降低,但加入抗氧化剂VE后,胞内GDNF含量显著上升,提示DBP激活NF-κB通路促进GDNF的释放.越来越多的证据表明(Kordower et al., 2000; Cao et al., 2008),GDNF的总体水平与神经保护作用的增强是相伴而生的;相反,它的衰减会损害对正常细胞结构的保护.Kordower等(2000)发现GDNF慢病毒载体在帕金森病灵长类动物模型中可以预防神经变性.CaO等(2008)还发现p65/p52 NF-κB参与了GDNF对PD早期大鼠多巴胺能神经元的影响,说明GDNF具有神经保护作用.
此外,细胞形态结果显示,DBP降低U251细胞活性,并介导产生细胞毒性.DBP + VE混合组与DBP单独暴露组比较发现,加入抗氧化剂VE处理后,U251细胞的细胞损伤得到一定程度的保护.文献报道证实(Lo et al., 2013),VE可抑制NF-κB的激活,从而发挥神经保护作用.本实验结果表明,VE作为非酶抗氧化剂,能有效地阻断DBP引起的氧化应激,降低细胞内ROS和MDA的生成,抑制NF-κB的激活,减轻细胞或细胞结构的损伤.提示,VE可能在一定程度上减轻DBP介导的神经毒性.
5 结论(Conclusions)综上所述,细胞活力和氧化应激水平的检测显示了DBP诱导细胞毒性的潜在风险.NF-κB和NF-κB通路相关蛋白的水平或含量变化表明NF-κB参与DBP介导的细胞毒性作用.VE作为抗氧化剂可阻断ROS的生成从而抑制NF-κB的活化,提示VE在体外对DBP介导的神经毒性具有一定的保护作用.本研究的结果,可为更全面地了解DBP的神经毒性作用,以及DBP诱导的相关神经疾病的治疗靶点提供基本的实验依据.
参考文献
| Cao J P, Wang H J, Yu J K, et al. 2008. The involvement of NF-kappaB p65/p52 in the effects of GDNF on DA neurons in early PD rats[J]. Brain Research Bulletin, 76(5): 505–511.DOI:10.1016/j.brainresbull.2008.03.007 |
| Chiba K, Kawakami K, Tohyama K. 1998. Simultaneous evaluation of cell viability by neutral red, MTT and crystal violet staining assays of the same cells[J]. Toxicology in Vitro, 12(3): 251–258.DOI:10.1016/S0887-2333(97)00107-0 |
| Cho S C, Bhang S Y, Hong Y C, et al. 2010. Relationship between environmental phthalate exposure and the intelligence of school-age children[J]. Environmental Health Perspectives, 118(7): 1027–1032.DOI:10.1289/ehp.0901376 |
| Dimitrov M, Nikolova I, Benbasat N, et al. 2011. Acute toxicity, antidepressive and mao inhibitory activity of mangiferin isolated from hypericum aucheri[J]. Biotechnology & Biotechnological Equipment, 25(4): 2668–2671. |
| Huang J, Kato K, Hashimoto K, et al. 1993. Neuron and glial cell marker proteins as indicators of heavy metal-induced neurotoxicity in neuroblastoma and glioma cell lines[J]. Archives of Toxicology, 67(7): 491–496.DOI:10.1007/BF01969920 |
| Johnson E A, Shvedova A A, Kisin E, et al. 2002. d-MDMA during vitamin E deficiency:effects on dopaminergic neurotoxicity and hepatotoxicity[J]. Brain Research, 933(2): 150–163.DOI:10.1016/S0006-8993(02)02313-2 |
| J?rgensen K A, Koefoednielsen P B, Karamperis N. 2003. Calcineurin phosphatase activity and immunosuppression. A review on the role of calcineurin phosphatase activity and the immunosuppressive effect of cyclosporin A and tacrolimus[J]. Scandinavian Journal of Immunology, 57(2): 93–98.DOI:10.1046/j.1365-3083.2003.01221.x |
| Kobrosly R W, Evans S, Miodovnik A, et al. 2014. Prenatal phthalate exposures and neurobehavioral development scores in boys and girls at 6~10 years of age[J]. Environmental Health Perspectives, 122(5): 521–528.DOI:10.1289/ehp.1307063 |
| Koch H M, Drexler H, Angerer J. 2003. An estimation of the daily intake of di(2-ethylhexyl)phthalate (DEHP) and other phthalates in the general population[J]. International Journal of Hygiene & Environmental Health, 206(2): 77–83. |
| Kordower J H, Emborg M E, Bloch J, et al. 2000. Neurodegeneration prevented by lentiviral vector delivery of GDNF in primate models of Parkinson's disease[J]. Science, 290(5492): 767–773.DOI:10.1126/science.290.5492.767 |
| 李桉琪, 唐春宇, 黄辉, 等. 2013. 沙颍河水PAEs污染对儿童甲状腺功能及智力的影响[J]. 卫生研究, 2013, 42(2): 236–240. |
| Lee B H, Lee M J, Park S, et al. 2010. Enhancement of proteasome activity by a small-molecule inhibitor of USP14[J]. Nature, 467(7312): 179–184.DOI:10.1038/nature09299 |
| Li P, Rossman T G. 2001. Genes upregulated in lead-resistant glioma cells reveal possible targets for lead-induced developmental neurotoxicity[J]. Toxicological Sciences, 64(1): 90–99.DOI:10.1093/toxsci/64.1.90 |
| Li X J, Jiang L, Chen L, et al. 2013. Neurotoxicity of dibutyl phthalate in brain development following perinatal exposure:A study in rats[J]. Environmental Toxicology & Pharmacology, 36(2): 392–402. |
| Lo E H, Dalkara T, Moskowitz M A. 2003. Neurological diseases:Mechanisms, challenges and opportunities in stroke[J]. Nature Reviews Neuroscience, 4(5): 399–415.DOI:10.1038/nrn1106 |
| Ma P, Yan B, Zeng Q, et al. 2014. Oral exposure of Kunming mice to diisononyl phthalate induces hepatic and renal tissue injury through the accumulation of ROS. Protective effect of melatonin[J]. Food & Chemical Toxicology, 68(6): 247–256. |
| Mialki R K, Zhao J, Wei J, et al. 2013. Overexpression of USP14 protease reduces I-κB protein levels and increases cytokine release in lung epithelial cells[J]. Journal of Biological Chemistry, 288(22): 15437–15441.DOI:10.1074/jbc.C112.446682 |
| Mincheva-Tasheva S, Soler R M. 2013. NF-κB signaling pathways:role in nervous system physiology and pathology[J]. Neuroscientist, 19(2): 175–194.DOI:10.1177/1073858412444007 |
| Miodovnik A. 2011. Environmental neurotoxicants and developing brain[J]. Mount Sinai Journal of Medicine A Journal of Translational & Personalized Medicine, 78(1): 58–77. |
| Miodovnik A, Edwards A, Bellinger D C, et al. 2014. Developmental neurotoxicity of ortho-phthalate diesters:Review of human and experimental evidence[J]. Neurotoxicology, 41(1): 112–122. |
| Morgan M J, Liu Z G. 2011. Crosstalk of reactive oxygen species and NF-κB signaling[J]. Cell Research, 21(1): 103–115.DOI:10.1038/cr.2010.178 |
| O'Neill L A, Kaltschmidt C. 1997. NF-κB:a crucial transcription factor for glial and neuronal cell function[J]. Trends in neurosciences, 20(6): 252–258.DOI:10.1016/S0166-2236(96)01035-1 |
| Sathyanarayana S, Karr C J, Lozano P, et al. 2008. Baby care products:possible sources of infant phthalate exposure[J]. Pediatrics, 121(2): 260–268.DOI:10.1542/peds.2006-3766 |
| Schieber M, Chandel N S. 2014. ROS function in redox signaling and oxidative stress[J]. Current biology, 24(10): 453–462.DOI:10.1016/j.cub.2014.03.034 |
| Schreck R, Albermann K, Baeuerle P A. 1991. Nuclear factor kappa B:an oxidative stress-responsive transcription factor of eukaryotic cells (a review)[J]. Free Radical Research Communications, 17(4): 221–237. |
| Shea K M. 2003. Pediatric exposure and potential toxicity of phthalate plasticizers[J]. Pediatrics, 111(6): 1467–1474.DOI:10.1542/peds.111.6.1467 |
| Tanaka T, Ohhashi K, Shitara H, et al. 2008. NF-kappaB independent signaling pathway is responsible for LPS-induced GDNF gene expression in primary rat glial cultures[J]. Neuroscience Letters, 431(3): 262–267.DOI:10.1016/j.neulet.2007.11.051 |
| Wang H G, Pathan N, Ethell I M, et al. 1999. Ca2+-induced apoptosis through calcineurin dephosphorylation of BAD[J]. Science, 284(5412): 339–343.DOI:10.1126/science.284.5412.339 |
| Xin C, Hu Y, Wang S, et al. 2017. The regulator of calcineurin 1 (RCAN1) inhibits nuclear factor kappaB signaling pathway and suppresses human malignant glioma cells growth[J]. Oncotarget, 8(7): 12003–12012. |
| Wojtowicz A K, Szychowski K A, Wnuk A, et al. 2017. Dibutyl phthalate (DBP)-induced apoptosis and neurotoxicity are mediated via the Aryl hydrocarbon receptor (AhR) but not by estrogen receptor alpha (ERα), estrogen receptor beta (ERβ), or peroxisome proliferator-activated receptor gamma (PPARγ) in mouse cortical neurons[J]. Neurotoxicity Research, 31(1): 77–89. |
| Wu Y, Li J, Yan B, et al. 2017. Oral exposure to dibutyl phthalate exacerbates chronic lymphocytic thyroiditis through oxidative stress in female Wistar rats[J]. Scientific Reports, 7(1): 15469.DOI:10.1038/s41598-017-15533-z |
| Xu B, Gao N Y, Cheng H, et al. 2009. Oxidative degradation of dimethyl phthalate (DMP) by UV/H2O2 process[J]. Journal of Hazardous Materials, 162(2/3): 954–959. |
| Yan B, Guo J, Liu X, et al. 2016. Oxidative stress mediates dibutyl phthalate induced anxiety-like behavior in Kunming mice[J]. Environmental Toxicology & Pharmacology, 45: 45–51. |
| Zhang G, Liu K, Ling X, et al. 2016. DBP-induced endoplasmic reticulum stress in male germ cells causes autophagy, which has a cytoprotective role against apoptosis in vitro and in vivo[J]. Toxicology Letters, 245: 86–98.DOI:10.1016/j.toxlet.2016.01.016 |
