 , 周启星2
, 周启星2
 , 王鑫2, 张倩茹3, 伍跃辉1, 陈威1, 赵伟1, 李博1
, 王鑫2, 张倩茹3, 伍跃辉1, 陈威1, 赵伟1, 李博11. 黑龙江省环境监测中心站, 哈尔滨 150056;
2. 南开大学环境科学与工程学院, 环境污染过程与基准教育部重点实验室/天津市城市生态环境修复与污染防治重点实验室, 天津 300071;
3. 中国科学院沈阳应用生态研究所, 沈阳 110016
收稿日期: 2017-08-23; 修回日期: 2017-10-10; 录用日期: 2017-10-11
基金项目: 中央高校基本科研业务费专项资金;高等学校学科创新引智计划(111计划)(No.T2017002)
作者简介: 顾平(1983—), 女, 副高级工程师, E-mail:guping2708@163.com
通讯作者(责任作者): 周启星, E-mail:zhouqx@nankai.edu.cn
摘要: 从长期受多环芳烃(PAHs)污染的土壤中获得1株高效降解菌BB-1,经鉴定为巨大芽孢杆菌Bacillus megaterium.为了考察菌株的降解特性,将10和20 mg·L-1的苯并[a]芘(B[a]P)加入到培养液中并在30℃下振荡培养8 d.结果表明,BB-1对不同浓度的B[a]P的降解率分别为52.1%和23.5%,B[a]P浓度为10 mg·L-1时降解效果更优.将不同重金属外加到培养液中,Cu2+(50 mg·L-1)和Cd2+(100 mg·L-1)能在一定程度上影响BB-1对B[a]P的生物降解作用,但菌株仍有很强的耐受性;Zn2+(200 mg·L-1)和Pb2+(300 mg·L-1)会显著影响降解效果.为了研究菌BB-1与植物的联合降解修复作用,通过对比研究将该菌株加入到种植紫茉莉的B[a]P污染土壤中,在未加入BB-1的污染土壤中,紫茉莉在开花期和成熟期对B[a]P的降解率分别为27.42%±1.99%和51.31%±3.06%,在加入BB-1的污染土壤中降解率分别为68.22%±1.21%和77.16%±0.62%,可见加入菌株BB-1后能显著提高紫茉莉对土壤中B[a]P的降解效率.为确定降解作用的菌株来源,分别对比了非根际和根际土壤中的B[a]P含量,发现在开花期和成熟期任何一种处理的根际土中B[a]P残留浓度都小于非根际土,说明土壤中B[a]P的去除主要是源于根际的作用.在植物修复的基础上,添加能耐受一定重金属浓度的高效B[a]P降解菌,能提高B[a]P降解率,有望为日后大规模田间应用提供可靠的技术参数.
关键词:多环芳烃苯并[a]芘污染土壤生物降解微生物-植物联合修复根际效应
Joint remediation of contaminated soil by an effective degradation bacteria of B[a]P and Mirabilis jalapa
GU Ping1,3
 , ZHOU Qixing2
, ZHOU Qixing2
 , WANG Xin2, ZHANG Qianru3, WU Yuehui1, CHEN Wei1, ZHAO Wei1, LI Bo1
, WANG Xin2, ZHANG Qianru3, WU Yuehui1, CHEN Wei1, ZHAO Wei1, LI Bo1 1. Heilongjiang Provincial Environmental Monitoring Center Station, Harbin 150056;
2. Ministry of Education Key Laboratory of Pollution Processes and Environmental Criteria/Tianjin Key Laboratory of Environmental Remediation and Pollution Control, College of Environmental Science and Engineering, Nankai University, Tianjin 300071;
3. Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang 110016
Received 23 August 2017; received in revised from 10 October 2017; accepted 11 October 2017
Supported by the Special Funds for Basic Scientific Research Services of Central Colleges and Universities and the "111" Program, Ministry of Education, China (No.T2017002)
Biography: GU Ping(1983—), female, associate senior engineer, E-mail:guping2708@163.com
*Corresponding author: ZHOU Qixing, E-mail:zhouqx@nankai.edu.cn
Abstract: An effective degrading bacterium BB-1 which was identified as Bacillus megaterium was obtained from the soil contaminated with polycyclic aromatic hydrocarbons (PAHs) for a long time. In order to investigate the degradation characteristics of the strain, 10 mg·L-1 and 20 mg·L-1 B[a]P was respectively added to the culture medium at 30℃ for 8 days, and the results showed that the degradation rate for B[a]P by BB-1 was 52.1% and 23.5% respectively, and the degradation ability was better when the added concentration of B[a]P was 10 mg·L-1. The addition of different heavy metals into the culture medium showed that Cu2+ (50 mg·L-1) and Cd2+ (100 mg·L-1) could affect the biodegradation of B[a]P by BB-1 to a certain extent, however, still with very strong tolerance; Zn2+ (200 mg·L-1) and Pb2+ (300 mg·L-1) significantly affected the degradation of B[a]P. In order to examine the degradation ability by the combination of BB-1 and remediation plants, the strain was added to B[a]P contaminated soil with growing Mirabilis jalapa. The results showed that the degradation rate of B[a]P in the contaminated soil without addition of BB-1 was 27.42%±1.99% and 51.31%±3.06%, respectively, during the flowering period and mature period, and, the degradation rate in the contaminated soil with addition of BB-1 was up to 68.22%±1.21% and 77.16%±0.62%, respectively. It is thus clear that the addition of the strain BB-1 could significantly improve the degradation of B[a]P in the soil. The results also showed that the residual concentration of B[a]P in rhizosphere soil was less than that in non-rhizosphere soil, with any processing during the flowering period and the mature period, in other words, the removal of B[a]P in soil was mainly attributed to the rhizosphere of plants. On the basis of phytoremediation, the addition of highly efficient B[a]P degrading bacteria, which could tolerate a certain concentration of heavy metals, could improve the degradation rate of B[a]P, that is expected to provide the basis for future large-scale field experiment.
Key words: polycyclic aromatic hydrocarbons (PAHs)benzo[a]pyrene (B[a]P)contaminated soilbiodegradationjoint microbiological-phytoremediationrhizospheric effect
1 引言(Introduction)多环芳烃(PAHs)是一类常见的土壤有毒有机污染物(Ghosh et al., 2014), 在河流及其沉积物中也有发现, 且沉积物中高环PAHs含量显著高于水中(王林芳等, 2017).苯并[a]芘(B[a]P)作为一种具有5环结构的强致癌性多环芳烃(包贞等, 2003; Jules et al., 2012), 其来源有天然源和人为源, 人为源多来自于石油、煤炭、木材及其他有机物不完全燃烧或高温裂解过程(Sun et al., 2011; Gómez et al., 2009; Gan et al., 2009).近年来, 石油开采的泄漏和炼制过程的排放, 成为石油开采区PAHs污染的重要来源(张宏波等, 2010;张亚楠等, 2015), 使得土壤中PAHs污染尤为严重.Wild等(1999)指出, 环境中90%以上的PAHs都存在于土壤中.国内也有资料显示, 辽河油田严重污染区土壤中含油量已达10 g·kg-1(姜昌亮等, 2001);某些城市工业污染场地表层土壤中PAHs平均含量达17.64 mg·kg-1 (廖晓勇等, 2011).由于PAHs稳定、难降解的特点, 使其在环境中呈不断增加的趋势, 给工业发达地区的人们带来了巨大的健康危害.同时, PAHs具有亲脂性, 水解和光解速率都非常缓慢(Zhou et al., 2005), 微生物降解(Huang et al., 2004; Parrish et al., 2004; 2005;Haritash et al., 2009; 孙姗姗等, 2016)、植物修复(范淑秀等, 2007; Zhou et al., 2011; 梁宵等, 2012)、微生物-植物联合修复成为其从环境中降解的主要途径, 而植物根际圈对其降解作用也值得探讨.如范淑秀等(2007)采用盆栽试验方法研究了苜蓿对菲污染土壤的修复, 结果发现, 经过60 d的修复, 根际和非根际土壤中菲的降解率分别为85.68%~91.40%和75.25%~86.61%.Kahng等(2005)研究了韩国新村湾附近分布的芦苇根际的PAHs降解菌的分解代谢基因, 发现双加氧酶的氨基酸序列是萘、菲、芘分解代谢编码酶的一部分, 而萘、菲、芘的分解也是由于芦苇根际细菌的作用.Wu等(2008)建立了一个使用生物刺激(添加磨碎的玉米棒)和生物添加(接种键核盘菌Monilinia菌株W5-2)手段修复PAHs污染土壤的微环境, 在30 d后发现, 接种菌株的一组PAHs总量降低了35%, 添加玉米棒的一组PAHs总量降低了16%, 而空白组PAHs总量仅降低了3%;接种菌株W5-2的一组, B[a]P和蒽的降解率分别为70%和72%, 而添加玉米棒和对照组的2种污染物降解率要低得多;之后作者又进行了基因毒理实验, 确定土壤的毒性降解主要是真菌修复发挥的作用.刘鑫等(2017)利用紫花苜蓿与PAHs降解菌株Rhizobium petrolearium SL-1联合修复土壤中PAHs, 发现盆栽试验中, 苜蓿+菌处理20和60 d时的苜蓿株高和干质量指标均优于仅种植苜蓿处理;苜蓿+菌联合降解PAHs效果明显优于只种植苜蓿或只接菌处理.Wu等(2008)将丛枝菌根(AM)真菌(Glomus etunicatum)与非离子表面活性剂(Triton X-100)掺杂在含菲的土壤中测定菲的降解, 发现土壤中残留的菲浓度显著降低, 菌根处理可以增加根际土壤中的菲消耗.同样, 将筛选出的高效降解菌株投入到受污染土壤中, 并结合植物修复手段进行修复试验(Peng et al., 2009), 对比降解效果, 是本研究的最终目的.
在实际污染土壤中, 如辽宁污灌区(李名升等, 2008), 重金属和PAHs往往被同时发现(王红旗等, 2011), 两者的复合污染已成为现今全球研究的热点(周启星等, 2004; Wang et al., 2006; Bao et al., 2013).例如, 孙约兵等研究了用观赏性花卉万寿菊来修复重金属和B[a]P复合污染土壤的效果(Sun et al., 2011);杨传杰等将一种镉超积累植物龙葵种在镉和PAHs复合污染土壤中, 通过施加化学试剂(包括EDTA、半胱氨酸、水杨酸和TW80), 来测试单独和共同作用下对污染土壤的修复效果(Yang et al., 2011).
紫茉莉既是一种观赏性花卉, 又是Cd污染土壤的超积累植物(刘家女等, 2007; Yu et al., 2009).但将紫茉莉作为供试植物来修复B[a]P污染土壤的研究还未曾有报道.因此, 本研究从长期受PAHs污染的土壤中筛选出B[a]P高效降解细菌, 将其投放到含Cd的B[a]P污染土壤中, 结合能耐受高浓度Cd的超积累植物紫茉莉, 进行联合修复, 在开花期和成熟期分别监测降解效果, 旨在为未来的重金属及PAHs复合污染治理及微生物-植物联合修复应用提供理论和数据支持.
2 材料与方法(Materials and methods)2.1 实验材料2.1.1 土样来源供试污染土样取自沈抚污灌区四方台大棚南一带表层(0~20 cm)污染土壤, 此地为石油污水灌溉多年的蔬菜田.土壤理化性质见表 1, 其中, Cd含量超过国家土壤环境质量标准(GB15618—1995)的农业用地2级标准(pH介于6.7~7.5之间, Cd含量为0.6 mg·kg-1)3.5倍;16种PAHs总量为0.569 mg·kg-1, 2~4环PAHs含量为0.462 mg·kg-1, 5~6环PAHs含量为0.106 mg·kg-1, B[a]P含量为0.041 mg·kg-1, 与荷兰土壤修复目标值相比, 所采集土壤中PAHs含量明显超标.空白土为对照的清洁土, 采自中国科学院沈阳生态站, 土壤类型及其理化性质见表 1.土壤风干后过4 mm尼龙筛, 备用.
表 1(Table 1)
| 表 1 供试土样理化性质 Table 1 Physical and chemical characters of the tested contaminated soil | ||||||||||||||||||||||||||||||||||||||||||||
表 1 供试土样理化性质 Table 1 Physical and chemical characters of the tested contaminated soil
| ||||||||||||||||||||||||||||||||||||||||||||
2.1.2 降解用液体培养基(NH4)2SO4 0.5 g, NaNO3 0.5 g, CaCl2 0.02 g, MgS04 0.2 g, KH2P04 1.0 g, NaH2PO4·H2O 1.0 g, 水1000 mL, pH=7.0, 121 ℃、蒸气灭菌30 min, 所用碳源为B[a]P(5、10、20 mg·L-1), 以丙酮溶液形式加入.
2.1.3 菌悬液制备将分离纯化后的菌种BB-1从斜面各挑取一环接入活化富集培养基(牛肉膏5 g, 蛋白胨10 g, NaCl 5 g, 蒸馏水1000 mL, pH =7.0, 灭菌条件同2.1.2节)中, 30 ℃摇床振荡培养48 h (此时处于对数生长期)后, 分别取3 mL菌液于离心管内, 离心10 min(8000 r·min-1), 用磷酸缓冲溶液清洗后离心15 min(10000 r·min-1), 反复3次.制成一定浓度的菌悬液冷藏备用.以上操作在无菌条件下进行, 以洗去培养基中的碳源.
2.2 实验方法2.2.1 B[a]P的测定B[a]P浓度的分析采用GC-FID法.设备条件:HP-6890, PLUS GC(Version A.03.07)气相色谱仪, 装有氢火焰检测器(FID), HP-5毛细管色谱柱(30.0 m×0.25 mm×0.25 μm);采用自动进样方式;进样口无分流模式, 温度250 ℃, 柱流量1.5 mL·min-1, 高纯氮气(99.999%)作载气, 炉温80 ℃, 氢火焰离子化检测器(FID)温度310 ℃.B[a]P在1.30~9.75 mg·L-1的范围内, 浓度与峰面积呈较好的线性关系, 线性方程为y=10.408x-2.1324, 其中, y为峰面积, x为B[a]P浓度, R2=0.9935.对样品进行加标回收率测定, 加标浓度为5 mg·L-1, 回收率测定结果为93.6%~108.1%, 符合100%±25%的规定.说明该方法可以用于培养液中B[a]P浓度的测定.
培养后的样品瓶从培养箱中取出后立即放入冰箱中(4 ℃)平衡l h以上.拿出后分别用移液管均匀取适量移至分液漏斗, 然后加入15 mL二氯甲烷, 振荡萃取10 min, 静置后收集有机相, 经过无水硫酸钠去水后存于茄形瓶中, 向水相中再加入10 mL二氯甲烷, 振荡萃取5 min, 同样过无水硫酸钠去水, 合并2次萃取的有机相, 于氮吹仪上将其溶剂蒸至微干, 最后用色谱纯的正己烷定容至5 mL, 立即转移到气谱进样瓶中上机测定.
2.2.2 菌株BB-1对B[a]P的降解实验无菌条件下, 将去掉碳源的供试菌悬液接入B[a]P浓度分别为5、10、20 mg·L-1的三角瓶中.同时设不接菌对照CK, 各3个重复, 每个重复两瓶.30 ℃恒温下振荡培养(200 r·min-1), 其中一瓶用于分析培养液中残留B[a]P浓度, 另一瓶用于测定OD600值.以时间为横坐标, 以B[a]P浓度和OD600为纵坐标做出曲线.
2.2.3 实验设计培育紫茉莉幼苗的同时, 将风干后过4 mm筛的供试土壤准确称量1 kg装入塑料盆, 取部分土壤加入溶于丙酮的B[a]P母液, 使投加的B[a]P浓度为2 mg·L-1, 待丙酮完全挥发后(1~2 d), 再与大量供试土壤混合, 搅拌均匀.放置1~2周沉化后, 土壤中B[a]P的初始含量为2.039 mg·kg-1, 选择生长一致的紫茉莉幼苗分别移入各处理盆中, 每盆栽2棵, 摆放时完全随机分组.移栽7 d后, 对应各处理分别投加菌剂, 不施底肥且露天栽培, 根据盆中土壤缺水情况, 不定期浇水(水中未检出Cd), 使土壤含水量经常保持在田间持水量的80%左右.于植物开花期和成熟期后取土壤样品.植物生长时间约为100 d.
实验设计了以下处理:①CK, 取清洁土壤做对照, 单一种植紫茉莉;②在复合污染土壤上, A.单一种植紫茉莉, 记为P;B.单一投加功能菌株BB-1, 记为BB;C.接种功能菌株BB-1并种植紫茉莉, 记为P+BB;D.未加菌株且未种紫茉莉, 记为B0.共计5个处理, 每处理重复6次.分两次取样, 一次在开花期, 随机取3次平行样品, 记为Ⅰ;另一次在成熟期, 取剩余3次重复样品,记为Ⅱ.
2.2.4 根际与非根际土壤根际土和非根际土土样采集参照《根际研究法》(刘芷宇, 1997), 土壤采集后, 充分混匀, 放置于低温冰箱中待分析.由于紫茉莉的根系在植物生长的盆钵中较为发达、致密, 盆钵中土壤被紧紧包围在根区, 因此, 将种植紫茉莉的土壤作为根际土壤, 而没有种植紫茉莉的土壤看成非根际土壤.前人也有类似的做法(Binet et al., 2001).
2.2.5 土壤中B[a]P测定方法参照文献(Sun et al., 2011; 宋玉芳等, 1999)方法, 提取后用气相色谱(GC)分析, 设备条件同上, 分析条件同文献(范淑秀等, 2007).方法回收率为93.07%±7.01%.
3 结果与讨论(Results and discussion)3.1 重金属离子对菌株BB-1降解B[a]P的影响从长期受PAHs污染的土壤中获得1株高效降解菌BB-1, 以其总DNA为模板, 采用细菌16S rDNA特异引物F27和R1492进行扩增, 获得1.5 kb大小的PCR产物, 用Blast软件将该片段测序结果和GenBank中已登录的核苷酸序列进行同源性比较, 发现菌株BB-1与Bacillus megaterium同源性为100%.根据形态及序列特征, 菌株BB-1被鉴定为巨大芽孢杆菌(Bacillus megaterium), 属细菌.在前期工作的基础上, 考察了几种常见重金属存在条件下菌株BB-1对B[a]P的降解效能(表 2).
表 2(Table 2)
| 表 2 不同重金属离子对菌株BB-1降解B[a]P的影响 Table 2 The effect of different heavy metal ions on B[a]P degradation by strain BB-1 | ||||||||||||||||||||||||||||
表 2 不同重金属离子对菌株BB-1降解B[a]P的影响 Table 2 The effect of different heavy metal ions on B[a]P degradation by strain BB-1
| ||||||||||||||||||||||||||||
通过8 d培养发现, 与同时间未添加重金属离子的对照组相比, Cu2+的存在基本不影响菌株BB-1对B[a]P的降解效能.继续培养发现, 在含Pb2+的培养基中细菌生长缓慢, 对B[a]P的降解效能处于一个较低水平.而Zn2+对菌株BB-1有明显的抑制作用, B[a]P几乎未被降解, 光密度值OD600=0.0081±0.0164, 显示菌株BB-1基本全部死亡.这表明Zn2+对该菌株存在明显的毒害作用, 因此, 菌株BB-1不能在存在Zn2+的环境中良好生长.路薇等(2015)通过酶活性检测发现, 邻苯二酚1, 2-双加氧酶活性显著高于邻苯二酚2, 3-双加氧酶活性, 表明其在荧蒽生物降解中起主导作用.重金属对菌株BB-1产生的毒害作用可能与其对酶活性的影响有关.尽管Cd2+也降低了菌株的降解率(降至14.44%±1.52%), 但仍然具有一定的降解效果及耐受性, 不至于产生毒性, 具备进一步将菌株投加到镉污染土壤中的条件.
3.2 不同浓度的外源B[a]P对菌株BB-1降解B[a]P的影响考察了不同初始浓度B[a]P对菌株BB-1降解率的影响, 同时设置未添加菌株的空白(CK), 结果如图 1所示.通过8 d的培养发现, 当B[a]P作为培养基中唯一碳源时, 随着其浓度由5 mg·L-1增加到20 mg·L-1, 菌株BB-1对B[a]P的降解效能逐渐下降, 降解率由66.36%降为23.50%, 下降了42.86%.由此可见, 菌株BB-1对较高浓度的B[a]P也具有降解效能, 但随着B[a]P浓度的增加, 对该菌株产生了一定的毒害作用, 5 mg·L-1和10 mg·L-1处理组间的差异并不显著, 但与20 mg·L-1处理组间存在显著差异, 且组间差异也很明显(F=24.619), 说明菌株BB-1对于中低浓度B[a]P的降解率大于其对高浓度B[a]P的降解率.而细菌的光密度结果与降解率的变化趋势相一致, 在B[a]P浓度为5、10和20 mg·L-1时, OD600分别为0.9676±0.0074、0.4903±0.0045和0.1610±0.0044.而相应的未添加菌剂的培养基中, B[a]P几乎未降解, 其降解率均在15%以下.
图 1(Fig. 1)
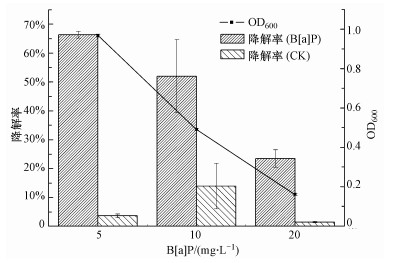 |
| 图 1 B[a]P浓度对菌株BB-1降解B[a]P的影响 Fig. 1The effect of various concentrations B[a]P on B[a]P degradation by strain BB-1 |
《地表水环境质量标准GB3838—2002》中, 集中式生活饮用水地表水源地特定项目标准限值规定B[a]P的浓度限值为2.8×10-6 mg·L-1, 因此, 本文中设定B[a]P浓度为5、10和20 mg·L-1, 属于中高浓度, 均可以提供足够的碳源给菌体, 3种浓度下BB-1的降解率均在23%以上.当B[a]P浓度从5 mg·L-1升高到10 mg·L-1, 其与菌体的相对比例增大, 菌体对B[a]P的利用量可能会上升, 但菌体的量减少, OD600降低, 其受诱导产生的降解酶在较高的B[a]P浓度下会减少, 因此, 总体的降解率表现为下降, 但差异并不显著.而B[a]P继续增加至高浓度20 mg·L-1时, 其对菌体产生了明显的毒性, 从而抑制了菌体生长, OD600低于0.2, 导致降解率也显著下降.孙珊珊等(2006)研究了PAHs降解真菌对芘的吸收存储和降解特性, 发现培养前期培养基中芘的消解以生物降解为主, 生物降解芘在培养0~14 d内逐渐增加, 此后基本达到稳定.
3.3 紫茉莉与菌株BB-1联合修复土壤中B[a]P的去除效果土著菌与紫茉莉单独及联合作用下降解土壤中的B[a]P, 开花期和成熟期的降解率如图 2所示.首先从外观上看, 污染土壤中的紫茉莉生长正常, 叶片没有出现如萎黄、缺绿等镉中毒现象, 可见紫茉莉对于一定浓度的重金属镉和较高浓度的B[a]P有很强的耐受力.其次, 4种处理下土壤中B[a]P的降解率(图 2)显示, 未使用任何修复手段的污染土(B0处理)在开花期和成熟期, 两次采土后测定的土壤中B[a]P的降解率都是几种处理中最低的, 分别为27.42%±1.99%和51.31%±3.06%, 与其它处理相比均有显著性差异.而添加了筛选的土著降解菌株BB-1后显著提高了B[a]P的降解率, 在开花期和成熟期分别达到了61.60%±1.64%和73.12%±2.26%, 显著高于B0处理.单一种植紫茉莉的P处理和既添加土著菌株BB-1又种植紫茉莉的P+BB处理对B[a]P的降解率最高但两者差异并不显著.综合几种修复手段来看, 植物和土著微生物联合修复处理(P+BB)的修复效果最好, 开花期和成熟期B[a]P的降解率分别为68.22%±1.21%和77.16%±0.62%.
图 2(Fig. 2)
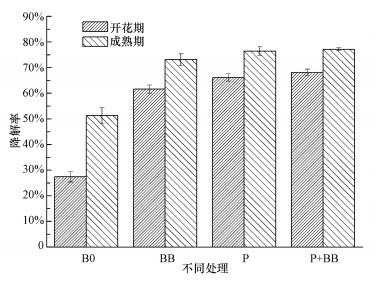 |
| 图 2 两个时期植物与BB-1不同处理对B[a]P的降解率 Fig. 2The degradation rate of B[a]P under different treatments between the plant and BB-1 in the two periods |
在开花期, 这种变化更加明显, B0处理的降解率显著低于BB、P、P+BB处理.PAHs在土壤中的自然降解主要是依靠挥发作用和光氧化作用(Huang et al., 2004), 很难去除大部分的诸如B[a]P这种难降解、难挥发的“三致”性化合物.经过约一个月的修复, 最终的B[a]P含量为(1.48±0.04) mg·kg-1, 仍高于国家标准.菌株BB-1经过驯化后投加到供试土壤中, 发现仅仅经过了开花期, B[a]P降解率就显著提高, 证明BB-1在实际受污染土壤中仍然发挥作用, 虽然低于在液体培养基中的降解率, 但差异并不显著, 试验效果很好.P处理的效果优于BB处理, 原因可能是植物本身存在发达的根系, 会产生一些微生物需要的能量和养分, 形成一个天然培养基, 使得原本存在于土壤中能耐受B[a]P的微生物群得到大量的繁殖生长, 从而更好地降解B[a]P.如果在受污土壤中既种植可以提供微生物养分、能量的紫茉莉, 又投加本研究自主筛选的高效降解菌株BB-1, 从最终的降解率来看, 效果是最优的.Huang等(2004)从长期受PAHs污染的铁路旁土壤中分离筛选出3株细菌用于植物修复, 发现修复过程中会产生吲哚乙酸、ACC脱氨酶等物质, 这些都能够促进植物的生长, 使植物和微生物形成互相促进的关系.也可能是因为投加的菌株本来就是从同一受污土壤里筛选的, 对土中的微生物不具有排斥性, 适应性更强, 结合植物的根际环境能更好的发挥作用.
3.4 根际与非根际土壤中PAHs的残留情况在开花期和成熟期两次取样, 根际与非根际土壤中B[a]P的残留量如图 3所示.可以看出, 无论是开花期还是成熟期, 任何一种处理的根际土B[a]P残留量都小于非根际土.说明土壤中PAHs的去除主要是源于根际的作用, 这种规律在未投菌的P和B0处理中尤为明显, 紫茉莉与菌株BB-1联合处理中开花期的根际残留量是(0.69±0.03) mg·kg-1, 而非根际土的残留量为(1.48±0.04) mg·kg-1, 相差0.79 mg·kg-1, 降解率相差38.74%.在成熟期也相差0.51 mg·kg-1, 降解率相差25.14%.可见, 植物根际区的存在能够明显促进PAHs的降解, 很多研究者都得到类似结论.如范淑秀等(2007)利用苜蓿修复菲污染土壤, 发现当菲的初始污染剂量达到445.22 mg·kg-1时, 根际与非根际土中菲降解率的差值最大达到8.43%;Liste等(2000)应用9种植物进行芘污染土壤的修复实验, 结果表明, 种植9种植物的土壤中芘的降解率均高于无植物对照土壤.而也有****的研究发现, 不同植物对同一种PAHs的吸收能力不同, 如Fismes等(2002)研究发现, 生菜、马铃薯、胡萝卜在室温盆栽条件下对PAHs富集能力最大的是马铃薯, 原因可能是根系PAHs的吸收过程需要载体协助和耗能的主动过程参与, 并且这个过程与H+关系密切, 是通过和H+共运方式进行.紫茉莉根系发达, 在根际圈很可能大量存在运送载体和H+, 促进了PAHs的吸收.而且研究表明(巩宗强等, 2001), 根际圈内存在着大量的可降解PAHs的微生物, 它们除利用自身的代谢活动降解有机污染物外, 还能以根系分泌物和根际圈内有机质为主要营养源对其进行降解, 从而具有根际圈外微生物所不具有的降解PAHs的独特之处.其实从水培实验中也可以直观地看出植物根系对PAHs的吸收作用, 易修等(2013)研究了小麦根系对萘、菲、芘吸收的动力学机制, 结果表明, 小麦根系对水培环境中的萘、菲和芘均有明显的吸收和累积作用, 且吸收量均随时间延长而增加, 整个吸收过程可分为快速吸收和慢速吸收两个阶段.因此, 植物根系吸收有机污染物的机理和动力学特性是今后研究的重点.
图 3(Fig. 3)
 |
| 图 3 开花期和成熟期根际与非根际土壤中B[a]P的残留量 Fig. 3The residual concentration of B[a]P in rhizosphere and non-rhizosphere soils duiring the anthesis and the autumn period |
资料显示, 随着PAHs苯环数量的增加, 其生物降解速率越来越低.许多微生物能以低分子量的PAHs(4环以内)作为唯一的碳源和能源, 并将其完全矿化.然而, 对于高分子量的PAHs, 由于其化学结构的复杂性及在水环境中的低溶解度, 难以被微生物直接降解(刘海滨等, 2011).研究表明, 大多数细菌对4环以上的高分子量PAHs的降解是以共代谢的方式进行的, 真菌对3环以上的PAHs的代谢也属于共代谢.B[a]P是一种含有5个苯环的、在土壤中难降解的PAHs, 但当适宜的共代谢底物存在时, 也可以被土壤中的微生物降解(Kanaly et al., 1997).结合根际圈的特性, 联合修复有望成为日后土壤中难降解PAHs生态修复的研究方向.
4 结论(Conclusions)1) 一定浓度重金属的存在可以影响菌株BB-1对B[a]P的降解效能, Cu2+(50 mg·L-1)对菌株BB-1降解率的影响很小, 而Pb2+(300 mg·L-1)和Zn2+(200 mg·L-1)则明显抑制该菌株的生长, Cd2+(100 mg·L-1)对菌株降解率有一定影响, 但仍具有耐受力.
2) B[a]P浓度从5 mg·L-1升高至20 mg·L-1时, 菌株BB-1对B[a]P的降解率逐渐下降, 由66.36%降为23.50%, 而从5 mg·L-1升至10 mg·L-1时, 两处理间差异并不明显, 但与20 mg·L-1处理间存在显著差异.
3) 未使用任何修复手段的污染土(B0处理), 在开花期和成熟期两次采土中对B[a]P的降解率都是最低的, 添加降解菌株BB-1后提高了B[a]P的降解率并显著高于B0处理, 单一种植紫茉莉的P处理和既添加土著菌株BB-1又种植紫茉莉的P+BB处理, 对于B[a]P的降解率差异并不显著, 但P+BB处理的修复效果最好, 降解率分别为68.22%±1.21%(开花期)和77.16%±0.62%(成熟期).
4) 任何一种处理的根际土B[a]P残留量都小于非根际土, 说明土壤中PAHs的去除主要是源于根际的作用, 这种规律在未投菌的P和B0处理中尤为明显, 紫茉莉与菌株BB-1联合处理中开花期的根际残留量是(0.69±0.02) mg·kg-1.
参考文献
| Bao Y Y, Wan Y, Zhou Q X, et al. 2013. Competitive adsorption and desorption of oxytetracycline and cadmium with different input loadings on cinnamon soil[J]. Journal of Soils and Sediments, 13(2): 364–374.DOI:10.1007/s11368-012-0600-3 |
| 包贞, 潘志彦, 杨晔, 等. 2003. 环境中多环芳烃的分布及降解[J]. 浙江工业大学学报, 2003, 31(5): 528–544. |
| Bient P, Portal J M, Leyval C. 2001. Application of GC-MS to the study of antharacene disappearance in the rhizosphere of ryegrass[J]. Organic Geochemistry, 32: 217–222.DOI:10.1016/S0146-6380(00)00168-6 |
| Fismes J, Perrin-Ganier C, Empereur-Bissonnet P, et al. 2002. Soil-to-root transfer and translocation of polycyclic aromatic hydrocarbons by vegetables grown on industrial contaminated soils[J]. Journal of Environmental Quality, 31(5): 1649–1656.DOI:10.2134/jeq2002.1649 |
| 范淑秀, 李培军, 巩宗强, 等. 2007. 苜蓿对多环芳烃菲污染土壤的修复作用研究[J]. 环境科学, 2007, 28(9): 2080–2083. |
| 巩宗强, 李培军, 王新, 等. 2001. 真菌对土壤中苯并[a]芘的共代谢降解[J]. 环境科学研究, 2001, 14(6): 36–39. |
| Gan S, Lau E V, Ng H K. 2009. Remediation of soils contaminated with polycyclic aromatic hydrocarbons (PAHs)[J]. Journal of Hazardous Materials, 172: 532–549.DOI:10.1016/j.jhazmat.2009.07.118 |
| Ghosh I, Jasmine J, Mukherji S. 2014. Biodegradation of pyrene by a Pseudomonas aeruginosa strain RS1 isolated from refinery sludge[J]. Bioresource Technology, 166: 548–558.DOI:10.1016/j.biortech.2014.05.074 |
| Gómez J, Alcántara M T, Pazos M, et al. 2009. A two-stage process using electrokinetic remediation and electrochemical degradation for treating benzo[a]pyrene spiked kaolin[J]. Chemosphere, 74: 1516–1521.DOI:10.1016/j.chemosphere.2008.11.019 |
| Haritash A K, Kaushik C P. 2009. Biodegradation aspects of polycyclic aromatic hydrocarbons(PAHs):a review[J]. Journal of Hazardous Materials, 169(1/3): 1–15. |
| Huang X D, El-Alawi Y, Penrose D M, et al. 2004. A multi-process phytoremediation system for removal of polycyclic aromatic hydrocarbons from contaminated soils[J]. Environmental Pollution, 130(3): 465–476.DOI:10.1016/j.envpol.2003.09.031 |
| Jules G E, Pratap S, Ramesh A, et al. 2012. In utero exposure to benzo(a) pyrene predisposes offspring to cardiovascular dysfunction in later-life[J]. Toxicology, 295(1/3): 56–67. |
| 姜昌亮, 孙铁珩, 李培军, 等. 2001. 石油污染土壤长料堆式异位生物修复技术研究[J]. 应用生态学报, 2001, 12(2): 279–282. |
| Kahng H Y, Oh K H. 2005. Molecular detection of catabolic genes for polycyclic aromatic hydrocarbons in the reed rhizosphere of sunchon bay[J]. Journal of Microbiology, 43(6): 572–576. |
| Kanaly R, Bartha R, Fogel S, et al. 1997. Biodegradation of[14C]benzo[a]pyrene added in crude oil to uncontaminated soil[J]. Applied and Environmental Microbiology, 63(11): 4511–4515. |
| Liste H H, Alexander M. 2000. Plant-promoted pyrene degradation in soil[J]. Chemosphere, 40: 7–10.DOI:10.1016/S0045-6535(99)00216-7 |
| 李名升, 佟连军. 2008. 辽宁省污灌区土壤重金属污染特征与生态风险评价[J]. 中国生态农业学报, 2008, 16(6): 1517–1522. |
| 梁宵, 占新华, 周立祥. 2012. 不同作物根系多环芳烃吸收特征差异的比较研究[J]. 环境科学, 2012, 33(7): 2516–2520. |
| 廖晓勇, 崇忠义, 闫秀兰, 等. 2011. 城市工业污染场地:中国环境修复领域的新课题[J]. 环境科学, 2011, 32(3): 784–792. |
| 刘海滨, 王翠苹, 张志远, 等. 2011. 苯并[a]芘高效降解菌筛选及其降解特性研究[J]. 环境科学, 2011, 23(9): 2696–2701. |
| 刘家女, 周启星, 孙挺, 等. 2007. 花卉植物应用于污染土壤修复的可行性研究[J]. 应用生态学报, 2007, 18(7): 1617–1623. |
| 刘鑫, 黄兴如, 张晓霞, 等. 2017. 高浓度多环芳烃污染土壤的微生物-植物联合修复技术研究[J]. 南京农业大学学报, 2017(4): 632–640.DOI:10.7685/jnau.201606036 |
| 刘芷宇. 1997. 根际研究法[M]. 南京: 江苏科学技术出版社. |
| 路薇, 罗娜, 董文, 等. 2015. 一株降解荧蒽的铜绿假单胞菌的筛选鉴定及其特性[J]. 环境科学学报, 2015, 35(11): 3486–3492. |
| Parrish Z D, Banks M K, Schwab A P. 2005. Assessment of contaminant lability during Phytoremediation of polycyclic aromatic hydrocarbon impacted soil[J]. Environmental Pollution, 137(2): 187–197.DOI:10.1016/j.envpol.2005.02.012 |
| Parrish Z D, Banks M K, Schwab A P. 2004. Effectiveness of phytoremediation as a secondary treatment for polycyclic aromatic hydrocarbons(PAHs) in composted soil[J]. Phytoremed, 6(2): 119–137.DOI:10.1080/16226510490454803 |
| Peng S W, Zhou Q X, Cai Z, et al. 2009. Phytoremediation of petroleum contaminated soils by Mirabilis Jalapa L. in a field plot experiment[J]. Journal of Hazardous Materials, 168(2/3): 1490–1496. |
| Sun Y B, Zhou Q X, Xu Y M, et al. 2011. Phytoremediation for co-contaminated soils of benzo[a]pyrene (B[a]P) and heavy metals using ornamental plant Tagetes patula[J]. Journal of Hazardous Materials, 186: 2075–2082.DOI:10.1016/j.jhazmat.2010.12.116 |
| 宋玉芳, 区自清, 孙铁珩. 1999. 土壤、植物样品中多环芳烃(PAHs)分析方法研究[J]. 应用生态学报, 1999, 6(1): 92–96. |
| 孙姗姗, 魏然, 倪进治, 等. 2016. 多环芳烃降解真菌Fusarium solani对芘的吸收存储和降解特性研究[J]. 环境科学学报, 2016, 36(7): 2408–2414. |
| Wang M E, Zhou Q X. 2006. Joint stress of chlorimuron-ethyl and cadmium on wheat Triticum aestivum at biochemical levels[J]. Environmental Pollution, 144(2): 572–580.DOI:10.1016/j.envpol.2006.01.024 |
| Wild S R, Jones K C. 1999. Polynuclear aromatic hydrocarbons in the united kingdom environment:a preliminary source inventory and budget[J]. Environmental Pollution, 88(1): 91–108. |
| Wu N Y, Zhang S Z, Huang H L, et al. 2008. Enhanced dissipation of phenanthrene in spiked soil by arbuscular Mycorrhizal alfalfa combined with a non-ionic surfactant amendment[J]. Science of the Total Environment, 394(2/3): 230–236. |
| Wu Y C, Luo Y M, Zou D X, et al. 2008. Bioremediation of polycyclic aromatic hydrocarbons contaminated soil with Monilinia sp.:degradation and microbial community analysis[J]. Biodegradation, 19(2): 247–257.DOI:10.1007/s10532-007-9131-9 |
| 王红旗, 王帅, 宁少尉, 等. 2011. 土壤铅-苯并[a]芘复合污染对小麦种子生长的影响研究[J]. 环境科学, 2011, 32(3): 886–894. |
| 王林芳, 党晋华, 刘利军, 等. 2017. 汾河上中游流域水环境中多环芳烃分布及分配[J]. 环境科学学报, 2017, 37(8): 2838–2845. |
| 易修, 袁嘉韩, 顾锁娣, 等. 2013. 小麦根系吸收萘、菲、芘的动力学特征[J]. 环境科学学报, 2013, 33(4): 1135–1140. |
| Yang C Y, Zhou Q X, Wei S H, et al. 2011. Chemical-assisted phytoremediation of Cd-PAHs contaminated soils using Solanum nigrum L.[J]. International Journal of Phytoremediation, 13(8): 818–833.DOI:10.1080/15226514.2010.532179 |
| Yu Z G, Zhou Q X. 2009. Growth responses and cadmium accumulation of Mirabilis jalapa L.under interaction between cadmium and phosphorus[J]. Journal of Hazardous Materials, 167: 38–43.DOI:10.1016/j.jhazmat.2008.12.082 |
| Zhou Q X, Cai Z, Zhang Z N, et al. 2011. Ecological remediation of hydrocarbon contaminated soils with weed plants[J]. Journal of Resources and Ecology, 2(2): 97–105. |
| Zhou Q X, Sun F H, Liu R. 2005. Joint chemical flushing of soils contaminated with petroleum hydrocarbons[J]. Environment International, 31(6): 835–839.DOI:10.1016/j.envint.2005.05.039 |
| 张宏波, 林爱军, 刘爽, 等. 2010. 芘高效降解菌的分离鉴定及其降解特性研究[J]. 环境科学, 2010, 31(1): 243–248. |
| 张亚楠, 杨兴伦, 卞永荣, 等. 2015. 化学提取法表征污染土壤中PAHs老化规律和蚯蚓富集特征[J]. 环境科学, 2015, 36(12): 4582–4589. |
| 周启星, 宋玉芳. 2004. 污染土壤修复原理与方法[M]. 北京: 科学出版社. |
