 , 马庆鑫2
, 马庆鑫2
 , 贺泓2
, 贺泓21. 华北电力大学, 资源与环境研究院, 北京 102206;
2. 中国科学院生态环境研究中心, 大气污染控制中心, 北京 100085
收稿日期: 2017-10-13; 修回日期: 2017-11-16; 录用日期: 2017-11-16
基金项目: 国家重点研发计划(No.2016YFC0202700);国家自然科学基金(No.41673004,91744205)
作者简介: 王铃(1990-), 女, E-mail:darlingyeyu@163.com
通讯作者(责任作者): 马庆鑫, E-mail:qxma@rcees.ac.cn
摘要: 使用原位漫反射红外傅里叶变换光谱(DRIFTS)研究了SO2在α-Al2O3、TiO2、CaO和α-Fe2O3颗粒物表面的非均相反应,考察了紫外光光照(波长约365 nm)对SO2在不同氧化物表面反应的影响.结果表明,无紫外光照射条件下,SO2在TiO2、α-Al2O3、CaO颗粒物表面反应的主要产物为亚硫酸盐;有紫外光照射条件下,SO2在TiO2、α-Al2O3、CaO颗粒物表面反应的主要产物为硫酸盐;但紫外光照射对SO2在α-Fe2O3表面的反应并没有明显的影响.推测机理可能是光照促进了颗粒物表面的亚硫酸盐向硫酸盐的转化.
关键词:SO2矿质颗粒物漫反射红外傅里叶变换光谱非均相反应紫外光照
Effect of UV light on the heterogeneous reaction of SO2 on different mineral oxide surfaces
WANG Ling1,2
 , MA Qingxin2
, MA Qingxin2
 , HE Hong2
, HE Hong2 1. Resources and Environmental Research Academy, North China Electric Power University, Beijing 102206;
2. Center for Air Pollution Control Technology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085
Received 13 October 2017; received in revised from 16 November 2017; accepted 16 November 2017
Supported by the National Key R & D Program of China(No.2016YFC0202700) and the National Natural Science Foundation of China(No.41673004, 91744205)
Biography: WANG Ling(1990—), female, E-mail:darlingyeyu@163.com
*Corresponding author: MA Qingxin, E-mail:qxma@rcees.ac.cn
Abstract: Heterogeneous reactions of SO2 on α-Al2O3, TiO2, CaO and α-Fe2O3 particle surfaces were studied using in situ diffuse reflectance infrared Fourier transform spectroscopy(DRIFTS). The influence of UV radiation(λ=ca. 365 nm) on the reaction of SO2 on different mineral oxides were investigated. The main product of the heterogeneous reactions of SO2 on TiO2, α-Al2O3 and CaO particles was sulfite in dark condition and sulfate in the presence of UV illumination, respectively. The UV illumination showed no obvious impact on the reaction on α-Fe2O3. The mechanism was proposed that the light may promote the conversion of sulfite to the sulfate on the surface of the particles.
Key words: SO2mineral oxideDRIFTSheterogeneous reactionUV light
1 引言(Introduction)据估计, 全球每年约有1000~3000 Tg(1 Tg=1012 g)的矿物气溶胶进入大气中, 主要是由强风吹扫地表土壤进入大气所致, 其化学组成与地壳元素相似, 主要由Si、Al、Ca和Fe等氧化物组成.矿物气溶胶是我国大气颗粒物的主要成分, 对华北及东北亚地区的大气造成严重的污染(汤大钢等, 2000; 王玮等, 2000).外场观测、实验室模拟和模式研究都证实, 矿质颗粒物表面的非均相反应对大气中常见的气相污染物的去除有重要的影响, 是多种气相污染物重要的汇和源过程(Sullivan et al., 2007; Li et al., 2016; Wang et al., 2017).进入大气中的矿质颗粒物在大气化学中起着重要的作用, 由于其特殊的表面结构及较大的比表面积, 可为大气中气相物质提供反应床, 使得痕量气体很容易在其表面发生吸附、催化、氧化和水解反应等(Ravishankara, 1997; Zhu et al., 2011; 马金珠等, 2011), 从而改变大气的气相和颗粒物的化学组成, 影响气态污染物的迁移转化, 改变大气颗粒物的吸湿性和光学性质(Usher et al., 2003; 马庆鑫等, 2015; 陈源等, 2017).
二次无机气溶胶对我国大城市地区重度灰霾的形成具有重要贡献, 其主要成分是硫酸盐、硝酸盐和铵盐, 其中, 硫酸盐的爆发增长过程尤为重要(Zhang et al., 2015; Guo et al., 2014).SO2是导致酸雨和硫酸盐气溶胶的重要前体物, 可以经过气相、液相及非均相反应生成硫酸盐(Mauldin Ⅲ ., 2012; Wang et al., 2014; Usher et al., 2002).硫酸盐气溶胶能通过反射太阳辐射和充当云凝结核产生气候致冷效应, 并且因其较强的吸湿性, 光散射效应明显, 对灰霾天气的产生具有重要的作用(李本纲等, 2016; 吴涧等, 2002).模式研究表明, 大气气溶胶存在硫酸盐被低估的问题, 其中, 矿质颗粒物表面的非均相反应被认为是硫酸盐生成的重要过程(Zheng et al., 2015).
目前, 有关SO2在矿质氧化物表面的非均相反应研究已经取得了一些进展.研究发现, SO2在Al2O3、TiO2、CaO、MgO等矿质氧化物表面反应, 仅在碱性的氧空位或羟基位点上形成亚硫酸盐(Usher et al., 2002; Zhang et al., 2006), 而在Fe2O3表面则不同, Fe(Ⅲ)的氧化性可直接将SO2转化为SO42-(Fu et al., 2007; Baltrusaitis et al., 2007).此外, 大气环境中的一些其他气体,如O3、NO2、H2O2、NH3等会促进SO2在矿尘表面的非均相反应过程(Ullerstam et al., 2002; Liu et al., 2012; Yang et al., 2016; 王占山等, 2016).并且矿质氧化物的形貌、晶型结构、酸碱性、氧化性等都会对SO2在其表面的反应产生影响(Fu et al., 2007; Yang et al., 2017).这些研究多是在暗反应条件下进行的.
目前已有研究表明, 光照会对大气污染性气体在大气中的反应产生影响, 并且光照对SO2发生非均相氧化的影响已引起越来越多的关注.Toledano等(2001)发现, 紫外线照射会引起Fe2+增加, 因此, 紫外光照射在α-Fe2O3表面的时候SO2的吸附显著增加; 但Fu等(2009)却发现, 室温下光照不会促进SO2在Fe2O3表面的非均相反应.除了Fe2O3以外, TiO2虽然相对丰度较低, 但由于光催化效率高, 可能对大气气溶胶的反应性有重要影响.Shang等(2010)发现, 在紫外光照射下二氧化钛表面SO2的摄取系数比没有紫外光照的情况高1个数量级, 并且光照强度越高, 其促进作用越强, 但干态下光照达到一定强度时这种促进作用会饱和.Grassian课题组利用原位红外光谱和XPS等手段也发现, 光照可促进SO2在TiO2表面向硫酸盐的转化(Baltrusaitis et al., 2010; Rubasinghege et al., 2010; Nanayakkara et al., 2012). Dupart等(2012)研究了亚利桑那测试尘(ATD)和氧化铁颗粒在气溶胶流动管中的反应, 发现在紫外线照射下可观察到新颗粒的形成, 他们提出, 光照使矿物颗粒中的金属氧化物表面产生·OH, 从而促进SO2向硫酸盐的转化. Park和Jang等测定了SO2在戈壁沙漠(GDD)和亚利桑那测试尘(ATD)颗粒表面硫酸盐生成的动力学摄取系数, 发现在紫外光照射下SO2的摄取系数显著高于黑暗中的摄取系数, 并且利用模式验证了这一观点(Park et al., 2016, 2017; Yu et al., 2017).尽管有了以上的研究, 但目前对于光照对SO2在颗粒物上的非均相反应的机理的认识仍不清楚.因此, 本文对光照对SO2在矿尘表面不同组分表面的非均相反应的影响进行研究.
2 材料与方法(Materials and methods)2.1 试剂与样品制备本文选取了矿质氧化物TiO2、α-Al2O3、CaO和α-Fe2O3.其中, α-Fe2O3利用氨水-沉淀法(Liu et al., 2010)制备, 其他矿质氧化物均为购买所得, 且属于分析纯级别(AR).采用美国Quantachrome公司的Autosorb-1C自动吸附装置对样品进行了比表面积的表征, 结果如表 1所示.
表 1(Table 1)
| 表 1 矿质颗粒物来源及比表面积分析结果 Table 1 Source and surface area of mineral oxide particles | |||||||||||||||
表 1 矿质颗粒物来源及比表面积分析结果 Table 1 Source and surface area of mineral oxide particles
| |||||||||||||||
实验用气体N2、O2、SO2纯度均为99.99%(北京华元气体化工有限公司), 具体浓度根据实验所需而适时改变.
2.2 物理表征粉末X射线衍射(XRD)表征:采用荷兰PANalytical X′Pert Pro型X射线衍射仪对矿质氧化物的晶相结构进行鉴定, 其操作电压为40 kV, 电流为40 mA, 采用Cu Kα射线测定(λ=0.15406 nm), 扫描角2θ的范围为10°~90°.
N2物理吸附表征:样品的比表面积采用美国Quantachrome公司的Autosorb-IC自动吸附仪测定, 即将颗粒物样品在573 K抽真空脱气3 h, 然后在液氮温度(77 K)下进行N2吸附-脱附等温线的测定, 样品的比表面积利用相对压力P/P0为0.05~0.35的分压范围由Brunauer-Emmett-Teller(BET)计算所得.
2.3 原位漫反射红外光谱研究原位漫反射傅里叶变换红外光谱(in situ DRIFTS)装置由带MCT检测器的傅立叶变换红外光谱仪(Nicolet 6700, Thermo Fisher Scientific, USA)、漫反射原位池及其附件组成.通过质量流量控制系统、温度控制系统精确控制原位池的气氛和样品的温度, 以实现在接近真实反应气氛下样品表面非均相反应过程的原位分析.原位漫反射红外研究实验过程如下:所有样品先于高温下(503 K)、100 mL·min-1模拟空气(80%N2 + 20%O2)中吹扫2 h以去除样品表面吸附杂质(如CO2及H2O), 然后降温至室温(303 K)稳定2 h后在模拟空气中平衡至基线平稳, 扣除气相中的水蒸气和CO2背景, 记录背景谱图.将5 ppm的SO2引入到原位池中进行反应, 对样品表面进行连续采谱, 波数范围在650~4000 cm-1内, 分辨率为4 cm-1, 扫描次数为100次.载气N2、O2和反应气SO2通过质量流量控制器调节流量, 并在气路中混合后进入原位池.
本文在数据处理过程中, 对吸收光谱进行了K-M变换(Kubelka-Munk).由于存在镜面反射光, 漫反射光谱的吸光度与样品组分含量不符合朗伯-比耳定律, 即样品浓度与光谱强度不成线性关系.通过K-M变换能够减少或消除任何与波长有关的镜面反射效应, 即经转换后的K-M函数与样品浓度的关系符合朗伯-比耳定律(Armaroli et al., 2004; 翁诗甫, 2010).
本研究分为光反应和暗反应过程.光反应时所用的加光装置为高亮度汞灯点光源平行光源(CHF-XM-500W, 北京畅拓科技有限公司), 最大电流为7.5 A.利用紫外液态光纤将光源直射在样品池带有透明玻璃窗口的样品表面, 光纤末端距玻璃窗口固定为4 cm左右.实验所用近紫外光照的具体参数采用光线光谱仪(BLUE-Wave-UVNb, Stellar Net Inc., USA)检测, 测得的光纤光谱结果如图 1所示.已有研究表明, 光强的增加有助于亚硫酸盐向硫酸盐转化, 紫外光越强硫酸盐生成越快, 但干态时光强对反应的促进在一定光强时会饱和(Shang et al., 2010; Li et al., 2011).本研究主要考察光照对SO2在不同矿质氧化物表面非均相反应的影响, 因此, 未考察光强的影响, 所有实验中光源强度保持不变.
图 1(Fig. 1)
 |
| 图 1 紫外光源光纤光谱图 Fig. 1The spectrum of ultraviolet light |
3 结果与讨论(Results and discussion)3.1 样品表征结果制备所得样品的XRD表征结果如图 2所示, 根据所得结果与文献对比可知, Al2O3和Fe2O3分别为α-Al2O3和α-Fe2O3晶型(李兆等, 2013; Liu et al., 2010), TiO2包含了锐钛矿和金红石, 其中, 锐钛矿占主要部分(陈中军等, 2008).
图 2(Fig. 2)
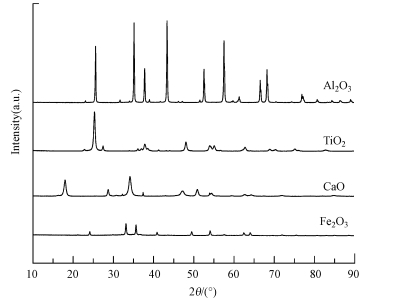 |
| 图 2 不同矿质氧化物的XRD谱图 Fig. 2XRD profile of mineral oxides |
3.2 光照对SO2在TiO2、CaO及α-Al2O3表面的非均相反应的影响利用DRIFTS技术在线分析颗粒物表面在反应过程中发生的变化.图 3为干态条件下SO2在TiO2、CaO及α-Al2O3表面吸附的原位红外光谱在暗反应及光反应条件下的对比结果, 可以看到在这几种氧化物表面, 光照均可促进SO2向硫酸盐的转化.图 3a为5 ppm SO2通入样品池后在TiO2表面反应原位反应6 h后的光谱图, 包括不加光的暗反应过程和加光的光反应过程.在光谱上峰值为正表示在样品表面有新物质生成, 而峰值为负则表示原样品表面在此波数对应的物种有所消耗.反应过程中TiO2表面光谱正负峰均有出现.对于暗反应的谱图, 可以看出在1100~1000 cm-1范围内有微弱的峰出现, 对应的峰位置波数为1074 cm-1, 文献中将在此范围内的特征峰归属为亚硫酸盐或亚硫酸氢盐(SO32-或HSO3-)(Yang et al., 2016).说明反应过程中只产生了少量的亚硫酸盐, 与文献结果一致.从图中可以明显看出, 与暗反应明显不同, SO2非均相光反应的出峰位置主要集中在1400~1100 cm-1范围内, 且峰强度增加.其中,主要红外峰的波数为1325、1291、1175和1145 cm-1, 分别归属为硫酸盐的凝聚态、双齿硫酸盐和桥式硫酸盐等(Nanayakkara et al., 2012).从这些结果可以看出, 加光对SO2在氧化物表面进行吸附和反应有明显的促进作用.
图 3(Fig. 3)
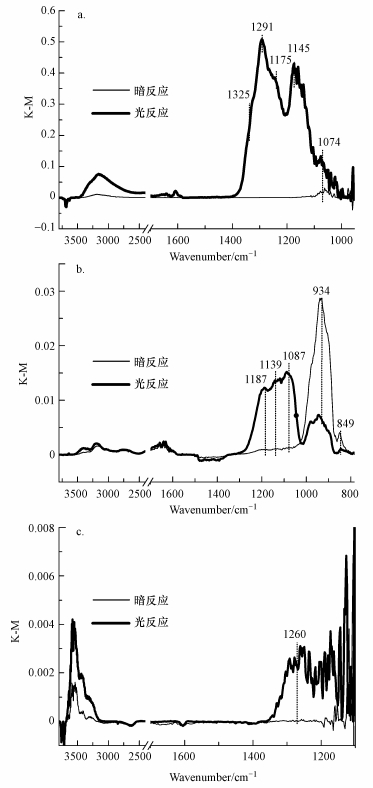 |
| 图 3 暗反应及光反应条件下SO2在TiO2(a)、CaO(b)、α-Al2O3(c)表面反应6 h的红外光谱对比 (5 ppm SO2, 总流量100 mL·min-1) Fig. 3DRIFTS spectra of particles TiO2(a), CaO(b), α-Al2O3(c), exposed to 5 ppm SO2 with or without UV light, balanced with synthetic air with a total flow of 100 mL· min-1 (The reaction time was 6 h) |
在其他矿质氧化物(如CaO和α-Al2O3)表面, SO2也会有类似的非均相反应, 其暗反应过程和光反应过程的红外光谱分别如图 3b和3c所示.在CaO表面, 暗反应下观察到934和849 cm-1处有红外吸收峰, 可归属为亚硫酸盐吸收峰(吴玲燕等, 2015).但光照条件下, 934和849 cm-1处的红外吸收峰明显减弱, 而新增了1187、1139和1087 cm-1处的强烈吸收, 归属为硫酸盐吸收峰(Liu et al., 2012), 表明光照促进了硫酸盐在CaO的生成.在α-Al2O3表面, 暗反应下没有观察到明显的含硫物种的红外吸收峰.而光照下, 在1260 cm-1处有强度明显的吸收峰出现, 并且在此1260 cm-1波数归属为硫酸盐伸缩振动峰(Usher et al., 2002; Yang et al., 2016; Zhang et al., 2006).因此, 可以看出, 在黑暗条件下, SO2在TiO2、CaO及α-Al2O3表面的吸附主要产物为亚硫酸盐物种; 但有光照作用在颗粒物表面时, 则主要产物为硫酸盐物种, 即光照可促进SO2向硫酸盐的转化.表 2总结了不同氧化物表面含硫物种的红外峰归属.
表 2(Table 2)
| 表 2 不同氧化物表面含硫物种的红外峰归属 Table 2 The assignments of sulfur-containing species on metal oxides surfaces | |||||||||||||||||||||||||||||
表 2 不同氧化物表面含硫物种的红外峰归属 Table 2 The assignments of sulfur-containing species on metal oxides surfaces
| |||||||||||||||||||||||||||||
为了进一步比较光照对SO2在颗粒物表面产物随时间的变化规律, 将图 3中表面产物的特征红外吸收峰积分进行半定量分析, 积分结果如图 4所示.从图中可以看到硫酸盐积分面积随反应时间的变化趋势, 并且反应6 h时的结果与红外光谱结果相一致, 光照条件下的硫酸盐生成量比黑暗条件下均大大增加; 但对亚硫酸而言, 不同氧化物上的结果却不尽相同, 光照能促进TiO2表面亚硫酸盐的生成, 但CaO表面有光照时的亚硫酸盐生成量比暗反应条件下少得多, 可能是由氧化物的酸碱性不同所致.
图 4(Fig. 4)
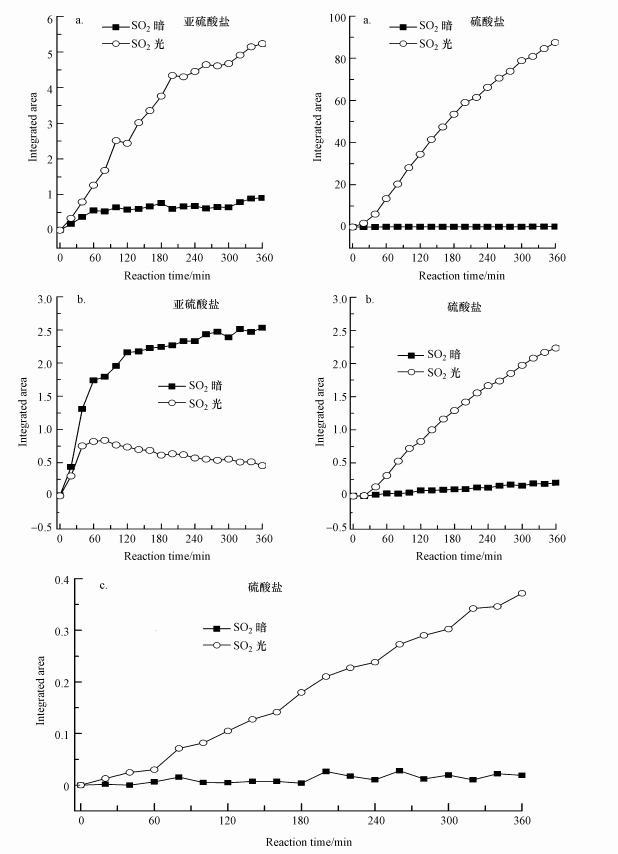 |
| 图 4 暗反应及光反应条件下SO2在TiO2(a)、CaO(b)、α-Al2O3(c)表面亚硫酸盐及硫酸盐红外光谱积分面积对比 Fig. 4Comparison of integrated area for suffite and sulfate species formed on TiO2(a), CaO(b), α-Al2O3(c) as a function of time with or without UV light |
图 5是SO2在氧化铁表面的非均相反应.Fe2O3是大气颗粒物中常见的一种氧化物, 与其他氧化物不同, 它的氧化性比较强, 没有观察到光照对SO2在Fe2O3表面非均相反应有明显的作用.如图 5a所示, 光反应及暗反应条件下, 反应6 h后的光谱图基本一致, 都在1232、1138和1050 cm-1处出现硫酸盐吸收峰(Fu et al., 2007; 2009), 无亚硫酸盐出现.且在氧化铁表面无消耗峰出现, 表明颗粒物表面羟基几乎不参与反应, 这主要是氧化铁中的铁元素通过二价和三价的循环转化实现对SO2的氧化.此外, 从图 5b给出的有无光照条件下表面产物的红外积分面积的对比图可以看出, 两种条件下的硫酸盐生成量并无明显差别, 即光照对SO2在Fe2O3表面的非均相反应没有明显的影响.
图 5(Fig. 5)
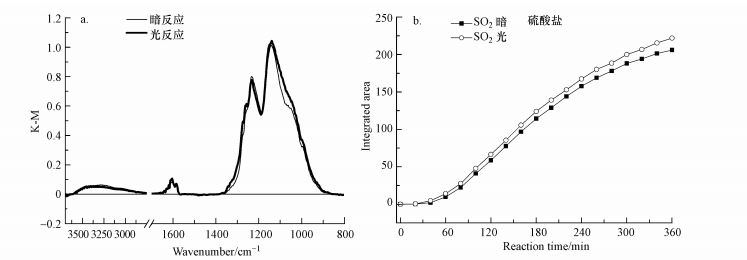 |
| 图 5 暗反应及光反应条件下SO2在α-Fe2O3表面反应6 h的红外光谱对比(a, 5 ppm SO2, 总流量100 mL·min-1)及硫酸盐红外光谱积分面积对比图(b) Fig. 5DRIFTS spectra of α-Fe2O3 exposed to 5 ppm SO2 with or without UV light balanced with synthetic air with a total flow of 100 mL· min-1(the reaction time was 6 h)(a) and comparison of integrated area for sulfate and suffite species formed(b) |
以上研究表明, SO2在不同性质矿质氧化物表面的吸附状态是不同的.可以看出, 暗反应下α-Al2O3、TiO2和CaO表面均是亚硫酸盐为主要产物.早期的研究认为, SO2可吸附于Lewis酸位点(不饱和的金属原子)形成弱吸附的SO2; 或者吸附于Lewis碱位点(暴露的氧原子)形成化学吸附的亚硫酸盐(Datta et al., 1985).本研究中光谱未检测到弱吸附的SO2红外振动峰, 故SO2可通过反应式(1)形成亚硫酸盐.
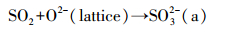 | (1) |
从红外光谱可以看到, 表面羟基也是吸附SO2的主要活性位点, 尤其是对于高度羟基化的氧化物如Al2O3、TiO2, 表面亚硫酸盐可通过反应式(2)和(3)产生(Goodman et al., 2001; Wang et al., 2016).
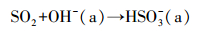 | (2) |
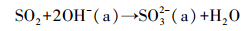 | (3) |
根据上述有无光照条件下SO2在4种氧化物表面的红外光谱结果看来, 光照可促进SO2在TiO2、CaO及α-Al2O3表面向硫酸盐的转化.TiO2是一种常见的n型半导体氧化物, 光照下可产生电子和空穴, 进而与空气中的其他组分反应生成·OH等氧化剂(Henderson 2011; Chen et al., 2012; Wang et al., 2016), 氧化SO2生成硫酸盐, 故而光照对SO2在TiO2表面的促进作用比其他氧化物更为强烈.有研究表明, 矿质氧化物的酸碱性、氧化性等会影响SO2的吸附形态和吸附容量(Fu et al., 2007; Yang et al., 2017).CaO是一种强碱性氧化物, 光照可促进SO2转化为硫酸盐; Al2O3是一种两性氧化物, 其碱性比CaO稍弱, 故而光照的促进作用也有所降低.但光照对SO2在Fe2O3上的反应无明显影响, 可能是因为氧化铁是一种强氧化性氧化物, 不需要借助其他氧化剂, 其自身就可以将SO2氧化生成硫酸盐, 因此, 光照不会影响SO2在其表面的氧化.由此可以推测出光照反应可能促进亚硫酸盐向硫酸盐转化.
4 结论(Conclusions)光照可促进SO2在TiO2、CaO及α-Al2O3表面的非均相反应, 进而增加其表面含硫物种的生成量, 即光照促进SO2在TiO2、CaO及α-Al2O3表面反应, 生成硫酸盐.但光照对SO2在Fe2O3表面的非均相反应没有明显的影响.并且结合观察到在CaO表面亚硫酸盐生成量的减少, 推测光照通过促进亚硫酸盐向硫酸盐转化, 从而加速SO2在颗粒物表面的非均相反应.
参考文献
| Al-Abadleh H A, Grassian V H. 2003. FT-IR study of water adsorption on aluminum oxide surfaces[J]. Langmuir, 19: 341–347.DOI:10.1021/la026208a |
| Armaroli T, Bécue T, Gautier S. 2004. Diffuse reflection infrared spectroscopy(DRIFTS):Application to the in situ analysis of catalysts[J]. Oil & Gas Science and Technology, 59: 215–237. |
| Baltrusaitis J, Cwiertny D M, Grassian V H. 2007. Adsorption of sulfur dioxide on hematite and goethite particle surfaces[J]. Physical Chemistry Chemical Physics, 9(41): 5542–5554.DOI:10.1039/b709167b |
| Baltrusaitis J, Jayaweera P M, Grassian V H. 2011. Sulfur dioxide adsorption on TiO2 nanoparticles:Influence of particle size, coadsorbates, sample pretreatment, and light on surface speciation and surface coverage[J]. The Journal of Physical Chemistry C, 115(2): 492–500.DOI:10.1021/jp108759b |
| Chen H H, Nanayakkara C E, Grassian V H. 2012. Titanium dioxide photocatalysis in atmospheric chemistry[J]. Chemical Reviews, 112(11): 5919–5948.DOI:10.1021/cr3002092 |
| 陈源, 谢绍东, 罗彬. 2017. 内江市大气细颗粒物化学组成及其消光特征[J]. 环境科学学报, 2017, 37(2): 485–492. |
| 陈中军, 王维, 蔡泉, 等. 2008. 用SAXS和XRD方法研究TiO2纳米颗粒微观结构[J]. 物理学报, 2008, 57(9): 5793–5799.DOI:10.7498/aps.57.5793 |
| Datta A, Cavell R G, Tower R W, et al. 1985. Claus catalysis.1.Adsorption of SO2 on the alumina catalyst studied by FTIR and EPR spectroscopy[J]. The Journal of Chemical Physics, 89(3): 443–449.DOI:10.1021/j100249a014 |
| Dupart Y, King S M, Nekat B, et al. 2012. Mineral dust photochemistry induces nucleation events in the presence of SO2[J]. Proceedings of the National Academy of Sciences, 109(51): 20842–20847.DOI:10.1073/pnas.1212297109 |
| Fu H B, Wang X, Wu H B, et al. 2007. Heterogeneous uptake and oxidation of SO2 on iron oxides[J]. The Journal of Physical Chemistry C, 111(16): 6077–6085.DOI:10.1021/jp070087b |
| Fu H B, Xu T G, Yang S G, et al. 2009. Photoinduced formation of Fe(Ⅲ)-Sulfato complexes on the surface of α-Fe2O3 and their photochemical performance[J]. The Journal of Physical Chemistry C, 113(26): 11316–11322.DOI:10.1021/jp8088275 |
| Goodman A L, Li P, Usher C R, et al. 2001. Heterogeneous uptake of sulfur dioxide on aluminum and magnesium oxide particles[J]. The Journal of Physical Chemistry A, 105: 6109–6120.DOI:10.1021/jp004423z |
| Guo S, Hu M, Zamora M L, et al. 2014. Elucidating severe urban haze formation in China[J]. Proceedings of the National Academy of Sciences, 111(49): 17373–17378.DOI:10.1073/pnas.1419604111 |
| Henderson M A, Epling W S, Peden C H F, et al. 2003. Insights into photoexcited electron scavenging processes on TiO2 obtained from studies of the reaction of O2 with OH groups adsorbed at electronic defects on TiO2(110)[J]. Journal of Physical Chemistry B, 107: 534–545.DOI:10.1021/jp0262113 |
| Henderson M A. 2011. A surface science perspective on TiO2 photocatalysis[J]. Surface Science Reports, 66(6/7): 185–297. |
| Li J, Shang J, Zhu T. 2011. Heterogeneous reactions of SO2 on ZnO particle surfaces[J]. Science China Chemistry, 54: 161–166.DOI:10.1007/s11426-010-4167-9 |
| Li W J, Shao L Y, Zhang D Z, et al. 2016. A review of single aerosol particle studies in the atmosphere of East Asia:morphology, mixing state, source, and heterogeneous reactions[J]. Journal of Cleaner Production, 112: 1330–1349.DOI:10.1016/j.jclepro.2015.04.050 |
| 李本纲, 张宇, 崔司宇, 等. 2016. 中国硫酸盐气溶胶直接辐射效应数值模拟[J]. 环境科学学报, 2016, 36(5): 1524–1529. |
| 李兆, 江元汝, 赵西成, 等. 2013. 水热-热解法合成不同形貌的α-Al2O3粉体[J]. 材料研究学报, 2013(4): 41–45. |
| Liu C, Ma Q X, Liu Y C, et al. 2012. Synergistic reaction between SO2 and NO2 on mineral oxides:a potential formation pathway of sulfate aerosol[J]. Physical Chemistry Chemical Physics, 14(5): 1668–1676.DOI:10.1039/C1CP22217A |
| Liu F D, He H. 2010. Structure-activity relationship of iron titanate catalysts in the selective catalytic reduction of NOx with NH3[J]. The Journal of Physical Chemistry C, 114(40): 16929–16936.DOI:10.1021/jp912163k |
| 马金珠, 刘永春, 马庆鑫, 等. 2011. 大气非均相反应及其环境效应[J]. 环境化学, 2011, 30(1): 97–119. |
| 马庆鑫, 马金珠, 楚碧武, 等. 2015. 矿质和黑碳颗粒物表面大气非均相反应研究进展[J]. 科学通报, 2015, 60(2): 122–136. |
| Mauldin Ⅲ R L, Berndt T, Sipil? M, et al. 2012. A new atmospherically relevant oxidant of sulphur dioxide[J]. Nature, 488(7410): 193–196.DOI:10.1038/nature11278 |
| Nanayakkara C E, Pettibone J, Grassian V H. 2012. Sulfur dioxide adsorption and photooxidation on isotopically-labeled titanium dioxide nanoparticle surfaces:roles of surface hydroxyl groups and adsorbed water in the formation and stability of adsorbed sulfite and sulfate[J]. Physical Chemistry Chemical Physics, 14(19): 6957–6966.DOI:10.1039/c2cp23684b |
| Pacchioni G, Clotet A, Ricart J M. 1994. A theoretical study of the adsorption and reaction of SO2 at surface and step sites of the MgO(100) surface[J]. Surface Science, 315: 337–350.DOI:10.1016/0039-6028(94)90137-6 |
| Park J Y, Jang M. 2016. Heterogeneous photooxidation of sulfur dioxide in the presence of airborne mineral dust particles[J]. RSC Advances, 6(63): 58617–58627.DOI:10.1039/C6RA09601H |
| Park J, Jang M, Yu Z C. 2017. Heterogeneous photooxidation of SO2 in the presence of two different mineral dust particles:Gobi and arizona dust[J]. Environmental Science & Technology, 51(17): 9605–9613. |
| Ravishankara A R. 1997. Heterogeneous and multiphase chemistry in the troposphere[J]. Science, 276(5315): 1058–1065.DOI:10.1126/science.276.5315.1058 |
| Rubasinghege G, Elzey S, Baltrusaitis J, et al. 2010. Reactions on atmospheric dust particles:surface photochemistry and size-dependent nanoscale redox chemistry[J]. The Journal of Physical Chemistry Letters, 1(11): 1729–1737.DOI:10.1021/jz100371d |
| Shang J, Li J, Zhu T. 2010. Heterogeneous reaction of SO2 on TiO2 particles[J]. Science China Chemistry, 53(12): 2637–2643.DOI:10.1007/s11426-010-4160-3 |
| Sullivan R C, Guazzotti S A, Sodeman D A, et al. 2007. Direct observations of the atmospheric processing of Asian mineral dust[J]. Atmospheric Chemistry & Physics, 7(5): 1213–1236. |
| 汤大钢, 刘红杰, 王玮, 等. 2000. 中国华北地区冬季大气污染物航空测量(Ⅰ)-空中气态污染物污染特征研究[J]. 环境科学研究, 2000, 13(1): 6–9. |
| Toledano D S, Henrich V E. 2001. Kinetics of SO2 adsorption on photoexcited α-Fe2O3[J]. The Journal of Physical Chemistry B, 105(18): 3872–3877.DOI:10.1021/jp003327v |
| Ullerstam M, Vogt R, Langer S, et al. 2002. The kinetics and mechanism of SO2 oxidation by O3 on mineral dust[J]. Physical Chemistry Chemical Physics, 4(19): 4694–4699.DOI:10.1039/B203529B |
| Usher C R, Al-Hosney H, Carlos-Cuellar S, et al. 2002. A laboratory study of the heterogeneous uptake and oxidation of sulfur dioxide on mineral dust particles[J]. Journal of Geophysical Research:Atmospheres, 107(D23): 4713.DOI:10.1029/2202JD002051 |
| Usher C R, Michel A E, Grassian V H. 2003. Reactions on mineral dust[J]. Chemical Reviews, 103(12): 4883–4939.DOI:10.1021/cr020657y |
| 王玮, 汤大钢, 刘红杰, 等. 2000. 中国华北地区冬季大气污染物航空测量(Ⅱ)——空中大气气溶胶污染特征研究[J]. 环境科学研究, 2000, 13(1): 10–13. |
| 王占山, 李云婷, 孙峰, 等. 2016. 2015年1月下旬北京市大气污染过程成因分析[J]. 环境科学学报, 2016, 36(7): 2324–2331. |
| Wang H M, You C F. 2016. Photocatalytic removal of low concentration SO2 by titanium dioxide[J]. Chemical Engineering Journal, 292: 199–206.DOI:10.1016/j.cej.2016.02.017 |
| Wang Y X, Zhang Q Q, Jiang J K, et al. 2014. Enhanced sulfate formation during China's severe winter haze episode in January 2013 missing from current models[J]. Journal of Geophysical Research:Atmospheres, 119(17): 425–440. |
| Wang Z, Pan X L, Uno I, et al. 2017. Significant impacts of heterogeneous reactions on the chemical composition and mixing state of dust particles:A case study during dust events over northern China[J]. Atmospheric Environment, 159: 83–91.DOI:10.1016/j.atmosenv.2017.03.044 |
| 翁诗甫. 2010. 傅里叶变换红外光谱分析(第2版)[M]. 北京: 化学工业出版社. |
| 吴涧, 蒋维楣, 刘红年, 等. 2002. 硫酸盐气溶胶直接和间接辐射气候效应的模拟研究[J]. 环境科学学报, 2002, 22(2): 131–134. |
| 吴玲燕, 佟胜睿, 葛茂发. 2015. 大气中SO2和HCOOH在CaO表面的耦合相互作用[J]. 化学学报, 2015, 73(2): 131–136. |
| Yang W W, He H, Ma Q X, et al. 2016. Synergistic formation of sulfate and ammonium resulting from reaction between SO2 and NH3 on typical mineral dust[J]. Physical Chemistry Chemical Physics, 18(2): 956–964.DOI:10.1039/C5CP06144J |
| Yang W W, Zhang J H, Ma Q X, et al. 2017. Heterogeneous reaction of SO2 on manganese oxides:The effect of crystal structure and relative humidity[J]. Scientific Reports, 7(1): 4550.DOI:10.1038/s41598-017-04551-6 |
| Yu Z C, Jang M, Park J. 2017. Modelling atmospheric mineral aerosol chemistry to predict heterogeneous photooxidation of SO2[J]. Atmospheric Chemistry & Physics, 17(16): 10001–10017. |
| Zhang R Y, Wang G H, Guo S, et al. 2015. Formation of urban fine particulate matter[J]. Chemical Reviews, 115(10): 3803–3855.DOI:10.1021/acs.chemrev.5b00067 |
| Zhang X Y, Zhuang G S, Chen J M, et al. 2006. Heterogeneous reactions of sulfur dioxide on typical mineral particles[J]. Journal of Physical Chemistry B, 110(25): 12588–12596.DOI:10.1021/jp0617773 |
| Zheng B, Zhang Q, Zhang Y, et al. 2015. Heterogeneous chemistry:a mechanism missing in current models to explain secondary inorganic aerosol formation during the January 2013 haze episode in North China[J]. Atmospheric Chemistry & Physics, 15(4): 2031–2049. |
| Zhu T, Shang J, Zhao D F. 2011. The roles of heterogeneous chemical processes in the formation of an air pollution complex and gray haze[J]. Science China Chemistry, 54(1): 145–153.DOI:10.1007/s11426-010-4181-y |
