 , 杨磊1
, 杨磊1
 , 李守娟1,2, 向倩1,2, 孙龙1, 方力3, 陈利顶1,2
, 李守娟1,2, 向倩1,2, 孙龙1, 方力3, 陈利顶1,21. 中国科学院生态环境研究中心城市与区域生态国家重点实验室, 北京 100085;
2. 中国科学院大学, 北京 100049;
3. 浙江省海产品健康危害因素关键技术研究重点实验室(舟山市疾病预防控制中心), 舟山 316021
收稿日期: 2017-08-11; 修回日期: 2017-10-11; 录用日期: 2017-10-11
基金项目: 国家自然科学基金(No.41571130064,41701018);中国博士后科学基金(No.Y7H1471205)
作者简介: 赵方凯(1993-), 男, E-mail:fkzhao_st@rcees.ac.cn
通讯作者(责任作者): 杨磊, E-mail:leiyang@rcees.ac.cn
摘要: 阐明土壤抗生素的空间分布特征对于认识抗生素的空间扩散和迁移过程、控制土壤抗生素污染、维护土壤安全具有重要意义.本研究通过空间采样,系统分析了长三角地区典型城郊流域土壤抗生素的空间分布特征,并探讨了人类活动、土壤性质和微生物群落对土壤抗生素分布的影响.结果表明,农田土壤中抗生素含量显著高于园地和林地,其中,检出浓度顺序为:四环素类(TCs)>喹诺酮类(QNs)>大环内酯类(MLs)>磺胺类(SAs),平均含量分别为41.43、11.38、0.15、0.09 μg·kg-1,农田土壤抗生素含量与有机肥施用密切相关.Spearman相关分析结果表明,TCs、QNs、SAs及抗生素总含量与距城镇距离、距道路距离、海拔及C/N具有显著的负相关性(p<0.05),表明这3类抗生素的空间分布受人类活动的强烈影响,而MLs含量与人类活动的关系则较弱.土壤养分、颗粒组成、pH、容重等对抗生素的吸附、迁移、降解等环境行为具有强烈的影响,其空间异质性影响了土壤抗生素空间分布的差异性.土壤微生物群落与土壤抗生素之间具有较为复杂的联系,研究发现,部分变形菌门、酸杆菌门、拟杆菌门、放线菌门及浮霉菌门细菌与土壤抗生素含量呈现负相关.方差分解分析揭示出土壤性质、人类活动及其相互作用是土壤抗生素空间分布的主要影响因素,对土壤抗生素分布空间变化的总解释度接近于58%,达到了较高水平.
关键词:土壤抗生素空间分布人类活动土壤性质微生物群落
Affecting factors of the spatial distribution of antibiotics in soils in typical peri-urban area of Yangtze River Delta
ZHAO Fangkai1,2
 , YANG Lei1
, YANG Lei1
 , LI Shoujuan1,2, XIANG Qian1,2, SUN Long1, FANG Li3, CHEN Liding1,2
, LI Shoujuan1,2, XIANG Qian1,2, SUN Long1, FANG Li3, CHEN Liding1,2 1. State Key Laboratory of Urban and Regional Ecology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085;
2. University of Chinese Academy of Sciences, Beijing 100049;
3. Key Laboratory of Health Risk Factors for Seafood of Zhejiang Province(Zhoushan Municipal District Center for Disease Control and Prevention), Zhoushan 316021
Received 11 August 2017; received in revised from 11 October 2017; accepted 11 October 2017
Supported by the National Natural Science Foundation of China (No.41571130064, 41701018) and the China Postdoctoral Science Foundation(No.Y7H1471205)
Biography: ZHAO Fangkai(1993—), male, E-mail:fkzhao_st@rcees.ac.cn
*Corresponding author: YANG Lei, E-mail:leiyang@rcees.ac.cn
Abstract: Identifying the spatial distribution of antibiotics in soils can help understanding the antibiotics' spatial diffusion and migration processes in environment. This can provide scientific guidance for decreasing soil antibiotic pollution and sustaining soil security. To explore the spatial distribution characteristics of soil antibiotics and their affecting factors, we determined the concentrations of antibiotics in 82 soil samples from a typical peri-urban area of Yangtze River Delta based on field sampling and laboratory analysis. Results of this study showed that the concentrations of antibiotics in cropland were significantly higher than that in orchard and forest. In cropland soil, significant differences were found between different groups of antibiotics:tetracyclines (TCs) > quinolones (QNs) > macrolides (MLs) > sulfonamides (SAs), with average concentrations of 41.43、11.38、0.15、0.09 μg·kg-1, respectively. The concentrations of antibiotics in cropland were closely related to organic fertilizer. Significant negative correlations (p < 0.05) were found between the concentrations of TCs, QNs and SAs in soils and distance to town, distance to road, altitude, and soil C/N ratio by Spearman correlation analysis. This indicated that the concentrations of these antibiotics in soils were strongly influenced by human activities. However, there were no significant correlation between MLs concentrations in soils and human activities. Besides, result of this study also found that soil properties, such as soil nutrient, soil texture, pH, and bulk density, could change the sorption, migration and degradation processes of antibiotics in soil environment. Soil properties should be considered as the critical factors of spatial distribution of soil antibiotics. In addition, soil bacterial communities had a complex relation with soil antibiotics. The soil bacterial communities can affect the biodegradation of antibiotics, while some antibiotics can be produced by natural bacteria. According to RDA analysis, Proteobacteria, Acidobacteria, Bacteroidetes, Actinobacteria and Planctomycetes had negative correlation with the concentration of antibiotics in soils. The variance partitioning analysis differentiate the effects of different affecting factors on spatial distribution of soil antibiotics with a total explained variance of 58%, and found the soil properties, human activities and their interactions were the main affecting factors.
Key words: soilsantibioticsspatial distributionhuman activitiessoil propertiesbacterial communities
1 引言(Introduction)抗生素被广泛应用于人类与动物疾病治疗和预防及禽畜饲料添加剂等多个领域(Tasho et al., 2016).据报道,2010年全球抗生素使用量达到了10~20万t(Tasho et al., 2016),而我国2013年抗生素使用量约为16.2万t(Zhang et al., 2015).由于抗生素不能完全被人或动物充分吸收利用,大部分被排出体外,最后进入水体或土壤环境.Zhang等(2015)评估认为我国2013年有5.4万t抗生素被人或动物排出体外,其中,5.38万t进入环境中造成抗生素污染.同时,在强烈的抗生素选择压力下,抗生素抗性基因(Antibiotic Resistance Genes,ARGs)也普遍出现在环境中,并且抗生素抗性的快速增强导致抗生素有效性降低,对人类和生态系统健康造成威胁(Martinez, 2009).
畜禽养殖中抗生素的大量使用,使得未吸收利用的抗生素进入畜禽粪便,而畜禽粪便又是有机肥的主要来源(赵方凯等, 2017).富含抗生素的有机肥施用是农田土壤抗生素污染的重要来源,再生水灌溉也会导致土壤中抗生素含量过高(Du et al., 2012; Wang et al., 2014),这一系列人类活动是抗生素进入土壤的主要途径.抗生素进入土壤后其含量及分布特征与其环境行为密切相关,而其环境行为又受到土壤性质的强烈影响(赵方凯等, 2017).已有研究表明,土壤抗生素的吸附、迁移、降解等环境行为受到土壤有机质、pH及土壤种类等的影响(Blackwell et al., 2009; Blackwell et al., 2007).另外,虽然抗生素可以有效杀灭微生物,但在长期暴露的条件下,微生物可以逐渐适应抗生素,并诱导产生抗性基因(刘元望等, 2016),尤其在普遍使用有机肥的农田土壤,富含抗生素的有机肥可以显著增加抗生素抗性基因的丰度(Zhao et al., 2017),最终导致微生物对抗生素产生耐药性,降低抗生素的有效性(Dubourg et al., 2017),甚至部分微生物可以产生相应降解酶降解抗生素(刘元望等, 2016).研究表明,土壤抗生素污染主要来源于人类活动(Martinez, 2009),其空间分布则是人类活动、土壤特征等多重因素综合作用的结果,目前关于土壤抗生素空间分布的研究多是针对不同管理措施的定性比较,针对人类活动、土壤特征、微生物等对土壤抗生素空间分布的影响及其量化表征则研究较少.
虽然已有研究针对土壤中抗生素分布及其环境行为的影响因素进行了探讨(赵方凯等, 2017),但目前均是分析和比较单一因素的作用,缺少对多个因素对土壤抗生素空间分布的综合作用研究.城郊地区有机肥施用量大,土壤中抗生素残留量高,尤其在我国长三角地区尤为显著(葛林科等, 2015).探讨城郊地区土壤抗生素的空间分布特征及其影响因素,对于揭示土壤环境中抗生素的迁移转化途径,维护土壤安全和提升土壤生态系统服务具有重要意义.本研究选取长三角地区典型城郊流域,通过空间分布式采样和实验室分析,对流域内人类活动进行定量化表征,探讨城郊地区土壤抗生素分布的关键影响因素,并初步探讨人类活动、土壤性质和微生物群落对土壤抗生素分布的综合作用.
2 材料与方法(Materials and methods)2.1 研究区概况与样品采集研究区樟溪流域位于浙江省宁波市郊区,面积为89.7 km2,属亚热带季风气候,多年平均温度为16.3 ℃,平均降雨量为1341~1961 mm.流域位于四明山区向宁绍平原的过渡地带,主要土壤类型为水稻土、红壤及黄红壤亚类,主要土地利用类型有林地、农田、园地、城镇建设用地和水域,土地利用受城镇扩张影响较大.流域内农田主要分布于溪谷平原,主要种植贝母,也有部分农田种植水稻、花生、蔬菜、果树等.
在流域内综合考虑地形特征、土壤类型、土地利用、城镇格局等因素布设土壤采样点82个,其中,农田样点42个、园地样点11个及林地样点29个.在每个采样点采集0~10 cm表层土壤样品,并在各个样点将随机采集的土壤样品均匀混合后装入自封袋.将每个土壤样品分为两份,一份装入放有干冰的保温箱内带回实验室,保存于-20 ℃冰箱中用于抗生素和微生物分析,另一份自然风干后测量土壤基本理化性质.本研究中土壤样品均于2016年7月采集.
2.2 土壤抗生素影响因素测定土壤理化性质采用常规方法分析(Sun et al., 2016; Tang et al., 2004; Zheng et al., 2009),其中,土壤容重(BD)和含水量(SMC)采用环刀取样以后烘干测量,每个样点取6次测量平均值作为该样点容重和土壤含水量.土壤颗粒组成采用激光粒度仪测定.有机质(SOM)采用重铬酸钾容量法(外加热法)进行测量,土壤pH采用土壤和水比例为1:2.5平衡后用pH计测定,总碳(TC)和总氮(TN)通过元素分析仪测量,速效磷(AP)采用0.5 mol·L-1 NaHCO3法提取,速效钾(AK)采用醋酸铵浸提,火焰光度法测量.
人类的可达性可以有效表征人类活动的强度,如空间距离和海拔高度等(Forman, 1998; Nogues-Bravo et al., 2008).另外,土地利用也是人类活动的重要表现形式,并且土地利用可以显著改变土壤的C/N(罗由林等, 2015).因此,选择距离道路距离(DR)、距离城镇距离(DT)、海拔(Altitude)及C/N来间接表征人类活动强度.DR和DT采用谷歌地球软件进行测量,海拔高度采用GPS测量.C/N根据实验测量所得总碳和总氮计算得到.在流域内选取29个不同土地利用的典型样点,采用高通量测序识别土壤微生物群落结构,在Illumina Miseq平台(Novogene)上对16S RNA进行扩增、纯化、定量、合并及排序(Zhu et al., 2017).
2.3 抗生素提取方法根据已发表文献(Gao et al., 2012; Zhou et al., 2017)的方法,土壤样品经冷冻干燥后研磨过60目筛,称取2.00 g样品,加入7.5 mL Na2EDTA-Mcllvaine缓冲液和7.5 mL有机溶剂(乙腈:甲醇:丙酮=2:2:1,体积比),依次进行涡旋、超声、离心.重复3次并合并上清液,稀释并过滤后调节pH至3.5.
对Oasis HLB柱预先使用6 mL丙酮、6 mL甲醇和6 mL Na2EDTA溶液(0.5 g·L-1,pH=3.5)进行活化,随后进行固相萃取,最后用5 mL超纯水和5 mL含5%甲醇的水溶液淋洗柱子,并抽真空20 min,再用3 mL甲醇、5 mL含1%甲酸的甲醇洗脱抗生素.洗脱液经氮吹近干后,用混合溶剂(甲醇:含1%甲酸的水溶液=1:1,体积比)定容至1 mL,冷藏于-20 ℃冰箱待HPLC-MS/MS测定.
利用高效液相色谱(Thermo Dionex Ulitmate 3000)串联三重四级杆质谱(Thermo TsQ Vantange)进行抗生素定量测定,流动相A为0.2%甲醇水溶液,B为甲醇:乙腈混合液(4:6,体积比).梯度洗脱程序设置为:0 min时88%A,0.5 min时88%A,6.0 min时70%A,9.0 min时50%A,9.5 min时5%A,12.5 min时5%A,12.7 min时88%A,15 min时88%A.各种抗生素(表 1)回收率良好,变化范围为64.45%~107.59%.
表 1(Table 1)
| 表 1 本研究选取的目标抗生素 Table 1 The selected target antibiotics in this study | ||||||||||
表 1 本研究选取的目标抗生素 Table 1 The selected target antibiotics in this study
| ||||||||||
2.4 统计分析不同土地利用类型土壤中不同种类抗生素含量使用SPSS22中的Kolmogorov-Smirnov非参数检验进行统计分析,并通过Spearman相关性分析检验抗生素含量与人类活动指标的关系.通过主坐标分析(PCoA)来识别不同土地利用类型土壤中抗生素的分布特征,人类活动因素和环境因素对抗生素分布的影响通过冗余分析(RDA)来表现,PCoA和RDA均使用Canoco 5进行分析并绘图.
3 结果与讨论(Results and discussion)3.1 不同土地利用类型土壤中抗生素组成及空间分布特征土壤样品中各类抗生素含量水平及空间分布如图 1所示,TCs的检出含量较高,最高为373.13 μg·kg-1,其中,CTC含量相对较高,最高为324.73 μg·kg-1;QNs的检出含量次之,最高为45.79 μg·kg-1,其中OFL、NOR及CIP所占比例较高,最高含量分别为21.66、12.84和12.26μg·kg-1;SAs和MLs含量相对较低,最高含量分别为0.38、0.55 μg·kg-1,SAs主要为SMZ和SMX,MLs主要为ERY.
图 1(Fig. 1)
 |
| 图 1 不同类型土壤抗生素的空间分布 (a.TCs, b.QNs, c.SAs, d.MLs) Fig. 1Spatial distribution of different types of antibiotics in soils |
通过Kolmogorov-Smirnov非参数检验(表 2),发现农田土壤中TCs和QNs含量显著高于园地和林地,并且园地TCs也显著高于林地.但在林地土壤中,TCs含量显著低于QNs和MLs含量,其中,QNs平均含量相对较高.通过对土壤抗生素含量进行主坐标分析(图 2),发现农田土壤中抗生素含量及组成与园地和林地有较为明显的区别,而园地和林地差异较小.
表 2(Table 2)
| 表 2 不同土地利用类型土壤抗生素含量 Table 2 Concentrations of antibiotics in soils unnder different land use types | |||||||||||||||||||||||||||
表 2 不同土地利用类型土壤抗生素含量 Table 2 Concentrations of antibiotics in soils unnder different land use types
| |||||||||||||||||||||||||||
图 2(Fig. 2)
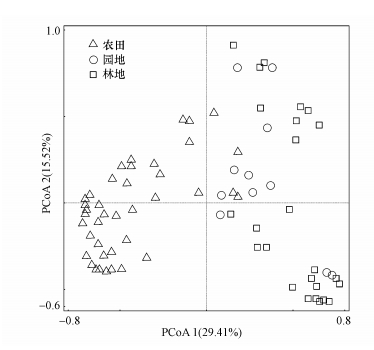 |
| 图 2 不同土地利用类型土壤抗生素组成的主坐标分析 Fig. 2Principal coordinates analysis of composition and concentration of antibiotics in soil under different land use types |
对不同土地利用类型土壤中抗生素组成的差异,已有许多****开展了相关研究,尤其是对施用有机肥的农田或蔬菜生产基地土壤抗生素分布开展了许多研究.研究发现,施用有机肥的土壤具有与有机肥相似的抗生素组成特征,TCs和QNs具有较高的含量,而SAs含量较低(Wang et al., 2017).通过对比本研究中农田土壤抗生素组成与Zhang等(2016a)对有机肥中抗生素含量与组成特征的研究,可以发现农田土壤抗生素与有机肥中抗生素组成具有高度的一致性.Li等(2015)对北京部分频繁施用粪肥的绿色大棚土壤中抗生素含量进行分析,发现TCs含量(102 μg·kg-1)最高,QNs含量次之(86 μg·kg-1),SAs和MLs含量较低,这与本研究结论也基本一致.有机肥施用可显著增加土壤中抗生素的含量,并且存留时间达到4个月以上(Zhou et al., 2017),尤其是长期连续施肥,TCs、QNs和SAs作为有机肥中的主要抗生素种类,会通过淋溶等过程进入土壤中并逐年累积(Solliec et al., 2016; Wang et al., 2017).因此,可以认为有机肥施用的强度决定了农田土壤抗生素含量.
3.2 人类活动的影响本研究选择距道路距离(DR)、距城镇距离(DT)、海拔(Altitude)及C/N来间接表征人类活动强度,研究人类活动强度对不同类型抗生素空间分布的影响.表 3相关分析结果表明,TCs、QNs、SAs与人类活动强度指标具有显著的负相关性;而MLs与人类活动并没有显著相关.这一结果表明人类活动会显著影响土壤中TCs、QNs、SAs类抗生素含量,随着人类活动增强土壤中这几类抗生素含量急剧增加,而MLs类抗生素受人类活动影响相对较弱.通过冗余分析对人类活动强度的影响进行判别,TCs、QNs和SAs与距道路距离、海拔及C/N均呈现负相关关系,而距城镇距离对MLs的分布影响更为强烈(图 3).
图 3(Fig. 3)
 |
| 图 3 人类活动对土壤抗生素分布影响的冗余分析 Fig. 3Redundancy analysis for the quantitative correlation between antibiotics and intensity of human activities |
表 3(Table 3)
| 表 3 土壤抗生素含量与人类活动指标的Spearman相关性 Table 3 Spearman correlation between antibiotic concentration in soil and intensity of human activities | |||||||||||||||||||||||||||||||||||
表 3 土壤抗生素含量与人类活动指标的Spearman相关性 Table 3 Spearman correlation between antibiotic concentration in soil and intensity of human activities
| |||||||||||||||||||||||||||||||||||
由于距离城镇较远的地区,也存在部分农田,并且发达的道路网络能够使人更易对农田土壤进行管理,所以距城镇距离对TCs、QNs和SAs 3种抗生素的影响相对较弱.而MLs由于其较低的吸附能力,更易受径流和入渗的影响,随水流迁移进入水体或进入地下水,导致表层土壤MLs含量较低,相比而言,林地表层土壤由于林冠截留的作用,受降雨影响较小,表层土壤MLs含量相对较高(Davis et al., 2006; Jent et al., 2013).土壤中MLs有多种来源,包括作为土壤微生物的代谢产物、大气降雨等,人类活动也是一项重要来源.但MLs由于其自身的分子特性,易发生迁移和降解等环境行为,受环境条件影响较大,因此,虽然人类活动能造成MLs在土壤中较高的环境负荷,但其在土壤中的最终含量与人类活动关系不显著(Tasho et al., 2016).Li等(2016)的研究也发现,水体中抗生素含量与裸地面积呈正相关,这是由于裸地缺少植被覆盖,更易产生径流,导致抗生素随径流迁移,而水体中TCs含量与开发区面积(包括公共建筑区、工业区及居住区)具有显著正相关,表明人类活动是水体中TCs的主要来源.除水文条件以外,研究发现抗生素含量也受到游客的强烈影响,由于游客的行为,导致药品及个人护理品(PPCPs)的购买量及使用量具有较大幅度的变化,从而影响环境中相应污染物的含量,所以当地的旅游产业也可能导致林地土壤中QNs及MLs具有较高的检出率及含量水平(Mandaric et al., 2017).另外,部分微生物也可以在自然条件下产生抗生素,导致林地土壤相应抗生素含量升高(Kelsic et al., 2015).
在规模化禽畜饲养基地,抗生素作为饲料添加剂及生长促进剂被大量使用,最终大部分被排入周边环境,导致禽畜饲养基地周围土壤抗生素含量远高于其他地区(Aust et al., 2008; Zhou et al., 2013).同样由于人类在鱼塘等水产养殖场地大量使用抗生素,导致水体和沉积物中抗生素逐渐累积,并且通过鱼塘水灌溉或者农田施用底泥,最终进入农田土壤中(Kim et al., 2017; Song et al., 2016).因此,可以认为土地利用及管理措施是影响土壤抗生素含量的重要因素.以上相关研究证明,人类活动是土壤抗生素污染的主要来源,人类活动强烈的地区,土壤抗生素具有较高的含量水平.
3.3 土壤性质的影响土壤性质和不同类型抗生素的RDA分析结果表明,速效磷和速效钾对土壤中TCs、QNs及SAs具有较强的影响,而对MLs的作用则有所不同(图 4).土壤容重、pH和土壤养分与TCs、QNs和SAs的关系密切,对MLs的影响较弱.土壤含水量及粉粒含量与MLs含量具有正相关关系.
图 4(Fig. 4)
 |
| 图 4 土壤性质对土壤抗生素分布影响的RDA分析 Fig. 4Redundancy analysis for the quantitative correlation between antibiotics and soil properties |
有机肥和化肥施用是土壤氮、磷、钾的重要来源,有机肥施用可以持续提高土壤速效养分的含量(Hooda et al., 2001; 林治安等, 2009).研究区内农田普遍存在大量施用氮磷钾(NPK)化肥、复合肥及有机肥的现象,这可能是导致土壤中TCs、QNs和SAs 3种抗生素含量与TN、AP和AK具有正相关性的原因之一.另外,通过与阳离子形成络合物,可以显著提高抗生素吸附量,并且通过对比K+、Ca2+、Na+ 3种离子对土霉素吸附的影响,发现含K+的土壤中土霉素含量最高(鲍艳宇等, 2009),而且长期施用NPK能够导致土壤阳离子交换量、氧化铁含量等显著上升,从而导致土壤对抗生素的吸附能力增强(Schj?Nning et al., 1994).
土壤容重、pH、有机质和土壤颗粒组成也可以影响抗生素的吸附迁移,导致土壤中抗生素含量的变化,其中pH作为一项重要影响因素,既可以影响土壤矿物电荷性质,也可以影响抗生素的电荷状态,从而影响抗生素的吸附.本研究中土壤pH变化范围为4.02~6.91,而SAs抗生素最大吸附量发生在中性pH值左右,表现出与pH具有较强的正相关性;但其他抗生素只有部分化合物具有此种特性,如OTC于中性pH值左右在土壤中金属氧化物上具有较大吸附量,但大多数化合物随pH上升,吸附能力呈下降趋势,所以TCs、QNs和MLs与pH的正相关较弱(MacKay et al., 2005; Pan et al., 2017; Zhang et al., 2014; 齐会勉等, 2009).本研究中RDA表明抗生素含量受到土壤粉粒影响,尤其是MLs和SAs,可能是由于土壤中黏粒含量较低,而砂粒吸附性能较差,导致大部分抗生素吸附在粉粒上;土壤黏粒含量对TCs、QNs及SAs表现出强烈的负影响,而有部分研究发现土壤抗生素在黏粒中具有较高的吸附量,这与本研究结果不一致.这一方面可能是由于在本研究区,土壤黏粒含量并不是其主要影响因素,另一方面也有研究发现,在4~7的土壤pH变化范围内,黏粒含量较低的土壤中抗生素含量反而较高(Srinivasan et al., 2013; Tasho et al., 2016).研究发现, 除土壤pH以外,还有许多其他因素也可以导致土壤中抗生素在黏粒上吸附量的下降,如溶解有机质、阳离子交换能力等(Tolls, 2001);由于砂粒含量的上升,导致土壤中吸附能力较弱的抗生素(SAs和MLs)能够经由孔隙水等进行迁移,所以与土壤砂粒含量呈现负相关,而由于TCs和QNs的吸附能力相对较强,其与砂粒含量关系不明显.因此可以认为,土壤性质与抗生素的吸附、迁移、降解等环境行为密切相关,其中,pH值和速效钾含量影响更为强烈.
3.4 微生物群落的影响微生物不仅受到抗生素的影响,部分微生物甚至能反过来影响抗生素的含量,并且部分抗生素也是微生物分解的自然产物.在测定的微生物群落中,选择总比例达到90%以上的8个优势种进行分析.根据冗余分析结果(图 5),变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)及浮霉菌门(Planctomycetes)与抗生素具有较为密切的关系.而绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)和芽单胞菌门(Gemmatimonadetes)对土壤抗生素分布的作用较弱.
图 5(Fig. 5)
 |
| 图 5 微生物群落对土壤抗生素分布影响的RDA分析 Fig. 5Redundancy analysis for the quantitative correlation between antibiotics and bacterial communities |
研究发现,土壤有机肥施用可以显著改变微生物群落(Lin et al., 2016),Hammesfahr等(2008)发现农田土壤施用猪粪会导致微生物群落丰度的短时普遍下降.但长期施用牛粪的情况下,会导致土壤微生物量、活性及多样性的增加,并且改变微生物群落结构(Peacock et al., 2001; Zhong et al., 2010).微生物活性与抗生素降解速率关系密切,并且抗性菌数量及多样性的增加使得抗生素有效性下降,并加快抗生素的降解(Le et al., 2005; Pan et al., 2016).关于微生物对抗生素的降解作用已经进行了大量研究.例如,SAs可以有效杀灭变形菌门细菌,但部分变形菌门细菌在污泥中也可以成为降解SAs的主要物种,有研究证实厚壁菌门和拟杆菌门细菌可能是磺胺的主要降解菌,这些均可能导致SAs与其呈负相关(Liao et al., 2016b; Yang et al., 2016),但本研究中由于没有在选定的土壤样品中检测出磺胺,导致SAs与厚壁菌门和拟杆菌门关系不明显.有研究发现,在活性污泥里,部分拟杆菌门细菌在四环素的选择压力下,随四环素含量增加逐渐降低,与四环素具有负相关关系(Zhang et al., 2016b);在多次施肥条件下,部分厚壁菌门、变形菌门、放线菌门细菌是金霉素的主要抗性细菌,并加速其降解(Fang et al., 2016).Liao等(2016a)发现在添加环丙沙星的情况下,经过28 d培育,某些拟杆菌门和放线菌门细菌都可以消除环丙沙星,将其作为碳氮来源.这些结论与图 5所示结果相似.以上相关研究表明,在抗生素的作用下,部分细菌群落被有效杀灭,呈下降趋势;也有部分细菌可以适应抗生素环境并产生相关降解酶降解抗生素.
除了被微生物降解以外,抗生素作为一项微生物的自然代谢产物,与微生物的关系也受到广泛关注(Martinez, 2008).ERY是糖多孢红霉菌(Saccharopolyspora erythraea,放线菌门)经过发酵得到的自然产物(Topp et al., 2016),但本研究中MLs与放线菌门呈负相关,这可能是因为部分放线菌门细菌对MLs的强烈降解作用导致其呈现负相关.
3.5 不同影响因素的共同驱动作用方差分解分析结果表明,微生物群落、人类活动及土壤性质对土壤抗生素分布的总解释度达到84.7%(图 6),其中,土壤性质的解释度最高(25.2%),人类活动次之(17.4%),微生物群落最低(6.9%).人类活动、土壤性质及两者之间的相互作用解释度处于相似水平,并且三者共同贡献了58%的解释度.而人类活动和土壤性质与微生物群落的相互作用解释度最低,分别为2.7%和1.3%.三者之间的共同作用解释度也较高,达到了15.8%.
图 6(Fig. 6)
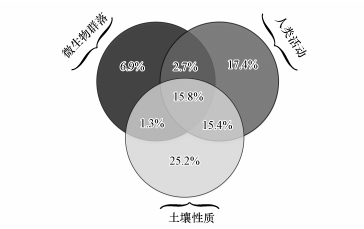 |
| 图 6 不同因素对土壤抗生素分布影响的方差分解分析 (残差15.3%) Fig. 6Partial redundancy analysis differentiated the effects of bacterial communities, human activities and soil properties on the distribution of antibiotics in soils |
抗生素抗性基因(ARGs)与抗生素密切相关,有关其分布的主要影响因素已进行了部分探讨,因而可以为土壤中抗生素的分布研究提供参考.例如,通过对中国大陆主要入河口ARGs分布进行分析,发现人为因子与环境因子共同解释了61.71%的方差变化,而细菌群落只解释了2.61%的方差变化(Zhu et al., 2017).但抗生素仍是ARGs分布的主要影响因素,尤其是在人类活动强烈的区域.例如,在武汉城市湖泊表层水体中,抗生素对ARGs的分布解释了49.11%(Yang et al., 2017).目前对于环境中抗生素迁移分布影响因素的综合研究较少,Liang等(2017)认为土壤性质及植物性状对土壤中抗生素的耗散累计解释了59.04%,但对ARGs的累计解释度高达95.46%.本研究中方差分解表明土壤性质及其与其他因子之间的共同作用解释了57.7%(图 6),与Liang等(2017)的研究结果相近.根据方差分解分析,可以认为人类活动和土壤性质及其相互作用是土壤抗生素分布的主要影响因素.
4 结论(Conclusions)1) TCs、QNs及SAs与人类活动指标具有显著的负相关性(p<0.05),甚至大部分达到了极显著水平(p<0.01),表明这3种抗生素主要来源于人类活动,而MLs与人类活动没有显著相关性.
2) 土壤性质与土壤抗生素含量密切相关,其中土壤pH能够强烈影响抗生素的吸附、迁移、降解等环境行为,从而影响其分布;而土壤养分,尤其是速效钾,与土壤抗生素表现出正相关关系,表明长期施肥条件下土壤对抗生素吸附能力的增强.
3) 土壤微生物群落结构与抗生素分布关系较为复杂,既受到抗生素的制约,又可以有效降解抗生素.其中,变形菌门、酸杆菌门、拟杆菌门、放线菌门及浮霉菌门细菌均对抗生素具有较强的影响,而绿弯菌门、厚壁菌门和芽单胞菌门细菌等影响作用较弱.
4) 不同土地利用类型通过人类活动强度、土壤性质及微生物群落结构的改变,显著影响土壤抗生素分布.通过方差分解分析,发现人类活动、土壤性质及其相互作用是土壤抗生素分布的主要驱动因素,累计高达57.7%;而微生物群落作用相对较弱,只占6.9%.
参考文献
| Aust M O, Godlinski F, Travis G R, et al. 2008. Distribution of sulfamethazine, chlortetracycline and tylosin in manure and soil of Canadian feedlots after subtherapeutic use in cattle[J]. Environmental Pollution, 156(3): 1243–1251.DOI:10.1016/j.envpol.2008.03.011 |
| Blackwell P A, Kay P, Ashauer R, et al. 2009. Effects of agricultural conditions on the leaching behaviour of veterinary antibiotics in soils[J]. Chemosphere, 75(1): 13–19.DOI:10.1016/j.chemosphere.2008.11.070 |
| 鲍艳宇, 周启星, 张浩. 2009. 阳离子类型对土霉素在2种土壤中吸附-解吸影响[J]. 环境科学, 2009, 30(2): 551–556. |
| Blackwell P A, Kay P, Boxall A B A. 2007. The dissipation and transport of veterinary antibiotics in a sandy loam soil[J]. Chemosphere, 67(2): 292–299.DOI:10.1016/j.chemosphere.2006.09.095 |
| Davis J G, Truman C C, Kim S C, et al. 2006. Antibiotic transport via runoff and soil loss[J]. Journal of Environmental Quality, 35(6): 2250–2260.DOI:10.2134/jeq2005.0348 |
| Du L F, Liu W K. 2012. Occurrence, fate, and ecotoxicity of antibiotics in agro-ecosystems. A review[J]. Agronomy for Sustainable Development, 32(2): 309–327.DOI:10.1007/s13593-011-0062-9 |
| Dubourg G, Abat C, Raoult D. 2017. Why new antibiotics are not obviously useful now[J]. International Journal of Antimicrobial Agents, 49: 549–553.DOI:10.1016/j.ijantimicag.2016.11.015 |
| Fang H, Han L, Cui Y, et al. 2016. Changes in soil microbial community structure and function associated with degradation and resistance of carbendazim and chlortetracycline during repeated treatments[J]. Science of the Total Environment, 572: 1203–1212.DOI:10.1016/j.scitotenv.2016.08.038 |
| Forman R T T. 1998. Road ecology:A solution for the giant embracing us[J]. Landscape Ecology, 13(4): 3–5. |
| Gao L, Shi Y, Li W, et al. 2012. Occurrence of antibiotics in eight sewage treatment plants in Beijing, China[J]. Chemosphere, 86(6): 665–671.DOI:10.1016/j.chemosphere.2011.11.019 |
| 葛林科, 任红蕾, 鲁建江, 等. 2015. 我国环境中新兴污染物抗生素及其抗性基因的分布特征[J]. 环境化学, 2015, 34(5): 875–883.DOI:10.7524/j.issn.0254-6108.2015.05.2014082501 |
| Hammesfahr U, Heuer H, Manzke B, et al. 2008. Impact of the antibiotic sulfadiazine and pig manure on the microbial community structure in agricultural soils[J]. Soil Biology & Biochemistry, 40(7): 1583–1591. |
| Hooda P S, Truesdale V W, Edwards A C, et al. 2001. Manuring and fertilization effects on phosphorus accumulation in soils and potential environmental implications[J]. Advances in Environmental Research, 5(1): 13–21.DOI:10.1016/S1093-0191(00)00037-X |
| Jent J R, Ryu H, Toledo-Hernandez C, et al. 2013. Determining hot spots of fecal contamination in a tropical watershed by combining land-use information and meteorological data with source-specific assays[J]. Environmental Science & Technology, 47(11): 5794–5802. |
| Kelsic E D, Zhao J, Vetsigian K, et al. 2015. Counteraction of antibiotic production and degradation stabilizes microbial communities[J]. Nature, 521(7553): 516-U208. |
| Kim H Y, Lee I S, Oh J E. 2017. Human and veterinary pharmaceuticals in the marine environment including fish farms in Korea[J]. Science of the Total Environment, 579: 940–949.DOI:10.1016/j.scitotenv.2016.10.039 |
| Le T X, Munekage Y, Kato S. 2005. Antibiotic resistance in bacteria from shrimp farming in mangrove areas[J]. Science of the Total Environment, 349(1/3): 95–105. |
| Li C, Chen J Y, Wang J H, et al. 2015. Occurrence of antibiotics in soils and manures from greenhouse vegetable production bases of Beijing, China and an associated risk assessment[J]. Science of the Total Environment, 521: 101–107. |
| Li J, Zhang H B, Chen Y S, et al. 2016. Sources identification of antibiotic pollution combining land use information and multivariate statistics[J]. Environmental Monitoring and Assessment, 188(7): 430–442.DOI:10.1007/s10661-016-5439-4 |
| Liang Y, Pei M, Wang D, et al. 2017. Improvement of soil ecosystem multifunctionality by dissipating manure-induced antibiotics and resistance genes[J]. Environmental Science & Technology, 51(9): 4988–4998. |
| Liao X, Li B, Zou R, et al. 2016a. Biodegradation of antibiotic ciprofloxacin:pathways, influential factors, and bacterial community structure[J]. Environmental Science and Pollution Research, 23(8): 7911–7918.DOI:10.1007/s11356-016-6054-1 |
| Liao X, Li B, Zou R, et al. 2016b. Antibiotic sulfanilamide biodegradation by acclimated microbial populations[J]. Applied Microbiology and Biotechnology, 100(5): 2439–2447.DOI:10.1007/s00253-015-7133-9 |
| 林治安, 赵秉强, 袁亮, 等. 2009. 长期定位施肥对土壤养分与作物产量的影响[J]. 中国农业科学, 2009, 42(8): 2809–2819. |
| 刘元望, 李兆君, 冯瑶, 等. 2016. 微生物降解抗生素的研究进展[J]. 农业环境科学学报, 2016, 35(2): 212–224.DOI:10.11654/jaes.2016.02.002 |
| 罗由林, 李启权, 王昌全, 等. 2015. 川中丘陵县域土壤碳氮比空间变异特征及其影响因素[J]. 应用生态学报, 2015, 26(1): 177–185. |
| Lin H, Sun W, Zhang Z, et al. 2016. Effects of manure and mineral fertilization strategies on soil antibiotic resistance gene levels and microbial community in a paddy-upland rotation system[J]. Environmental Pollution, 211: 332–337.DOI:10.1016/j.envpol.2016.01.007 |
| MacKay A A, Canterbury B. 2005. Oxytetracycline sorption to organic matter by metal-bridging[J]. Journal of Environmental Quality, 34(6): 1964–1971.DOI:10.2134/jeq2005.0014 |
| Mandaric L, Diamantini E, Stella E, et al. 2017. Contamination sources and distribution patterns of pharmaceuticals and personal care products in Alpine rivers strongly affected by tourism[J]. Science of the Total Environment, 590-591: 484–494.DOI:10.1016/j.scitotenv.2017.02.185 |
| Martinez J L. 2008. Antibiotics and antibiotic resistance genes in natural environments[J]. Science, 321(5887): 365–367.DOI:10.1126/science.1159483 |
| Martinez J L. 2009. Environmental pollution by antibiotics and by antibiotic resistance determinants[J]. Environmental Pollution, 157(11): 2893–2902.DOI:10.1016/j.envpol.2009.05.051 |
| Nogues-Bravo D, Araujo M B, Romdal T, et al. 2008. Scale effects and human impact on the elevational species richness gradients[J]. Nature, 453(7192): 216–218.DOI:10.1038/nature06812 |
| Pan M, Chu L M. 2016. Adsorption and degradation of five selected antibiotics in agricultural soil[J]. Science of the Total Environment, 545: 48–56. |
| Pan M, Chu L M. 2017. Leaching behavior of veterinary antibiotics in animal manure-applied soils[J]. Science of the Total Environment, 579: 466–473.DOI:10.1016/j.scitotenv.2016.11.072 |
| Peacock A D, Mullen M D, Ringelberg D B, et al. 2001. Soil microbial community responses to dairy manure or ammonium nitrate applications[J]. Soil Biology & Biochemistry, 33(7): 1011–1019. |
| 齐会勉, 吕亮, 乔显亮. 2009. 抗生素在土壤中的吸附行为研究进展[J]. 土壤, 2009, 41(5): 703–708. |
| Schj?Nning P, Christensen B T, Carstensen B. 1994. Physical and chemical properties of a sandy loam receiving animal manure, mineral fertilizer or no fertilizer for 90 years[J]. European Journal of Soil Science, 45(3): 257–268.DOI:10.1111/ejs.1994.45.issue-3 |
| Solliec M, Roy-Lachapelle A, Gasser M O, et al. 2016. Fractionation and analysis of veterinary antibiotics and their related degradation products in agricultural soils and drainage waters following swine manure amendment[J]. Science of the Total Environment, 543: 524–535.DOI:10.1016/j.scitotenv.2015.11.061 |
| Song C, Zhang C, Fan L M, et al. 2016. Occurrence of antibiotics and their impacts to primary productivity in fishponds around Tai Lake, China[J]. Chemosphere, 161: 127–135.DOI:10.1016/j.chemosphere.2016.07.009 |
| Srinivasan P, Sarmah A K, Manley-Harris M. 2013. Co-contaminants and factors affecting the sorption behaviour of two sulfonamides in pasture soils[J]. Environmental Pollution, 180: 165–172.DOI:10.1016/j.envpol.2013.05.022 |
| Sun L, Zhang G H, Luan L L, et al. 2016. Temporal variation in soil resistance to flowing water erosion for soil incorporated with plant litters in the Loess Plateau of China[J]. Catena, 145: 239–245.DOI:10.1016/j.catena.2016.06.016 |
| Tang J C, Kanamori T, Inoue Y, et al. 2004. Changes in the microbial community structure during thermophilic composting of manure as detected by the quinone profile method[J]. Process Biochemistry, 39(12): 1999–2006.DOI:10.1016/j.procbio.2003.09.029 |
| Tasho R P, Cho J Y. 2016. Veterinary antibiotics in animal waste, its distribution in soil and uptake by plants:A review[J]. Science of the Total Environment, 563: 366–376. |
| Tolls J. 2001. Sorption of veterinary pharmaceuticals in soils:A review[J]. Environmental Science & Technology, 35(17): 3397–3406. |
| Topp E, Renaud J, Sumarah M, et al. 2016. Reduced persistence of the macrolide antibiotics erythromycin, clarithromycin and azithromycin in agricultural soil following several years of exposure in the field[J]. Science of the Total Environment, 562: 136–144.DOI:10.1016/j.scitotenv.2016.03.210 |
| Wang F H, Qiao M, Su J Q, et al. 2014. High throughput profiling of antibiotic resistance genes in urban park soils with reclaimed water irrigation[J]. Environmental Science & Technology, 48(16): 9079–9085. |
| Wang H, Chu Y X, Fang C R. 2017. Occurrence of veterinary antibiotics in swine manure from large-scale feedlots in Zhejiang Province, China[J]. Bulletin of Environmental Contamination and Toxicology, 98(4): 472–477.DOI:10.1007/s00128-017-2052-3 |
| Yang C W, Hsiao W C, Chang B V. 2016. Biodegradation of sulfonamide antibiotics in sludge[J]. Chemosphere, 150: 559–565.DOI:10.1016/j.chemosphere.2016.02.064 |
| Yang Y, Xu C, Cao X, et al. 2017. Antibiotic resistance genes in surface water of eutrophic urban lakes are related to heavy metals, antibiotics, lake morphology and anthropic impact[J]. Ecotoxicology, 26(6): 831–840.DOI:10.1007/s10646-017-1814-3 |
| Zhang H, Zhou Y, Huang Y, et al. 2016a. Residues and risks of veterinary antibiotics in protected vegetable soils following application of different manures[J]. Chemosphere, 152: 229–237.DOI:10.1016/j.chemosphere.2016.02.111 |
| Zhang Y, Geng J, Ma H, et al. 2016b. Characterization of microbial community and antibiotic resistance genes in activated sludge under tetracycline and sulfamethoxazole selection pressure[J]. Science of the Total Environment, 571: 479–486.DOI:10.1016/j.scitotenv.2016.07.014 |
| Zhang Q Q, Ying G G, Pan C G, et al. 2015. Comprehensive evaluation of antibiotics emission and fate in the river basins of China:source Analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environmental Science & Technology, 49(11): 6772–6782. |
| Zhang Y L, Lin S S, Dai C M, et al. 2014. Sorption-desorption and transport of trimethoprim and sulfonamide antibiotics in agricultural soil:effect of soil type, dissolved organic matter, and pH[J]. Environmental Science and Pollution Research, 21(9): 5827–5835.DOI:10.1007/s11356-014-2493-8 |
| Zhao X, Wang J, Zhu L, et al. 2017. Environmental analysis of typical antibiotic-resistant bacteria and ARGs in farmland soil chronically fertilized with chicken manure[J]. Science of the Total Environment, 593-594: 10–17.DOI:10.1016/j.scitotenv.2017.03.062 |
| Zheng S, Hu J, Chen K, et al. 2009. Soil microbial activity measured by microcalorimetry in response to long-term fertilization regimes and available phosphorous on heat evolution[J]. Soil Biology & Biochemistry, 41(10): 2094–2099. |
| Zhong W, Gu T, Wang W, et al. 2010. The effects of mineral fertilizer and organic manure on soil microbial community and diversity[J]. Plant and Soil, 326(1): 511–522. |
| Zhou L J, Ying G G, Liu S, et al. 2013. Excretion masses and environmental occurrence of antibiotics in typical swine and dairy cattle farms in China[J]. Science of the Total Environment, 444: 183–195.DOI:10.1016/j.scitotenv.2012.11.087 |
| Zhou X, Qiao M, Wang F H, et al. 2017. Use of commercial organic fertilizer increases the abundance of antibiotic resistance genes and antibiotics in soil[J]. Environmental Science and Pollution Research, 24(1): 701–710.DOI:10.1007/s11356-016-7854-z |
| Zhu Y G, Zhao Y, Li B, et al. 2017. Continental-scale pollution of estuaries with antibiotic resistance genes[J]. Nature Microbiology, 2: 16270.DOI:10.1038/nmicrobiol.2016.270 |
| 赵方凯, 杨磊, 乔敏, 等. 2017. 土壤中抗生素的环境行为及分布特征研究进展[J]. 土壤, 2017, 49(3): 428–436. |
