, 房烽, 张黎明, 马晓琪, 黄天寅, 陈家斌
, 房烽, 张黎明, 马晓琪, 黄天寅, 陈家斌

苏州科技大学环境科学与工程学院, 苏州 215009
收稿日期: 2017-05-17; 修回日期: 2017-07-17; 录用日期: 2017-07-20
基金项目: 国家自然科学基金(No.51478283);江苏省普通高校专业学位研究生科研创新计划项目(No.SJLX16-0561)
作者简介: 房聪(1990-), 女, E-mail:Lcandy2013@163.com
通讯作者(责任作者): 陈家斌, E-mail:chenjiabincn@163.com
摘要: 将磷酸氢二铵((NH4)2HPO4)作为活化剂制备秸秆活性炭(SAC),并用其活化过一硫酸盐(PMS)产生硫酸根自由基(SO4-·)降解偶氮染料酸性橙7(AO7).首先对活化前后的SAC进行FTIR表征,发现(NH4)2 HPO4活化后的SAC含氧官能团特征峰强度增强,可能有利于过一硫酸钾的活化.其次研究了活化剂浓度、SAC投加量、PMS浓度、初始pH、抑制剂对AO7降解效果的影响.结果表明,AO7脱色率随着活化剂浓度、SAC投加量、PMS浓度的增加而增加;同时在偏中性条件下,有利于SAC活化PMS脱色AO7;加入相同物质的量比(2000/1)的甲醇、叔丁醇、苯酚,55 min内AO7脱色率分别为88.4%、66.2%、13.4%,苯酚对反应抑制效果最好,表明SAC表面的硫酸根和羟基自由基在AO7脱色中起主要作用.最后通过紫外光谱扫描、气质联用(GC-MS)和TOC分析表明,AO7的偶氮键和萘环结构被破坏,生成含苯环类中间产物,最终矿化为二氧化碳和水,矿化率可达31.7%.
关键词:稻草秸秆活性炭活化剂过一硫酸盐硫酸根自由基酸性橙7脱色
Degradation of acid orange 7 by peroxymonosulfate activated by straw activated carbon
FANG Cong
 , FANG Feng, ZHANG Liming, MA Xiaoqi, HUANG Tianyin, CHEN Jiabin
, FANG Feng, ZHANG Liming, MA Xiaoqi, HUANG Tianyin, CHEN Jiabin

School of Environmental Science and Engineering, Suzhou University of Science and Technology, Suzhou 215009
Received 17 May 2017; received in revised from 17 July 2017; accepted 20 July 2017
Supported by the National Natural Science Foundation of China(No.51478283)and the Jiangsu Province University Professional Degree Graduate Research and Innovation Project(No.SJLX16-0561)
Biography: FANG Cong(1990-), female, E-mail:Lcandy2013@163.com
*Corresponding author: CHEN Jiabin, E-mail:chenjiabincn@163.com
Abstract: Straw activated carbon (SAC) was prepared from straw with diammonium phosphate((NH4)2HPO4)as activator.SAC was then used to activate peroxymonosulfate (PMS) to produce sulfate radical for the decolorization of azo dye Acid Orange 7. The characterization of the synthesized SAC by FTIR indicated that the peak intensity of oxygen containing functional group of SAC increased, potentially favorable for PMS activation. The effect of (NH4)2HPO4 concentration, SAC dosage, PMS concentrations, initial pH and radical scavengerson the degradation of AO7 were studied. The results demonstrated that the decolorization of AO7 increased with increasing of (NH4)2HPO4 concentration, SAC dosage, PMS concentration. Neutral pH was most favorable for SAC to activate PMS for AO7 decolorization. After addition of excess amount (2000/1) of methanol, tert-butanol and phenol, the decolorization efficiencies of AO7 were 88.4%, 66.2%, 13.4%, respectively, and thus the surface bound sulfate and hydroxyl radicals were responsible for AO7 decolorization. From the analysis of GC/MS, UV-Vis spectra, and TOC, the azo band and naphthalene ring of AO7 were destroyed by radicals, generating the benzene-containing intermediate products, and mineralizing to CO2 and H2O (31.7%).
Key words: rice strawactivated carbonactivatorperoxymonosulfatesulfateradicalacid orange 7decolorization
1 引言(Introduction)偶氮染料具有着色牢、种类多、性质稳等特点,在纺织、印染等行业中得到广泛应用(Lin et al., 2014);但其废水则具有毒性大、色度高、难降解等特点,若未处理直接排入水体中会导致严重的环境问题,因此,在环境保护领域中受到了广泛关注(Wu et al., 2012).现有的传统处理工艺如絮凝、吸附和膜过滤,仅将偶氮染料从水体中移除并未使其得到降解;生物处理虽可破坏其脱色基团偶氮键,但耗时长、成本高、初始投资大, 无法推广运行(Forgacs et al., 2004; Brillas et al., 2009).相比之下, 高级氧化技术具有(Totrov et al., 2004; Sirtori et al., 2006; Kusvuran et al., 2004)反应快、二次污染少、矿化率高等特点,可很好地解决传统处理工艺带来的反应慢、二次污染、矿化率低等问题.
活化过硫酸盐是一种新型的高级氧化技术,可产生相比于羟基自由基(E0=1.9~2.7V)(Buxton et al., 1988)具有更高氧化电势的硫酸根自由基(E0=2.5~3.1V)(Neta et al., 1988),过二硫酸盐(PS)和过一硫酸盐(PMS)是两种常用的产生硫酸根自由基的氧化剂,与过二硫酸盐相比,过一硫酸盐由于其自身结构不对称,很易被激发与活化.过一硫酸盐活化方式多样,如热(Tan et al., 2012; Deng et al., 2013)、微波(Lee et al., 2009)、紫外光(Neppolian et al., 2008; Saien et al., 2011)、过渡金属(Oh et al., 2010; Anipsitakis et al., 2004)、活性炭(Kimura et al., 1994)等.活性炭是一种良好的吸附剂和催化剂(Szymański, 2008),但因其来源以煤炭或木材为主,生产成本较高,使其应用受到限制.因此,寻找新的廉价资源制备活性炭成为近年来研究的焦点.
我国在收获丰富的农产品的同时也产生了上亿吨的农作物废料,虽然部分可用来发电或作为饲料等再生利用,但仍有一半以上被直接焚烧和填埋处理,不仅造成了资源浪费,更是造成了严重的大气污染和土壤污染.近年来,利用农作物废料制备活性炭已成为国内外的研究热点,这不仅可实现农作物废料的资源化、降低活性炭的生产成本,还可实现污染物的去除.例如,利用锯木屑制备的生物质活性炭可吸附70%以上的孔雀绿(Khattri et al., 2009);利用葵瓜壳(Hameed, 2008)制备的生物质活性炭可吸附去除水中90%的甲基紫;研究发现,生物质活性炭对重金属和有机污染物有较好的吸附作用(Chen et al., 2008; Cao et al., 2009; Liu et al., 2009).最近,Liang等(2009)用活性炭(AC)活化过硫酸盐(PS)降解TCE,在PS 2 g·L-1、AC 1 g·L-1的条件下,4 h内TCE去除率达80%以上;Lee等(2013)用AC活化PS降解全氟辛酸,与不加入AC的反应体系相比,AC的存在明显加速了全氟辛酸的降解;杨梅梅等(2013)利用AC催化PS降解金橙G也得到了较好的去除效果.
本研究以稻草秸秆为原料制备活性炭(SAC),使其活化过一硫酸钾(PMS)降解偶氮染料酸性橙7(AO7),研究各因素(活化剂浓度、PMS量、初始pH等)对AO7降解的影响,分析甲醇、叔丁醇、苯酚等抑制剂对SAC活化PMS降解AO7的影响,并且对其降解过程进行分析.
2 材料与方法(Materials and methods)2.1 材料试剂与实验设备稻草秸秆收集于苏州当地农田;过一硫酸盐(HKSO5·0.5KHSO4·0.5K2SO4,PMS)购于Sigma-Aldrich;酸性橙7(AO7)购于国药集团化学试剂有限公司;硫酸(H2SO4)、氢氧化钠(NaOH)、磷酸氢二铵((NH4)2HPO4)、苯酚(Phenol)、甲醇(Mathnol)、叔丁醇(TBA)、亚硝酸钠(NaNO2)均为分析纯,购于国药集团化学试剂有限公司;实验室用水为去离子水.
2.2 活化剂的制备与表征2.2.1 活化剂的制备挑选干燥后的优质稻草秸秆割成3 cm左右,置于2%(质量分数)NaOH浸渍液中浸泡48 h,然后取出用蒸馏水清洗至中性,在烘箱中105℃条件下干燥后备用.碱处理是为了除去材料表面的灰分、蜡质及其他可溶性于水的杂质.分别称量4份已经干燥好的样品20 g放入编号为1、2、3、4的500 mL烧杯中,分别往烧杯中加入0、10%、20%、30%(质量分数)的(NH4)2HPO4浸渍液300 mL,待24 h后分别取出后置于烘箱中105℃烘干;然后在恒温鼓风烘箱中200℃下预氧化2 h;最后在箱式气氛炉中700 ℃条件下活化60 min,待样品冷却至室温后取出,分别研磨过100目筛,将所得秸秆活性炭分别记为SAC0、SAC1、SAC2、SAC3.
2.2.2 活化剂的表征表面形貌采用Quanta 25扫描电子显微镜电镜(SEM,美国FEI)观测;表面官能团利用Nicolet 6700傅立叶变换红外光谱仪(美国Thermo Fisher Scientific)测试;采用Boehm滴定法测定表面含氧官能团的含量(Boehm, 2001).
2.3 降解实验本实验采用偶氮染料AO7为目标污染物.先往250 mL广口锥形瓶中加入20 mg·L-1的AO7溶液,然后加入一定量PMS,用NaOH和H2SO4将pH调节至7.0,迅速加入一定量的SAC启动反应,在规定时间迅速取样5 mL,用0.2 mol·L-1的NaNO2猝灭后通过0.45 μm膜过滤留待后续测量.
2.4 吸附实验取一定量的SAC0、SAC1、SAC2、SAC3加入到250 mL广口锥形瓶中,再加入20 mg·L-1的AO7溶液,置于搅拌器上搅拌均匀,规定时间取样迅速通过0.45 μm膜过滤留待后续测量.
2.5 分析方法偶氮染料AO7的浓度利用Mapada UV-1600(PC)紫外可见分光光度计,在AO7最大吸收波长484 nm处测量其吸光度,代入标准曲线求得其浓度.总有机碳(TOC)采用TOC测定仪(TOC-LCPH,岛津)测定.
pH测量采用便携式pH计(Thermo A121,美国赛默飞世尔科技);采用超声清洗波(KQ-200 KDB,昆山舒美超声仪器公司)进行超声;采用箱式气氛炉(TKSXQ-4-13,宜兴市斯太尔精工厂)进行热解反应.
3 结果与讨论(Results and discussion)3.1 稻草活性炭的表征3.1.1 扫描电镜分析图 1a为未经(NH4)2HPO4活化的SAC0表面形貌图,图 1b为经其活化的SAC2的表面形貌图.由图 1b可知,活化后的稻草秸秆活性炭表面更加粗糙和凹凸不平,可能是活化剂(NH4)2HPO4附着在稻草上面与其发生反应后形成的.这种结构可促进活性碳比表面积和孔径的增大.
图 1(Fig. 1)
 |
| 图 1 SAC0(a)与SAC2(b)的SEM图 Fig. 1SEM images of SAC0(a) and SAC2(b) |
3.1.2 FTIR秸秆改性前后的FTIR图如图 2所示.3400 cm-1处出现的伸缩振动峰为—OH的振动(Fang et al., 2015);2925、2850 cm-1处出现的伸缩振动峰为饱和碳上的C—H(Lowde et al., 1978);1622 cm-1处出现的伸缩振动峰为C=C振动或者是醌基振动(Studebaker et al., 1972)及C=O振动、羧基中C—O振动(shizaki et al., 1983);1388 cm-1处为—CH3的弯曲振动;1000~1200 cm-1处为C—O振动(Tan et al., 2014)或者为—OH的弯曲振动峰.从图中可看出,秸秆活性炭经(NH4)2HPO4活化后位于1093、1388、1626、3400 cm-1处的振动峰有所增强,表明羧酸和内脂类官能团特征峰增强可能更有利于过一硫酸钾的活化.
图 2(Fig. 2)
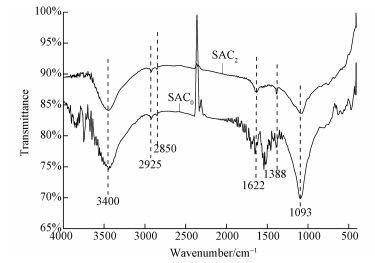 |
| 图 2 SAC0与SAC2的FTIR图 Fig. 2FT-IR spectra of SAC0 and SAC2 |
3.1.3 SAC2的表面含氧官能团采用Boehm法测定SAC2表面含氧官能团含量,结果如表 1所示.这些表面含氧官能团的存在有利于活化过一硫酸钾产生硫酸根自由基(Saputra et al., 2013; Yang et al., 2011).
表 1(Table 1)
| 表 1 SAC2的Bohem滴定结果 Table 1 The results of Bohem titration | ||||||||
表 1 SAC2的Bohem滴定结果 Table 1 The results of Bohem titration
| ||||||||
3.2 不同浓度磷酸氢二铵制备SAC活化PMS对AO7的降解影响不同浓度(NH4)2HPO4制备的SAC活化PMS对AO7的降解影响如图 3所示.随着(NH4)2HPO4浓度的升高,制备得到的SAC的吸附作用增大且活化PMS的能力增强,依次为SAC0<SAC1<SAC2<SAC3.
图 3(Fig. 3)
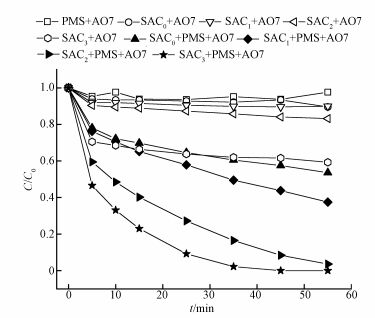 |
| 图 3 不同体系下AO7的降解效果([AO7]=20 mg·L-1, [SAC0]=[SAC1]=[SAC2]=[SAC3]=0.3 g·L-1, T=298 K, [PMS]=6.5 mmol·L-1, pH=7) Fig. 3The degradation of AO7 in different systems |
由图可知,当(NH4)2HPO4浓度为0%时,55 min内SAC0对AO7的吸附去除率为10.4%,SAC0/PMS活化体系的AO7脱色率为31.3%;当(NH4)2HPO4浓度为10%时,55 min内SAC1对AO7的吸附去除率为10.0%,SAC1/PMS活化体系的AO7脱色率为62.5%;当(NH4)2HPO4浓度为20%时,55 min内SAC2对AO7的吸附去除率为16.8%,SAC2/PMS活化体系的AO7脱色率为96.4%;当(NH4)2HPO4浓度提高至30%时,55 min内SAC3对AO7的吸附去除率为40.7%,但SAC3/PMS活化体系35 min内使得AO7完全脱色.考虑到当(NH4)2HPO4浓度为30%时,AO7脱色速率增加不多,且为节约药品、降低成本等,故在后续的实验中选择(NH4)2HPO4浓度为20%条件下制得的SAC2作为活化剂.
3.3 SAC2投加量对SAC2/PMS体系降解AO7的影响不同SAC2投加量对体系活化降解AO7的影响如图 4所示.可以看出,随着SAC2投加量的增大,SAC2/PMS体系对AO7的脱色效果越好.当投加量为0.1 g·L-1时,55 min内SAC2/PMS体系的AO7脱色率为35.4%;然而当投加量增大到0.3 g·L-1时脱色率达到了95.6%;再继续增大投加量到0.8g·L-1时,AO7完全脱色仅需25 min.而且此反应符合一级动力学,在SAC2投加量从0.1 g·L-1增加到0.8 g·L-1的过程中,反应速率常数k也从0.007 min-1增加到0.139 min-1.由图还可看出,SAC2投加量的增大使得SAC2吸附容量增加,从而提高了对AO7的吸附作用.但更为重要的是,增多了活性点位,可使更多PMS得到活化从而产生更多硫酸根自由基,因而加速了反应的进行.但考虑到当SAC2投加量>0.3 g·L-1时,AO7脱色速率增加不大,综合经济效益方面的考虑,本实验选择0.3 g·L-1作为SAC2的最佳投加量.
图 4(Fig. 4)
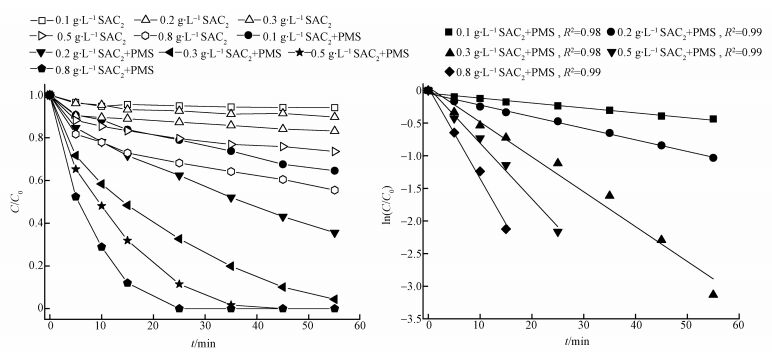 |
| 图 4 SAC2/PMS体系中SAC2投加量对AO7降解的影响([AO7]=20 mg·L-1, T=298 K, [PMS]=6.5 mmol·L-1, pH=7) Fig. 4Effect of SAC2 dosage on adsorption and degradation of AO7 in the SAC2/PMS system |
3.4 PMS浓度对SAC2/PMS体系降解AO7的影响固定SAC2投加量为0.3 g·L-1,考察分别加入不同浓度(0、1.63、3.25、6.50、9.75、13.00 mmol·L-1)的PMS时,对AO7脱色率的影响.由图 5可以看出,当不加PMS时,55 min内SAC2的吸附去除率仅为16.8%,表明在PMS浓度分别为1.63、3.25、6.50、9.75、13.00 mmol·L-1时,SAC2/PMS体系的氧化降解居于主导地位.随着PMS浓度的提高,AO7的氧化降解速率也随之增大.当PMS浓度为1.63 mmol·L-1时,反应时间至55 min时脱色率仅为25.0%;当PMS浓度为3.25 mmol·L-1时,反应时间至55 min时脱色率为53.7%;然而当PMS浓度分别为6.50、9.75、13.00 mmol·L-1时,分别在55、45、35 min时AO7的脱色率依次为95.6%、99.9%、99.4%.同时发现,当PMS浓度大于9.75 mmol·L-1时,AO7脱色速率减慢,而此反应符合一级动力学,不同PMS浓度下的反应速率常数分别为0.005、0.013、0.053、0.085、0.108 min-1.由此也可看出,反应速率相对减慢.原因可能是当PMS浓度较高时,产生大量的自由基会相互反应,生成氧化能力较差的SO5-(Tan et al., 2014; Hou et al., 2012).因此,PMS浓度应控制在与一定范围内,后续的实验在PMS浓度为6.5 mmol·L-1下进行.
图 5(Fig. 5)
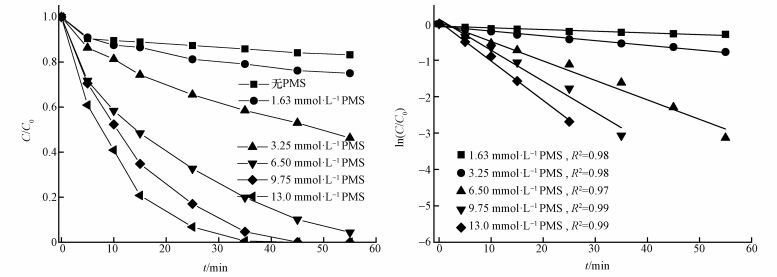 |
| 图 5 SAC2/PMS体系中PMS浓度对AO7降解的影响([AO7]=20 mg·L-1, [SAC2]=0.3 g·L-1, T=298 K, pH=7) Fig. 5Effect of PMS concentrations on the degradation of AO7 in the SAC2/PMS system |
3.5 不同自由基抑制剂对SAC2/PMS体系降解AO7的影响甲醇(MA)和叔丁醇(TBA)是两种常见的SO4-·和HO·抑制剂(Nie et al., 2014).MA含有α-H,对SO4-·和HO·都有较高的反应速率,所以对两者都具有较好的猝灭效果;其次,TBA与HO·有较高的反应速率,而对SO4-·的淬灭效果较弱(Yan et al., 2011; Furman et al., 2011).故本实验采用MA和TBA对SAC2活化PMS体系中的自由基进行鉴定,结果如图 6示.图 6a、6b显示,n(MA)/n(PMS)从100/1增加到2000/1时,反应脱色率由95.7%降至88.4%;n(TBA)/n(PMS)从100/1增加到2000/1时,反应脱色率由74.3%降至66.2%,对AO7的脱色有一定抑制但不完全,原因是甲醇为亲水性化合物,在液-液相反应中扩散均匀,能到达很好的抑制效果(Liang et al., 2013),但在固-液两相非均相反应体系中,不易在固体活化剂表面和周围积累,所以不能对SAC2表面的自由基产生猝灭作用.故推测,自由基大部分产生在SAC2的表面.为了证明此猜想,采用苯酚作为抑制剂,因为苯酚是疏水性化合物,极易扩散到SAC2表面,并且苯酚对SO4-·和HO·的捕获能力强于叔丁醇,所以应该能很好地抑制该反应.图 6c表明,加入苯酚后,AO7的脱色明显被抑制.由此实验得出,SAC2/PMS体系降解AO7主要发生在SAC2的表面及其周围,并且SO4-·和HO·都对AO7的脱色有很大的贡献.
图 6(Fig. 6)
 |
| 图 6 SAC2/PMS体系中自由基抑制剂对AO7降解的影响([AO7]=20 mg·L-1, [SAC2]=0.3 g·L-1, T=298 K, [PMS]=6.5 mmol·L-1, pH=7) Fig. 6Degradation of AO7 in the SAC2/PMS system in the presence of different radical scavengers |
3.6 初始pH对SAC2/PMS体系降解AO7的影响不同初始pH对SAC2/PMS体系降解AO7的影响如图 7所示.由图可知,在pH为2~8时,AO7脱色速率随pH升高而加快,当pH为8时,AO7的脱色率为94.8%,pH为2时,AO7的脱色率为83.5%.可能在强酸性条件下,反应体系中的H+容易与HSO5-中的O—O形成氢键(Zhang et al., 2013),致使SAC2活化PMS产生SO4-·的效率降低,使AO7脱色率下降.同时发现,当pH为10时,AO7脱色速率变慢,这可能与SAC2表面零点电荷(pHpzc)有关.当溶液pH<pHpzc时,SAC2表面带正电荷,溶液pH>pHpzc时,SAC2表面带负电荷,经测得SAC2的pHpzc为3.06,所以当溶液pH为10时,SAC2表面带负电荷;而且在pH为10时,溶液中PMS主要存在形式为SO52-,与SAC2产生静电相斥作用,致使活化降解AO7的效率降低.
图 7(Fig. 7)
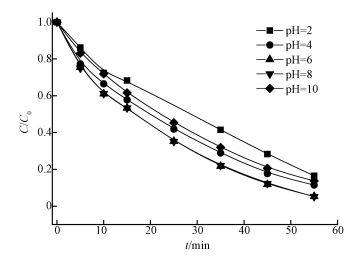 |
| 图 7 初始pH对SAC2/PMS体系降解AO7的影响([AO7]=20 mg·L-1, [SAC2]=0.3 g·L-1, T=298 K, [PMS]=6.5 mmol·L-1) Fig. 7Effect of initial pH on the degradation of AO7 in the SAC2/PMS system |
3.7 SAC2的重复使用SAC2的重复使用情况如图 8所示,SAC2在第0、1、2、3次重复使用时,AO7的脱色率分别为98.0%、90.9%、72.5%、68.3%.虽然AO7的脱色速率在逐渐减慢,但仍有比较好的脱色效果.重复使用3次后SAC2的性能下降,可能是因为SAC2表面上可活化PMS的官能团减少,导致活化PMS产生自由基的效果降低,还可能是因为反应过程中AO7及其中间产物吸附在SAC2的表面,使得PMS接触SAC2表面的活性位点几率降低从而影响SAC2的重复性能,又可能在膜分离回收SAC2过程中会损失一部分,也会使AO7脱色减慢.
图 8(Fig. 8)
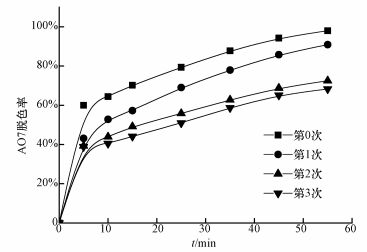 |
| 图 8 SAC2的重复使用对AO7溶液的处理效果([AO7]=20 mg·L-1, [SAC2]=0.3 g·L-1, T=298 K, [PMS]=6.5 mmol·L-1, pH=7) Fig. 8Efficiency of AO7 by SAC2 (reuse for three times) induced PMS oxidaiton |
3.8 AO7降解过程中TOC变化及紫外可见光谱图 9为SAC2活化PMS降解AO7体系中TOC变化情况.在0、5、15、35、55 min时分别取样,测得TOC去除率分别为0、12.8%、16.1%、28.2%、31.7%,结果表明,SAC2/PMS体系对AO7不仅有很好的脱色率,也具有一定的矿化能力.还可看出,反应在15~35 min时矿化率有显著提升而在35~55 min时矿化率明显降低.可能是随反应进行,生成了较难矿化的中间产物,而且PMS浓度随反应进行而降低,产生的SO4-·量减少.
图 9(Fig. 9)
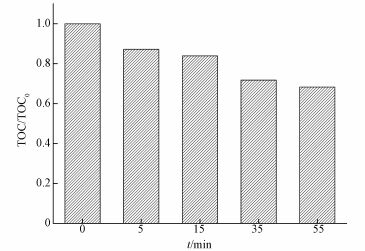 |
| 图 9 SAC2/PMS体系中TOC的去除率([AO7]=20 mg·L-1, [SAC2]=0.3 g·L-1, T=298 K, [PMS]=6.5 mmol·L-1, pH=7) Fig. 9TOC removal in the SAC2/PMS systems |
图 10为SAC2活化PMS降解AO7过程中紫外可见光谱.可以看出,AO7主要有484 nm和310 nm处特征吸收峰,分别代表AO7的发色基团偶氮键和萘环结构.随活化反应的进行,位于484 nm和310 nm处的AO7特征吸收峰强度不断下降,表明AO7的偶氮键和萘环节都不断被SO4-·和·OH氧化;55 min后偶氮键(484 nm)和萘环(310 nm)的特征峰渐近消失,而在255 nm处形成新的吸收峰.利用GC/MS对AO7降解过程中的产物进行鉴定,检测到的主要中间产物如表 2所示,可知降解产物多以苯环为主,达到染料脱色目的.
图 10(Fig. 10)
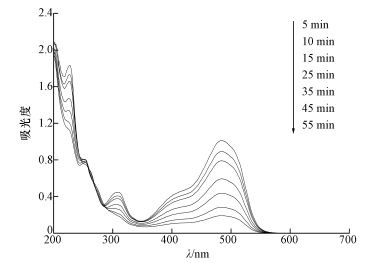 |
| 图 10 AO7降解的紫外可见光谱([AO7]=20 mg·L-1, [SAC2]=0.3 g·L-1, T=298 K, [PMS]=6.5 mmol·L-1, T=298 K, pH=7) Fig. 10UV-Vis spectra for degradation of AO7 |
表 2(Table 2)
| 表 2 GC/MS测得的AO7降解的降解产物 Table 2 Degradation products of AO7 determined by GC/MS | ||||||||||||||||
表 2 GC/MS测得的AO7降解的降解产物 Table 2 Degradation products of AO7 determined by GC/MS
| ||||||||||||||||
4 结论(Conclusions)1) 经过磷酸氢二铵改性后的秸秆活性炭活化过一硫酸钾产生了SO4-·和HO·,从而有效使AO7脱色且自由基产生范围在SAC表面及其周围,并有一定的矿化作用.
2) 随着SAC2投加量和PMS浓度的升高,AO7脱色也随之加快;在偏中性条件下,有利于SAC2活化PMS降解AO7;SAC2也具有一定的重复使用性.
3) 通过GC/MS和紫外光谱分析可知,AO7脱色过程中发色基团偶氮键和萘环结构均被破坏,生成以苯环类物质为主的中间产物,进而达到脱色的目的.
参考文献
| Anipsitakis G P, Dionysiou D D. 2004. Radical generation by the interaction of transition metals with common oxidants[J]. Environmental Science & Technology, 38(13): 3705–3712. |
| Brillas E, Martínez-Huitle C A. 2009. Decontamination of wastewaters containing synthetic organic dyes by electrochemical methods.An updated review[J]. Applied Catalysis B Environmental, 87(3): 105–145. |
| Boehm H P. 2002. Surface oxides on carbon and their analysis:a critical assessment[J]. Carbon, 40: 145–149.DOI:10.1016/S0008-6223(01)00165-8 |
| Buxton G V, Greenstock C L, Helman W P, et al. 1988. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (·OH/·O-)in aqueous solution[J]. Journal of Physical & Chemical Reference Data, 17(2): 513–886. |
| Cao X, Ma L, Gao B, et al. 2009. Dairy-manure derived biochar effectively sorbs lead and atrazine[J]. Environmental Science & Technology, 43(9): 3285–3291. |
| Chen B, Zhou D, Zhu L. 2008. Transitional adsorption and partition of nonpolar and polar aromatic contaminants by biochars of pine needles with different pyrolytic temperatures[J]. Environmental Science & Technology, 42(14): 5137–5143. |
| Deng J, Shao Y, Gao N, et al. 2013. Thermally activated persulfate (TAP) oxidation of antiepileptic drug carbamazepine in water[J]. Chemical Engineering Journal, 228: 765–771.DOI:10.1016/j.cej.2013.05.044 |
| Fang G, Liu C, Gao J, et al. 2015. Manipulation of persistent free radicals in biochar to activate persulfate for contaminant degradation[J]. Environmental Science & Technology, 49(9): 5645–5653. |
| Forgacs E, Cserháti T, Oros G. 2004. Removal of synthetic dyes from wastewaters:a review[J]. Environment International, 30(7): 953–971.DOI:10.1016/j.envint.2004.02.001 |
| Furman O S, Teel A L, Ahmad M, et al. 2011. Effect of basicity on persulfate reactivity[J]. Journal of Environmental Engineering, 137(4): 241–247.DOI:10.1061/(ASCE)EE.1943-7870.0000323 |
| Hameed B H. 2008. Equilibrium and kinetic studies of methyl violet sorption by agricultural waste[J]. Journal of Hazardous Materials, 154(1/3): 204–212. |
| Hou L, Hui Z, Xue X. 2012. Ultrasound enhanced heterogeneous activation of peroxydisulfate by magnetite catalyst for the degradation of tetracycline in water[J]. Separation & Purification Technology, 84(2): 147–152. |
| Ishizaki C, Martí I. 1981. Surface oxide structures on a commercial activated carbon[J]. Carbon, 19(6): 409–412.DOI:10.1016/0008-6223(81)90023-3 |
| Khattri S D, Singh M K. 2009. Removal of malachite green from dye wastewater using neem sawdust by adsorption[J]. Journal of Hazardous Materials, 167(1/3): 1089–1094. |
| Kimura M, Miyamoto I. 1994. Discovery of the activated-carbon radical AC+ and the novel oxidation-reactions comprising the AC/AC+ cycle as a catalyst in an aqueous solution[J]. Bulletin of the Chemical Society of Japan, 67(9): 2357–2360.DOI:10.1246/bcsj.67.2357 |
| Kusvuran E, Gulnaz O, Irmak S, et al. 2004. Comparison of several advanced oxidation processes for the decolorization of Reactive Red 120 azo dye in aqueous solution[J]. Journal of Hazardous Materials, 109(1/3): 85–93. |
| Lee Y, Lo S, Kuo J, et al. 2013. Promoted degradation of perfluorooctanic acid by persulfate when adding activated carbon[J]. Journal of Hazardous Materials, 261: 463–469.DOI:10.1016/j.jhazmat.2013.07.054 |
| Lee Y C, Lo S L, Chiueh P T, et al. 2009. Efficient decomposition of perfluorocarboxylic acids in aqueous solution using microwave-induced persulfate[J]. Water Research, 43(11): 2811–2816.DOI:10.1016/j.watres.2009.03.052 |
| Liang C, Lin Y T, Shin W H. 2009. Persulfate regeneration of trichloroethylene spent activated carbon[J]. Journal of Hazardous Materials, 168(1): 187–192.DOI:10.1016/j.jhazmat.2009.02.006 |
| Liang H Y, Zhang Y Q, Huang S B, et al. 2013. Oxidative degradation of p-chloroaniline by copper oxidate activated persulfate[J]. Chemical Engineering Journal, 218(3): 384–391. |
| Lin H, Zhang H, Hou L. 2014. Degradation of C.I.Acid Orange 7 in aqueous solution by a novel electro/Fe3O4/PDS process[J]. Journal of Hazardous Materials, 276(9): 182–191. |
| Liu Z G, Zhang F S. 2009. Removal of lead from water using biochars prepared from hydrothermal liquefaction of biomass[J]. Journal of Hazardous Materials, 167(1/3): 933–939. |
| Lowde D R, Williams J O, Mcnicol B D. 1978. The characterisation of catalyst surfaces by cyclic voltammetry[J]. Applications of Surface Science, 1(2): 215–240.DOI:10.1016/0378-5963(78)90016-8 |
| Morterra C, Low M J D. 1983. IR studies of carbons-Ⅱ:The vacuum pyrolysis of cellulose[J]. Carbon, 21(3): 283–288.DOI:10.1016/0008-6223(83)90092-1 |
| Neppolian B, Celik E, Choi H. 2008. Photochemical oxidation of arsenic(Ⅲ) to arsenic(V) using peroxydisulfate ions as an oxidizing agent[J]. Environmental Science & Technology, 42(16): 6179–6184. |
| Neta P, Huie R E, Ross A B. 1988. Rate constants for reactions of inorganic radicals in aqueous-solution[J]. Journal of Physical & Chemical Reference Data, 17(3): 1027–1284. |
| Nie M, Yang Y, Zhang Z, et al. 2014. Degradation of chloramphenicol by thermally activated persulfate in aqueous solution[J]. Chemical Engineering Journal, 246(246): 373–382. |
| Oh S Y, Kang S G, Chiu P C. 2010. Degradation of 2, 4-dinitrotoluene by persulfate activated with zero-valent iron[J]. Science of the Total Environment, 408(16): 3464–3468.DOI:10.1016/j.scitotenv.2010.04.032 |
| Saien J, Ojaghloo Z. 2011. Homogeneous and heterogeneous AOPs for rapid degradation of Triton X-100 in aqueous media via UV light, nanotitania hydrogen peroxide and potassium persulfate[J]. Chemical Engineering Journal, 167(1): 172–182.DOI:10.1016/j.cej.2010.12.017 |
| Saputra E, Muhammad S, Sun H, et al. 2013. Activated carbons as green and effective catalysts for generation of reactive radicals in degradation of aqueous phenol[J]. RSC Adv, 3: 21905–21910.DOI:10.1039/c3ra42455c |
| Sirtori C, Altvater P K, Freitas A M D, et al. 2006. Degradation of aqueous solutions of camphor by heterogeneous photocatalysis[J]. Journal of Hazardous Materials, 129(1/3): 110–115. |
| Studebaker M L, RinehartSr R W. 1972. Infrared studies of oxygen-containing groups on the surface of Carbon Black[J]. Rubber Chemistry and Technology, 45(1): 106–116.DOI:10.5254/1.3544690 |
| Szymański G S. 2008. Catalytic destruction of methyl tertiary butyl ether (MTBE) using oxidized carbon[J]. Catalysis Today, 137(2/4): 460–465. |
| Tan C, Gao N, Deng Y, et al. 2012. Heat-activated persulfate oxidation of diuron in water[J]. Chemical Engineering Journal, 203: 294–300.DOI:10.1016/j.cej.2012.07.005 |
| Tan C, Gao N, Deng Y, et al. 2014. Radical induced degradation of acetaminophen with Fe3O4 magnetic nanoparticles as heterogeneous activator of peroxymonosulfate[J]. Journal of Hazardous Materials, 276(9): 452–460. |
| Totrov M, Jiang X, Kong X, et al. 2004. Photocatalytic degradation of Azo Dye Acid Red 14 in water on ZnO as an alternative catalyst to TiO2[J]. Journal of Photochemistry and Photobiology A:Chemistry: 317–322. |
| Wu J, Zhang H, Qiu J. 2012. Degradation of Acid Orange 7 in aqueous solution by a novel electro/Fe2+/peroxydisulfate process[J]. Journal of Hazardous Materials, 215-216: 138–145.DOI:10.1016/j.jhazmat.2012.02.047 |
| Yan J, Lei M, Zhu L, et al. 2011. Degradation of sulfamonomethoxine with Fe3O4 magnetic nanoparticles as heterogeneous activator of persulfate[J]. Journal of Hazardous Materials, 186(2/3): 1398–1404. |
| Yang S, Yang X, Shao X, et al. 2011. Activated carbon catalyzed persulfate oxidation of Azo Dye Acid Orange 7 at ambient temperature[J]. Journal of hazardous materials, 186(1): 659–666.DOI:10.1016/j.jhazmat.2010.11.057 |
| 杨梅梅, 周少奇, 刘聃, 等. 2013. 活性炭催化过硫酸钠降解金橙G动力学[J]. 环境科学, 2013, 34(3): 962–967. |
| Zhang T, Zhu H, Croué J P. 2013. Production of sulfate radical from peroxymonosulfate induced by a magnetically separable CuFe2O4 spinel in water:efficiency, stability, and mechanism[J]. Environmental Science & Technology, 47(6): 2784–2791. |