广西大学资源环境与材料学院, 南宁 530004
School of Resources, Environment and Materials, Guangxi University, Nanning 530004, China
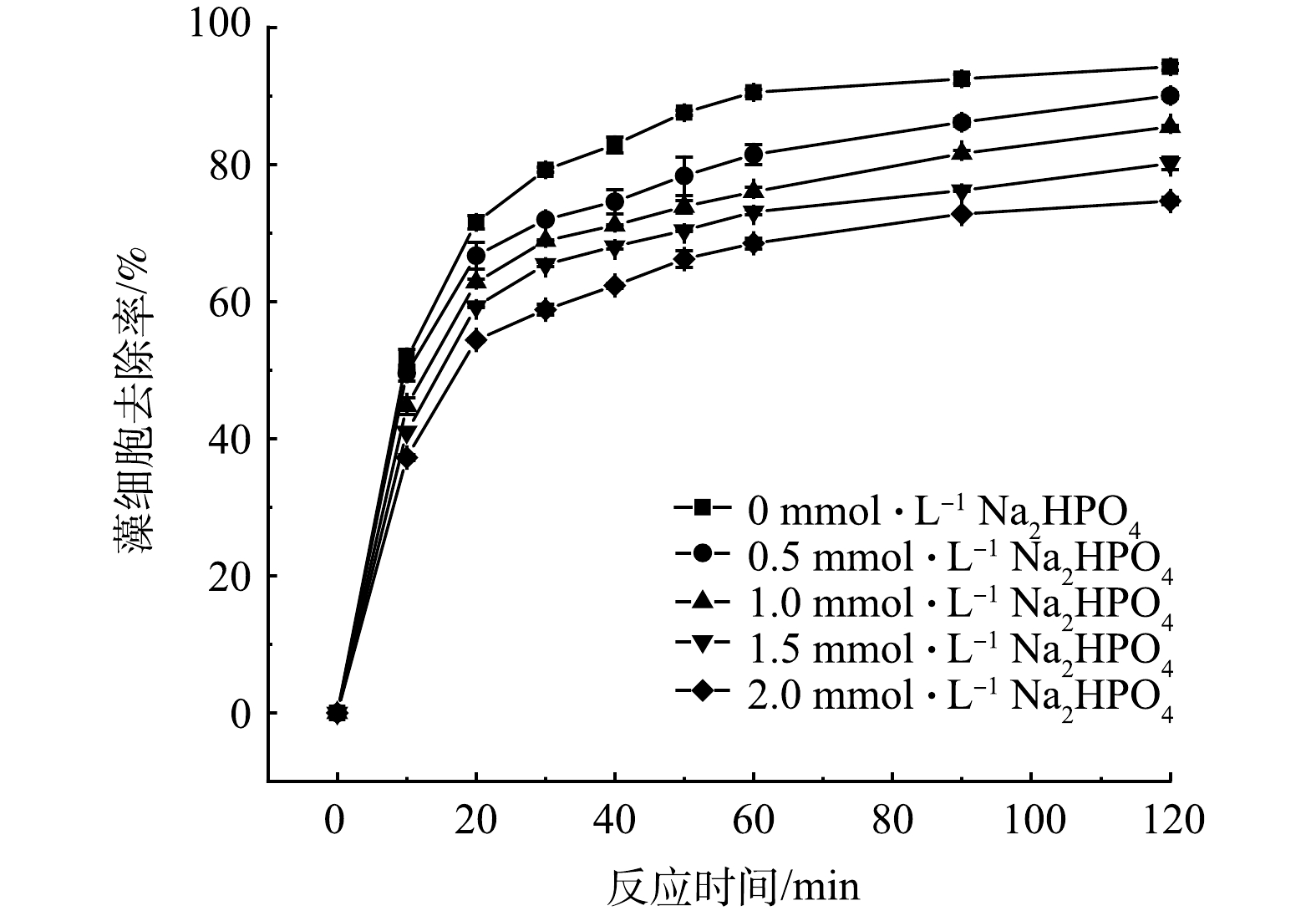
的去除率分别为94.66%、58.92%和41.52%,藻细胞去除的氧化、絮凝的贡献率分别为30.50%和69.50%;当pH为6.0~10.0时,藻细胞去除率均保持较高水平,其中弱酸环境有利于提高藻细胞的去除;外加的HPO
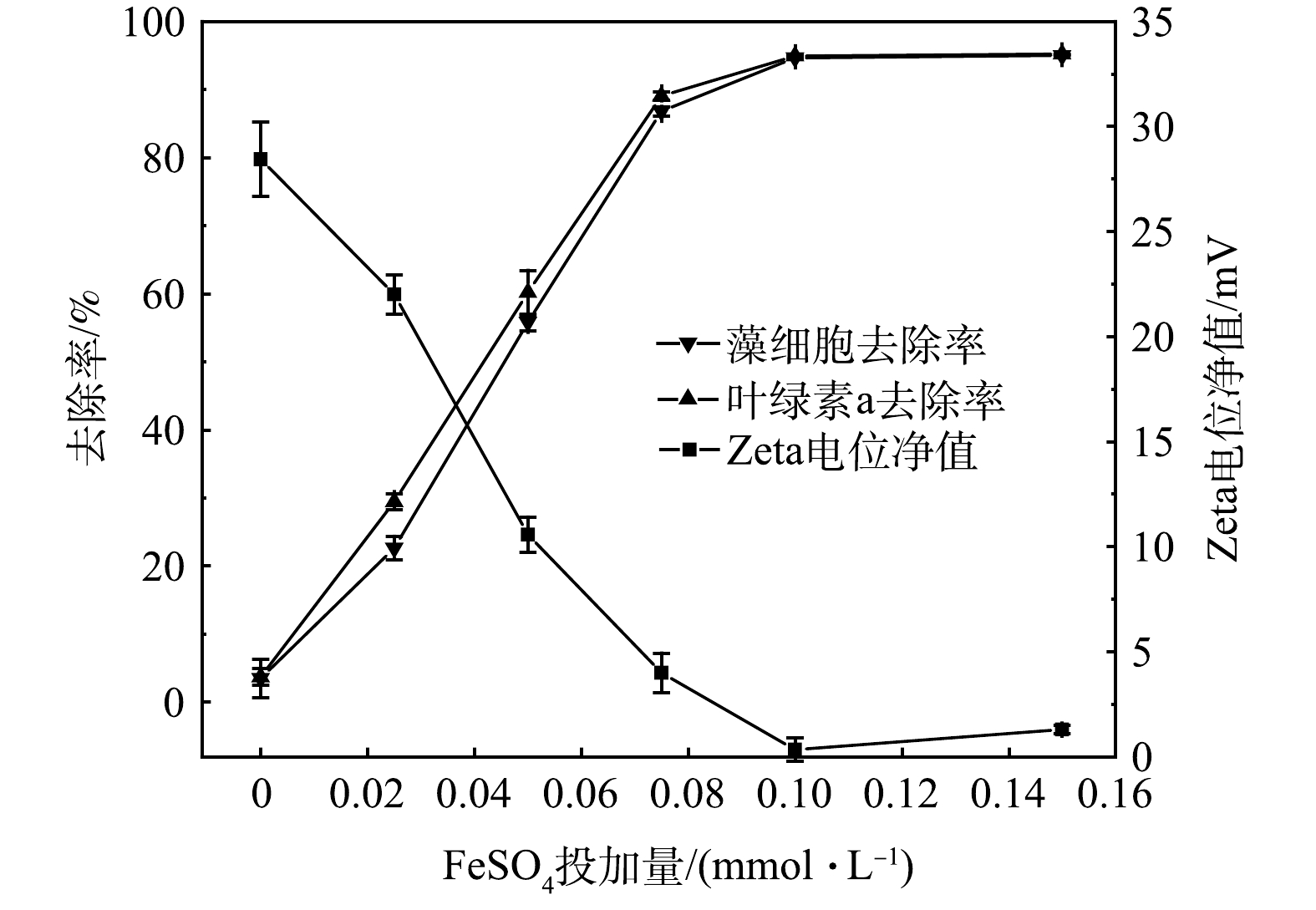
时,藻细胞、叶绿素a去除率随着Zeta电位净值降低而升高。扫描电镜表征结果表明,协同氧化后大多数藻细胞形态结构完整,从而可有效避免IOMs释放。以上研究结果可为FeSO
-PMS治理富营养化水体中蓝藻水华提供参考。
Avoiding the formation of disinfection by-products (DBPs) and the release of intracellular organic matters (IOMs) are keys to resolve the potential risks of cyanobacterial blooms treated by traditional techniques. In this study, the advanced oxidation technology based on FeSO
cells was investigated. The effects of FeSO
were studied. Results showed that when the doses of FeSO
measurements were reduced by 94.66%, 58.92% and 41.52%, respectively. The oxidation and flocculation process contributed to the algae cell removal rates were 30.50% and 69.50%, respectively. The removal rates of
could maintained at a high level when the pH was in the rage of 6.0~10.0, especial with mild acidic conditions. Due to competitive inhibition of
, the removal efficiencies of algae cells began to decrease. FeSO
-PMS could effectively degrade organic matters (AOMs) with fluorescence characteristics. While the dosage of FeSO
, the removal rate of algae cells and Chl-a increased with the decrease of the absolute Zeta potential. Scanning electron microscopy analysis also showed that most of algae cells had non-destructive morphology and structure after coordinated oxidation, which indicated this process effectively avoiding the release of IOMs. The above results can provide theoretical foundation for FeSO
-PMS treating cyanobacteria blooms in eutrophic water bodies.
.
Effect of pH on the removal rate of algae cells
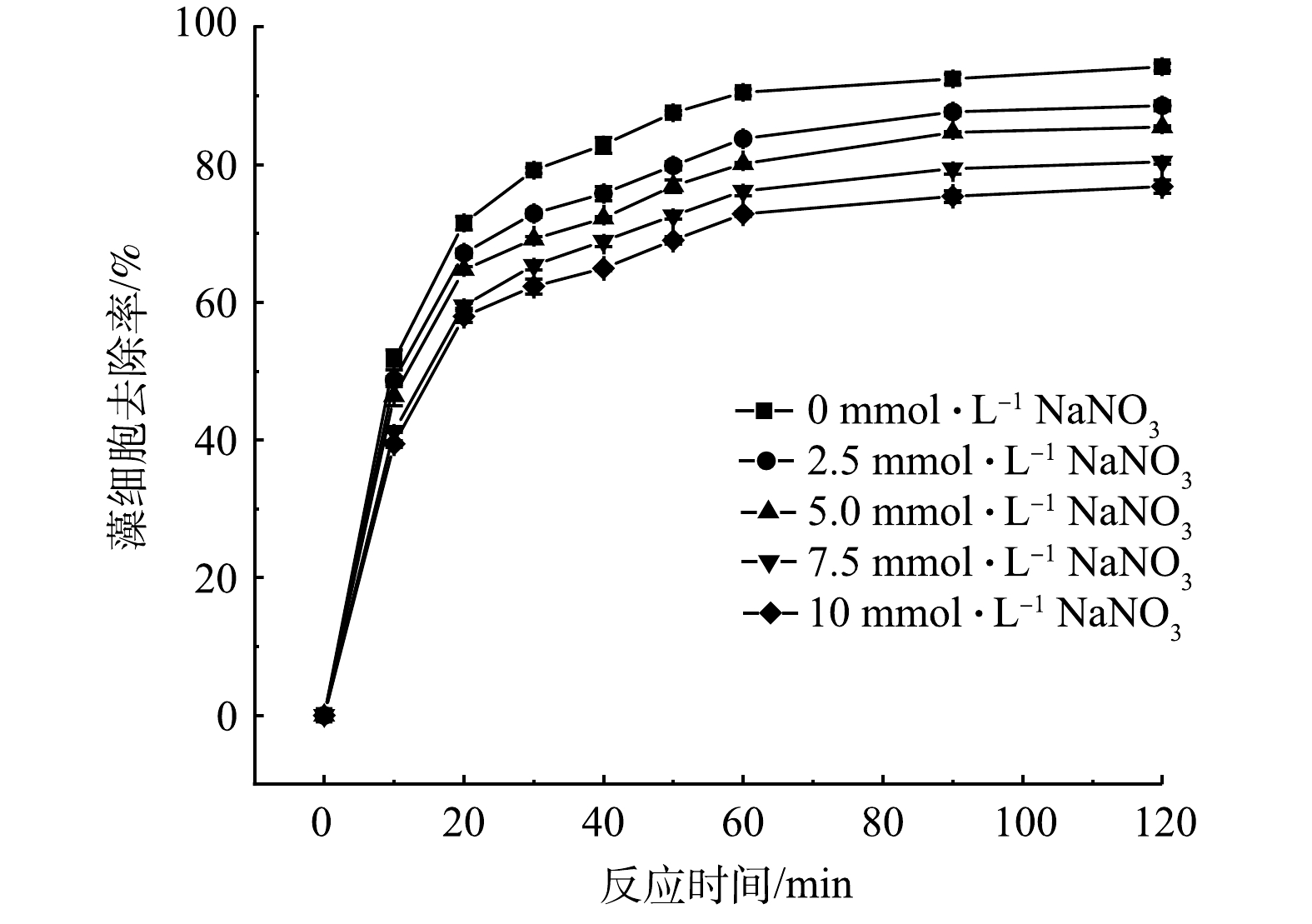
on the removal rate of algae cells
on the removal rate of algae cells
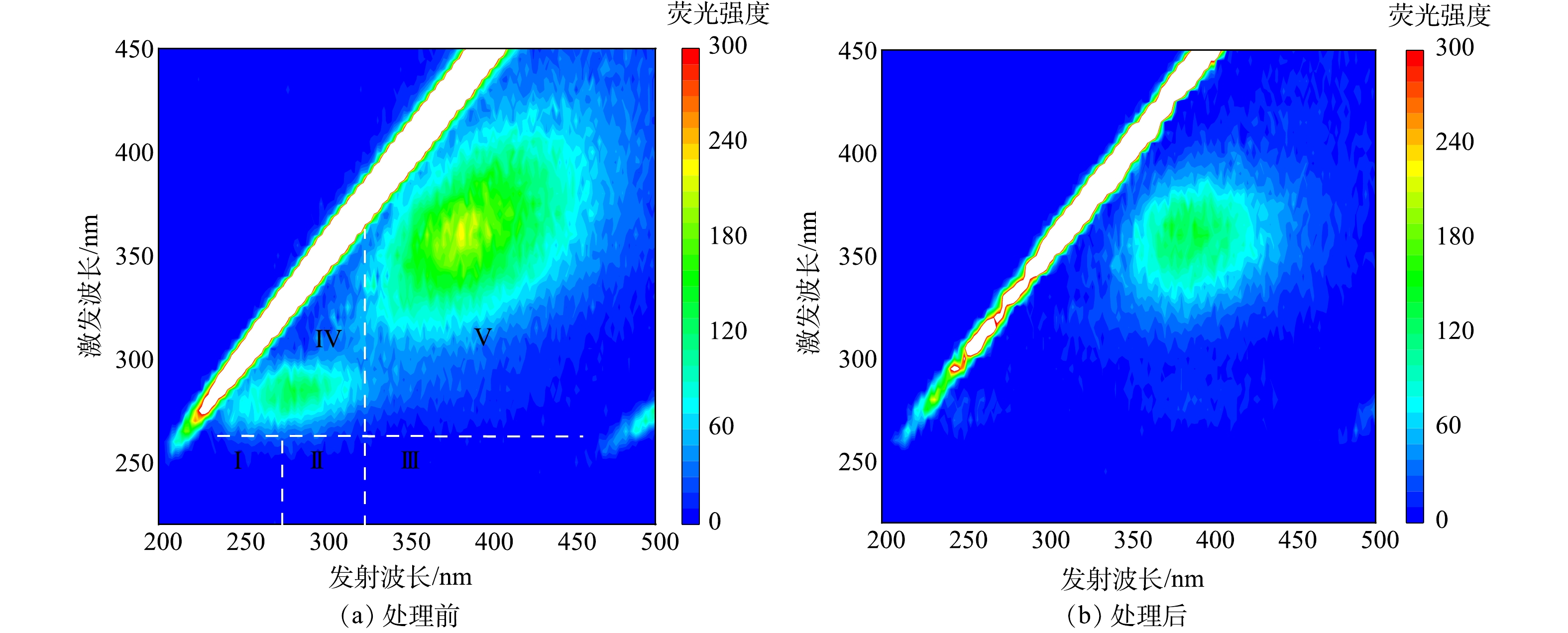
Changes of fluorescence EEM spectra of extracellular AOMs
Zeta电位净值、藻细胞、叶绿素a去除率变化
Changes of the absolute value of zeta potentials and the removal rate of algae cells and Chl-a
| [1] | LI X, GUO M, DUAN X, et al. Distribution of organic phosphorus species in sediment profiles of shallow lakes and its effect on photo-release of phosphate during sediment resuspension[J]. Environment International, 2019, 130: 104916-104925. doi: 10.1016/j.envint.2019.104916 |
| [2] | 魏群, 王磊, 马湘蒙, 等. 淡水湖库蓝藻水华治理对策研究与展望[J]. 华北水利水电大学学报(自然科学版), 2021, 42(1): 22-30. |
| [3] | ZHAO F, CHU H, YU Z, et al. The filtration and fouling performance of membranes with different pore sizes in algae harvesting[J]. Science of the Total Environment, 2017, 587: 87-93. |
| [4] | PAERL H W, OTTEN T G. Harmful cyanobacterial blooms: Causes, consequences, and controls[J]. Microbial Ecology, 2013, 65(4): 995-1010. doi: 10.1007/s00248-012-0159-y |
| [5] | MOUSAVI S M S, DEHGHANZADEH R, EBRAHIMI S M. Comparative analysis of ozonation (O3) and activated carbon catalyzed ozonation (ACCO) for destroying chlorophyll a and reducing dissolved organic carbon from a eutrophic water reservoir[J]. Chemical Engineering Journal, 2017, 314: 396-405. doi: 10.1016/j.cej.2016.11.159 |
| [6] | DITTMANN E, WIEGAND C. Cyanobacterial toxins-occurrence, biosynthesis and impact on human affairs[J]. Molecular Nutrition & Food Research, 2010, 50(1): 7-17. |
| [7] | 刘宇程, 杨冰, 李沁蔓, 等. Cl-和pH对高级氧化工艺去除含盐废水中有机物的影响及机理[J]. 环境工程学报, 2021, 15(5): 1487-1499. doi: 10.12030/j.cjee.202009046 |
| [8] | FENG M, CIZMAS L, WANG Z, et al. Synergistic effect of aqueous removal of fluoroquinolones by a combined use of peroxymonosulfate and ferrate(VI)[J]. Chemosphere Environmental Toxicology & Risk Assessment, 2017, 177: 144-148. |
| [9] | MATILAINEN A, SILLANPAEAE M. Removal of natural organic matter from drinking water by advanced oxidation processes[J]. Chemosphere, 2010, 80(4): 351-365. doi: 10.1016/j.chemosphere.2010.04.067 |
| [10] | MA X, YAN X, YAO J, et al. Feasibility and comparative analysis of cadmium biosorption by living Scenedesmus obliquus FACHB-12 biofilms[J]. Chemosphere, 2021, 275: 130125-130133. doi: 10.1016/j.chemosphere.2021.130125 |
| [11] | MA X, CHEN Y, LIU F, et al. Enhanced tolerance and resistance characteristics of Scenedesmus obliquus FACHB-12 with K3 carrier in cadmium polluted water[J]. Algal Research, 2021, 55: 102267-102276. doi: 10.1016/j.algal.2021.102267 |
| [12] | GU N, WU Y, GAO J, et al. Microcystis aeruginosa removal by in situ chemical oxidation using persulfate activated by Fe2+ ions[J]. Ecological Engineering, 2017, 99: 290-297. doi: 10.1016/j.ecoleng.2016.11.048 |
| [13] | HAN D, JIANGYONG H. The optimal method for peroxydisulfate quenching: A comparison of commonly used reductants[J]. Chemosphere, 2021, 262: 128000-128005. doi: 10.1016/j.chemosphere.2020.128000 |
| [14] | MARTIN P, IVANA K, LENKA C, et al. Current knowledge in the field of algal organic matter adsorption onto activated carbon in drinking water treatment[J]. Science of the Total Environment, 2021, 799: 149455-149473. doi: 10.1016/j.scitotenv.2021.149455 |
| [15] | CHANIKYA P, NIDHEESH P V, BABU D S, et al. Treatment of dyeing wastewater by combined sulfate radical based electrochemical advanced oxidation and electrocoagulation processes[J]. Separation and Purification Technology, 2021, 254: 117570-117580. doi: 10.1016/j.seppur.2020.117570 |
| [16] | WANG Z, CHEN Y, XIE P, et al. Removal of Microcystis aeruginosa by UV-activated persulfate: Performance and characteristics[J]. Chemical Engineering Journal, 2016, 300: 245-253. doi: 10.1016/j.cej.2016.04.125 |
| [17] | KAYLA P, LEI L, YOUCHUL J, et al. The application of potassium permanganate to treat cyanobacteria-laden water: A review[J]. Process Safety and Environmental Protection, 2021, 148: 400-414. doi: 10.1016/j.psep.2020.09.058 |
| [18] | FANG G, DIONYSIOU D D, WANG Y, et al. Sulfate radical-based degradation of polychlorinated biphenyls: Effects of chloride ion and reaction kinetics[J]. Journal of Hazardous Materials, 2012: 227-228. |
| [19] | BANERJEE M, KONAR R S. Comment on the paper "polymerization of acrylonitrile initiated by K2S2O8-Fe(II) redox system"[J]. Journal of Polymer ence Polymer Chemistry Edition, 2010, 22(5): 1193-1195. |
| [20] | LIPCZYNSKA-KOCHANY E, SPRAH G, HARMS S. Influence of some groundwater and surface waters constituents on the degradation of 4-chlorophenol by the Fenton reaction[J]. Chemosphere, 1995, 30(1): 9-20. doi: 10.1016/0045-6535(94)00371-Z |
| [21] | TAO Z, LILI D, HONGQIANG R, et al. Thermodynamic modeling of ferric phosphate precipitation for phosphorus removal and recovery from wastewater[J]. Journal of Hazardous Materials, 2010, 176: 444-450. doi: 10.1016/j.jhazmat.2009.11.049 |
| [22] | MPRA B, CSL A, UKA C, et al. Oxidative degradation of benzoic acid using Fe0- and sulfidized Fe0-activated persulfate: A comparative study[J]. Chemical Engineering Journal, 2017, 315: 426-436. doi: 10.1016/j.cej.2017.01.031 |
| [23] | 王庆良, 李倩倩, 童东革, 等. 光化学反应中自由基的作用及反应影响因素的研究进展[J]. 环境化学, 2020, 39(2): 301-316. doi: 10.7524/j.issn.0254-6108.2019061802 |
| [24] | ZHANG H, HUANG Q, KE Z, et al. Degradation of microcystin-LR in water by glow discharge plasma oxidation at the gas-solution interface and its safety evaluation[J]. Water Research, 2012, 46(19): 6554-6562. doi: 10.1016/j.watres.2012.09.041 |
| [25] | GUO T, YANG Y, LIU R, et al. Enhanced removal of intracellular organic matters (IOM) from Microcystic aeruginosa by aluminum coagulation[J]. Separation and Purification Technology, 2017, 189: 279-287. doi: 10.1016/j.seppur.2017.06.066 |
| [26] | YANG T, WANG L, LIU Y, et al. Removal of organoarsenic with ferrate and ferrate resultant nanoparticles: Oxidation and adsorption[J]. Environmental Science & Technology, 2018, 52(22): 13325-13335. |
| [27] | 黄芳, 温佳欣, 赵成, 等. 紫外光催化耦合化学絮凝工艺及其对腐殖酸抑制污泥发酵产酸的缓解效果[J]. 环境工程学报, 2021, 15(6): 2037-2045. doi: 10.12030/j.cjee.202102073 |
| [28] | CHEN W, WESTERHOFF P, LEENHEER J A, et al. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science & Technology, 2015, 37(24): 5701-5710. |
| [29] | TIAN J, WU C, YU H, et al. Applying ultraviolet/persulfate (UV/PS) pre-oxidation for controlling ultrafiltration membrane fouling by natural organic matter (NOM) in surface water[J]. Water Research, 2018, 132: 190-199. doi: 10.1016/j.watres.2018.01.005 |
| [30] | RAUL E M, OLEG S P, JACQUES S, et al. Surface charge and zeta-potential of metabolically active and dead cyanobacteria[J]. Journal of Colloid and Interface Science, 2008, 323(2): 317-325. doi: 10.1016/j.jcis.2008.04.041 |
| [31] | ZHANG G, ZHANG P, FAN M. Ultrasound-enhanced coagulation for Microcystis aeruginosa removal[J]. Ultrasonics Sonochemistry, 2008, 16(3): 334-338. |
| [32] | ZHOU J, LIU J, ZHAO Z, et al. Microcystis aeruginosa-laden water treatment using peroxymonosulfate enhanced Fe(II) coagulation: Performance and the role of in situ formed Fe3O4[J]. Chemical Engineering Journal, 2020, 382: 123012-123023. doi: 10.1016/j.cej.2019.123012 |
| [33] | MATZEK L W, CARTER K E. Activated persulfate for organic chemical degradation: A review[J]. Chemosphere, 2016, 151: 178-188. doi: 10.1016/j.chemosphere.2016.02.055 |
| [34] | PIVOKONSKY M, SAFARIKOVA J, BUBAKOVA P, et al. Coagulation of peptides and proteins produced by Microcystis aeruginosa: Interaction mechanisms and the effect of Fe-peptide/protein complexes formation[J]. Water Research, 2012, 46(17): 5583-5590. doi: 10.1016/j.watres.2012.07.040 |
| [35] | LIN J, LI X, HAN L, et al. Folium Sennae protects against hydroxyl radical-induced DNA damage via antioxidant mechanism: An in vitro study[J]. Botanical Studies, 2014, 55(1): 1-8. doi: 10.1186/1999-3110-55-1 |
| [36] | LIU B, QU F, CHEN W, et al. Microcystis aeruginosa-laden water treatment using enhanced coagulation by persulfate/Fe(II), ozone and permanganate: Comparison of the simultaneous and successive oxidant dosing strategy[J]. Water Research, 2017, 125: 72-80. doi: 10.1016/j.watres.2017.08.035 |

































































































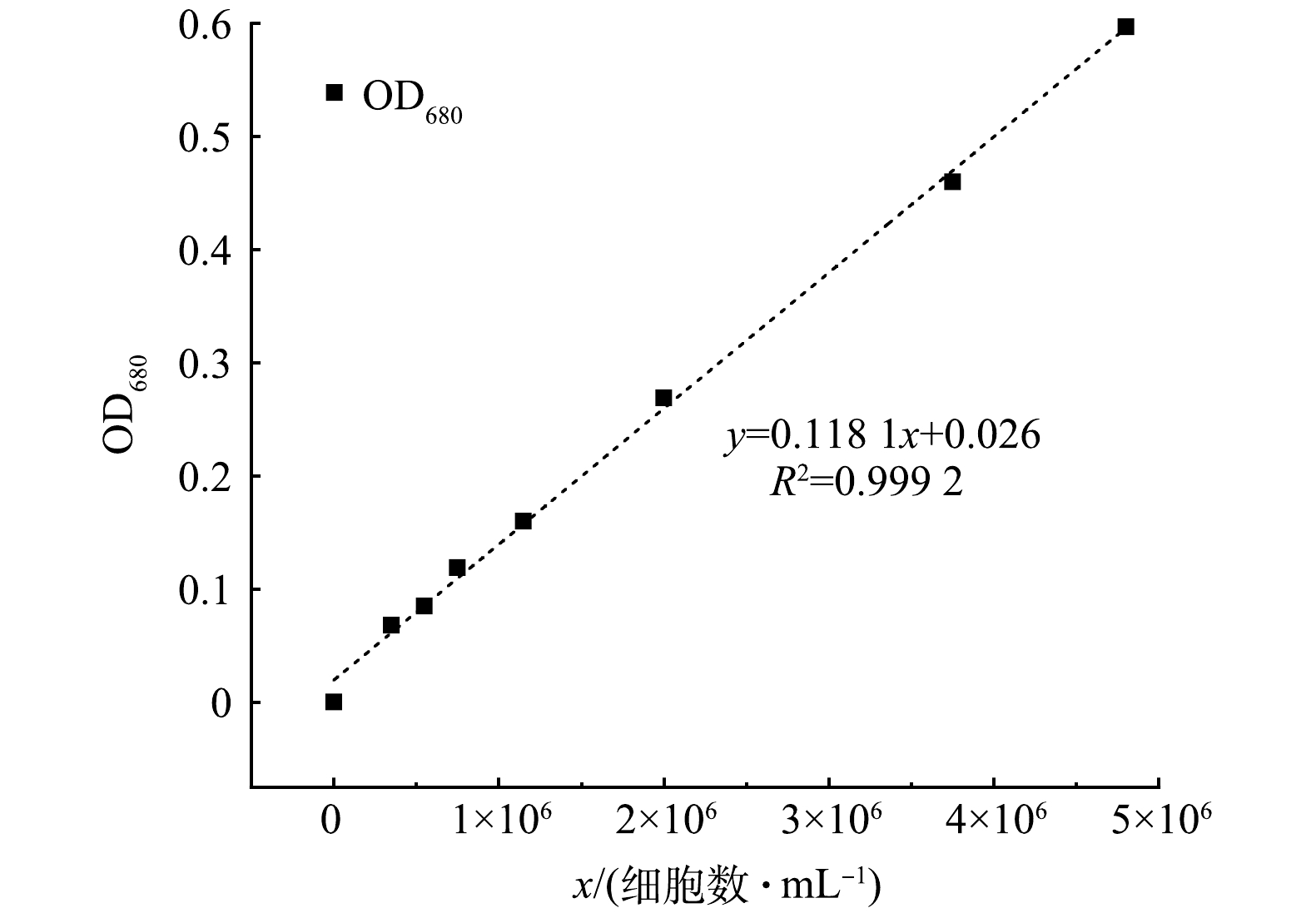
 下载:
下载: 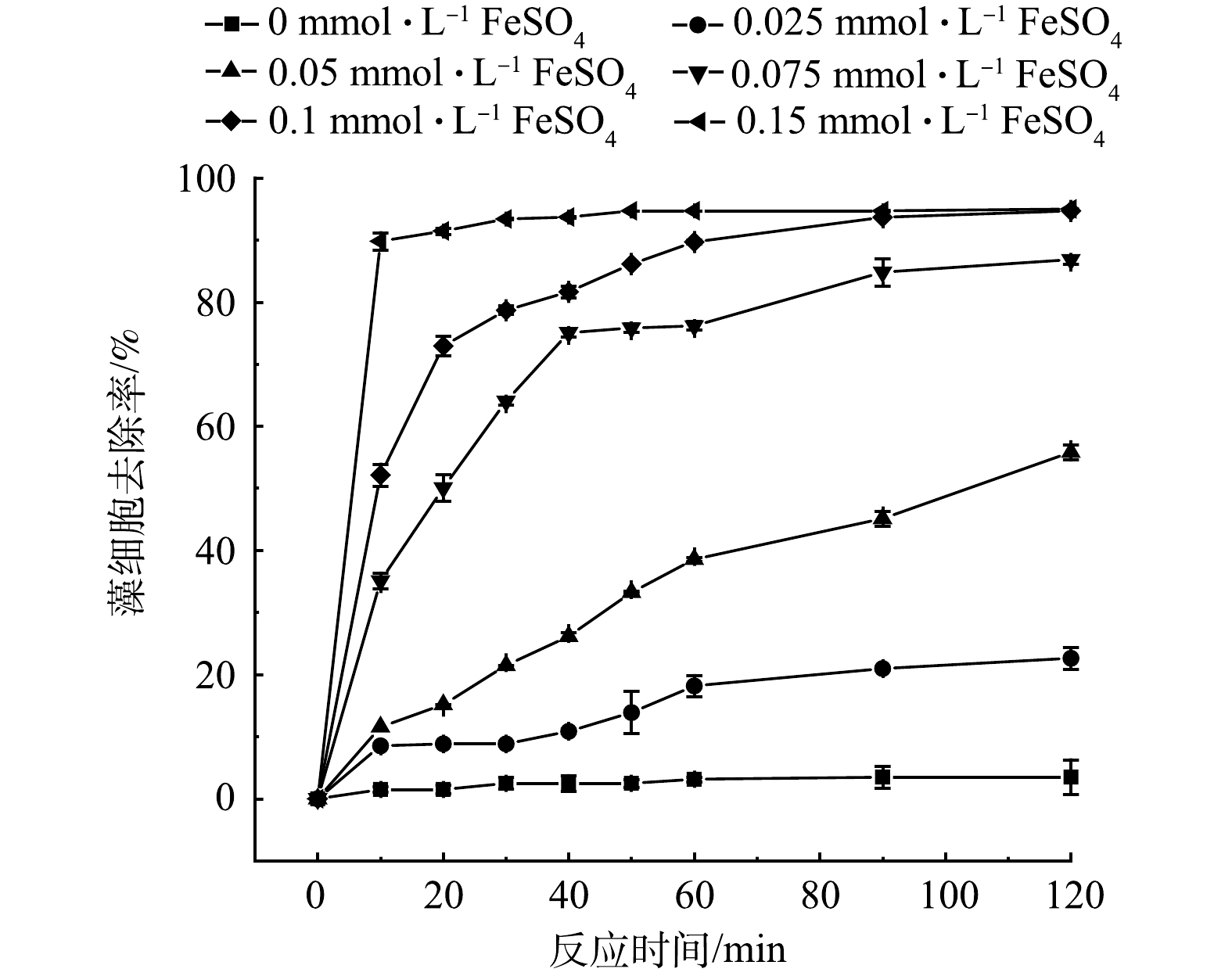
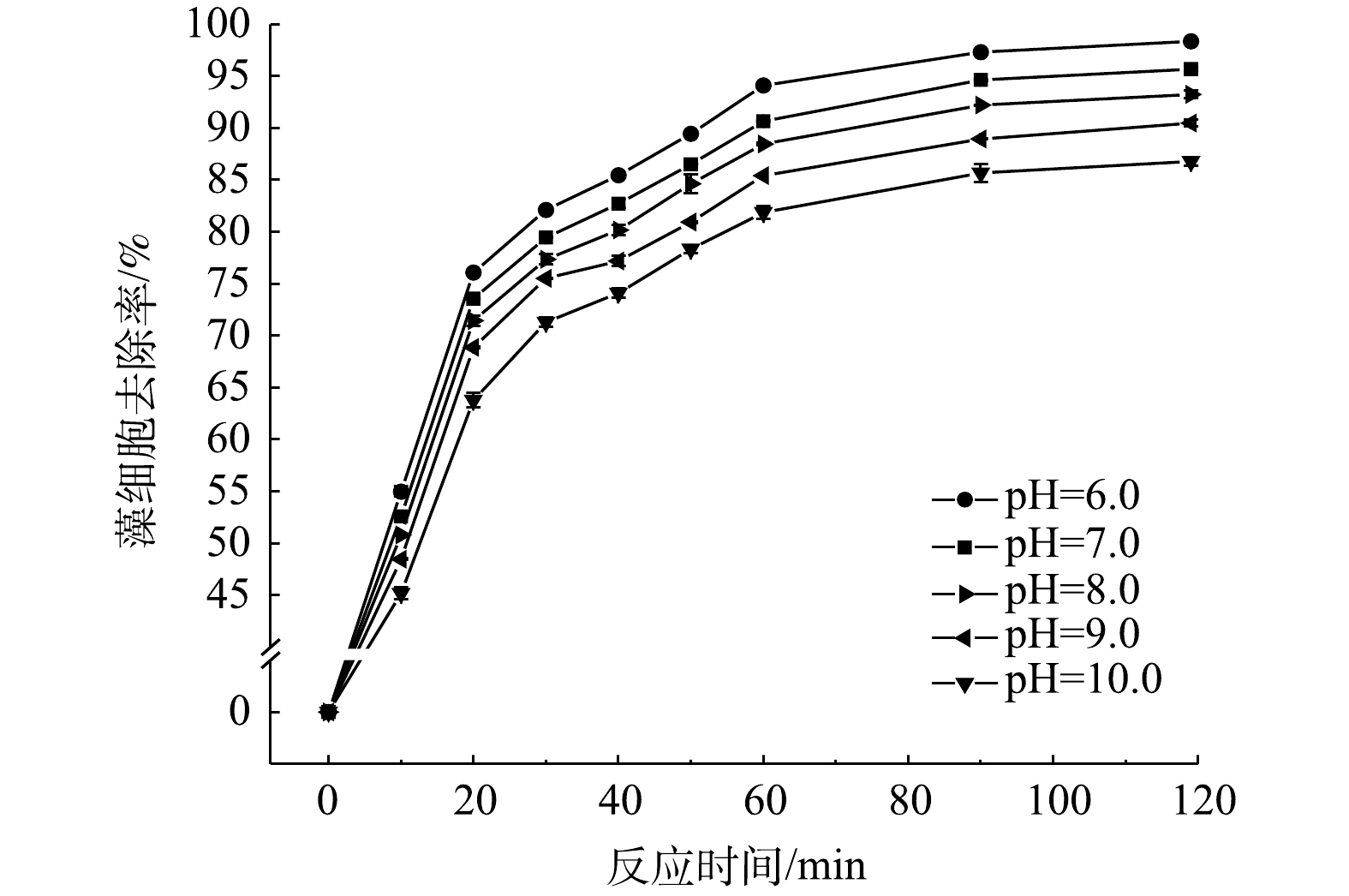




 点击查看大图
点击查看大图