全文HTML
--> --> --> 氨氮作为水体中的主要污染物之一,容易使水体富营养化,导致“水华”和“赤潮”发生,严重威胁生态环境[1]。硝化和反硝化作用是生物脱氮的两个重要步骤。硝化作用是在好氧条件下氨氧化细菌(ammonia-oxidizing bacteria,AOB)和亚硝酸盐氧化细菌(nitrite-oxidizing bacteria,NOB)将氨氮转化为亚硝酸盐和硝酸盐的过程,反硝化作用是通过反硝化细菌将硝酸盐和亚硝酸盐还原成气态氮的过程。生物脱氮因经济高效、易于操作和绿色无二次污染等优点成为研究热点。但是,由于硝化细菌生长缓慢、同化效率低和环境敏感性高,并且高氨氮废水中存在大量的游离氨会对传统生物脱氮法中的微生物活性产生抑制作用,因此,保持细菌的活性,维持生物量是影响脱氮效率的关键因素[2]。群体感应(quorum sensing,QS)是指微生物能自发合成并释放信号分子来感知周围细菌密度,当信号分子的浓度到达一定阈值后被细胞感知并调控相关基因的表达,从而调节微生物的一些行为,如生物膜的形成、生物发光和胞外多糖产生等[3-4]。已知的信号分子根据其化学种类的不同分为三大类:革兰氏阴性菌分泌的酰基高丝氨酸内酯(N-acyl-homoserine-lactones,AHLs)、革兰氏阳性菌分泌的寡肽(autoinducter peptide,AIP)和能同时调控革兰氏阴性菌和阳性菌实现细菌种间交流的呋喃硼酸二酯(AI-2)。酰基高丝氨酸内酯环是AHLs信号分子的共同特征,酰基侧链的长度、碳链骨架饱和度和取代基的不同导致了AHLs的多样性和特异性[5]。硝化功能细菌属于革兰氏阴性菌,种内产生的信号分子为AHLs,因此,本实验主要研究AHLs类信号分子对硝化细菌的影响。
1997年BATCHELOR等[6]首次发现Nitrosomonas europaea存在群体感应现象,其中高细胞密度培养比低细胞密度培养会产生和积累更多AHLs,并且外源添加3-oxo-C6-HSL信号分子有利于饥饿状态下的N. europaea恢复生长。最近的研究表明,硝化细菌可以通过QS调节自身的行为,例如提高细菌的活性、促进生物膜的生长以及调节胞外聚合物(extracellular polymeric substances,EPS)的合成,从而更好地聚集,占用更多资源和空间,保持环境中的种群优势[6-8]。在硝化反应器的混合培养中,投加不同种类的AHLs可发现,AHLs通过改变EPS的组成防止生长缓慢的硝化细菌流失,并且3-oxo-C6-HSL和C6-HSL有利于促进细菌的附着并提高脱氮效率[7]。同样,将硝化颗粒污泥中含有AHL的细胞提取物添加到硝化活性污泥中,处理30 d后,提高了细胞的粘附和聚集性,提高了微生物的活性,最大氨氮去除率提高了83.3%[8]。前期调研发现,C7-HSL是少见的酰基侧链C原子为奇数的信号分子且在污水处理中研究较少,而C8-HSL和3-oxo-C10-HSL是脱氮过程中的典型信号分子。因此,本研究添加C7-HSL、C8-HSL和3-oxo-C10-HSL到硝化系统中,通过观察污泥生长特性、硝化性能的变化以及EPS成分的改变,研究信号分子对处理高氨氮负荷污水的影响。
1.1. 实验试剂
AHLs类信号分子N-Heptanoyl-L-homoserine lactone (C7-HSL)、N-Octanoyl-L-homoserine lactone (C8-HSL)和N-(3-oxodecanoyl)-L-homoserine lactone (3-oxo-C10-HSL) 购买自美国sigma-aldrich公司,并储存在?20 ℃。实验所用试剂无特殊说明均为分析纯。1.2. 硝化污泥的培养
本实验污泥取自武汉市沙湖污水处理厂二沉池,经曝气后添加到序批式反应器(sequencing batch reactor, SBR)中,并逐步提高氨氮浓度来驯化富集脱氮功能细菌。SBR的有效容积为18 L,循环周期为8h(进水0.25 h,曝气搅拌6.5 h,静沉0.5 h,出水0.25 h,静置0.5 h),每周期进出水体积为9 L。接种初期,污泥总悬浮固体浓度(mixed liquor suspended solids,MLSS)为3.2 g·L?1,初始污泥沉降比(sludge settling velocity, SV)为24%,










1.3. 信号分子对硝化污泥的影响
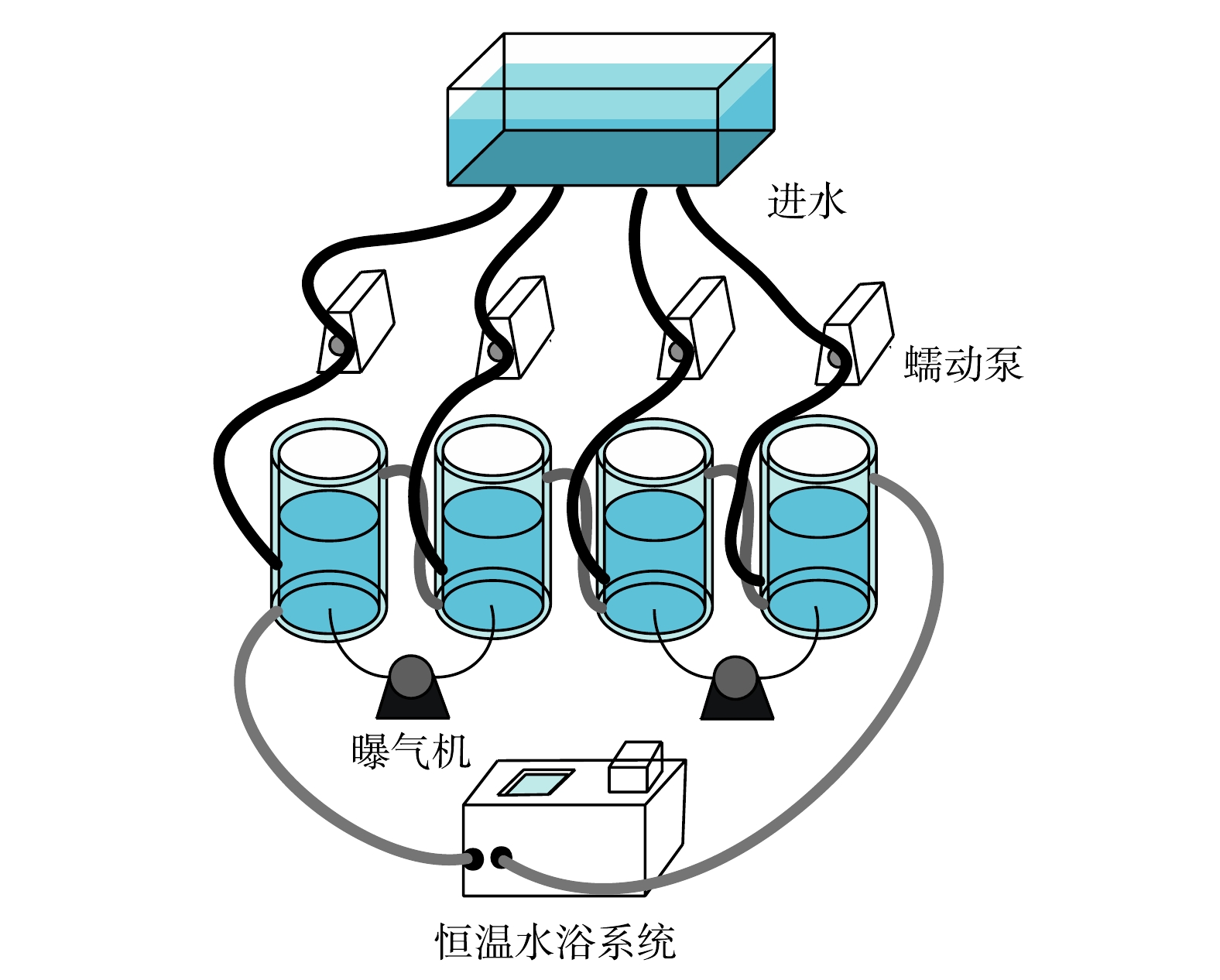
将SBR中的活性污泥分别接种到体积为1 L的4个SBR中(图1),分别为空白组、C7-HSL组、C8-HSL组和3-oxo-C10-HSL组,以相同条件运行40 d。恒温水循环系统设置为25 ℃,控制DO在2.0左右,进水pH维持在8.0~8.1,出水pH维持在7.0~7.1。每周期12 h(进水1 h,曝气搅拌9 h,静沉出水1 h,休息1 h),每周期进出水500 mL,每天排泥大约3%,进水配方见表1。初始MLSS为3.52 g·L?1,初始进水


























1.4. 分析方法
实验中MLSS、混合液挥发性悬浮固体浓度(mixed liquid volatile suspended solids,MLVSS)、出水悬浮物(effluent suspended solids,ESS)、TN、


1.5. EPS提取及测定
EPS的提取采用高速离心法[11],分为松散结合型EPS (loosely-bond EPS,LB-EPS)和紧密结合型EPS (tightly-bond EPS,TB-EPS)。蛋白质的测定采用SK3501 BCA 改良型试剂盒(上海生工,中国)。多糖的测定为苯酚-浓硫酸法,具体方法参照DUBOIS等[12]的研究。TB-EPS的检测采用荧光光度计(F-7000 FL Spectrophotometer,日本)测量三维荧光光谱(fluorescence excitation-emission matrix, EEM),光谱设置条件如下:激发波长(Ex) 200~450 nm,步长5 nm;发射波长(Em) 280~550 nm,步长5 nm;狭缝宽度为5 nm,扫描速度2 400 nm·min?1。1.6. AHL的提取与检测
利用固相萃取(solid-phase extraction,SPE)技术对样品中的AHLs进行浓缩,具体操作遵循LI等[13]的方法。AHL的检测参考胡惠秩[14]的方法。对于AHL定量,构建了5~100 nmol·L?1的基质匹配标准曲线,经计算C7-HSL、C8-HSL和3-oxo-C10-HSL的加标回收率分别为(98.82±4.21)%、(100.00±5.56)%、(97.65±6.85)%。1.7. 数据计算分析
每次从每个反应器各取3个平行样,测量结果取平均值,用SPSS软件(R26.0.0.0)分析数据的差异性与相关性。游离氨(free ammonia,FA)与游离亚硝酸(free nitrous acid,FNA)可以表征其对NOB的抑制作用,FA和FNA一般根据式(1)和式(2)进行计算;在活性实验中,氨氮的消耗速率(
式中:CFA为游离氨质量浓度,mg·L?1;CFNA为游离亚硝酸质量浓度,mg·L?1;

式中:


2.1. 信号分子对硝化污泥生长的影响
经过40 d的运行,4组SBR中的硝化污泥均得到了一定程度的增长。如表2所示,与空白组相比,添加了信号分子反应器的MLSS显著增加(P<0.05),增长率大约在20%~50%,其中C7-HSL组的MLSS增加的最多,达到(3.76±0.15) g·L?1,其增长量在1.24 g·L?1左右,大约是空白组增长量的5倍。出水悬浮物ESS可反映活性污泥的沉降能力与结构稳定性,实验组的ESS均比空白组低,空白组最高为0.035 g·L?1,C7-HSL组最低为0.025 g·L?1。计算MLVSS/MLSS可以反映硝化污泥中生物量的比例。结果表明,C7-HSL组的MLVSS/MLSS值最高,为0.764。比较各组平均生长速率(以MLSS计),实验组较空白组平均生长速率显著增加(P<0.05),C7-HSL组增加最明显,为(0.169±0.022) g·(L·d)?1,比空白组高出35.20%,C8-HSL组和3-oxo-C10-HSL组也明显高于空白组9.60%和10.40%。LI等[7]添加C6-HSL和3-oxo-C6-HSL,使得微生物的生长速率分别提高至0.260 g·(L·d)?1和0.227 g·(L·d)?1,几乎是空白组的2倍,同时提高了NH4+-N降解率。同样地,WU等[8]在硝化活性污泥中添加从硝化颗粒污泥中提取的含AHL的细胞提取物,经过30 d的培养后,污泥增长速率增加了0.01 g·(L·d)?1。本研究结果印证了LI和WU的研究中添加信号分子后污泥平均生长速率提高和氨氮降解效率提高的结论,但生长速率的结果有所不同。这种差异可能是因信号分子浓度的不同造成的,LI等[7]每天投加的信号分子浓度为2 μmol·L?1,WU等[8]的细胞提取物里含有的信号分子浓度比较低。综上所述,添加信号分子可以明显促进微生物的生长,提高微生物的生长速率,其中C7-HSL信号分子的提升效果最显著。2.2. 信号分子对硝化污泥处理性能的影响
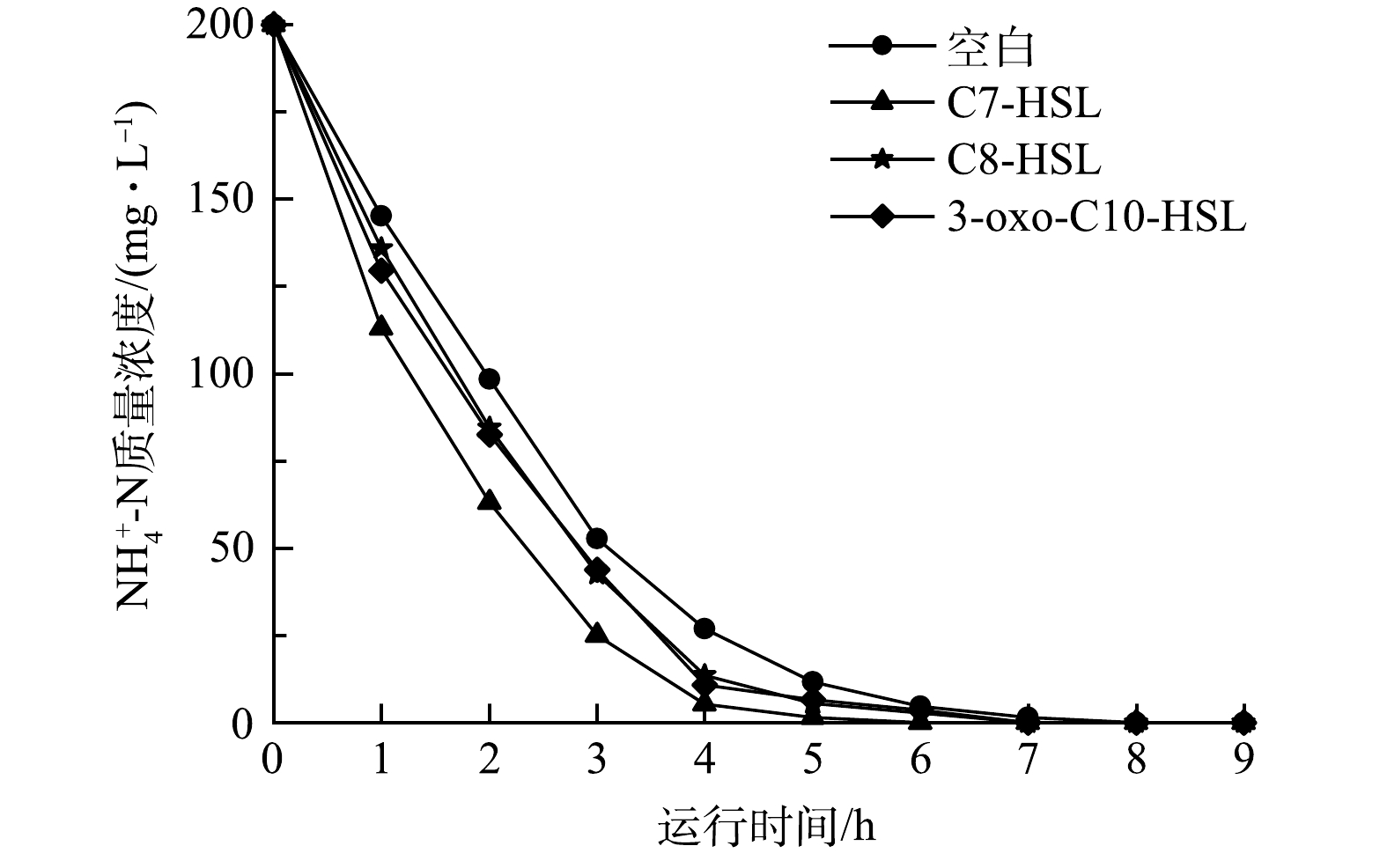
由图2可以看出,在小试实验初期,进水































































































































































































































































值得注意的是,在第15天,进水






















































在第35天时,每隔1 h测量每个反应器中的

















































此外,通过氮平衡的计算,系统中约50%的氮随着出水排出,氮损失在8%~12%。因为氮源是微生物生长所必须的物质,推测此部分氮被细菌自身生长繁殖所消耗。实验中空白组的出水总氮高于实验组,这可能是信号分子提高了微生物的生长速率,导致更多的氮被用于微生物的生长[17]。高NH4+-N负荷下,NH4+-N降解效率的提高,可能与在信号分子的作用下MLSS的增长和微生物活性增强有关,使得系统的稳定性得到加强,缩短了系统达到稳定所需的时间。
2.3. 信号分子对EPS结构的影响
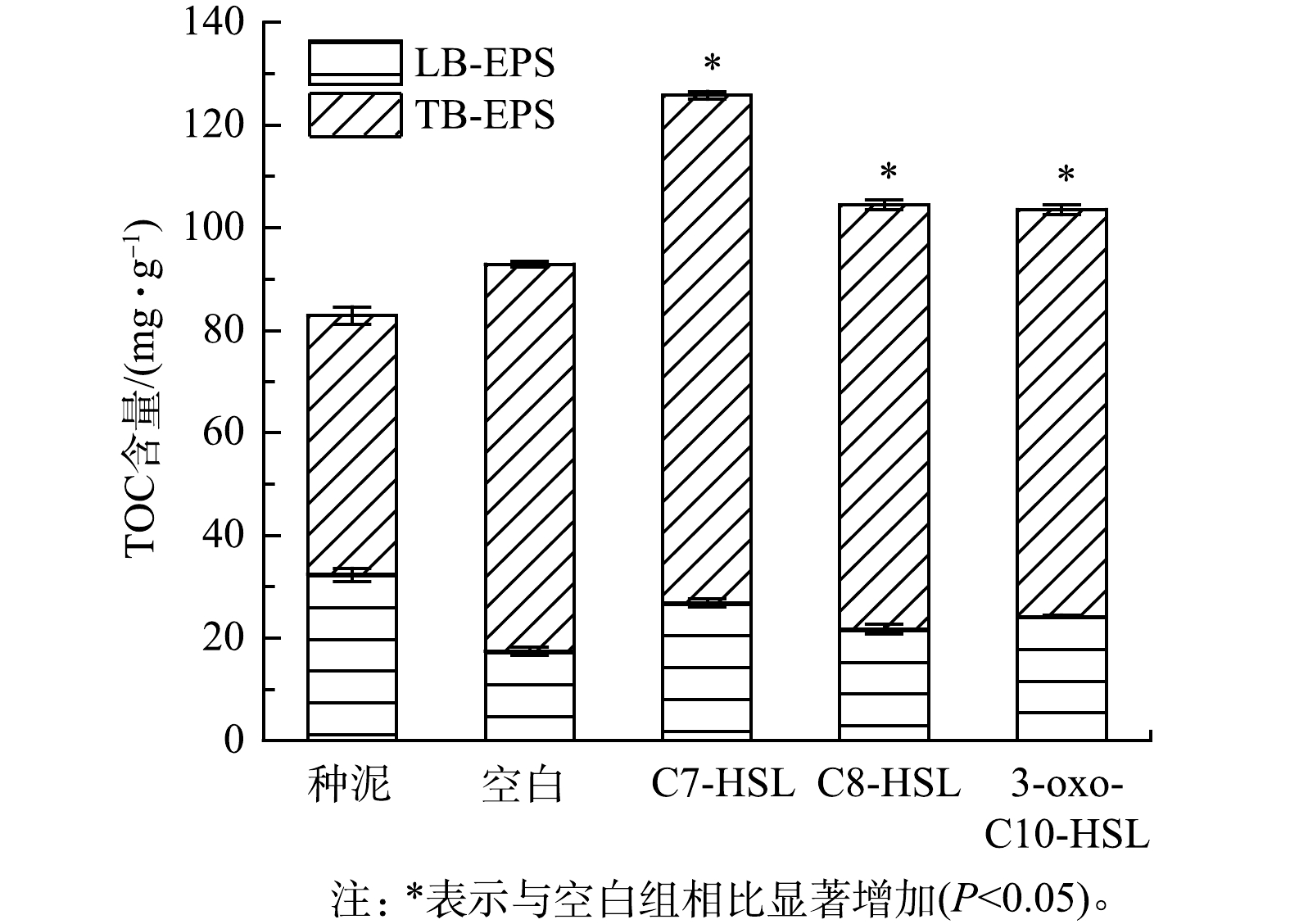
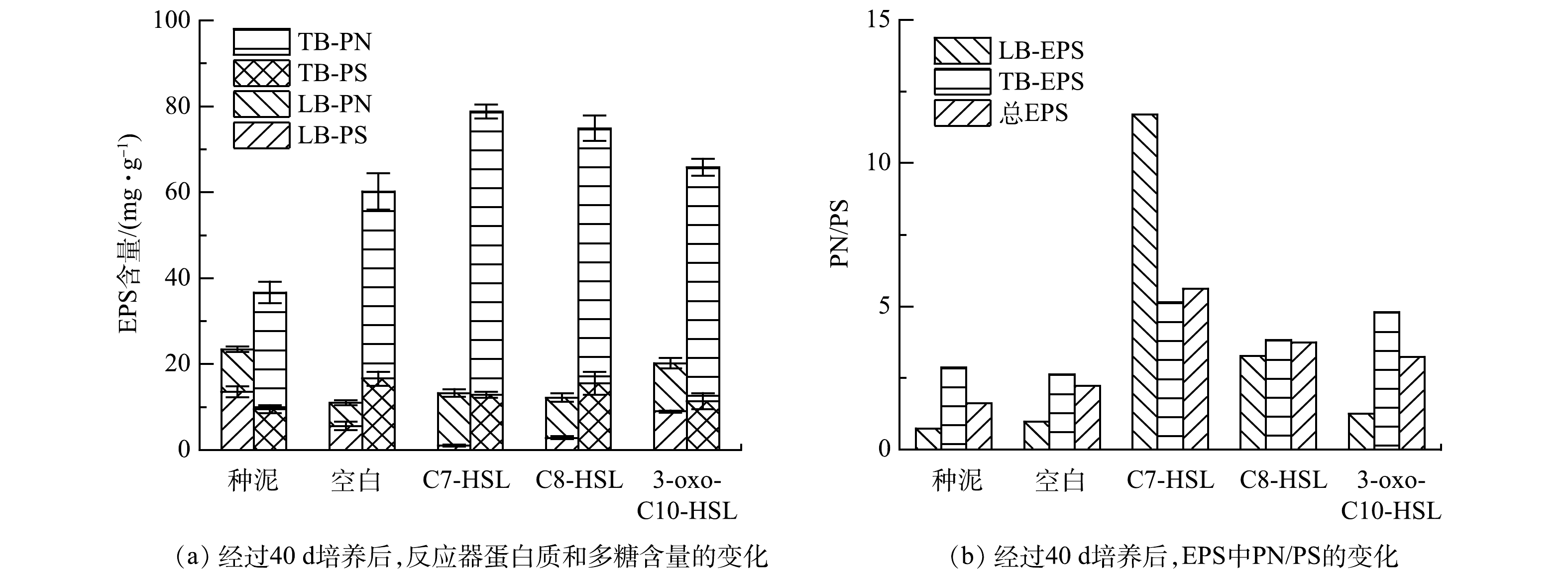
EPS主要是微生物自身代谢产生的高分子聚合物,是细菌抵御外界环境压力的重要屏障[18]。EPS的主要由蛋白质、多糖、腐殖酸和无机物组成,其中蛋白质和多糖的含量占总EPS的70%~80%,对微生物结构及其聚集体的稳定起重要作用[19]。TOC可以表征总EPS的含量[20]。图4表示反应器中LB-EPS和TB-EPS的TOC的变化情况,可以看出,TB-EPS是活性污泥EPS的主要组成部分。经过40 d的培养,所有组别总TOC含量增加,其中C7-HSL组增长最多,较接种污泥增长了51.9%。对于TB-EPS,空白组、C7-HSL组、C8-HSL组和3-oxo-C10-HSL组分别增长了24.90、48.42 、32.26和28.77 mg·g?1(以MLSS计),C7-HSL组TB-EPS的增长量几乎是空白组增长量的2倍。与TB-EPS的变化趋势不同,所有组别的LB-EPS的含量都下降,空白组下降最多,下降了14.91 mg·g?1,C7-HSL组下降最少,只下降了5.45 mg·g?1。这说明在信号分子的作用下,微生物分泌的EPS有增加的趋势,其中C7-HSL对EPS的影响明显优于其他两种信号分子。YEON等[21]在膜生物反应器中观察到,添加C8-HSL可以使EPS的含量增加。而有研究者发现,添加香草醛、猪肾脏化酶可使AHL降解,导致EPS含量降低[22]。QS可以通过介导尿苷二磷酸-N-乙酰半乳糖胺(UDP-GlcNAc)的合成来实现对EPS含量的调节[23]。LB-EPS和TB-EPS对污泥的絮凝沉降性有重要影响,由于LB-EPS通常带负电,其产生的静电斥力导致细胞附着能力降低,因此,LB-EPS含量越高,污泥细胞的附着力越低。TB-EPS中存在的大量羟基以及部分羧基提供丰富充足的阳离子结合位点,以及TB-EPS中含有的相对疏松、对聚集有利的蛋白二级结构使TB-EPS发挥主要的污泥促聚作用[24],由此可知,TB-EPS含量越高,对污泥的聚集越有利[25]。本实验结果说明,添加信号分子有利于TB-EPS的形成,从而促进了污泥的聚集,增加稳定性。图5(a)表示TB-EPS和LB-EPS中蛋白质(PN)和多糖(PS)的含量。各组总蛋白质含量均升高,对于TB-EPS中蛋白质含量,空白组、C7-HSL组、C8-HSL组和3-oxo-C10-HSL组较种泥增长了60.32%、142.63%、118.43%和100.40%。而对于LB-EPS中蛋白质含量,相较种泥的(9.9±0.65) mg·g?1,C7-HSL组和3-oxo-C10-HSL组的含量分别增长23.64%和13.23%,而空白组下降了82.32%,C8-HSL组下降5.86%。以上结果表明,蛋白质是EPS的主要组成成分,同时信号分子可以促进EPS中蛋白质的合成,对TB-EPS中蛋白质合成的影响更大,促进效果排序为C7-HSL>C8-HSL>3-oxo-C10-HSL。总多糖的含量变化与蛋白质含量变化相反,其中LB-EPS中的多糖含量较种泥均下降,C7-HSL组下降最多,下降了12.52 mg·g?1。与LB-EPS多糖含量变化相反,空白组、C7-HSL组、C8-HSL组和3-oxo-C10-HSL组TB-EPS的多糖含量较种泥的(9.51±0.96) mg·g?1分别增长了74.68%、35.29%、63.28%和19.35%。结果表明,信号分子对LB-EPS中多糖的合成有明显的抑制作用,其中C7-HSL抑制作用最明显。对于TB-EPS中的多糖,实验组的多糖含量比种泥高,但比空白组低。结合总多糖含量变化,前述结果说明信号分子抑制了EPS中多糖的合成,其中C7-HSL的抑制作用最明显。在YU的研究中,添加C8-HSL导致EPS的多糖减少9.8%,添加C6-HSL使多糖含量增加了42.3%。而在本实验中,信号分子的添加,导致多糖含量减少了10%~40%,此差异可能是由于信号分子种类的不同造成的[26]。蛋白质和氨基酸组成的二级结构显著促进了疏水相互作用,进而促进了微生物聚集体的高聚集活性[27],而多糖是污泥亲水性重要成分。同时,EPS是带负电的负离子层,蛋白质含有的羧基带正电荷,能中和羧基和磷酸基团的负电荷,从而降低污泥的表面净负电荷,提高污泥的聚集性[28]。此外,也有研究表明,QS可以调节细胞外蛋白质的含量,提高微生物的聚集能力和污泥结构的稳定性[7,29]。
对比EPS中蛋白质和多糖的比值,如图5(b)所示,经过40 d的培养,所有组别的蛋白质/多糖(PN/PS)值较种泥均增大,并且实验组比空白组高。其中C7-HSL组中LB-EPS和TB-EPS的PN/PS均最大,分别为11.70和5.13,分别是空白组的12.1倍和1.9倍,是C8-HSL组的3.6倍和1.3倍,是3-oxo-C10-HSL组的9.4倍和1.1倍。根据TAN等[30]的研究结果,AHLs不仅会影响EPS浓度,也会改变PN/PS的比值,而PN/PS比值的升高有利于微生物的聚集和活性污泥的稳定,提高污泥絮凝沉降性能。
通过以上的结果与分析可看出,信号分子的添加可以促进EPS的形成,并改变EPS组成成分,促进微生物产生更多的胞外蛋白,从而增强污泥的稳定性。出水悬浮物ESS的浓度可以表征活性污泥结构的稳定性,从实验结果可以看出,实验组的ESS均比空白组低。这一结果印证了添加信号分子可以增强污泥的稳定性。
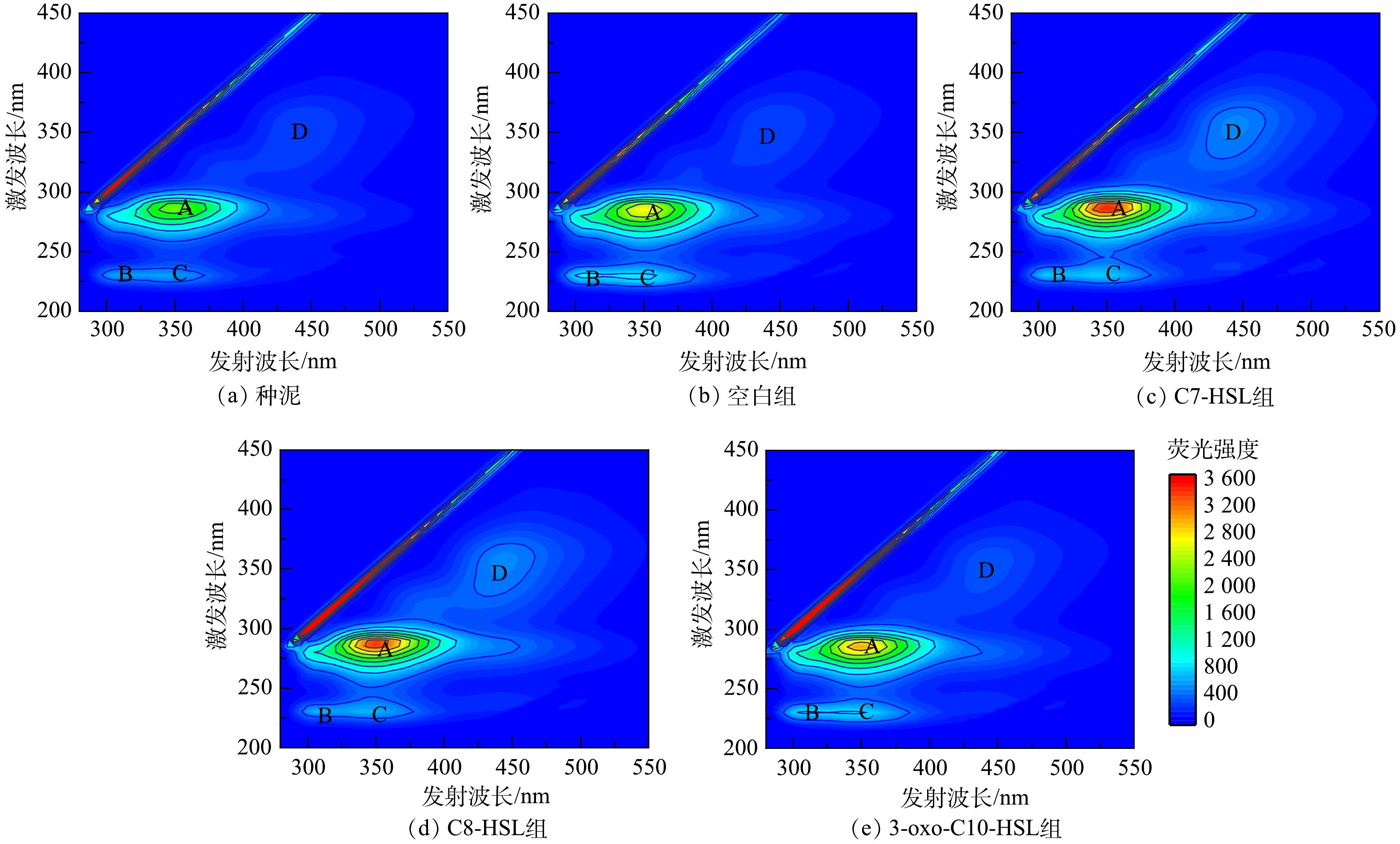
2.4. 3D-EEM光谱分析
3D-EEM光谱可以进一步表征污泥EPS中不同种类蛋白质与腐殖酸的变化。参照CHEN等[31]的研究,根据峰位置将荧光区域分为Ⅰ~Ⅴ5个部分,分别代表芳香类蛋白、类黄腐酸、微生物副产物类蛋白和腐殖酸。由图6可知,3D-EEM谱图中主要存在4个峰,即A、B、C、D ,不同样品中对应的TB-EPS峰参数如表4所示。经过40 d的培养,各组样品TB-EPS峰的种类以及位置相似,但荧光强度不同,其主要成分为蛋白质类物质,这与测定的TB-EPS中蛋白质占主要成分相一致。在各组样品中,A峰荧光强度比B、C、D峰的荧光强度高,A峰位置在Ⅳ区,代表物质为微生物副产物类蛋白(主要为色氨酸类蛋白)[32]。实验组相较于空白组,A峰荧光强度均有所提升,C7-HSL组A峰的荧光强度最大为3 466.555,比空白组提高了26.80%。B峰和C峰,表示类芳香族蛋白,与A峰的结果不同,空白组的B、C峰较实验组高,实验结果表明,信号分子有可能通过促进微生物副产物类蛋白的产生从而改变EPS的化学结构。色氨酸类蛋白为疏水性物质,可以促进污泥形成更紧密的结构,并且可与EPS中芳环氨基酸结构共同作用提高活性污泥结构稳定性[33-34]。D峰在Ⅴ区,表示腐殖酸,说明样品中存在高分子量和高芳香度基团。腐殖酸在粘附和提供电子供体或受体方面起重要作用,在EPS的絮凝和生物吸附起次要作用,其影响很大程度上取决于它们的性质和浓度[35]。种泥与空白组TB-EPS的D峰的荧光强度相近,而比实验组的低,说明信号分子可能促进了腐殖酸的产生。2.5. 信号分子浓度的变化
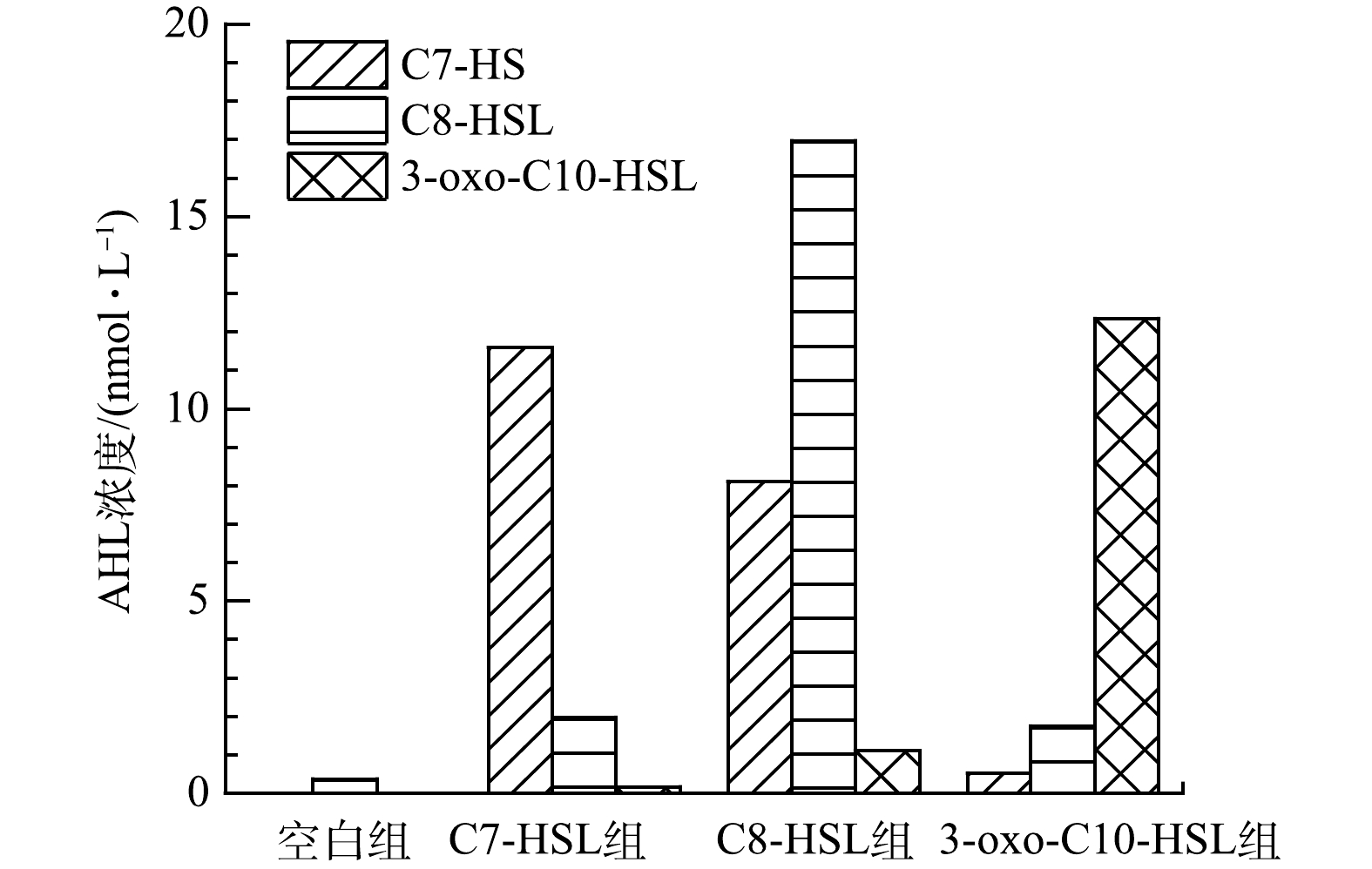
图7表示运行1个周期后空白组与实验组出水信号分子的浓度变化。空白组中C7-HSL和3-oxo-C10-HSL浓度均低于检测限(≤0.02 nmol·L?1)。从信号分子剩余量结果可知,外源添加的信号分子几乎全部被消耗。其中,C7-HSL组浓度最低,说明C7-HSL被利用的最多,这与C7-HSL组MLSS增长最多、微生物平均生长速率最高的变化规律相符。同时,C7-HSL组硝化污泥的活性、



值得注意的是,C8-HSL组中内源产生的C7-HSL浓度高达8.112 nmol·L?1,而3-oxo-C10-HSL组C7-HSL仅为0.523 nmol·L?1,空白组未检测到,说明C8-HSL可能与C7-HSL关系密切。3-oxo-C10-HSL组比C8-HSL组消耗的信号分子多,3-oxo-C10-HSL组的污泥浓度、污泥平均生长速率和硝化污泥活性较C8-HSL组稍高,但EPS含量、蛋白质含量以及3D-EEM光谱中A峰表示的色氨酸类蛋白含量均比C8-HSL组低。这可能是由于C8-HSL组内源产生的C7-HSL造成的,也可能是由于C8-HSL和3-oxo-C10-HSL对EPS的调控作用不同。有研究[36]表明,C8-HSL的添加使硝化细菌EPS中各种成分的荧光强度大幅增加,然而3-oxo-C10-HSL的加入降低了EPS的荧光强度。空白组、C7-HSL组和3-oxo-C10-HSL组都内源产生了C8-HSL,其含量排序C7-HSL组>3-oxo-C10-HSL组>空白组,相应的MLSS变化趋势为C7-HSL组>3-oxo-C10-HSL组>空白组。统计学分析结果表明,信号分子的浓度与生物密度呈正相关(r=0.863, P=0.003)。
2.6. 信号分子的作用
有研究[37]表明,在低温条件下,信号分子的添加可加速膜生物反应器中生物膜的生长并且提高了生物膜的活性;在中盐度(2%)条件下,添加AHL可提高好氧颗粒污泥的COD去除率[38]。从本研究结果可以看出,在高



































外源信号分子可以提高NOB细菌的亚硝酸盐利用率和硝化速率[39]。本研究中,NOB在面对FA浓度抑制时,C8-HSL和3-oxo-C10-HSL信号分子有利于提高NOB活性,但是C8-HSL和3-oxo-C10-HSL对NOB活性提高有限,导致FNA浓度越来越高,不足以使其应对更高的亚硝酸盐负荷,NOB活性逐渐被抑制。然而,在面对同样高浓度的亚硝酸盐时,外源添加C7-HSL的活性污泥经过6 d的适应,几乎没有亚硝酸盐的积累,说明不同的信号分子对功能基因的调节有差异。基于以上的分析,我们推测:信号分子可以提高微生物对抗环境压力的能力,尤其是在高氨氮负荷的冲击下,可以有效缓解高浓度亚硝酸盐对NOB活性的抑制。今后的研究也可以尝试外源添加信号分子去除某些新型污染物,比如多氯联苯、双酚A,还可以通过信号分子促进EPS的形成,利用EPS复杂的三维结构吸附重金属,从而提高其在重金属等不利条件下的活性。


2)信号分子可以促进活性污泥EPS的形成,并且改变EPS的组成,从而促进色氨酸类蛋白和腐殖酸的形成,提高蛋白质/多糖的比值。
3)信号分子有利于微生物对抗不利的环境,添加C7-HSL可为处理高

参考文献



 下载:
下载: 











 点击查看大图
点击查看大图