全文HTML
--> --> --> 水体富营养化是当今社会面临的主要水环境问题之一,如何有效地控制水体中的氮、磷仍是当前亟待解决的问题[1-3]。生物修复是现代原位处理富营养化水体的主要研究方向之一[4]。植物修复技术是生物修复技术的重要组成部分,因其成本较低、环境友好而受到广泛关注[5-6]。水生植物修复的机理主要包括水生植物的吸收同化、底物吸附、微生物降解和其他作用[7-8]。植物吸收同化是去除水中营养物质的重要方式,水生植物能利用其发达的根系完成对水中营养物质的富集、转化和吸收,进行生长代谢[9]。通过对植物进行合理收割可实现氮磷的空间转移[10-11]。然而,水生植物对氮磷的吸收能力和偏好有所不同[12]。ZHU等[3]探究了7种水生植物人工浮岛对富营养化水体中养分的吸收特点,发现7种植物的氮和磷积累量分别为0.51~4.48 g·m?2和0.06~0.33 g·m?2,水芹和满天星对氮磷的去除效果最好。BARYA等[13]研究发现,种植美人蕉的人工湿地对污水TN和TP的去除率分别达到60.37%和81.53%,略高于种植菖蒲的人工湿地所对应的56.33%和79.57%。QIN等[14]通过原位修复实验发现,凤眼莲凭借着发达的根系对氮有着超强的累积能力,占TN去除率的58.64%,但对TP的去除能力弱于水浮莲。植物吸收动力学是比较不同植物养分吸收特性的有效方法。米氏(Miehaelis-Menten)学说创建于20世纪50年代初,解释了植物根系对离子吸收的原理,促进了根系养分离子吸收动力学的发展,并为植物元素吸收的研究提供了可量化的手段[15]。研究水生植物的养分吸收动力学特性,可有助于评价不同植物对水体养分状况的适应性、鉴定并筛选收高效的植物品种[16]。
当前研究多单独探究水生植物的修复机理[17-18],或只利用耗竭法探究植物在不同浓度下对营养物质的吸收特性[19-20],很少从水生植物对营养物质的吸收特性理论上分析水生植物及其组合对营养物质的同化量和去除效果的影响,并依据吸收动力学计算结果优化植物修复富营养化水体中的植物配置。本研究首先探究了苦草、凤眼莲和菖蒲对
1.1. 实验材料与实验方法
在西安市的曲江池和莲湖采集生长状况良好且性状一致的苦草、菖蒲和凤眼莲作为研究对象,放入盛有1/2 Hoagland营养液[21]的培养箱中培养待用。1) 3种水生植物的养分吸收动力学实验。采用常规耗竭法测定3种植物对
以无氮磷的Hoagland营养液为底液,分别使用NH4Cl、KNO3和KH2PO4配制
根据吸收液的浓度变化拟合可求得离子消耗曲线方程,通常采用一元二次多项式方程[22](式(1))表示。对式(1)求负导数可得到浓度变化速率方程,如式(2)所示。在式(2)中,使x→0,则y'=?b即为浓度最大变化速率,进一步求得最大吸收速率(式(3))。
式中:x为吸收时间,h;y为处理离子浓度,mg·L?1。
式中:Imax为最大吸收速率,mg·(g·h)?1;V为加入的吸收液体积(计算时忽略因取样减少的吸收液体积),L;M根为植物根干质量,g。
将y' =?1/2b带入式(2)中求出x,将其带入式(1)所得的y值即为米氏常数Km。令y' =0,求出吸收速率为0的时间x,回代到式(1)中即得到平衡浓度Cmin。
2) 3种水生植物及其组合净化富营养化水体实验。实验在西安建筑科技大学实验室内进行,将选择的植株放入1/8 Hoagland营养液中驯化14 d,然后清洗干净用吸水纸吸干水分,测量每组植物的鲜质量、叶长和根长,种植于36 cm×26 cm×22 cm的白色透明塑料箱中,箱内底部放入用蒸馏水清洗过的5 kg石英砂(箱内厚度约4 cm)以固定植物根系。实验用水取自西安市护城河,原水中
实验共设置8组,分别为苦草组、菖蒲组、凤眼莲组、苦草+菖蒲组、苦草+凤眼莲组、菖蒲+凤眼莲组、苦草+菖蒲+凤眼莲组和空白对照组,空白组箱内只放置石英砂,每组设3个重复。苦草组、菖蒲组和凤眼莲组中的植物鲜质量分别为40、80、80 g,两两组合和3种组合时各植物鲜质量相应取单独设置时的1/2和1/3。实验期间每天光照10 h,光照强度6 000 lx。以植物移植到培养箱后的当天为第1次取样时间,以后每4 d取样1次,取样时间为12:00—13:00,每次取50 mL,实验持续时间28 d。取样前用蒸馏水补充因蒸发而减少的水量。
1.2. 分析方法
1)水样分析。水质参数的测定参考《水和废水监测分析方法(第4版)》,2)植物样本分析。实验结束后,将植株从溶液中取出,用蒸馏水冲洗残留在根部的基质。用吸水纸吸干水分后,测量植物的鲜质量、叶长和根长,结果取3组平行的平均值。然后将植物器官分离,在70 ℃下烘干至恒重,用H2SO4-H2O2消煮法测定植物器官的TN和TP含量[25],实验开始前用同样方法取样测定各植物器官的TN和TP含量。
1.3. 数据处理
在模拟实验中,通过测定水体中TN和TP的浓度、植物鲜质量和植株TN和TP含量来确定水体TN和TP的去除率η和植物同化去除率η1,分别根据式(4)和式(5)进行计算,根据式(6)来比较每组中单位鲜质量的植物对污染物同化去除的差异,弥补初始植物鲜质量不同造成的差异。式中:η为污染物去除率;η1为植物同化去除率;c1和c2分别为初始和结束时水体污染物浓度,mg·L?1;ρ1和ρ2分别为初始和结束时植物体内TN和TP的含量,mg·g?1;m1和m2分别为初始和结束时植物鲜质量,g;V为实验水体体积,L;v为植物同化比去除率,mg·(kg·d)?1;M为植物吸收同化的TN或TP的量,mg;ω为初始和结束时的平均生物量(鲜质量),kg;Δt为实验时间,d。采用SPSS 18软件对数据进行统计分析,用Origin 8.5软件作图。
2.1. 3种水生植物营养吸收动力学特征
3种水生植物吸收由表1可知:3种水生植物对
由表2可知,3种水生植物对
由表3可知,3种水生植物对
2.2. 3种水生植物净化富营养化水体实验
1)植物生长情况和植株氮磷含量变化。在28 d的实验期间,各组植物均正常生长。植物的鲜质量和体内氮磷含量的变化能直接反映植物吸收同化氮磷的量。实验结束时,各组植物的鲜质量和株高均出现不同程度的增加。由表4可以看出,7个植物组中的植物鲜质量增长率为10.57%~67.57%,苦草+凤眼莲组和苦草+菖蒲+凤眼莲组的鲜质量增长率排在前2位,这表明苦草和凤眼莲组合能相互促进植株的生长。在实验开始前,各植物器官的氮磷含量就有较大差异。凤眼莲叶的氮含量和苦草叶的磷含量最高,分别为39.30 mg·g?1和8.26 mg·g?1。在实验结束时,大部分植物的根和叶的氮磷含量高于实验前,苦草+菖蒲+凤眼莲组的凤眼莲叶和苦草+凤眼莲组的苦草叶氮和磷含量最高,分别为46.33 mg·g?1和8.76 mg·g?1。
2)各组系统水体净化结果分析。图2(a)~图2(d)分别是各组水体中
由图2(b)可知,各组的
由图2(c)可知,各组的TN浓度总体呈下降趋势。前期TN去除速率快,与沉降作用和植物较强的吸收作用有关。随着实验进行,沉降作用减弱,植物吸收趋于饱和、速率减慢,TN浓度下降速率略有减缓。各植物组对TN的去除效果显著,苦草+菖蒲+凤眼莲组对TN去除率最高,为80.34%,其余各组去除率为66.42%~77.58%。
由图2(d)可知,除空白组外,各组TP浓度在前13 d呈骤降趋势,之后各组下降趋势减缓,到第21天时,除空白组和菖蒲组,其余6组的TP浓度均降到0.10 mg·L?1以下,此后浓度基本保持不变。实验结束时,苦草+菖蒲组和苦草+菖蒲+凤眼莲组的去除率最高,为97.50%,菖蒲组的TP去除率是除空白外最低的,为82.50%。上述结果表明,各组植物均能快速、高效的去除水体中的TP,去除率均显著高于空白组(P<0.05)。
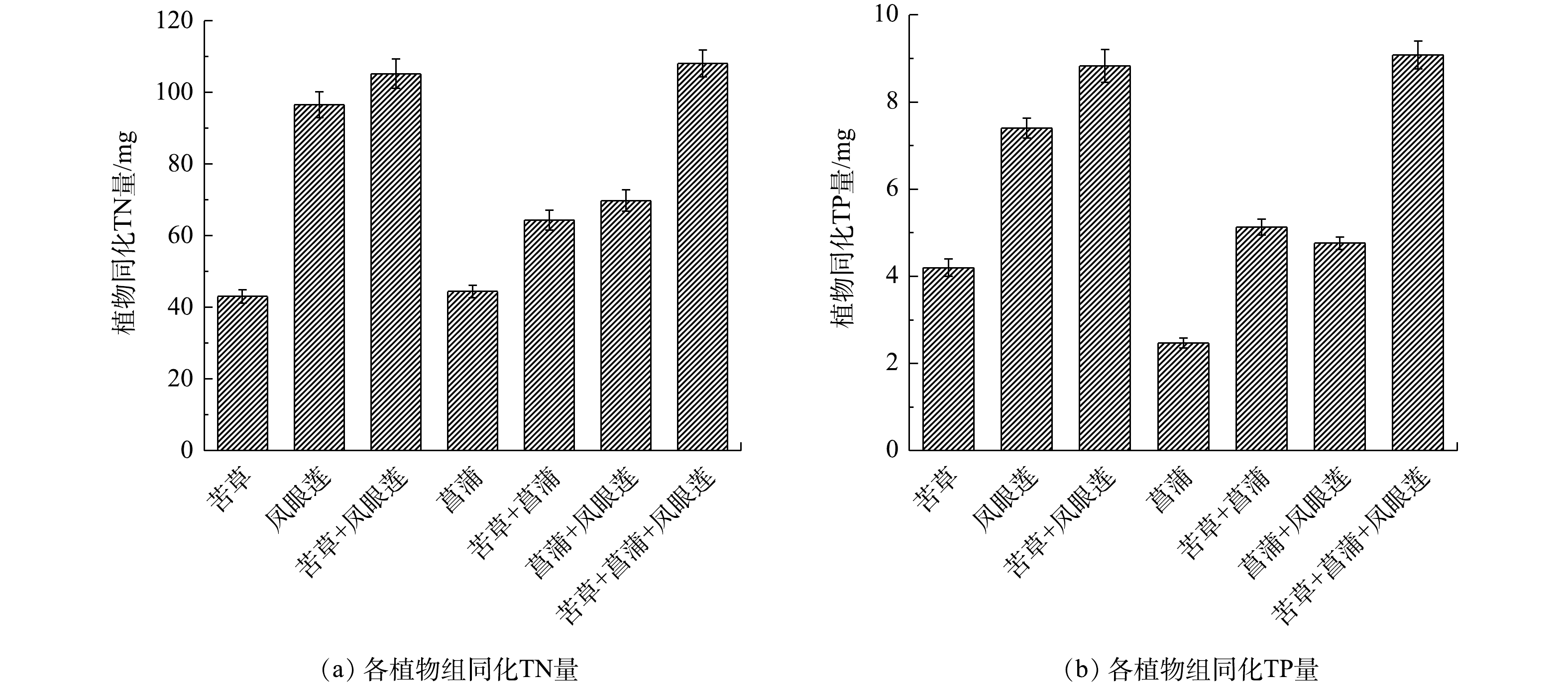
图3是模拟净化实验中各植物组同化去除TN和TP的量,表5是各植物组对TN和TP的植物同化比去除率。由图3(a)可知,各植物组同化去除TN的量在43.03~108.08 mg,苦草+菖蒲+凤眼莲组和苦草+凤眼莲组排在前两位,且显著高于其他组(P<0.05),分别占水体中TN的64.33%和59.32%,是TN去除的主要方式。各植物组的同化比去除率在12.26 ~29.53 mg·(kg·d)?1,苦草+凤眼莲组和苦草+菖蒲+凤眼莲组的同化比去除率较大,且显著高于其他组(P<0.05)。由图3(b)可知,各植物组同化去除TP的量为2.47~9.08 mg,苦草+菖蒲+凤眼莲组和苦草+凤眼莲组排前两位,且显著高于其他组(P<0.05),分别占水体中TP的81.04%和78.88%,是TP去除的主要方式。各植物组的同化比去除率为0.68~2.46 mg·(kg·d)?1。苦草+凤眼莲组和苦草+菖蒲+凤眼莲组的同化比去除率较大,且显著高于其他组(P<0.05)。
上述结果表明,植物对氮、磷物质的吸收同化是植物修复的主要去除方式,分别占到水体中TN和TP的25.61%~64.33%和22.03%~81.04%。这个比例和QIN等[14]的研究结果相似,高于金树权等[27]的研究结果。这可能与植物种植密度、生长季节和污水类型等有关。植物根系吸收的铵态氮,可直接与光合作用产物有机酸相结合,形成氨基酸,进而生成其他含氮有机物。而硝态氮被植物吸收后,要在体内被还原成铵态氮后才能被利用[28]。无机磷在植物吸收及同化作用下可转化成为ATP、DNA和RNA等有机物质、矿化的营养盐等,有利于植物的吸收并参与光合作用[29]。植物吸收的氮、磷元素,促进了植物的生长,最终变成植物体的一部分。氮磷在植物体内的积累不仅和水体的氮磷浓度有关,还和植物本身特性有关[30]。凤眼莲在高
有研究[31-32]表明,不同水生植物组合对水体中营养物质去除效果要明显好于单一植物。苦草+菖蒲+凤眼莲组对氮磷去除率最高,苦草+凤眼莲组的同化比去除率最高,也表明植物组合对氮磷的吸收偏好强于单一植物,可以在不同浓度下对氮磷保持较高的吸收速率,从而提高了营养物质吸收的多样性。除此之外,丰富的水生植物种类提高了水体中微生物的多样性,进而加强了微生物对氮磷的降解作用,这也是植物组合的去除效果优于单一植物的原因之一[2,8]。在今后的生态修复工程中,可根据待修复水体中污染物种类和浓度,从吸收动力学参数的角度选择合适的修复植物,有助于提高修复效果。
2)各植物组对水体中的氮磷营养物质去除效果显著,植物的吸收同化是植物修复去除氮磷的重要途径。苦草+凤眼莲组对TN和TP的植物同化比去除率最高,分别为29.53 mg·(kg·d)?1和2.46 mg·(kg·d)?1。苦草+菖蒲+凤眼莲组对TN、TP的去除率和吸收同化量均为最高,分别为80.34%、97.50%和108.08 mg、9.08 mg。
3)苦草+凤眼莲组和苦草+菖蒲+凤眼莲组均表现出对氮磷吸收能力的协同提高。苦草、菖蒲和凤眼莲3种水生植物相互组合,弥补了各植物间对不同营养物的吸收特征差异,显著提高了植物对水体中营养物质的同化去除率和总去除率。
参考文献













 下载:
下载: 
 点击查看大图
点击查看大图