全文HTML
--> --> --> 2019年中国生态环境状况公报显示,全国地表水中Ⅰ~Ⅲ、Ⅳ~Ⅴ、劣Ⅴ类水质断面分别占71.0%、22.3%和6.7%,水环境污染依然是现阶段我国环境污染治理的重大难题[1]。人工湿地(constructed wetlands, CWs)作为一种新型污水生态处理技术,具有成本低、绿色持续和稳定有效等优点,近年来被广泛运用于各类水处理中[2]。CWs由物理、化学和生物三重机制协同净化,其中,起主导作用的为生物机制[3],其由微生物和植物协同完成[4]。湿地植物作为CWs核心成分之一,对CWs高效净化污水起到关键作用。植物特有的景观功能可以营造优美空间,提升湿地生态美学价值。因此,合理选用湿地植物对CWs净化、景观等功能的发挥至关重要。传统CWs植物的选用多偏向单一种,造价便宜、施工简单和易于管理,但湿地植物单一,植物-微生物稳定性差,协同作用未充分发挥,植物景观功能未得到有效利用。国外****研究了欧洲植物物种丰富度对生态系统的影响,结果表明,植物物种丰富度的减少会改变群落组成及功能特性,降低群落结构复杂性,导致维持生态系统服务功能的系统稳定性和弹性降低;而增加植物物种丰富度能大幅度提升景观多样性及生态系统服务功能(生产、气候调节、侵蚀控制等),因此,增加人工湿地的植物多样性对系统稳定性的维持具有重要作用[5-7]。
当人工湿地植物群落布局不同时,植物生物量、根系分布特征、生长期、营养吸收能力、抗逆性等方面均存在显著差异,使用多种植物组合,不同植物互相协同,可以提高综合性污水净化率,保持较为稳定的水质净化效果[8]。现有研究报道多集中在植物组合对不同浓度污水净化效果及不同植物群落对水体氮磷净化差异上[9-10],在景观化湿地植物群落的构建以及植物生理响应对人工湿地水质净化改善的原因等方面尚缺乏深入研究。因此,本文从植物净化效果、株高、花期、季相、生长期等角度,筛选4种大型华东地区常用湿地植物,结合景观生态理念,合理配置2种中型、1种小型湿地植物,构建不同湿地植物群落,分析了不同群落污水净化效果,探究了植物群落构建效果,阐述植物生理响应、植物-微生物协同净化机理,得到适宜人工湿地的最佳植物群落配置。预期成果将为提升CWs净化与景观美学功能,提高CWs系统生物多样性及稳定性,并为CWs工程建设、植物筛选与配置提供科技支撑。
1.1. 人工湿地装置构建
本实验采用人工湿地小试系统,依据《人工湿地污水处理工程技术规范2005—2010》构建装置:直径20 cm、高50 cm柱状PVC材质实验箱底部设置取水口,2种粒径石英砂为填充介质,大粒径(φ=6~8 mm)填于上、下两层,小粒径(φ=2~4 mm)填于中层,上、中、下层分别填充 20、20、5 cm,上层石英砂表面种植幼苗期植物,植物种植密度为36 株·m?2。装置启动期间使用模拟污水加入装置进行微生物接种驯化,稳定期为30 d。1.2. 实验设计与运行
本实验于上海海洋大学室外实验基地进行,开展日期为2019年2—12月,主要环境参数为:气温为15~36 °C,相对湿度为50%~80%;上层基质孔隙率为38.69%,中层基质孔隙率为35.47%。将4种大型湿地植物(株高>1 m)黄花美人蕉(Canna indica L. var. flava Roxb.)、红花美人蕉(Canna indica L.)、千屈菜(Lythrum salicaria L.)、黄菖蒲(Iris pseudacorus),分别与2种中型植物(株高0.5~0.8 m)西伯利亚鸢尾(Iris sibirica)、灯芯草(Juncus effusus L.)及1种小型植物(株高<0.4 m)铜钱草(Hydrocotyle vulgaris)搭配种植[8],从而形成CW-G1、CW-G2、CW-G3、CW-G4共4种植物群落;7种植物单种对照分别为CW-CK-C.f、CW-CK-C.i、CW-CK-L.s、CW-CK-I.p、CW-CK-I.s、CW-CK-J.e、CW-CK-H.v;1个空白对照(表1)。根据HJ2005-2010人工湿地污水处理工程技术规范模拟生活污水,进水条件为:总氮30 mg·L?1(硝氮15 mg·L?1、氨氮15 mg·L?1);耗氧有机污染物的浓度(以COD计)120 mg·L?1;总磷2 mg·L?1(用KNO3、(NH4)2SO4、C6H12O6、K2HPO4配置污水)。人工湿地运行方式采用间歇式进水,水力停留时间(HRT)为(4 d),并设置3组平行CWs。1.3. 检测方法
环境指标:气温、相对湿度(空气质量检测仪,CW-AQT100,赛纳威,中国)。水质检测:DO、pH、温度、氧化还原电位(HQd便携式多参数水质分析仪)、NH3-N(纳氏试剂光度法)、NO3-N(紫外分光光度法)、COD(重铬酸钾法)、TP(钼锑抗分光光度法)。植物检测:水解氨基酸采用茚三酮比色法;酶活性、可溶性糖、总蛋白采用南京建成生物工程研究所试剂盒。每株取3片长势较好的植物叶片,去叶脉后剪碎混匀,?20 °C低温保存待测。微生物多样性:选取CWs装置内距底部25 cm处的石英砂(装置与平行装置内样品混合)10 g。对16S rRNA基因V4~V5区的引物进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,采用Illumina MiSeq平台对群落DNA片段进行双端(paired-end)测序,通过QIIME软件调用USEARCH检查并剔除疑问序列,从而获得样品有效序列,采用可操作分类单元(operational taxonomic unit,OTU)进行分析。
1.4. 数据分析
本研究采用 Excel2018及SPSS24进行数据处理与分析,数据为平均值±标准差,采用LSD法进行多重比较。2.1. 植物群落污水净化效果比较
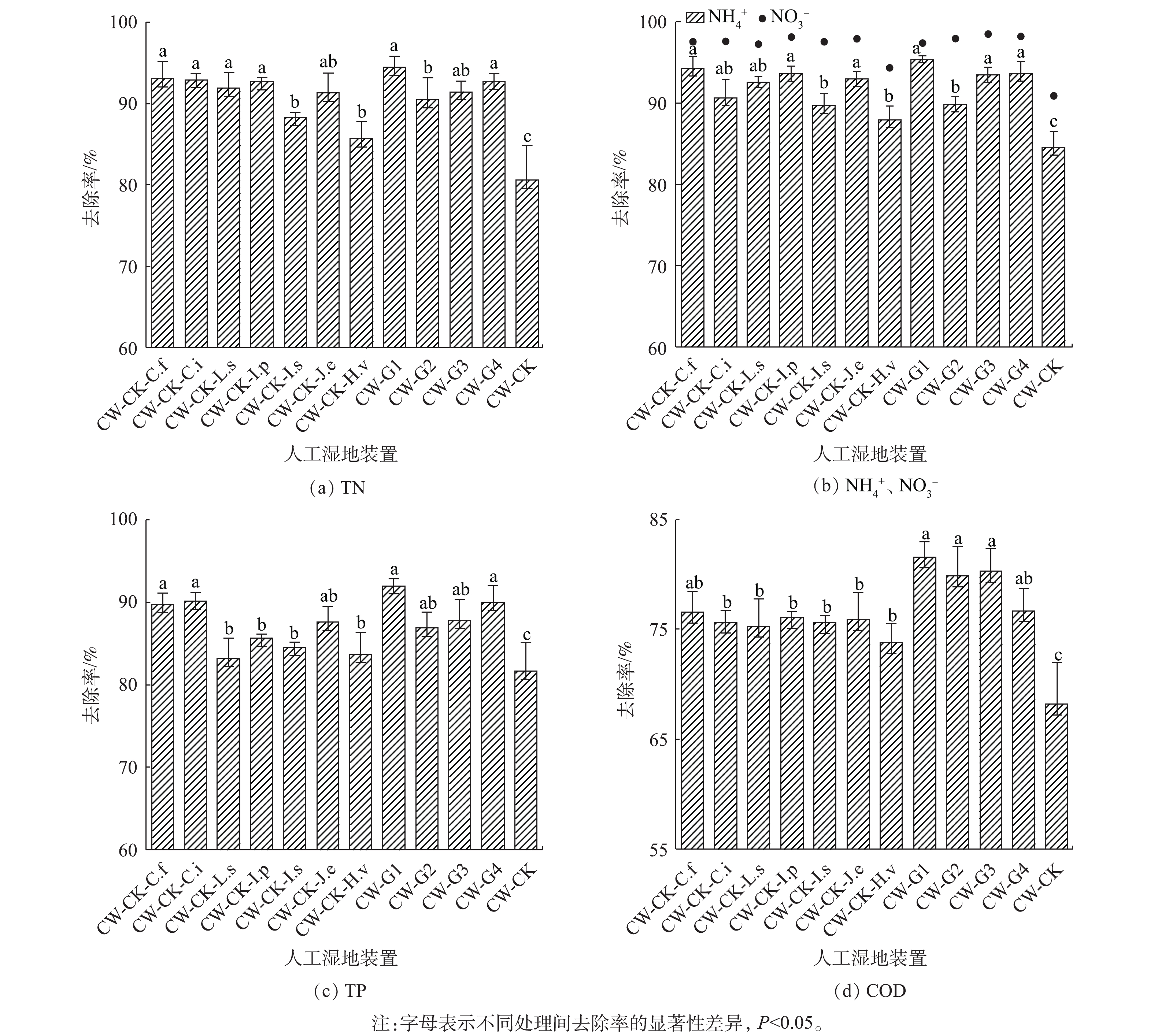
在实验期间,进水水温为15.5~24.9 °C、pH为7.37~7.62、DO含量为8.11~9.0 mg·L?1、氧化还原电位为152.4~229.4 mV,经4 d(HRT=4 d)后取样。出水水温为16.2~28.2 °C、pH为6.01~7.53、DO含量为1.04~3.60 mg·L?1、氧化还原电位为?158.81~87.2 mV,同时,对TN、TP和COD去除率进行了测定。由图1可知,CW-CK空白对照中对应的TN、NH3-N、NO3-N、TP、COD去除率均显著低于11个实验装置中对应的5种污染物去除率(P<0.01)。由图1(a)可知,CW-G1群落对TN的去除率最高;CW-G1、CW-G4群落对TN的去除率较黄花美人蕉、黄菖蒲单种有所提高,但差异不显著(P>0.05);CW-G2、CW-G3群落对TN的去除率较红花美人蕉和千屈菜单种有所下降,且CW-G2群落对TN的去除率下降显著(P<0.01)。由图1(b)可知,各装置对氨氮的去除效果及装置间差异性与对TN的去除效果类似,CW-G1群落对氨氮的去除率最高,依次为CW-G4、CW-G3、CW-G2;而各装置对硝氮去除率无显著性差异,且去除率均达到93%以上,这说明装置中反硝化过程可有效进行,装置对TN的去除主要受氨氮去除效果的影响。由图1(c)可知,CW-G1群落对TP的去除率最高;CW-G1、CW-G3、CW-G4群落对TP的去除率较黄花美人蕉、千屈菜、黄菖蒲单种有所上升,且CW-G4群落上升显著(P<0.01);CW-G2群落对TP的去除率较红花美人蕉单种下降,下降效果不显著(P>0.05)。由图1(d)可知,CW-G1群落对COD的去除率最高;CW-G1、CW-G2、CW-G3、CW-G4群落对COD的去除率较黄花美人蕉、红花美人蕉、千屈菜、黄菖蒲单种上升,且CW-G2、CW-G3群落中COD的去除率上升效果显著(P<0.05)。综上所述,从对TN、TP、COD的去除效果来看,植物群落与植物单种处理间存在显著差异(P<0.05),这表明通过植物搭配可以改变湿地系统水质净化效果。有研究表明,植物配置良好的系统可以有效防治富营养化水体水华的发生[11-12]及抑制藻类生长[13]等,人工湿地作为污水处理系统,合理的植物配置可以提高湿地的运行效果,进而提升尾水水质。不同植物对同一污染物净化效果不同,部分能高效吸收氮,部分能更好富集磷,多种植物组合有利于植物间取长补短[14];不同植物根系特性不同,大型植物红、黄美人蕉、千屈菜、黄菖蒲根系发达,须根丰富;而中小型植物西伯利亚鸢尾、灯芯草、铜钱草根系浅而须根少,不同植物组合可以提高根系对基质垂直空间的利用率[15];不同植物根系分泌物不同,将不同植物组合也可能对根际整体的微生物群落产生影响,从而影响湿地系统污水净化效率[16]。
4个植物群落对于TN和TP的去除率依次为CW-G1>CW-G4>CW-G3>CW-G2;4个植物群落对于COD的去除率依次为CW-G1>CW-G3>CW-G2>CW-G4,这表明不同植物配置对污染物去除效果也存在差异。郝桂芝等[17]研究发现,由6种不同湿地植物组成的3个群落对水体中氮磷净化效果存在显著差异;李莎莎等[18]研究发现,4种不同空间配置的湿地植物群落对生活污水中TN、TP、COD等的去除均存在差异,本研究的结果也与前人研究的结果相一致。因此,植物配置时需进行合理的选择,才能更大程度提高湿地净化效率。
2.2. 植物酶活性比较
植物细胞生理代谢会产生活性氧(ROS),正常情况下,植物体内有害氧清除系统可保证ROS的动态平衡[19];而逆境胁迫会打破这种平衡,使ROS大量积累,并与细胞膜脂反应造成膜伤害[20]。因此,在人工湿地污水胁迫下,植物体内代谢平衡被破坏,为了满足自身生长、发育及繁殖等,植物会通过改变自身形态和生理变化以适应污水胁迫[21]。氧化物歧化酶SOD是植物体内ROS清除系统中优先发挥作用的抗氧化酶,是细胞防御活性氧危害的第一道防线。其先将植物体内超氧物阴离子自由基
丙二醛MDA是细胞膜脂过氧化的重要产物,其含量变化可直接反应胁迫下细胞膜系统受伤害程度[23]。由图2(m)~图2(p)可知,CW-G1群落4种植物MDA含量均显著低于4种植物单种处理(P<0.05);CW-G2群落内红美人蕉、铜钱草MDA含量低于二者单种,西伯利亚鸢尾、灯芯草MDA含量高于二者单种;CW-G3、CW-G4群落除铜钱草MDA含量低于铜钱草单种,另3种植物均高于其单种处理。
SOD、POD、CAT为植物体内3种抗氧化酶,在一定范围内,SOD和POD或CAT共同作用能将
2.3. 植物可溶性糖、脯氨酸含量比较
植物可溶性糖、脯氨酸含量变化情况见图3。植物可溶性糖含量变化如图3(a)~图3(d)所示,实验中4种人工湿地植物群落内4种植物叶片可溶性糖含量均显著低于4种植物单种(P<0.05),群落中的黄花美人蕉、红花美人蕉、千屈菜、黄菖蒲较单种处理分别降低39.6%、59.2%、36.8%、59.8%。植物光合作用最先生成的碳水化合物为葡萄糖,葡萄糖很快转化为淀粉,暂时存储于叶绿体中,之后运送到植物各个部分供生长代谢所用。在本研究中,一方面可能是长期污水胁迫导致叶片受损,使得葡萄糖转化为淀粉的过程受阻,在相同条件下,植物单种处理得到的可溶性糖含量显著高于植物群落,这表明单种处理下植物叶片受损更严重,葡萄糖无法快速转化为淀粉而积累于叶片中,使得可溶性糖含量升高,这与孟昱等[25]的研究结果一致;另一方面,也可能是长期污水胁迫造成植物体受损,使光合作用产物不能被植物正常利用,导致葡萄糖在叶片中积累。植物单种处理叶片中的可溶性糖含量更高,表明单种处理下植物所受损伤更为严重,植物混种可以有效提高抗干扰能力,这也与贾琼[26]的研究结果一致。
在正常条件下,植物体内游离脯氨酸含量较低;在逆境条件下,植物体内游离脯氨酸会大量产生并积累,从而调节细胞渗透势以抵抗外界干扰[27]。由图3(e)~图3(h)可知,实验中4种植物群落除CW-G4中灯芯草游离脯氨酸含量均显著高于灯芯草单种(P<0.05),此外,在3个植物群落中的4种植物游离脯氨酸含量均低于4种植物单种处理。植物群落游离脯氨酸含量低于植物单种处理,这表明污水对单种植物有较大的伤害,植物群落可以有效降低外界不利条件对植物的伤害,这也与李玟等[28]的研究结果一致。
2.4. 植物群落根际微生物比较
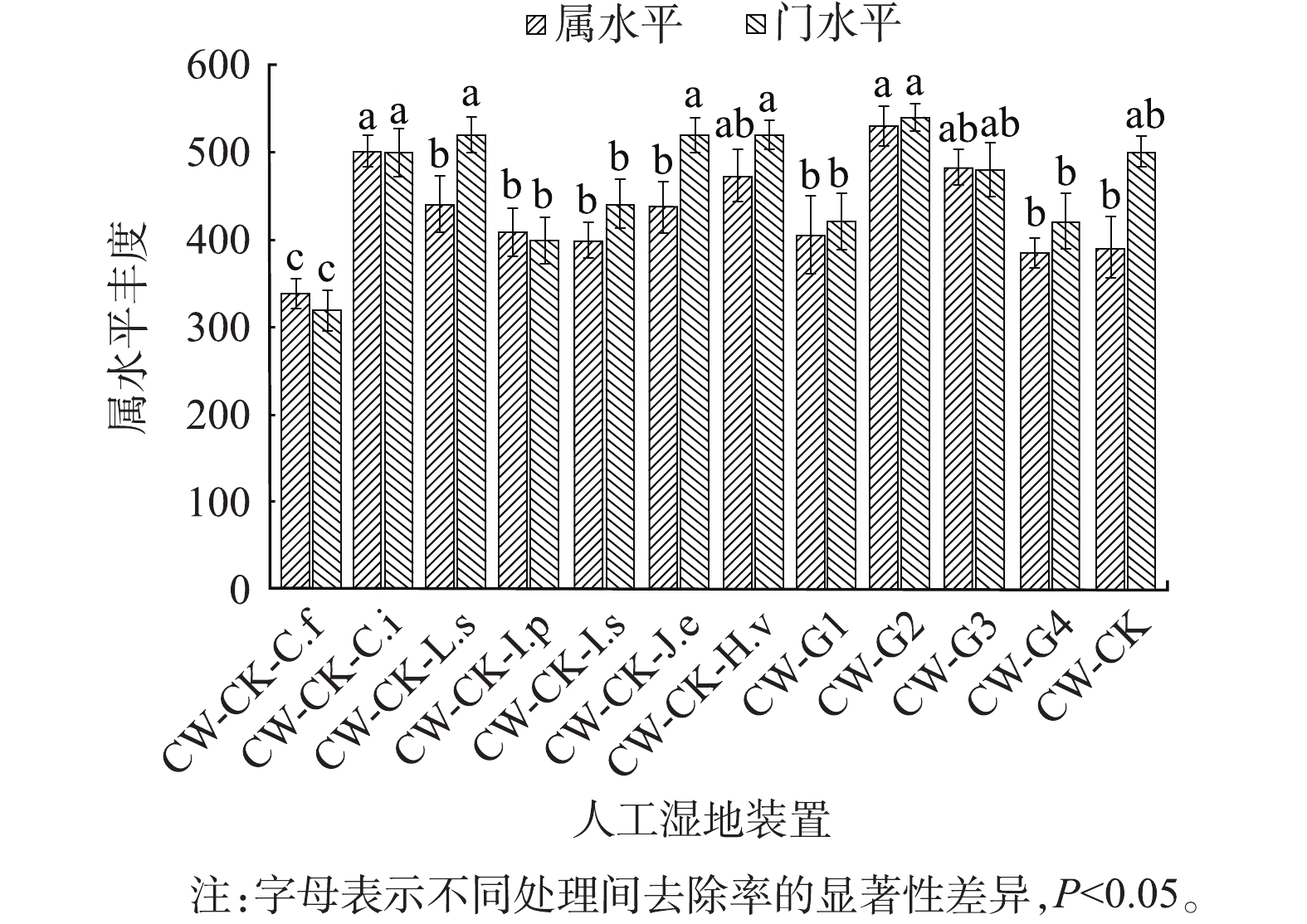
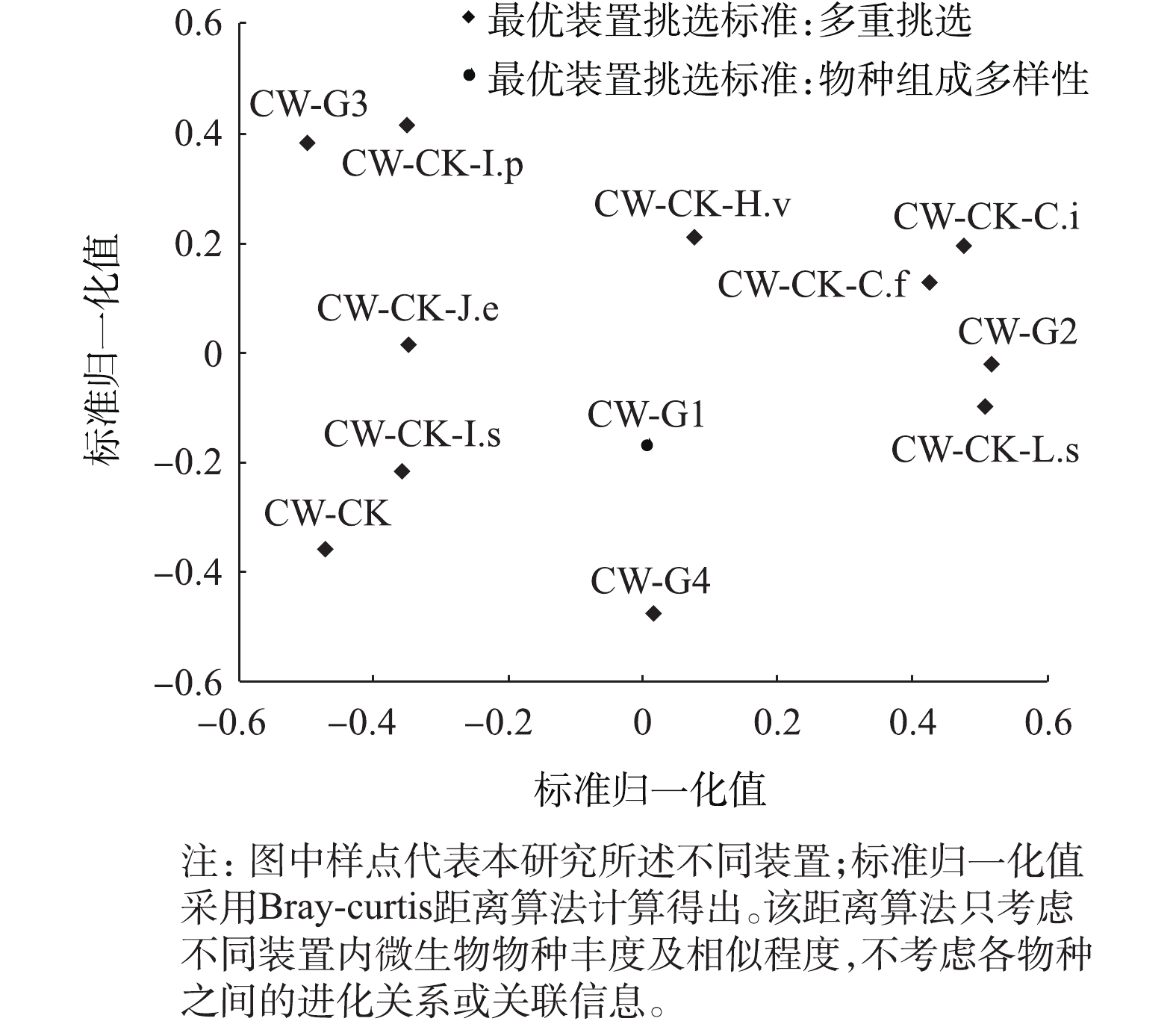
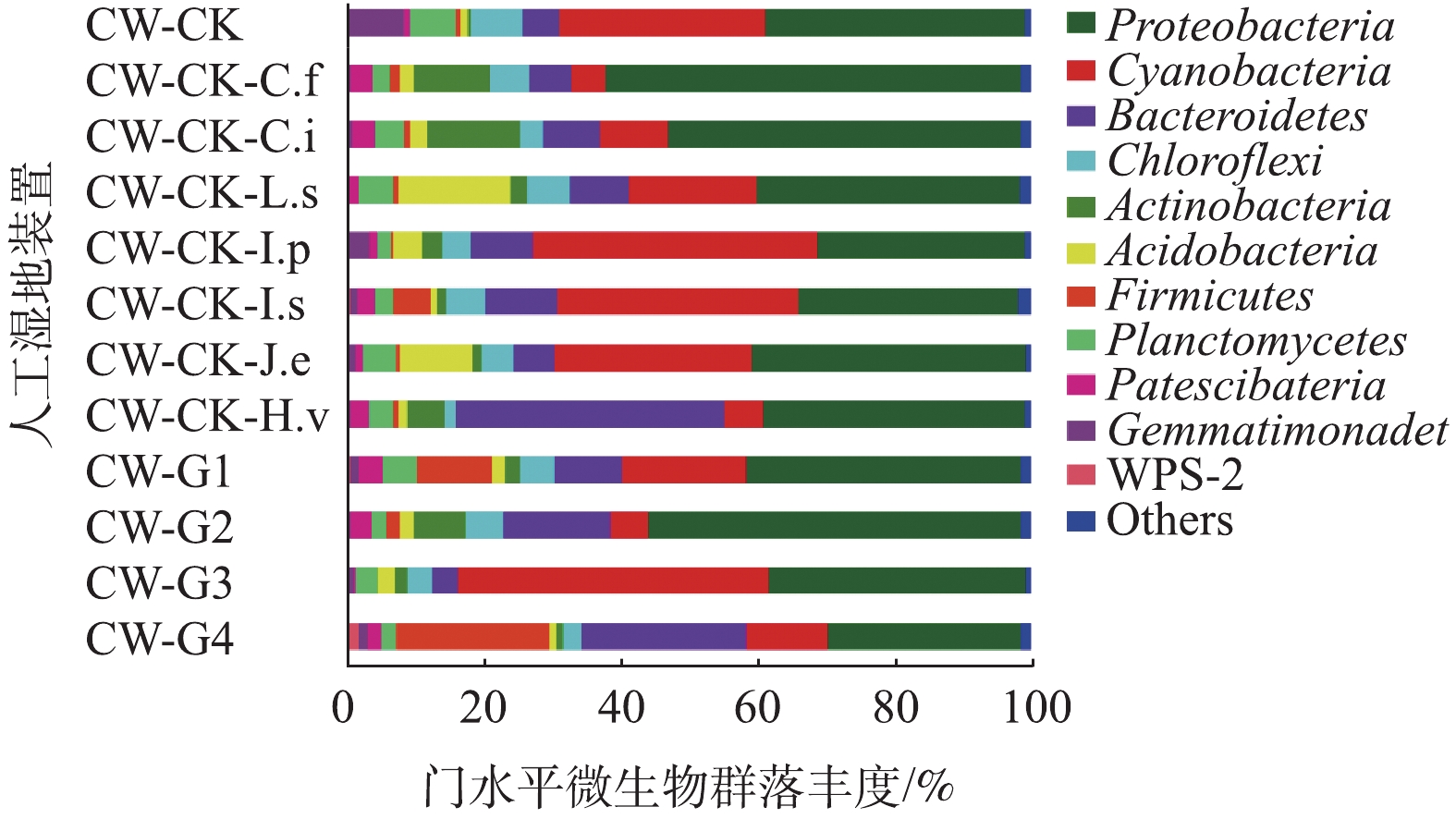
人工湿地中氮去除以微生物的硝化反硝化作用为主导,不同植物根际分泌物不同,使植物根际富集不同功能微生物。图4为微生物在门、属分类水平下的群落物种丰度。由图4可知,与空白对照相比,种植植物处理提高了门、属水平下微生物群落的物种丰度,CW-G1群落在门、属水平均有最高的物种丰度。图5为各样本微生物组选择有益的分类丰度(MicroPITA)分析图,图中横纵坐标为标准归一化计算后装置中微生物群落属水平下的群落丰度,样本间距离越近,代表样本中微生物群落丰度越相似。MicroPITA分析是一种在分级研究中挑选样本的计算工具,能够更有效的分配资源,降低研究成本,最大化利用样本。Maximum diversity代表按照样本物种组成多样性挑选的样本,即样本alpha多样性最高的样本,可知,CW-G1群落微生物物种组成多样性最高。综上所述,CW-G1群落植物配置方式最利于微生物富集,这也与CW-G1群落水质净化效果最佳的结果相一致。图6为门水平下的微生物群落组成,优势细菌群落在门水平上达到11门以上,其中,以变形菌门(Proteobacteria)、蓝藻菌门(Cyanobacteria)、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)为主,还包括放线菌门(Actinobacteria)、酸杆菌门(Acidobacterio)、厚壁菌门(Firmicutes)等。变形菌门是根际微生物中丰度最高的菌门,可参与有机物降解、氮转化等;蓝藻菌门能够吸收大量的氨、氮等污染物质;拟杆菌门能够代谢碳水化合物,降解有机物[29];浮霉菌门中厌氧氨氧化菌能够在缺氧环境下利用亚硝酸盐氧化铵离子生成氮气,是污水处理中重要的细菌[30]。样本中各微生物群落组成相似,但各菌门均匀度存在差异。Alpha多样性分析得到各样本Smithwilson指数,结果表明,CW-G1群落最高,Smithwilson指数表征群落均匀度,表明CW-G1群落各菌门微生物均匀分布,此种植物配置方式在保证物种丰富度的同时,也可以保证物种均匀度,使各菌门细菌共同协作,高效净化污水。
2) CW-G2、CW-G3、CW-G4群落在净化不同污染物时净化效果表现为有提升和减弱,这说明植物间相互作用有促进和抑制作用,故植物选择时需谨慎考虑。
3) CW-G1群落SOD、CAT、POD含量显著提高(P<0.05),且MDA含量最低,这表明SOD和CAT或POD是黄美人蕉群落抵抗污水胁迫的一种有效防御策略。
4) CW-G1群落根围基质适于多种微生物生存,Alpha多样性最高,各微生物融合最好,对人工湿地净水功能的发挥有促进作用。
参考文献

 下载:
下载: 

 点击查看大图
点击查看大图