全文HTML
--> --> --> 随着经济的迅速发展,我国城市化进程加快,为保障供水,水库已逐渐成为众多城市的主要水源地。由于水库水一般浊度较低、停留时间较长易导致藻类繁殖,故会产生由藻类代谢产物引起的异味等问题,从而降低饮用水的品质[1],引发公众对饮水安全的担忧[2]。在我国,2-甲基异莰醇(2-MIB)引起的土霉味是饮用水嗅味问题的主要原因之一[3]。由于2-MIB嗅味阈值极低(4~10 ng·L?1)[4],且混凝、沉淀及过滤等常规处理工艺对其去除效果有限,往往需要投加粉末活性炭等深度处理工艺对其加以去除,这不仅会增加制水成本,而且会增加给水厂的运行管理难度。已有研究[5]表明,水库水源中的2-MIB主要由底栖丝状蓝藻生长代谢产生,包括颤藻、席藻等。近年来,日本[6]、美国[7]、中国湖北[8]等许多国家和地区都暴发了浮游型丝状蓝藻伪鱼腥藻产生2-MIB引起的土霉味问题。不同于常规的底栖产嗅藻,伪鱼腥藻细胞内具有伪空胞结构[9-11],能在一定程度上调节其在水体中的垂向位置,以获取适宜的光能与充分的营养盐,进而增加自身的竞争优势[12]。目前,关于伪鱼腥藻的研究相对较少[13-14],尤其是关于伪鱼腥藻和致嗅物质的昼夜与垂向分布规律及其驱动因素的研究鲜有报道。本研究选取华东地区某水源水库为研究对象,该水库平均水深为4.3 m,最大水深为6.5 m,水力停留时间为2 ~ 3 d左右。该水库以东太湖为水源,后经太浦河流入水库。该水库近年来出现季节性嗅味问题,通过在库区及太浦河长期对比原位监测,解析了嗅味产生来源,识别了潜在产嗅藻种;同时在嗅味高峰期间,开展了连续72 h的监测,分析了潜在产嗅藻的昼夜及垂向分布特征,并探讨了伪鱼腥藻与理化指标间的关系,以期为解决水源水库中典型嗅味问题提供参考。
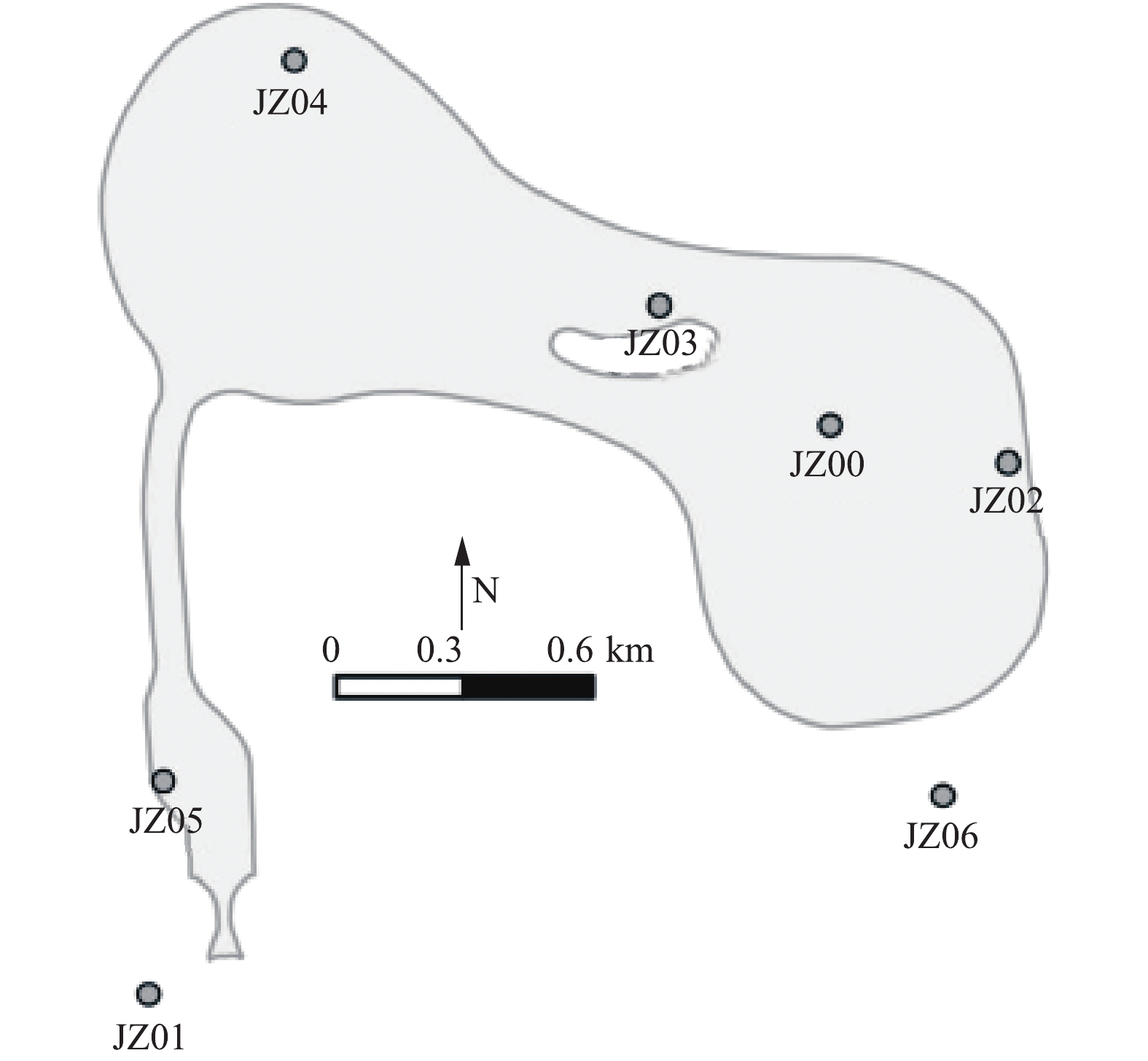
1.1. 样品采集
根据水库地形以及流场分析,在库区内共设置了7个常规采样点。如图1所示,分别为库东(JZ00)、取水口(JZ01,位于太浦河中)、输水口(JZ02)、库中央(JZ03)、库北(JZ04)、引水渠(JZ05)和泵房(JZ06),同时在水库上游太浦河沿线设置了5个采样点(东太湖口至JZ01间等距离设置5个采样点,图1未标示)。利用多参数水质仪原位测定水体常规理化指标,同时将水样带回实验室用于营养盐、嗅味物质以及藻类计数的进一步分析。水库内的采样频率为每周1次,上游沿线为每月1次。为进一步解析潜在产嗅藻在水库水中的分布特征,于2018年7月24日08:00至27日08:00在水库输水口(JZ02)附近开展了72 h连续采样调查。采样时刻为06:00、08:00、10:00、12:00、14:00、16:00、18:00、22:00和02:00,采样深度分别为水面下0.2、0.8、1.5、3.0和5.5 m,其中0.2 m和0.8 m的水样记为表层水,1.5 m和3.0 m记为中层水,5.5 m记为底层水。水样分析监测指标同上。
采用有机玻璃采水器(SC-01A,2.5 L,北京市格雷斯普科技开发有限公司)对不同水深的水样进行采集。每个样品采集1 L水样,随后分别从中取出100 mL和50 mL样品用于藻类计数和2-MIB测定,样品中分别加入5%的鲁戈试剂[15]与10 mg·L?1氯化汞[16],固定保存;此外,取300 mL水样经0.45 μm滤膜(BX60,上海兴亚净化材料厂)过滤,以用于溶解态营养盐的分析。
1.2. 藻类计数
将藻类计数样品在100 mL量筒中静置48 h,待藻细胞沉降至底部,移除上层90 mL溶液,完成藻细胞10倍富集过程,随后保持在黑暗中,直至细胞计数。藻种鉴定主要基于显微镜(Nikon DS-Ri1,日本)形态学观察[17]与藻类图谱比对方法[18],藻细胞计数参照显微分析方法[19],并采用藻类计数软件(https://cc.drwater.net)完成。另外,由于丝状藻种与聚团类藻种难以通过细胞直接计数,本研究通过测量丝状藻单位细胞长度与丝状藻总长度估算丝状藻细胞数量,并通过测定聚团类藻细胞密度与藻团总体积估算聚团类藻细胞数量。1.3. 致嗅物质定量分析
样品中致嗅物质2-MIB和土臭素(geosmin)的定量分析采用顶空固相微萃取(HSPME)[20]与气相色谱-质谱(GCMS)联用方法(Agilent 7890/5977,美国安捷伦科技公司)。具体操作为:将10 mL水样和1 g氯化钠置于顶空样品瓶中,首先在60 ℃下以450 r·min?1的转速振荡15 min,然后采用顶空萃取30 min后进样,在进样口处250 ℃解析5 min。样品在气相色谱中采用不分流进样,其升温程序为:柱温箱以60 ℃保持2.5 min,以8 ℃·min?1升温至250 ℃,并保持5 min。质谱检测器采用离子选择模式(SIM)进行定量分析,其中2-MIB定量离子质荷比为95,geosmin的质荷比则为112。1.4. 其他水质参数
水样中氨氮、硝酸盐氮、亚硝酸盐氮、总磷、总氮和耗氧量的分析分别采用纳氏试剂分光光度法和紫外分光光度法、重氮耦合分光光度法、钼酸铵分光光度法、碱性过硫酸钾消解紫外分光光度法和酸性高锰酸钾氧化法[21]。常规理化参数采用多参数水质分析仪(EXO2,美国)在现场原位分层测定,主要包括水温、电导率、溶解性固体、盐度、pH、氧化还原电位、浊度以及叶绿素等指标。水体透明度用塞氏盘法(黑白两色,直径20 cm)测定。1.5. 数据处理与分析
实验所得数据采用Originpro2016进行统计分析与制图。水库地形图采用R 3.6.0软件绘制。2.1. 典型嗅味物质的季节分布
图2为2018年4月至2019年12月期间该水库中典型土霉味物质2-甲基异莰醇(2-MIB)和土臭素(geosmin)的浓度变化。由2018年和2019年总2-MIB的分布情况可以看出,在2年内,2-MIB浓度存在相同的季节分布规律,整体来看,2019年比2018年略高。2018-11—2019-03期间浓度较低,低于嗅阈值;5—9月期间,检出浓度较高,在2年内,2-MIB浓度出现了2次高峰,分别为2018-05上旬和2018-07中下旬以及2019-04下旬和2019-07中下旬。其中,最高浓度均出现在7月下旬,水库取水口(JZ01)在2019年检测到最高值(187 ng·L?1),3 d后,水库输水口(JZ02)达到该位置最高值(89 ng·L?1)。由2018年和2019年总geosmin的分布情况可以看出,2018年geosmin浓度全年均低于嗅阈值。2019年7月末,geosmin浓度首次出现超出嗅味阈值的现象,达到30 ng·L?1,同期2-MIB浓度也相对较高。2019年,geosmin共出现了2次嗅味高峰期,分别在2019-07-22—2019-08-04和2019-09-24—2019-10-06。7月24日,取水口geosmin浓度达到83 ng·L?1,而输水口geosmin浓度在8月2日达到最大值(40 ng·L?1)。与2-MIB类似,geosmin浓度2019年出现峰值的频次和数值均高于2018年,这说明未来geosmin也可能会带来潜在嗅味风险。总体看来,该水库目前土霉味嗅味问题主要是由2-MIB引起的。
2.2. 潜在产嗅藻的识别与来源分析
图3是该水库在监测期间内(2018-04—2019-10)镜检出的4株丝状蓝藻与2-MIB浓度的Pearson相关分析结果。由图3可知,束丝藻(Pearson相关系数=0.672 5, P<0.01)和伪鱼腥藻(Pearson相关系数=0.726 3, P<0.01)与2-MIB浓度呈显著正相关关系,而颤藻(Pearson相关系数=0.257 4, P=0.15)和浮丝藻(Pearson相关系数=0.318 4, P=0.60)与2-MIB浓度则无明显相关性。由于束丝藻并非典型的产嗅蓝藻,且监测期间内,检出频率较低,不被认为是该水库的产嗅藻。伪鱼腥藻是典型的产2-MIB蓝藻[6, 22-24],也在我国多个水体中检出[22, 25]。RONG等[22]在研究中国南方一水库时发现,伪鱼腥藻是水库中2-MIB主要来源,其生长受到CODMn和DOC的影响。NIIYAMA等[6]在日本琵琶湖分离出2株不同颜色的伪鱼腥藻,其中1株可产生2-MIB。因此,根据现有的证据来看,伪鱼腥藻是该水库中致嗅物质2-MIB的潜在产生来源。图4为该水库内7个常规采样点以及上游沿线5个采样点的伪鱼腥藻平均密度的时空变化规律以及库内外伪鱼腥藻的相关性分析结果。由图4可以看出,库内外伪鱼腥藻的平均密度随时间变化的趋势相似。伪鱼腥藻细胞密度从2018年5月开始升高,在7月达到峰值(1.28×106个·L?1),随后开始减少,冬季细胞密度达到最低。2019年,伪鱼腥藻细胞密度出现高峰的时间分别为4、5和7月。由库内外伪鱼腥藻细胞密度的相关性分析结果可知,库内伪鱼腥藻的存在主要来源于上游水体(Pearson相关系数=0.938 5,P<0.01)。
2.3. 伪鱼腥藻影响因子的分析
表1为自2018年监测以来伪鱼腥藻与常规水质指标的相关性分析结果。可以看出,伪鱼腥藻的生长与电导率、溶解性总固体、盐度、pH、溶解氧、叶绿素a和透明度呈显著正相关(P<0.01);与氧化还原电位(Pearson相关系数=?0.251 0, P<0.01)和浊度(Pearson相关系数=?0.137 4, P=0.028)呈显著负相关;与总氮和总磷有一定的相关性,但显著性不大(P>0.05);与氨氮、硝酸盐氮、亚硝酸盐氮和耗氧量没有相关性;与水温及采样点有一定的相关性。由于水库较小,换水量较大,水体温度未出现明显的层化现象。在5—9月平均水温为25.6 ℃,最高水温出现在7月,达到32.5 ℃。有研究[26]报道,伪鱼腥藻具有很强的温度适应性,最适温度为20~30 ℃。ZHANG等[8]在研究不同温度对伪鱼腥藻产嗅量的影响中发现,伪鱼腥藻在10 ℃下生长速率最低,但产嗅量为最高,在30 ℃下生长速率最高而产嗅量最低。因此,25 ℃下伪鱼腥藻的产嗅量相对较高,可见该水库夏季水温适宜伪鱼腥藻生长。由于该水库中营养盐含量相对充足,总氮浓度为0.8~3.5 mg·L?1,总磷浓度为0.04~0.30 mg·L?1,不是伪鱼腥藻生长限制因素,因而伪鱼腥藻与氮、磷浓度相关性不显著。在本研究中发现,伪鱼腥藻与透明度成正相关,而与浊度呈负相关,这说明其生长与水下光照关系较大,这与已有丝状蓝藻的研究结果[27-28]相符。此外,叶绿素a主要由蓝藻及绿藻等含叶绿素a的藻细胞贡献,其他理化指标与伪鱼腥藻生长关系不大。采样点位置与伪鱼腥藻浓度之间的相关性表明伪鱼腥藻存在空间差异性,进一步发现其细胞密度沿水库取水口至输水口沿程降低,也验证了其主要来源为外源输入。根据以上结果,在高嗅期间水温适宜,营养盐相对充足,水下光照是驱动其生长的重要因素。
2.4. 水库中伪鱼腥藻昼夜及垂向分布特征
在短期内,水下光照主要与藻细胞所在深度和时间相关。因此,为进一步解析潜在产嗅伪鱼腥藻在水库中的分布特征,本研究在水库高2-MIB浓度期间开展了连续72 h的调查。在此期间,共检出藻类7门67属,包括蓝藻门14属、绿藻门30属、硅藻门14属、隐藻门1属、裸藻门3属、甲藻门2属以及金藻门3属。蓝藻门、绿藻门、隐藻门的平均藻细胞密度占比分别为35.1%、30.9%与24.6%,其他藻门总占比则为9.4%。蓝藻门占比最高,是藻类中最主要的组成部分,其中,优势藻种分别是伪鱼腥藻(Pseudanabaena)、平裂藻(Merismopedia)和微囊藻(Microcystis)。从潜在产嗅藻分布来看,除伪鱼腥藻密度较高外,其他丝状蓝藻包括颤藻(Oscillatoria)、束丝藻(Aphanizomenon)以及浮丝藻(Planktothrix)等检出率均较低。图5显示了伪鱼腥藻在不同时间和不同水深处的的分布情况。伪鱼腥藻从08:00左右开始往表层水体迁移,10:00—14:00在表层水体中的细胞密度占比达到最高,随后从表层水体逐渐往中层水体迁移,约至16:00在表层水体中的细胞密度占比达到最低值;在15:00—22:00,中层水体中伪鱼腥藻的细胞密度占比较大;而在底层水体中细胞密度占比白天相对较低,夜间相对较高。由此可见,白天伪鱼腥藻在水体中存在垂向迁移运动,而夜间藻细胞密度在各水层无显著差异。伪鱼腥藻的昼夜垂向分布的特点可能与其白天为了进行光合作用往表层迁移,夜里为了更好的吸收营养盐而往底层迁移的特性有关。
WALSBY[29]研究了鱼腥藻在不同光照条件下的浮力,发现低光照度下的鱼腥藻伪空胞较大,随着光照强度的增加,鱼腥藻的细胞膨胀压力增大,从而破坏伪空胞,导致其浮力损失,表明不同的光照强度确实可以诱导调控藻细胞内伪空胞大小。此外,藻细胞还可以通过对碳水化合物的积累与消耗来调节细胞浮力。KROMKAMP等[30]的研究表明,微囊藻细胞的碳水化合物含量在白天比夜间高,细胞密度与碳水化合物呈正相关。该结果与本研究中伪鱼腥藻从14时开始往下层迁移的现象一致,可能的原因是随着藻细胞光合作用的增强,伪鱼腥藻的碳水化合物含量增加,细胞密度逐渐增大,导致细胞浮力减少。另外,表层过强的光照可使伪鱼腥藻细胞内伪空胞破裂,导致浮力下降[14]。因此,有伪空腔的蓝藻细胞可以根据环境条件调节自身的浮力。
2)电导率、溶解性总固体、溶解氧、透明度、氧化还原电位、浊度等与伪鱼腥藻的生长有关,是驱动伪鱼腥藻生长分布的重要因素。
3)白天伪鱼腥藻在水体中存在垂向迁移运动,而夜间其在各水层的分布无明显变化。
参考文献

 下载:
下载: 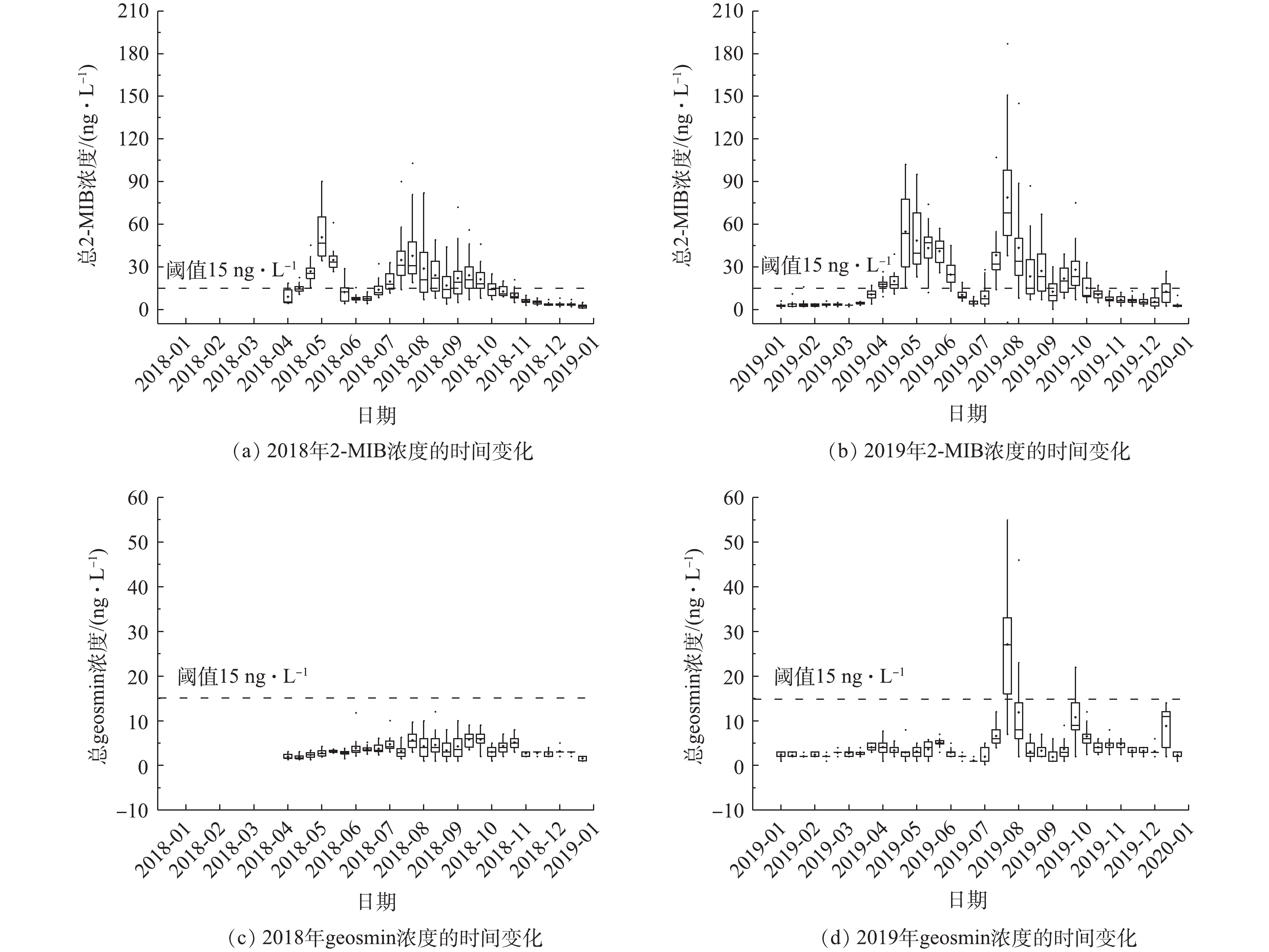



 点击查看大图
点击查看大图