
1. 沈阳化工大学 应用化学学院, 辽宁 沈阳 110142;
2. 大连理工大学 精细化工国家重点实验室, 辽宁 大连 116024
2019-12-16 收稿, 2019-02-20 录用
基金项目: 国家自然科学基金项目(U1908202)和辽宁省****支持项目(20183532)资助
*通讯作者: 姜新东
摘要: 本综述涵盖了2002年以来BODIPY/aza-BODIPY作为荧光团的设计、合成和功能化,包括在荧光猝灭、金属离子、阴离子及生物分子检测等方面的应用。讨论了aza-BODIPY的制备、aza-BODIPY硼中心的取代,以及1-甲基-1H-吡咯基取代3,5位aza-BODIPY等衍生染料的合成、性能及应用。
关键词: 氟硼二吡咯近红外荧光染料单线态氧化学传感器氨基酸
Recent Advances of the Near-infrared Fluorescent BODIPY/aza-BODIPY Dyes
YUE Shuai1, SHAO Zhumei1, JIANG Xindong1,2

1. College of Applied Chemistry, Shenyang University of Chemical Technology, Shenyang 110142, Liaoning, P. R. China;
2. State Key Laboratory of Fine Chemicals, Dalian University of Technology, Dalian 116024, Liaoning, P. R. China
*Corresponding author: JIANG Xindong
Abstract: This review covers the design, synthesis and functionalization of BODIPY/aza-BODIPY as fluorophore probes since 2002, including applications for fluorescence quenching, metal ion, anion, biomolecular detection, etc. Synthesis, properties and application of novel aza-BODIPY, substituted aza-BODIPY on the boron center, new near-Infrared-fluorescent aza-BODIPY dyes with 1-methyl-1H-pyrrolyl substituents at the 3, 5-positions and so forth, were herein discussed.
Key words: aza-BODIPYnear infrared fluorescent dyesinglet oxygenchemical sensorsamino acid
1 引言近红外荧光染料能够减少背景吸收、荧光、光散射,并能够提高荧光探针和化学传感器的灵敏度[1],更重要的是,近红外区域(650~900 nm)的光在组织中具有深度穿透能力,能够进行体内成像和光动力学治疗[2]。因此,新型近红外荧光染料的合成与设计,引起了越来越多人的兴趣[3-5]。氟硼二吡咯甲川(BODIPY)荧光强、稳定,并且容易修饰。所以,人们将BODIPY染料作为生物标记的候选物[6-8]。
aza-BODIPY的结构是以氮原子取代BODIPY的meso位碳原子,使吸收光谱显著红移[9-13]。使用亚胺基取代BODIPY系统中的一个亚甲基,可以缩小分子轨道间能隙差值(图 1)。事实上,aza-BODIPY的荧光量子产率要比BODIPY减少很多,然而随着仪器和设备的发展,只要荧光量子产率超过0.01就能被检测并使用。因此,新型近红外aza-BODIPY吸引了越来越多科研工作者的兴趣。
图 1
 | 图 1 BODIPY和aza-BODIPY的光学性能比较 |
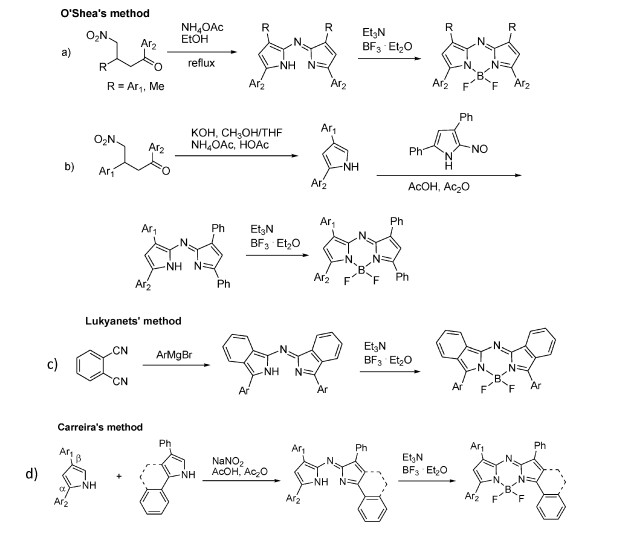
2 aza-BODIPY染料的合成方法相对于BODIPY,aza-BODIPY的合成方法较少[14, 15]。最近,O’shea等开发了合成路线,得到了由1, 3-二芳基-4-硝基-1-丁酮或3-甲基-4-硝基-1-芳基丁烷产生的对称aza-BODIPY的合成方法(图 2a)[16-18],该方法可广泛用于合成各种结构aza-BODIPY,并且,O’Shea等也报道了不对称aza-BODIPY的合成方法(图 2b)。Lukyanets报道了含有苯基的aza-BODIPY的合成方法, 将邻苯二甲腈与格式试剂反应,产率10%~30%(图 2c)[19]。Carreira等利用单独的2, 4-二芳基吡咯或芳基稠合的2, 4-二芳基吡咯,提供了更普遍、更有效的合成对称与不对称aza-BODIPY的方法(图 2d)[20]。
图 2
 | 图 2 aza-BODIPY染料合成方法 |
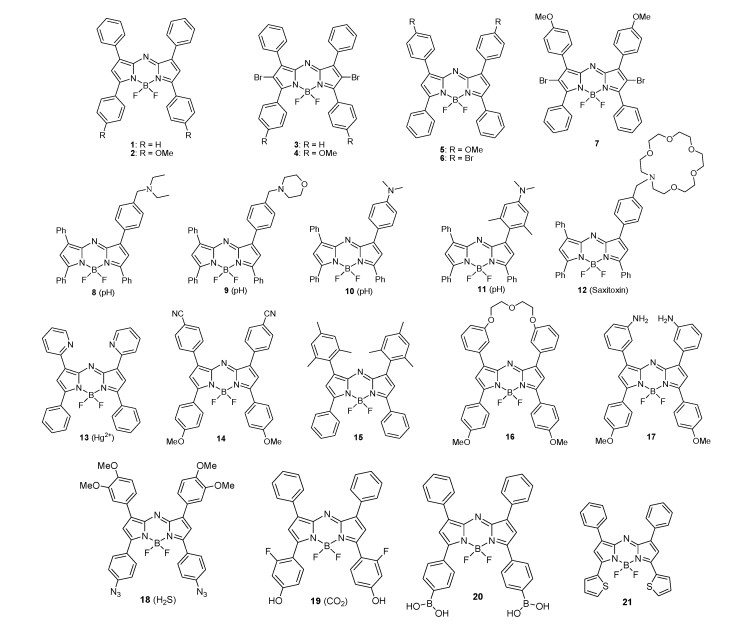
3 aza-BODIPY染料的结构及应用3.1 O’shea方法合成的aza-BODIPYO’Shea等在2002年首次报道了aza-BODIPY 1~4的合成及性质,并且溴取代的aza-BODIPY (3和4)被证实具有光动力治疗的功能。随后,O’shea等还制备了在1/7位具有—OMe/Br的氮杂-BODIPY 5~7[16-18]。利用光诱导电子转移(PET)机制,aza-BODIPY 8和9的二乙胺和吗啉作为质子的受体,可以对酸值感应[21]。通过内部电荷转移(ICT)调节,aza-BODIPY 10和11能用作pH探针[22]。合成的具有冠醚的aza-BODIPY 12,对中性小分子能够响应[23](图 3)。对于aza-BODIPY 13,在1, 7位的2-吡啶基取代基对于金属离子的结合有着非常明确的效果。化学传感器对Hg2+有选择性[24]。引入供电子或吸电子基团,可以通过增加HOMO或降低LUMO能量进一步降低HOMO-LUMO间隙,并使相应染料的吸收发生红移[25]。如3、5位的—OMe基团和1、7位的—CN基团取代的aza-BODIPY 14与母体aza-BODIPY 1(图 1)相比,其吸收、发射明显发生红移[26]。基于1, 7-苯基取代的aza-BODIPY受限旋转,通过制限旋转芳基的引入,aza-BODIPY 15具有更高荧光量子产率(高达0.81),并减少溶液中的非辐射弛豫过程[27]。为冻结1, 7位苯基的旋转,进行具有乙二醇片段连接的两个芳基取代,同时,增加aza-BODIPY 16的亲水性,并将其应用于细胞内HepG2细胞成像[28]。Burgess等报道了含有NH2基的氮杂-BODIPY 17[29]。含有叠氮基的aza-BODIPY 18表现出对H2S的选择性[30]。羟基取代的aza-BODIPY 19,是二氧化碳的传感器[31]。硼酸取代的近红外荧光染料20可以用于血液系统中葡萄糖含量的监控[32],其原理是aza-BODIPY上作为缺电子基团的硼酸基团与过氧化氢反应生成富电子酚基团,导致其发射波长从682 nm到724 nm显著红移。相对1, 3, 5, 7-四苯基aza-BODIPY 1,用噻吩代替其苯环发生了显著红移。aza-BODIPY 21具有较强的近红外荧光,在乙腈中的荧光量子产率是0.46,是非常有竞争力的近红外荧光团[33]。
图 3
 | 图 3 O’shea法合成的染料及其应用 |
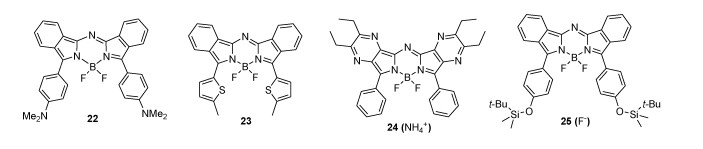
3.2 Lukyanets方法合成的aza-BODIPY邻苯二甲腈与格式试剂反应,成功制备了苯基稠合的aza-BODIPY[33],尽管该方法很容易且在商业上可行,但合成的aza-BODIPY结构单一,限制了其广泛使用。在苯环3, 5位的对位上引入供电子基团合成22(图 4),或用噻吩环取代形成23,导致了显著的红移[34]。吡嗪稠合的aza-BODIPY 24在685 nm具有强吸收带。染料24可以用作NH4+的比色剂和荧光传感器[35]。由于F-对硅的强亲和力,近红外aza-BODIPY 25对F-有高选择性(图 4)[36],加入F-时荧光强度的猝灭可归因于分子内电荷转移的特性,此外,25可用于监测活细胞中F-的存在。
图 4
 | 图 4 Lukyanets法合成的染料及其应用 |
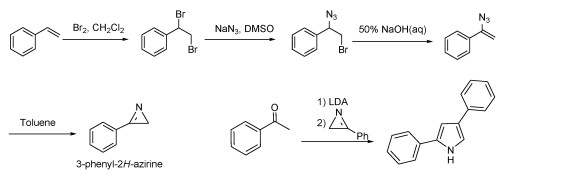
3.3 Carreira方法合成的aza-BODIPY为了制备2, 4-二苯基吡咯,使用相应的酮(如苯乙酮)与2-苯基氮丙烯反应,在LDA或NaH存在下得到2, 4-二苯基-1H-吡咯(图 5)[20],利用这种方法,已合成了许多典型的吡咯。吡咯的独特结构已经通过X射线单晶衍射证实[37]。采用Carreira的方法,这些新型吡咯适合于合成aza-BODIPY及其衍生物(图 6)。Carreira等在2006年开发了具有适当取代和限制的新型荧光染料aza-BODIPY 26~29(图 7)[20],新的aza-BODIPY染料拥有700~900 nm的峰值荧光,有高量子产率、窄半峰宽、高稳定性的特点。
图 5
 | 图 5 2, 4-二苯基吡咯的合成 |
图 6
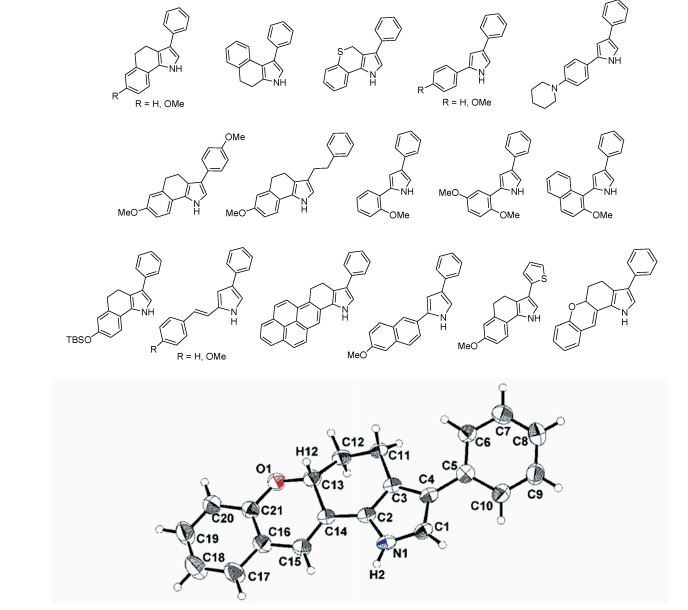 | 图 6 用于合成BODIPY、aza-BODIPY染料的吡咯和ORTEP图[37] |
图 7
 | 图 7 Carreira方法合成的染料及其应用 |
此外,在Carreira法的基础上,Jiang团队最近在aza-BODIPY领域中,在可旋转部分的π共轭延伸和刚性的方面取得了突破,由于刚性化和π共轭的延伸的组合效应,在近红外区域(λabs=746 nm,λem=762 nm)制备了对称的含芘aza-BODIPY 30。在芘稠合的aza-BODIPY中,观察到HOMO-LUMO(轨道)带隙的最低能量吸收带降低[38]。
Jiang等成功制备了含有萘基的aza-BODIPY 31a[39],通过萘基延长π共轭系统对其光物理性质有显著影响,具有萘基的aza-BODIPY 31a的最大吸收和发射波长分别为λabs=706 nm,λem=733 nm,与带有苯基的2(λabs=688 nm,λem=715 nm)的BDP相比,有显著红移。作为光敏剂aza-BODIPY 31b(在甲苯中λabs=704 nm)可以产生一定的单重态氧,并且被认为是潜在地用于产生单重态氧的光敏剂。Jiang等在aza-BODIPY染料的基础上制造出近红外的荧光探针32[40],探针32具有弱荧光,用硫醇裂解DNBS释放aza-BODIPY荧光,同时在NIR区域发出荧光(λem=755 nm,Φf=0.14),对半胱氨酸具有高度选择性,并且检测快速。
Jiang等还报道了含噻吩基的aza-BODIPY 33[41],aza-BODIPY 33在氯仿中其NIR区域吸收在760 nm处,发射在782 nm处。作为NIR型化学传感器的33对Hg2+具有高度选择性,其荧光猝灭是由于与Hg2+结合后电子从噻吩基到aza-BODIPY母核的转移, 化学传感器33可用于检测MCF-7细胞中的Hg2+,表明其可用于研究Hg2+在生物系统中的作用。
修饰aza-BODIPY的关键在于母体分子的修饰,非常有效的修饰方法之一是通过Knoevenagel反应延伸共轭系统[42-45]。在aza-BODIPY系统中的3, 5位缺少甲基,Knoevenagel反应对其是无效的。使用3-乙基-2, 4-二甲基-吡咯预期的产物是在3, 5位上包含甲基的aza-BODIPY,但得到的是3-氨基或3-乙酰氨基BODIPY[46-48]。如上所述,表明使用Carreira方法(图 2)合成aza-BODIPY的基本要求是在吡咯的α、β位具有芳基。Jiang组挑战了这一假设,在NIR区成功制备了不对称的含苯乙烯基的aza-BODIPY 34和35(图 8)[49],这是一个带有苯乙烯基的新型aza-BODIPY结构,可以避免使用Knoevenagel反应。
图 8
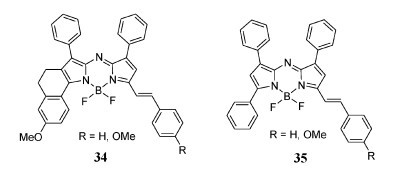 | 图 8 不对称苯乙烯基取代的aza-BODIPY染料 |
Jiao小组最近报道了一类近红外β-噻吩稠合aza-BODIPY,使用的吡咯是在Suzuki-Miyaura偶联反应中获得的[50]。aza-BODIPY 36(图 9)在800 nm处可以看到尖锐的吸收和荧光发射带,在700~ 380 nm的可见光范围内具有非常低的吸收。
图 9
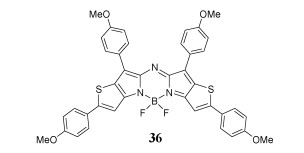 | 图 9 噻吩融合的aza-BODIPY染料 |
4 近红外荧光染料衍生物的合成及应用4.1 aza-BODIPY硼中心的取代尽管Ziessel等已经详细报道了氟原子在BODIPY体系中的取代[51],但硼中心取代的aza-BODIPY报道较少。37结构具有B—O键,将中心硼原子与3/5位苯基的邻位相连(图 10)[51]。与38[52]的无制限结构相比,37的吸收和发射最大值分别红移了88 nm和58 nm,荧光量子产率也大幅提升,这主要归因于BODIPY核的与3, 5位的芳基之间的共面性增强[52]。而aza-BODIPY 39中硼中心用芳基修饰,致使荧光量子产率极低,而40炔基化修饰导致荧光量子产率较高[53],并且,Jiang等还通过X射线晶体学证实了39和40的结构(ORTEP图见图 10)[54]。
图 10
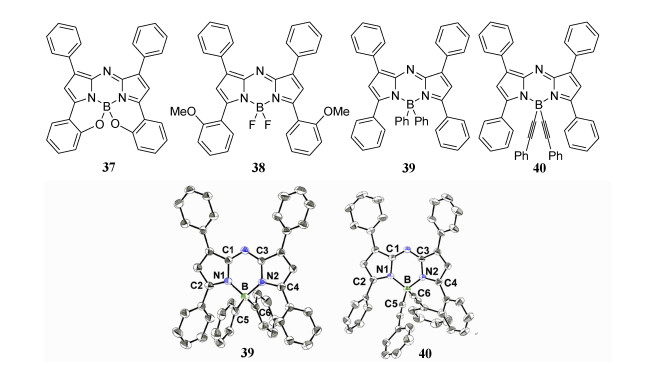 | 图 10 F取代的aza-BODIPY染料及aza-BODIPY ORTEP图[54] |
4.2 1-甲基-1H-吡咯基取代3, 5位的近红外荧光aza-BODIPY染料尽管研究人员已经获得了多种aza-BODIPY体系,但目前还没有报道在3, 5位上合成带有吡咯基的aza-BODIPY体系。作者曾报道了在3, 5位上含有吡咯基的近红外荧光aza-BODIPY染料41和42的设计和合成(图 11)[55],染料41和42的吸收和发射最大值明显不同,41的光谱在721 nm处吸收,751 nm处发射,而42比41具有更长的吸收和发射波长(λabs=754 nm, λem=803 nm),由于吡咯环的电子供体作用导致红移。然而,染料41和42的不同构象导致了其光物理性质的显著差异,与41相比,42中吡咯取代基的自由旋转,由于硼中心的氟原子而变得复杂,并且似乎在减慢或被禁止,这与Burgess小组报道的受约束的aza-BODIPY(由B—O键引起)和它的不受约束的前驱体之间的光谱对比一致[52, 56]。此外,41和42具有较高的消光系数和较大的荧光量子产量,而42具有较大的斯托克斯位移。染料41在近红外区域稳定性好、灵敏度高、荧光量子产率高,适合标记活细胞用于近红外区域的成像检测。
图 11
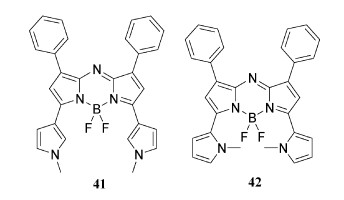 | 图 11 近红外荧光染料aza-BODIPY 41和42 |
在细胞染色实验中,将含量1.0×10-5 mol/L染料41(在0.5%DMSO体积比的PBS中)与Hep-2细胞在37 ℃下孵育15 min,除去多余的染料后,用ArrayScan VTI HCS Reader倒置荧光显微镜进行荧光成像,激光激发波长为620 nm,结果表明,染料41可以有效进行细胞染色(图 12)[55]。染料41具有可透膜性,位于细胞质中,而细胞核保持完好,未被染色。
图 12
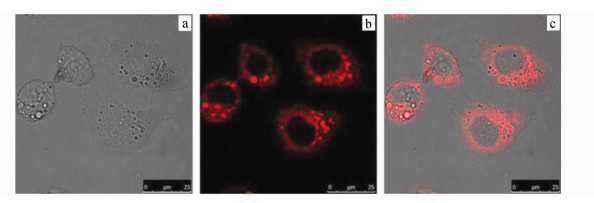 | 图 12 1.0×10-5 mol/L染料41在37 ℃下、0.5%DMSO的PBS中,孵育Hep-2细胞15 min的荧光显微镜成像,黑色区域为细胞核, 比例尺:25 μma.白光成像; b.激发光λex=620 nm的成像; c.图像a和b的叠加 |
4.3 二溴化含噻吩基aza-BODIPY的单重态氧产生性能由于3, 5位具有噻吩环的aza-BODIPY染料的单重态氧产生尚未见报道,作者曾设计合成了2, 6-二溴化的aza-BODIPY 43和3, 5-二溴化的aza-BODIPY 44(图 13)[57]。43和44的半峰宽(FWHM)有着显著不同,44的吸收带更窄,43的荧光寿命明显短于44的。尽管二者的荧光量子产率略有不同,但消光系数几乎相同。检测单重态氧,结果发现在2, 6-位具有溴取代的43的单重态氧的产生比在3, 5-位具有溴取代的44更有效。但43是比亚甲蓝弱得多的PS[58]。
图 13
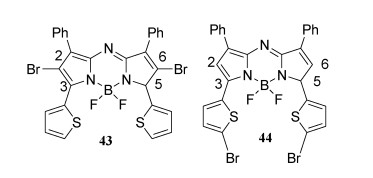 | 图 13 含噻吩基的aza-BODIPY光敏剂 |
4.4 具有—F/—N3/—NH2基团的近红外aza-BODIPY的合成、结构及光物理性质aza-BODIPY通过引入一个供电子/吸电子基团,可以增加HOMO和/或降低LUMO能量,进一步减小HOMO-LUMO能级差,达到更大的红移吸收和发射带[59, 60]。相比之下,在1/7位置上带有吸电子基团(如—CN)的aza-BODIPY也会使吸收/发射带红移[61]。由于氟是一种强诱导受体,引入氟原子,成功设计合成了45~48(图 14)。aza-BODIPY 46的固态结构通过单晶X射线分析得到了证实(图 15), 发现其F—CPh键距比报道的氟化物短。NaN3通过亲核取代,形成了含—N3/—NH2的aza-BODIPY 49和50[62](图 16),这些aza-BODIPY在近红外区域有吸收和发射。虽然在45~48的1/7位置引入了F原子,但氟原子对光物理性质的影响微乎其微,而带有—N3/—NH2的49和50有着显著的红移,50可作为pH值的荧光探针。
图 14
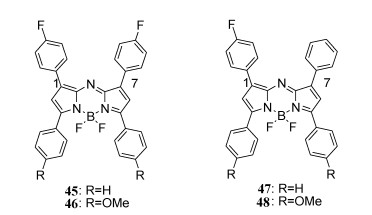 | 图 14 含氟的染料aza-BODIPY 45-48 |
图 15
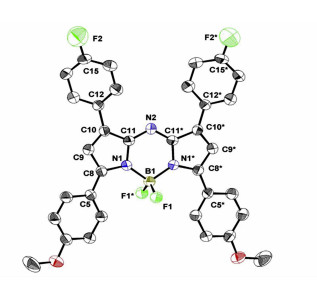 | 图 15 aza-BODIPY 46的ORTEP图[61] |
图 16
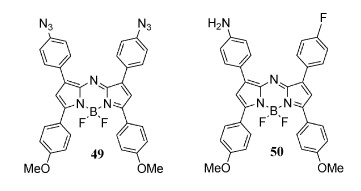 | 图 16 aza-BODIPY染料49和50 |
4.5 甲硫基取代BODIPY/aza-BODIPY的合成及应用甲硫基取代BODIPY/aza-BODIPY极为罕见[63-65],Jiang课题组制备了含有—SMe基团的新吡咯,并应用于合成一系列新的BODIPY/aza-BODIPY 51~55[66](图 17),为了与—SMe基团的51的光物理性质进行严格比较,我们还制备了—OMe基团取代的已知aza-BODIPY 56[67]。由于ICT效应,在荧光染料中引入供电子的甲硫基可以显著降低量子产率,使光谱红移,提高消光系数和大斯托克斯位移。此外,MO计算很好地支持并解释了51和56之间吸收最大值的差异。通过HClO将BODIPY 53的硫醚转化为相应的吸电子亚砜,可以恢复量子产率并使其发射光谱蓝移,染料53对HClO具有高敏感性和选择性。
图 17
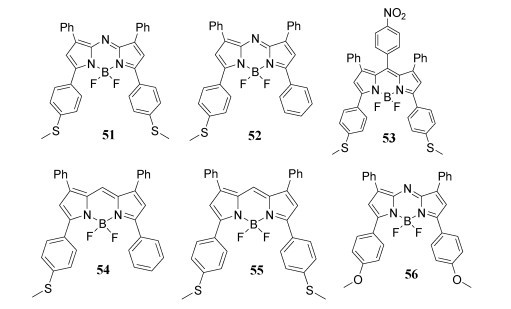 | 图 17 甲硫基取代的染料BODIPY / aza-BODIPY |
4.6 Meso-CF3-BODIPY化合物的合成一锅法合成meso-CF3-BODIPY染料[57, 68-72],PhSiCl3在这一合成中起着至关重要的作用,提供了Cl源,生成酰氯。BODIPY 57~62[73](图 18)吸收光谱覆盖红光区域(λabs=553~703 nm)。与相应的R-BODIPY (R=H、烷基、芳基等)对比[52], 强吸电子基—CF3基团导致吸收光谱红移。Meso-CF3-BODIPY 58~61没有荧光。然而,染料62有窄的半峰宽、高摩尔消光系数和较好的荧光量子产率[41]。X-ray单晶衍射证实了meso-CF3-BODIPY 59的固态结构(图 19)。sp3杂化的硼中心出现轻微歪曲的四面体结构,这是—CF3基团的立体位阻引起的结果。
图 18
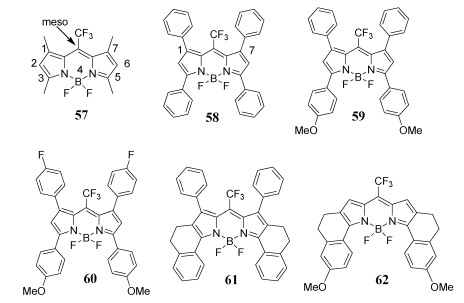 | 图 18 meso位—CF3取代的BODIPY染料57~62 |
图 19
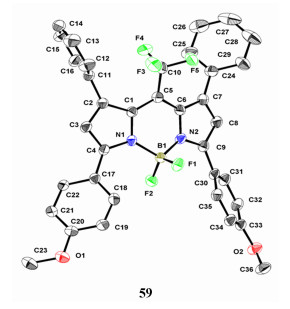 | 图 19 染料59的X-ray晶体结构[73] |
由于强吸电子—CF3基团稳定了反应生成的碳负离子,在80 ℃的低温下,通过Knoevenagel缩合反应合成了BODIPY 63(图 20)[74, 75]。63中的二甲氨基不仅用作pH识别单元,而且又与—CF3组建了推拉系统,染料63是一种近红外pH响应的荧光探针。
图 20
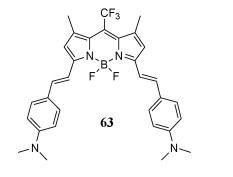 | 图 20 荧光染料BODIPY 63 |
Meso-CF3-BODIPY 58与NBS反应,生成二溴取代meso-CF3-BODIPY 64(图 21), 64单重态氧生成效率是母体58的2.4倍。
图 21
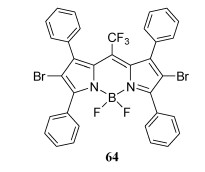 | 图 21 光敏剂BODIPY 64 |
4.7 长波长吸收五元环BODIPY/aza-BODIPY的合成及光物理性质五元环稠合BODIPY/aza-BODIPY具有近似平面的结构[76, 77],作者利用五元环设计合成了BODIPY/aza-BODIPY 65~68[78](图 22)。
图 22
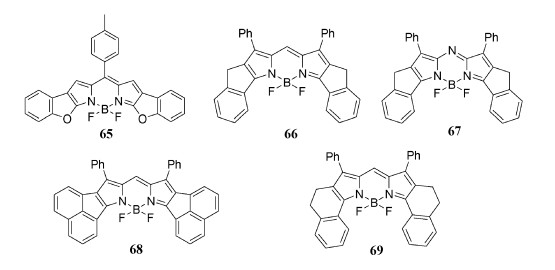 | 图 22 五元环融合BODIPY/aza-BODIPY染料65~69 |
为了严格比较光物理性质,还制备了新的BODIPY 69(图 22)。五元并环和六元并环结构的BODIPY/aza-BODIPY光谱性质几乎一致,通过X射线晶体学分析证实了BODIPY 69的固态结构[78](图 23),六元环稠合的BODIPY 69的母核不是平面而是扭曲的。
图 23
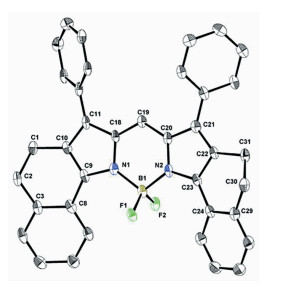 | 图 23 染料69的分子结构[78] |
4.8 近红外荧光aza-BODIPY探针用于L-赖氨酸的特异性检测基于3-氯BODIPY的荧光化学传感器的反应原理[79, 80],作者对其进行新的修饰,并通过在C—Cl键中插入噻吩基来构建荧光探针(图 24)[81],在CH2Cl2中,aza-BODIPY 70在近红外区域有吸收和发射(λabs/λex =732/753 nm),具有高摩尔消光系数和中等荧光量子产率。加入Lys后,N-亲核试剂直接攻击芳环的卤素,产生氨基取代的aza-BODIPY,导致PET效应。探针70对Lys具有选择性和敏感性,并可用于检测PC3细胞中的Lys。
图 24
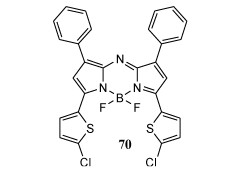 | 图 24 荧光染料BODIPY 70 |
将2 μmol/L的70与PC3细胞在37 ℃下孵育20 min后,洗涤除去过量的染料。用ArrayScanS VTI HCS Reader倒置荧光显微镜进行荧光成像,在细胞质区域观察到强而明亮的红色荧光图像(λex=655 nm),表明探针70具有出色的细胞膜通透性(图 25)。将处理过的细胞与Lys在培养基中于37 ℃孵育20 min后,PC3细胞显示出明显的荧光衰减,显然,添加Lys 20 min后,显微镜图像的荧光强度变得很弱,表明染料70能够有效地检测活细胞内的细胞内Lys摄取。
图 25
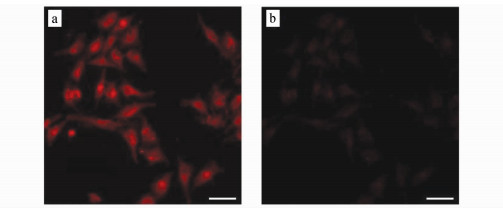 | 图 25 2 μmol/L染料70在37 ℃下、5%DMSO(体积分数)的PBS中孵育PC3细胞20 min的荧光显微镜图像比例尺:20 μma.红色表示细胞质区域被70染色(λex=655 nm);b.进一步与20 μmol/L赖氨酸在37 ℃下反应20 min |
4.9 对H2S的高选择性的二硝基氟苯硫解的荧光探针的合成设计合成了一种检测H2S的“裸眼”荧光开关探针(图 26)。在生理pH值7.4时,H2S的主要形态为HS-,HS-/H2S的比值约为3/1[82]。根据文献报道[83-85],作者采用NaHS作为H2S的当量化合物[86],加入NaHS时,通过保护DNP基团可以顺利进行裂解反应。探针71的吸收和发射最大值分别为580 nm和615 nm,探针71为强荧光,加入NaHS后,吸收最大值红移至617 nm,荧光强度显著降低90%。这些结果表明,这种DNP基团与BODIPY母核的直接连接可以有效地恢复荧光团的量子产率。然而,当通过H2S除去71中的二硝基苯以释放羟基时,72中的羟基向BODIPY母核进行电子转移,引起荧光猝灭。
图 26
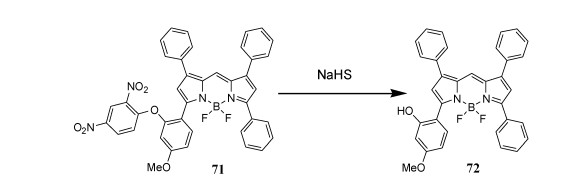 | 图 26 开关型荧光分子探针的设计方案 |
将5 μmol/L的71与HCT-116和CT-26细胞在37 ℃下孵育30 min。在可视化之前,洗涤除去多余的染料。ArrayScanS VTI HCS Reader倒置荧光显微镜进行荧光成像(图 27), 在细胞质区域观察到强而明亮的红色荧光图像(λex=550 nm),表明探针71具有出色的细胞膜通透性, 将处理过的细胞与NaHS(20.0 μmol/L)在培养基中于37 ℃孵育50 min后,HCT-116和CT-26细胞显示出明显的荧光猝灭,并且细胞质区域中未发现明显的荧光, 表明染料71能够有效检测活细胞内的细胞内HS-摄取。
图 27
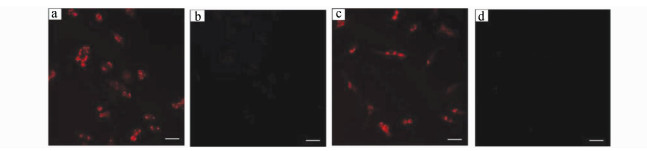 | 图 27 5 μmol/L染料71在37 ℃下孵育HCT-116、CT-26细胞30 min,而后,进一步与20 μmol/L NaHS在37 ℃孵育50 min的荧光显微镜图像,比例尺:20 μm[86]a.红色表示HCT-116细胞质区域被染料71染色(λex=550nm); b. HCT-116细胞质无色区域为染料71与NaHS (λex=550 nm); c.红色表示CT-26细胞质区域被染料71染色(λex=550 nm); d. CT-26细胞质无色区域为染料71与NaHS (λex=550 nm) |
4.10 1, 7位含萘基aza-BODIPY染料的合成及其在单重态产氧中的应用利用重原子效应,通过增加S1→T1跃迁,可以提高单重态氧的生成效率[87]。近红外吸收染料73Br和74Br(λabs=705 nm)光照下可以产生单重态氧(图 28)[88]。由于重原子效应,与73H和74H相比,73Br和74Br荧光均非常弱。与相应的母体aza-BODIPY 74H(λabs=718 nm)相比,74Br的最大吸收蓝移至698 nm。近红外染料73和74具有高消光系数。与母体aza-BODIPY相比,二溴取代的aza-BODIPY作为PS产生单重态氧,更为有效。在此过程中,没有观察到含萘基的aza-BODIPY染料被光漂白。
图 28
 | 图 28 萘取代的aza-BODIPY染料 |
4.11 新型5,6,5,6-四环吡嗪/吡咯稠合不对称双(BF2)荧光染料BOPYPY的合成、性能及应用Jiao等[89]报道了含有吡咯和N-杂芳烃衍生物(BOPPY)的不对称双(BF2)荧光团的新结构。2019年,我们首次报道了5, 6, 5, 6-四环吡嗪/吡咯稠合的不对称双(BF2)荧光染料(BOPYPY)(图 29)[90],BOPYPY 75在490 nm、522 nm处发射,与典型的BODIPY染料相比,具有大的斯托克斯位移(79 nm)。与75相比,BOPYPY 76~80通过相应吡咯的π-共轭的延伸,具有长波长吸收(λabs=498~546 nm),并且它们的发射甚至达到红色区域(λem=560~610 nm)。此外,BOPYPY 76~80具有高摩尔消光系数、高荧光量子产率和更大的斯托克斯位移(96~106 nm)。BOPYPY 75与4-二甲基氨基苯甲醛的Knoevenagel反应,能够平稳地生成带二甲基氨基取代的染料81(图 30),其可作为pH响应性荧光传感器检测酸值。
图 29
 | 图 29 荧光染料BOPYPY 75~80 |
图 30
 | 图 30 pH荧光分子探针81 |
4.12 BODIPY/aza-BODIPY在光扳机方面的应用为了对活细胞中的CO进行选择性成像,Chang及其同事使用了钯配合物82(图 31)[91]。由于钯的重原子效应,82的荧光被猝灭。与CO反应后,钯原子从BODIPY中释放出来,导致荧光恢复,荧光开启,对CO具有选择性,并且几乎不受ROS或活性氮(RNS)的影响。
图 31
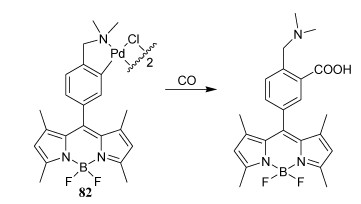 | 图 31 基于钯的重原子效应淬灭的CO响应探针 |
通过环二氧甲烷中间体进行的苯酚分子内氧化可用于检测ONOO-(图 32)[92, 93]。通过PeT控制,化合物83与ONOO-反应产生荧光,开启响应[94]。
图 32
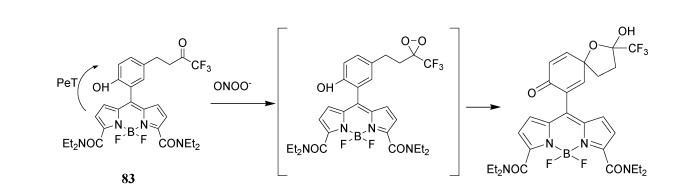 | 图 32 基于ONOO-检测的BODIPY探针 |
5 结论尽管Lukyanets的方法很容易实现且在商业上可行,但合成的aza-BODIPY结构单一,其功能很少被报道。O’Shea的方法占据了合成aza-BODIPY的主要位置[95]。而通过Carreira方法合成的具有更长波长的芳基稠合的aza-BODIPY及其应用,未来值得提倡和期待。
参考文献
| [1] | Ntziachristos V, Ripoll J, Weissleder R. Would near-infrared fluorescence signals propagate through large human organs for clinical studies?[J]. Optics Letters, 2002, 27(18): 333-335. |
| [2] | Becker A, Hessenius C, Licha K, et al. Receptor-targeted optical imaging of tumors with near-infrared fluorescent ligands[J]. Nature Biotechnology, 2001, 19(4): 327-331. |
| [3] | Descalzo A B, Rurack K. On the signalling pathways and Cu(Ⅱ)-mediated anion indication of N-meso-substituted heptamethine cyanine dyes[J]. Chemistry:A European Journal, 2009, 15(3): 3173-3185. |
| [4] | Barthram A M, Cleary R L, Kowallick R, et al. A new redoxtunable near-IR dye based on a trinuclear ruthenium(Ⅱ) complex of hexahydroxytriphenylene[J]. Chemical Communications, 1998(24): 2695-2696. DOI:10.1039/a807835a |
| [5] | Li H, Nguyen N, Fronczek F R, et al. Syntheses and properties of octa-, tetra-, and di-hydroxy-substituted phthalocyanines[J]. Tetrahedron, 2009, 65(17): 3357-3363. DOI:10.1016/j.tet.2009.02.012 |
| [6] | Reents R, Wagner M, Kuhlmann J, et al. Synthesis and application of fluorescence-labeled Ras-proteins for live-cell imaging[J]. Angewandte Chemie International Edition, 2004, 43(20): 2711-2714. DOI:10.1002/anie.200353265 |
| [7] | Burghart A, Thoresen L H, Chen J, et al. Energy transfer cassettes based on BODIPY dyes[J]. Chemical Communications, 2000, 2203-2204. |
| [8] | Beer G, Niederalt C, Grimme S, et al. Redox dwitches with chiroptical signal expression based on binaphthyl boron dipyrromethene conjugates[J]. Angewandte Chemie International Edition, 2000, 39: 3252-3255. |
| [9] | Umezawa K, Nakamura Y, Makino H, et al. Bright, color-tunable fluorescent dyes in the visible-near-infrared region[J]. Journal of the American Chemical Society, 2008, 130(5): 1550-1551. DOI:10.1021/ja077756j |
| [10] | Chen J, Reibenspies J, Derecskei-Kovacs A, et al. Through-space 13C-19F coupling can reveal conformations of modified BODIPY dyes[J]. Chemical Communications, 1999(24): 2501-2502. DOI:10.1039/a907559c |
| [11] | Descalzo A B, Xu H J, Xue Z L, et al. Phenanthrene-fused boron-dipyrromethenes as bright long-wavelength fluorophores[J]. Optics Letters, 2008, 10(8): 1581-1584. |
| [12] | Okujima T, Tomimori Y, Nakamura J, et al. Synthesis of π-expanded BODIPY and their fluorescent properties in the visible-near-infrared region[J]. Tetrahedron, 2010, 66: 6895-6900. DOI:10.1016/j.tet.2010.06.045 |
| [13] | Kowada T, Yamaguchi S, Ohe K. Highly fluorescent BODIPY dyes modulated with spirofluorene moieties[J]. Optics Letters, 2010, 12(2): 296-299. |
| [14] | Boens N, Leen V, Dehaen W. Fluorescent indicators based on BODIPY[J]. Chemical Society Reviews, 2012, 41(3): 1130-1172. DOI:10.1039/C1CS15132K |
| [15] | Lu H, Mack J, Yang Y, et al. Structural modification strategies for the rational design of red/NIR region BODIPY[J]. Chemical Society Reviews, 2014, 43(13): 4778-4823. DOI:10.1039/C4CS00030G |
| [16] | Killoran J, Allen L, Gallagher J, et al. Synthesis of BF2 chelates of tetraarylazadipyrromethenes and evidence for their photodynamic therapeutic behavior[J]. Chemical Communications, 2002(17): 1862-1863. DOI:10.1039/B204317C |
| [17] | Gorman A, Killoran J, O'Shea C, et al. In vitro demonstration of the heavy-atom effect for photodynamic therapy[J]. Journal of the American Chemical Society, 2004, 126(34): 10619-10631. DOI:10.1021/ja047649e |
| [18] | McDonnell S O, Hall M J, Allen L T, et al. Supramolecular photonic therapeutic agents[J]. Journal of the American Chemical Society, 2005, 127(47): 16360-16361. DOI:10.1021/ja0553497 |
| [19] | Donyagina V F, Shimizu S, Kobayashi N, et al. Synthesis of N, N-difluoroboryl complexes of 3, 3'-diarylazadiisoindolylmethenes[J]. Tetrahedron Letters, 2008, 49: 6152-6154. DOI:10.1016/j.tetlet.2008.08.026 |
| [20] | Zhao W, Carreira E M. Conformationally restricted aza-BODIPY:Highly fluorescent, stable near-infrared absorbing dyes[J]. Chemistry:A European Journal, 2006, 12(27): 7254-7263. DOI:10.1002/chem.200600527 |
| [21] | Hall M J, Allen L T, O'Shea D F. PET modulated fluorescent sensing from the BF2 chelated azadipyrromethene platform[J]. Organic & Biomolecular Chemistry, 2006, 4(5): 776-780. |
| [22] | Killoran J, O'Shea D F. Impact of a conformationally restricted receptor on the BF2 chelated azadipyrromethene fluorosensing platform[J]. Chemical Communications, 2006(14): 1503-1505. DOI:10.1039/b513878g |
| [23] | Gawley R E, Mao H, Mahbubul Haque M, et al. Visible fluorescence chemosensor for saxitoxin[J]. The Journal of Organic Chemistry, 2007, 72(6): 2187-2191. |
| [24] | Coskun A, Yilmaz M D, Akkaya E U. Bis(2-pyridyl)-substituted boratriazaindacene as an NIR-emitting chemosensor for Hg(Ⅱ)[J]. Optics Letters, 2007, 9(4): 607-609. |
| [25] | Loudet A, Burgess K. BODIPY dyes and their derivatives:Syntheses and spectroscopic properties[J]. Chemical Reviews, 2007, 107(11): 4891-4932. DOI:10.1021/cr078381n |
| [26] | Jiao L, Wu Y, Wang S, et al. Accessing near-infrared-absorbing BF2-azadipyrromethenes via a push-pull Effect[J]. The Journal of Organic Chemistry, 2014, 79(4): 1830-1835. |
| [27] | Jiao L, Wu Y, Ding Y, et al. Conformationally restricted aza-dipyrromethene boron difluorides (aza-BODIPY) with high fluorescent quantum yields[J]. Chemistry, An Asian Journal, 2014, 9(3): 805-810. |
| [28] | Kamkaew A, Thavornpradit S, Puangsamlee T, et al. Oligoethylene glycol-substituted aza-BODIPY dyes as red emitting ER-probes[J]. Organic & Biomolecular Chemistry, 2015, 13(30): 8271-8276. |
| [29] | Kamkaew A, Burgess K. Aza-BODIPY dyes with enhanced hydrophilicity[J]. Chemical Communications, 2015, 51(53): 10664-10667. DOI:10.1039/C5CC03649F |
| [30] | Adarsh N, Krishnan M, Ramaiah D. Sensitive naked eye detection of hydrogen sulfide and nitric oxide by aza-BODIPY dyes in aqueous medium[J]. Analytical Chemistry, 2014, 86(18): 9335-9342. DOI:10.1021/ac502849d |
| [31] | Schutting S, Jokic T, Strobl M, et al. NIR optical carbon dioxide sensors based on highly photostable dihydroxyaza-BODIPY dyes[J]. Journal of Materials Chemistry C, 2015, 3(21): 5474-5483. DOI:10.1039/C5TC00346F |
| [32] | Liu Y, Zhu J, Xu Y, et al. Boronic acid functionalized aza-Bodipy (azaBDPBA) based fluorescence optodes for the analysis of glucose in whole blood[J]. ACS Applied Materials & Interfaces, 2015, 7(21): 11141-11145. |
| [33] | Zhang X, Yu H, Xiao Y. Replacing phenyl ring with thiophene:an approach to longer wavelength aza-dipyrromethene boron difluoride (Aza-BODIPY) dyes[J]. The Journal of Organic Chemistry, 2012, 77(1): 669-673. |
| [34] | Lu H, Shimizu S, Mack J, et al. Synthesis and spectroscopic properties of fused-ring-expanded aza-boradiazaindacenes[J]. Chemistry, An Asian Journal, 2011, 6(4): 1026-1037. DOI:10.1002/asia.201000641 |
| [35] | Liu H, Mack J, Fuo Q, et al. A selective colorimetric and fluorometric ammonium ion sensor based on the Haggregation of an aza-BODIPY with fused pyrazine rings[J]. Chemical Communications, 2011, 47(44): 12092-12094. DOI:10.1039/c1cc15746a |
| [36] | Zou B, Liu H, Mack J, et al. A new aza-BODIPY based NIR region colorimetric and fluorescent chemodosimeter for fluoride[J]. RSC Advances, 2014, 4(96): 53864-53869. DOI:10.1039/C4RA06416J |
| [37] | Jiang X D, Gao R, Yue Y, et al. A NIR BODIPY dye bearing 3, 4, 4a-trihydroxanthene moieties[J]. Organic & Biomolecular Chemistry, 2012, 10(34): 6861-6865. |
| [38] | Jiang X D, Xi D, Sun C, et al. Synthesis of a pyrenyl-fused aza-BODIPY as a near-infrared dye having the absorption maximum at 746 nm[J]. Tetrahedron Letters, 2015, 56(34): 4868-4870. DOI:10.1016/j.tetlet.2015.06.053 |
| [39] | Jiang X D, Xi D, Le Guennic B, et al. Synthesis of NIR naphthyl-containing aza-BODIPY and measure of the singlet oxygen generation[J]. Tetrahedron, 2015, 71(40): 7676-7680. DOI:10.1016/j.tet.2015.07.068 |
| [40] | Jiang X D, Zhang J, Shao X, et al. A selective fluorescent turn-on NIR probe for cysteine[J]. Organic & Biomolecular Chemistry, 2012, 10(10): 1966-1968. |
| [41] | Jiang X D, Zhao J, Li Q, et al. Synthesis of NIR fluorescent thienyl-containing aza-BODIPY and its application for detection of Hg2+:electron transfer by bonding with Hg2+[J]. Dyes and Pigments, 2016, 125: 136-141. DOI:10.1016/j.dyepig.2015.09.023 |
| [42] | Zheng Q, Xu G, Prasad P N. Conformationally restricted dipyrromethene boron difluoride (BODIPY) dyes:Highly fluorescent, multicolored probes for cellular imaging[J]. Chemistry-A European Journal, 2008, 14(19): 5812-5819. DOI:10.1002/chem.200800309 |
| [43] | Wang D P, Shiraishi Y, Hirai T. A BODIPY-based fluorescent chemodosimeter for Cu(Ⅱ) driven by an oxidative dehydrogenation mechanism[J]. Chemical Communications, 2011, 47(9): 2673-26765. DOI:10.1039/c0cc04069j |
| [44] | Bura T, Pascal R, Ulrich G, et al. Highly substituted Bodipy dyes with spectroscopic features sensitive to the environment[J]. The Journal of Organic Chemistry, 2011, 76(4): 1109-1117. |
| [45] | Zhu S, Zhang J, Vegesna G, et al. Highly watersoluble neutral BODIPY dyes with controllable fluorescence quantum yields[J]. Organic Letters, 2011, 13(3): 438-441. DOI:10.1021/ol102758z |
| [46] | Liras M, Prieto J B, Pintado-Sierra M, et al. Synthesis, photophysical properties, and laser behavior of 3-amino and 3-acetamido BODIPY dyes[J]. Organic Letters, 2007, 9(21): 4183-4186. DOI:10.1021/ol701674b |
| [47] | Wang Y, Descalzo A B, Shen Z, et al. Dihydronaphthalene-fused boron-dipyrromethene (BODIPY) dyes:Insight into the electronic and conformational tuning modes of BODIPY fluorophores[J]. Chemistry-A European Journal, 2010, 16(9): 2887-2903. DOI:10.1002/chem.200902527 |
| [48] | Wang Y, Descalzo, A B, Shen Z, et al. Dihydronaphthalene-fused boron-dipyrromethene (BODIPY) dyes:Insight into the electronic and conformational tuning modes of BODIPY fluorophores[J]. Chemistry-A European Journal, 2012, 18: 7306-7309. DOI:10.1002/chem.201201081 |
| [49] | Jiang X D, Xi D, Zhao J, et al. A styryl-containing aza-BODIPY as near-infrared dye[J]. RSC Advances, 2014, 4(105): 60970-60973. DOI:10.1039/C4RA10188J |
| [50] | Wu Y, Cheng C, Jiao L J, et al. β-Thiophene-fused BF2-azadipyrromethenes as near-infrared dyes[J]. Organic Letters, 2014, 16(3): 748-751. DOI:10.1021/ol4034622 |
| [51] | Ulrich G, Ziessel R, Harriman A. The chemistry of fluorescent bodipy dyes:Versatility unsurpassed[J]. Angewandte Chemie (International ed. in English), 2008, 47(7): 1184-1201. DOI:10.1002/anie.200702070 |
| [52] | Loudet A, Bandichhor R, Burgess K, et al. B, O-chelated azadipyrromethenes as near-IR probes[J]. Organic Letters, 2008, 10(21): 4771-4774. DOI:10.1021/ol8018506 |
| [53] | Jiang X D, Fu Y, Zhang T, et al. Synthesis and properties of NIR aza-BODIPY with aryl and alkynyl substituents on the boron center[J]. Tetrahedron Letters, 2012, 53(42): 5703-5706. DOI:10.1016/j.tetlet.2012.08.056 |
| [54] | Jiang X D, Li S, Guan J, et al. Recent advances of the near-infrared fluorescent aza-BODIPY dyes[J]. Current Organic Chemistry, 2016, 20: 1736-1744. DOI:10.2174/1385272820666160229224354 |
| [55] | Jiang X D, Guan J, Li Q, et al. New near-infrared-fluorescent aza-BODIPY dyes with 1-methyl-1H-pyrrolyl substituents at the 3, 5-positions[J]. Asian Journal of Organic Chemistry, 2016, 5(8): 1063-1067. DOI:10.1002/ajoc.201600201 |
| [56] | Yakubovskyi V P, Shandura M P, Kovtun Y P. Pyrrolidylsubstituted azadipyrromethene with fully chelated boron atom[J]. Synthetic Communications, 2010, 40(7): 944-950. DOI:10.1080/00397910903219542 |
| [57] | Jiang X D, Li S, Le Guennic B, et al. Singlet oxygen generation properties of isometrically dibromated thienyl-containing aza-BODIPY[J]. Physical Chemistry Chemical Physics, 2016, 18(48): 32686-32690. DOI:10.1039/C6CP05705E |
| [58] | Orth K, Ruck A, Stanescu A, et al. Intraluminal treatment of inoperable oesophageal tumours by intralesional photodynamic therapy with methylene blue[J]. Lancet, 1995, 345(8948): 519-520. DOI:10.1016/S0140-6736(95)90617-7 |
| [59] | Lu H, Mack J, Yang Y, et al. Structural modification strategies for the rational design of red/NIR region BODIPY[J]. Chemical Society Reviews, 2014, 43(13): 4778-4823. DOI:10.1039/C4CS00030G |
| [60] | Bellier Q, Pégaz S, Aronica C, et al. Near-infrared nitrofluorene substitued aza-boron-dipyrromethenes dyes[J]. Organic Letters, 2011, 13(1): 22-25. DOI:10.1021/ol102701v |
| [61] | Jiao L, Wu Y, Wang S, et al. Accessing near-infrared-absorbing BF2-azadipyrromethenes via a push-pull effect[J]. The Journal of Organic Chemistry, 2014, 79(4): 1830-1835. |
| [62] | Jiang X D, Guan J, Zhao J L, et al. Synthesis, structure and photophysical properties of NIR aza-BODIPY with -F/-N3/-NH2 groups at 1, 7-positions[J]. Dyes and Pigments, 2017, 136: 619-626. DOI:10.1016/j.dyepig.2016.09.019 |
| [63] | Kim T, Park S, Choi Y, et al. A BODIPY-based probe for the selective detection of hypochlorous acid in living cells[J]. Chemistry-An Asian Journal, 2011, 6(6): 1358-1361. |
| [64] | Kim D, Yamamoto K, Ahn K H. A BODIPY-based reactive probe for ratio-metric fluorescence sensing of mercury ions[J]. Tetrahedron, 2012, 68: 5279-5282. DOI:10.1016/j.tet.2012.01.091 |
| [65] | Ahrens J, Bo?ker B, Brandhorst K, et al. Sulfur-bridged BODIPY dyemers[J]. Chemistry:A European Journal, 2013, 19(34): 11382-11395. DOI:10.1002/chem.201300893 |
| [66] | Jiang X D, Liu X, Fang T, et al. Synthesis and application of methylthio-substituted BODIPY/aza-BODIPY[J]. Dyes and Pigments, 2017, 146: 438-444. DOI:10.1016/j.dyepig.2017.07.038 |
| [67] | Gorman A, Killoran J, O'Shea C, et al. Vitro demonstration of the heavy-atom effect for photodynamic therapy[J]. Journal of the American Chemical Society, 2004, 126(34): 10619-10631. DOI:10.1021/ja047649e |
| [68] | Jiang X D, Kakuda K, Matsukawa S, et al. Synthesis and application of a bidentate ligand based on decafluoro-3-phenyl-3-pentanol:steric effect of pentafluoroethyl groups on the stereomutation of O-equatorial C-apical spirophosphoranes[J]. Chemistry-An Asian Journal, 2007, 2(2): 314-323. |
| [69] | Jiang X D, Matsukawa S, Yamamichi H, et al. First isolation and kinetic study of hypervalent 10-As-5 organoarsenic compounds with a C-apical, O-equatorial configuration[J]. Inorganic Chemistry, 2007, 46(14): 5480-5482. DOI:10.1021/ic700678a |
| [70] | Jiang X D, Matsukawa S, Kojima S, et al. Synthesis and characterization of antiapicophilic arsoranes and related compounds[J]. Inorganic Chemistry, 2012, 51(20): 10996-11006. DOI:10.1021/ic3014893 |
| [71] | Jiang X D, Zhao J L, Xi D M, et al. A new water-soluble phosphorus-dipyrromethene and phosphorus-azadipyrromethene dye:PODIPY/aza-PODIPY[J]. Chemistry:A European Journal, 2015, 21(16): 6079-6082. DOI:10.1002/chem.201406535 |
| [72] | Jiang X D, Zhang J, Furuyama T, et al. Development of mono- and di-AcO substituted BODIPY on the boron center[J]. Organic Letters, 2012, 14(1): 248-251. DOI:10.1021/ol2030229 |
| [73] | Jiang X D, Fang T, Liu X, et al. Synthesis of meso-CF3-substituted BODIPY compounds with redshifted absorption[J]. European Journal of Organic Chemistry, 2017, 2017(34): 5074-5079. DOI:10.1002/ejoc.201700800 |
| [74] | Zheng Q, Xu G, Prasad P N. Conformationally restricted dipyrromethene boron difluoride (BODIPY) dyes:highly fluorescent, multicolored probes for cellular imaging[J]. Chemistry:A European Journal, 2008, 14(19): 5812-5819. DOI:10.1002/chem.200800309 |
| [75] | Wang D, Shiraishi Y, Hirai T. A distyryl BODIPY derivative as a fluorescent probe for selective detection of chrom-ium(Ⅲ)[J]. Tetrahedron Letters, 2010, 51(18): 2545-2549. DOI:10.1016/j.tetlet.2010.03.013 |
| [76] | Chen J, Burghart A. 4, 4-Difluoro-4-bora-3a, 4a-diaza-s-indacene (BODIPY) dyes modified for extended conjugation and restricted bond rotations[J]. The Journal of Organic Chemistry, 2000, 65(10): 2900-2906. DOI:10.1021/jo991927o |
| [77] | Leen V, Qin W, Yang W, et al. Synthesis, spectroscopy, crystal structure determination, and quantum chemical calculations of BODIPY dyes with increasing conformational restriction and concomitant red-shifted visible absorption and fluorescence spectra[J]. Chemistry-An Asian Journal, 2010, 5(9): 2016-2026. DOI:10.1002/asia.201000248 |
| [78] | Jiang X D, Liu X, Fang T, et al. Synthesis and photophysical properties of long wavelength absorbing BODIPY/aza-BODIPY bearing a five-membered ring[J]. Tetrahedron Letters, 2018, 59: 546-549. DOI:10.1016/j.tetlet.2018.01.002 |
| [79] | Niu L Y, Guan Y S, Chen Y Z, et al. BODIPY-based ratiometric fluorescent sensor for highly selective detection of glutathione over cysteine and homocysteine[J]. Journal of the American Chemical Society, 2012, 134(46): 18928-18931. DOI:10.1021/ja309079f |
| [80] | Niu L Y, Chen Y Z, Zheng H R, et al. Design strategies of fluorescent probes for selective detection among biothiols[J]. Chemical Society Reviews, 2015, 44(17): 6143-6160. DOI:10.1039/C5CS00152H |
| [81] | Jiang X D, Yue S, Jia L, et al. NIR fluorescent azaBODIPY-based probe for the specific detection of L-Lysine[J]. Chemistr Select, 2018, 3(26): 7581-7585. |
| [82] | Kabil O, Banerjee R. Redox biochemistry of hydrogen sulfide[J]. Journal of Biological Chemistry, 2010, 285: 21903-21907. DOI:10.1074/jbc.R110.128363 |
| [83] | Lippert A R, New E J, Chang C J. Reaction-based fluorescent probes for selective imaging of hydrogen sulfide in living cells[J]. Journal of the American Chemical Society, 2011, 133: 10078-10080. DOI:10.1021/ja203661j |
| [84] | Peng H, Cheng Y, Dai C, et al. A fluorescent probe for fast and quantitative detection of hydrogen sulfide in blood[J]. Angewandte Chemie International Edition, 2011, 50: 9672-9675. DOI:10.1002/anie.201104236 |
| [85] | Liu C, Pan J, Li S, et al. Capture and visualization of hydrogen sulfide by a fiuorescent probe[J]. Angewandte Chemie International Edition, 2011, 50: 10327-10329. DOI:10.1002/anie.201104305 |
| [86] | Fang T, Jiang X D, Sun C L, et al. BODIPY-based naked-eye fluorescent on-off probe with high selectivity for H2S based on thiolysis of dinitrophenyl ether[J]. Sensors & Actuators:B. Chemical, 2019, 290: 551-557. |
| [87] | Majumdar P, Yuan X, Li S, et al. Cyclometalated Ir(Ⅲ) complexes with styryl-BODIPY ligands showing near IR absorption/emission:preparation, study of photophysical properties and application as photodynamic/luminescence imaging materials[J]. Journal of Materials Chemistry B, 2014, 2: 2838-2854. DOI:10.1039/C4TB00284A |
| [88] | Jiang X D, Zhang T J, Sun C L, et al. Synthesis of aza-BODIPY dyes bearing the naphthyl groups at 1, 7-positions and application for singlet oxygen generation[J]. Chinese Chemical Letters, 2019, 30: 1055-1058. DOI:10.1016/j.cclet.2019.02.016 |
| [89] | Yu C, Jiao L, Hao E, et al. A family of highly fluorescent and unsymmetric bis(BF2) chromophore containing both pyrrole and N-heteroarene derivatives:BOPPY[J]. Organic Letters, 2018, 20(15): 4462-4466. DOI:10.1021/acs.orglett.8b01752 |
| [90] | Jiang X D, Yue S, Chen K P, et al. Synthesis, properties and application of novel 5, 6, 5, 6-tetracyclic pyrazine/pyrrole-fused unsymmetric bis(BF2) fluorescent dyes:BOPYPYs[J]. Chinese Chemical Letters, 2019, 30: 2271-2273. DOI:10.1016/j.cclet.2019.07.027 |
| [91] | Michel B W, Lippert A R, Chang C J. A reaction-based fluorescent probe for selective imaging of carbon monoxide in living cells using a palladium-mediated carbonylation[J]. Journal of the American Chemical Society, 2012, 134(38): 15668-15671. DOI:10.1021/ja307017b |
| [92] | Yang D, Wong M K, Yan Z. Regioselective intramolecular oxidation of phenols and anisoles by dioxiranes generated in situ[J]. The Journal of Organic Chemistry, 2000, 65(13): 4179-4184. DOI:10.1021/jo000458j |
| [93] | Yang D, Wang H L, Sun Z N, et al. A highly selective fluorescent probe for the detection and imaging of peroxynitrite in living cells[J]. Journal of the American Chemical Society, 2006, 128(18): 6004-6005. DOI:10.1021/ja0603756 |
| [94] | Sun Z N, Wang H L, Liu F Q, et al. BODIPY-based fluorescent probe for peroxynitrite detection and imaging in living cells[J]. Organic Letters, 2009, 11(9): 1887-1890. DOI:10.1021/ol900279z |
| [95] | Ge Y, O'Shea F D. Azadipyrromethenes:from traditional dye chemistry to leading edge applications[J]. Chemical Society Reviews, 2016, 45(14): 3846-3864. DOI:10.1039/C6CS00200E |
