0 引言
【研究意义】玉米是我国重要的粮食作物、饲料来源及轻工业加工原料,在国民经济及农业生产中占有重要地位。玉米果穗在田间生长过程中会遭遇病原真菌的侵染,造成部分果穗发生穗腐病,表现为籽粒、穗轴或整个果穗霉变,使发病籽粒携带大量病原菌[1,2,3,4]。发病籽粒收获后,由于含水量较高或贮藏不当等原因,容易造成周围籽粒腐烂,导致玉米品质劣变[5,6]。不仅如此,病原真菌在生长代谢过程中还会产生伏马毒素、黄曲霉毒素等多种霉菌毒素,造成食用者中毒[7]。而且玉米籽粒作为主要的饲料来源,真菌污染导致饲料适口性及营养价值降低,牲畜中毒或死亡,也会造成水产品、乳及乳制品、肉类等农副产品连锁性污染[8,9,10,11,12],据美国食品和药物管理局的调查表明,全球25%的饲料及饲料原料受到真菌毒素的污染[13]。有些果穗或籽粒表面无明显病害症状,但这并不代表其不携带病菌。由于玉米的营养物质较为丰富,同时其胚芽大、吸湿性较强,若晾晒不彻底或贮藏环境湿度较大,当温度合适时,也可能会引起籽粒表面或内部潜藏真菌快速、大量繁殖,引起周围籽粒发生霉变。因此,检测玉米籽粒带菌量及病菌种类并提出预防措施,对玉米安全生产具有重要意义。【前人研究进展】真菌毒素是产毒真菌的次级代谢产物,许多研究将关注点放在真菌毒素,从而忽视了对真菌的研究,真菌与真菌毒素并非一一对应,一种真菌可产生多种真菌毒素,一种毒素也可能由多种真菌产生,因此不能从毒素推测真菌种类。真菌侵染不仅发生在玉米的开花、结果、成熟、收获过程中,也发生在玉米籽粒晾晒、收购、加工、贮藏、运输等过程[14]。国内外对完熟期与贮藏期玉米籽粒带菌检测的研究较多,对收获前期籽粒带菌检测的研究较少。MANNAA等[15,16]对收获前后有害真菌和真菌毒素的危害以及控制策略进行了综述,并对收获前期、收获时、贮藏期真菌群落的种类进行了统计分析,发现玉米籽粒在不同阶段携带真菌群落种类以及数量会发生改变;LACEY[17]研究发现,玉米果穗于吐丝期开始就会受到真菌感染,乳熟期以后若虫害发生会加重感染,且收获前和收获后镰孢菌与黄曲霉对玉米果穗危害较大。许多研究表明,镰孢菌(Fusarium spp.)为玉米穗腐病的主要致病菌,同时也是玉米种子或籽粒携带的优势菌群[18,19,20,21,22]。MARCO等[7]对墨西哥27个贮藏期玉米样本进行带菌检测,发现镰孢菌的分离比例较大,为32%;曲晓丽等[18]对从农户收集的88份玉米籽粒进行带菌检测,发现镰孢菌为优势菌属,同时青霉菌(Penicillium spp.)、曲霉菌(Aspergillus spp.)、黑孢菌(Nigrospora spp.)、木霉菌(Trichoderma spp.)的分离频率亦较高;郭聪聪等[19]采集2011—2012年间甘肃省5个地区的225 份玉米籽粒样本进行了镰孢菌的分离、鉴定,共分离出516株镰孢菌,其中轮枝镰孢(F. verticillioides)为优势病原菌。我国对玉米种子带菌检测的研究较多,马奇样等[23]对500粒种子洗涤检查发现,寄藏于种子的真菌孢子数量大,分布普遍;罗晓杨等[20]采用平板培养法、冷冻滤纸法对24份玉米生产品种进行了种子带菌检测,结果表明玉米种子主要携带镰孢菌,其次为曲霉菌和青霉菌。【本研究切入点】玉米在生长过程中果穗会遭遇大量病原菌的侵染而发生穗腐病,但是未出现病症的籽粒表面及内部携带病原菌的种类以及数量还未见报道。迄今为止,我国对农作物真菌污染的研究主要是取作物收获后或贮藏期的籽粒作为样本,缺少对于收获前真菌检测的研究,且取样并非表面完全无病症的籽粒。【拟解决的关键问题】对黄淮海夏玉米区乳熟期及完熟期的表面无病症籽粒进行带菌检测,明确玉米籽粒在不同熟期的带菌情况,为玉米安全生产、贮藏、加工与检疫提供依据与参考。1 材料与方法
1.1 试验材料
试验材料为笔者实验室2017年采集的黄淮海夏玉米区玉米穗样本,分别于玉米乳熟期、完熟期在河北省(29个)、河南省(26个)、山东省(27个)、安徽省(8个)4个省共90个市/县进行采样。品种为郑单958,每个地区选择无明显病虫害发生的地块,每个地块去除4行边行,中间区域每隔10 m采集1个未发生病虫害、果穗饱满的玉米穗,每个地区分别于乳熟期和完熟期各取4个果穗,共计720个果穗样本。具体采样时间见表1。Table 1
表1
表1采样地区与时间
Table 1Sampling spot and time
| 省份 Province | 乳熟期采样时间 Sampling time of milk-ripening stage | 完熟期采样时间 Sampling time of full-ripening stage |
|---|---|---|
| 河北Hebei | 2017-09-07—2017-09-09 | 2017-09-23—2017-09-25 |
| 河南Henan | 2017-09-01—2017-09-03 | 2017-09-18—2017-09-20 |
| 山东Shandong | 2017-09-04—2017-09-07 | 2017-09-21—2017-09-23 |
| 安徽Anhui | 2017-09-04 | 2017-09-20 |
新窗口打开
1.2 试验方法
1.2.1 样品采集与保存 取样时连同苞叶一起取下,用灭菌后的吸水纸包裹严实,乳熟期果穗由于含水量较高,取下后置于装有冰袋的泡沫盒内,以便运输途中保存。成熟期果穗含水量较低,直接用灭菌后的吸水纸包好后置于泡沫盒中保存运输。1.2.2 籽粒外部带菌种类及带菌量检测 带菌检测时需要对每个市/县采集的乳熟期与完熟期的各4个果穗进行检测,将每个玉米穗全部脱粒,籽粒充分混匀后从中随机取10粒置于50 mL离心管中,加入10 mL灭菌水,用斡旋振荡器充分振荡10 min,2 000 r/min 离心10 min,倒去上清液,加5 mL无菌水均匀悬浮后取出适当体积用无菌水进行系列梯度稀释,稀释梯度分别为10、50、100倍,每个稀释梯度菌悬液吸取100 μL均匀涂抹到直径9 cm的PDA平板上(PDA中加适量乳酸抑制细菌),20℃恒温箱中黑暗条件下培养观察,5 d后观察平板上的菌落,根据菌落的培养性状和形态特征,参考文献[24,25]对孢子进行识别与鉴定,根据菌落总数和稀释倍数计算孢子负荷量以及各菌属的分离比例。
孢子负荷量(个/粒)=菌落总数×稀释倍数/10粒
某类菌分离比例(%)=(某类真菌菌落个数/菌落总数)×100
1.2.3 籽粒内部带菌种类及带菌量检测 籽粒内部带菌检测采用美国国家种子健康体系(National Seed Health System,NSHS)建议的PDA平板法[26],每个玉米穗检测10粒。将籽粒外部检测时的10个玉米籽粒置于2%的次氯酸钠溶液中消毒10 min,用无菌水冲洗3次,置于灭菌滤纸上,于超净台中吹干表面游离水;然后将籽粒均匀摆放在直径为9 cm的PDA平板上,每皿10粒;26℃恒温箱中12 h光照/12 h黑暗培养,5 d后镜检,计算籽粒带菌率以及分离到的各菌属的分离频率。
籽粒带菌率(%)=(带菌籽粒数/检测籽粒总数)×100
某类菌分离频率(%)=(带某类菌籽粒数/带菌籽粒总数)×100
1.2.4 病原菌鉴定 将内部检测分离到的真菌转移到新的PDA培养基进行纯化培养,根据病原菌的菌落形态,以及分生孢子的有无、大小、形态等特征对分离到的病原菌进行初步鉴定[24,25]。提取病原菌基因组DNA并进行PCR扩增,扩增引物为通用引物ITS1(TC CGTAGGTGAACCTGCGG)与ITS4(TCCTCCGCTT ATTGATATGC)、EF1(ATGGGTAAGGARGACAAG AC)与EF2(GGARGTACCAGTSATCATGTT),PCR反应体系:2×Es Taq Master Mix 12.5 μL,10 μmol·L-1的上游引物和下游引物各0.5 μL,模板DNA 1.0 μL,ddH2O 10.5 μL。PCR程序:95℃预变性10 min;95℃变性1 min,53℃退火30 s(退火温度视引物而定),72℃延伸45 s,共38个循环;72℃延伸10 min,4℃保存扩增产物。扩增产物用1%琼脂糖凝胶电泳检测,由生工生物工程(上海)股份有限公司测序,测序结果于NCBI网站进行Blast比对。
1.3 数据处理
利用Excel 2010对试验数据进行分析整理。将不同地区计算得来的所有果穗样本的孢子负荷量和籽粒带菌率以及检测分离到的各真菌的分离频率进行数据录入,并计算不同地区各时期4个果穗检测结果的平均值。2 结果
2.1 不同地区玉米籽粒的带菌量
对黄淮海夏玉米区玉米籽粒内部及外部带菌量进行统计分析,图1为籽粒内部及外部带菌检测结果。每个地区取4个果穗籽粒带菌率及孢子负荷量的平均值(表2),结果显示,试验样本籽粒带菌量均较大,不同地区采集的乳熟期籽粒的孢子负荷量在0—1 886个/粒,均值为439个/粒;籽粒带菌率在0—65.0%,均值为23.6%;不同地区采集的完熟期籽粒的孢子负荷量在18—2 658个/粒,均值为942个/粒;籽粒带菌率在10.0%—100.0%,均值为59.6%。乳熟期与完熟期的籽粒带菌率与孢子负荷量差异均较大,检测的90个地区中,86个地区完熟期籽粒的孢子负荷量大于乳熟期籽粒的孢子负荷量,87个地区完熟期籽粒带菌率大于乳熟期籽粒带菌率。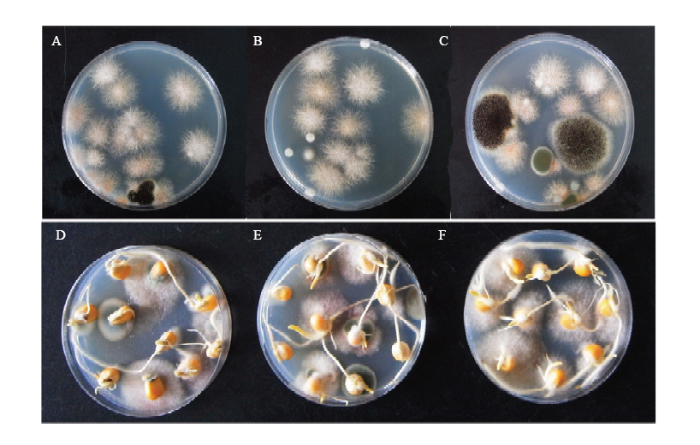 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1籽粒带菌检测图片
A—C:玉米籽粒外部带菌检测图片The external detection of maize grains;D—F:玉米籽粒内部带菌检测图片The internal detection of maize grains
-->Fig. 1Pictures of the detection of fungi carried by maize grain
-->
Table 2
表2
表2不同地区籽粒带菌结果
Table 2Results of grain carrying fungi in different areas
| 编号 Number | 省 Province | 市/县 City/County | 籽粒带菌率Rate of grains with fungi (%) | 孢子负荷量(个/粒)Spore load | ||
|---|---|---|---|---|---|---|
| 乳熟期 Milk-ripening stage | 完熟期 Full-ripening stage | 乳熟期 Milk-ripening stage | 完熟期 Full-ripening stage | |||
| 1 | 河北Hebei | 武强Wuqiang | 10.0 | 52.5 | 75 | 33 |
| 2 | 河北Hebei | 涿州Zhuozhou | 2.5 | 55.0 | 1448 | 2160 |
| 3 | 河北Hebei | 万全Wanquan | 47.5 | 47.5 | 188 | 228 |
| 4 | 河北Hebei | 昌黎Changli | 2.5 | 40.0 | 34 | 128 |
| 5 | 河北Hebei | 怀来Huailai | 5.0 | 47.5 | 0 | 83 |
| 6 | 河北Hebei | 滦平Luanping | 47.5 | 87.5 | 1064 | 1123 |
| 7 | 河北Hebei | 廊坊Langfang | 15.0 | 85.0 | 90 | 1780 |
| 8 | 河北Hebei | 平泉Pingquan | 35.0 | 77.5 | 240 | 1895 |
| 9 | 河北Hebei | 玉田Yutian | 32.5 | 75.0 | 604 | 863 |
| 10 | 河北Hebei | 故城Gucheng | 32.5 | 87.5 | 202 | 538 |
| 11 | 河北Hebei | 鹿泉Luquan | 5.0 | 72.5 | 1020 | 1278 |
| 12 | 河北Hebei | 沧州Cangzhou | 12.5 | 60.0 | 324 | 425 |
| 13 | 河北Hebei | 定兴Dingxing | 17.5 | 65.0 | 54 | 70 |
| 14 | 河北Hebei | 衡水Hengshui | 7.5 | 75.0 | 636 | 938 |
| 15 | 河北Hebei | 赵县Zhaoxian | 12.5 | 80.0 | 330 | 823 |
| 16 | 河北Hebei | 邢台Xingtai | 2.5 | 40.0 | 174 | 265 |
| 17 | 河北Hebei | 藁城Gaocheng | 16.0 | 42.5 | 77 | 313 |
| 18 | 河北Hebei | 蠡县Lixian | 37.5 | 50.0 | 984 | 1303 |
| 19 | 河北Hebei | 高阳Gaoyang | 17.5 | 42.5 | 66 | 288 |
| 20 | 河北Hebei | 大明Daming | 22.5 | 52.5 | 708 | 1263 |
| 21 | 河北Hebei | 肃宁Suning | 0.0 | 47.5 | 260 | 1453 |
| 22 | 河北Hebei | 成安Cheng’an | 7.5 | 65.0 | 86 | 1845 |
| 23 | 河北Hebei | 无极Wuji | 52.5 | 57.5 | 14 | 1008 |
| 24 | 河北Hebei | 鸡泽Jize | 15.0 | 50.0 | 68 | 1520 |
| 25 | 河北Hebei | 新乐Xinle | 5.0 | 37.5 | 642 | 648 |
| 26 | 河北Hebei | 河间Hejian | 20.0 | 50.0 | 64 | 1260 |
| 27 | 河北Hebei | 满城Mancheng | 42.5 | 55.0 | 36 | 78 |
| 28 | 河北Hebei | 望都Wangdu | 30.0 | 70.0 | 12 | 793 |
| 29 | 河北Hebei | 深州Shenzhou | 5.0 | 67.5 | 64 | 1183 |
| 30 | 河南Henan | 睢阳Suiyang | 2.5 | 52.5 | 28 | 265 |
| 31 | 河南Henan | 新郑Xinzheng | 27.5 | 100.0 | 2 | 275 |
| 32 | 河南Henan | 汝阳Ruyang | 20.0 | 57.5 | 112 | 360 |
| 33 | 河南Henan | 温县Wenxian | 25.0 | 97.5 | 88 | 573 |
| 34 | 河南Henan | 淇县Qixian | 10.0 | 72.5 | 42 | 168 |
| 35 | 河南Henan | 南阳Nanyang | 5.0 | 95.0 | 4 | 643 |
| 36 | 河南Henan | 鹤壁Hebi | 47.5 | 87.5 | 370 | 453 |
| 37 | 河南Henan | 驻马店Zhumadian | 47.5 | 52.5 | 78 | 545 |
| 38 | 河南Henan | 淮阳Huaiyang | 37.5 | 100.0 | 368 | 18 |
| 续表2 Continued Table 2 | ||||||
| 编号 Number | 省 Province | 市/县 City/County | 籽粒带菌率Rate of grains with fungi (%) | 孢子负荷量(个/粒)Spore load | ||
| 乳熟期 Milk-ripening stage | 完熟期 Full-ripening stage | 乳熟期 Milk-ripening stage | 完熟期 Full-ripening stage | |||
| 39 | 河南Henan | 遂平Suiping | 10.0 | 97.5 | 492 | 867 |
| 40 | 河南Henan | 夏邑Xiayi | 60.0 | 82.5 | 452 | 1208 |
| 41 | 河南Henan | 焦作Jiaozuo | 37.5 | 92.5 | 106 | 1503 |
| 42 | 河南Henan | 漯河Luohe | 35.0 | 70.0 | 970 | 1910 |
| 43 | 河南Henan | 通许Tongxu | 20.0 | 48.0 | 160 | 2252 |
| 44 | 河南Henan | 平顶山Pingdingshan | 32.5 | 52.5 | 1410 | 2290 |
| 45 | 河南Henan | 内黄Neihuang | 22.5 | 45.0 | 160 | 783 |
| 46 | 河南Henan | 襄县Xiangxian | 15.0 | 77.5 | 1056 | 2658 |
| 47 | 河南Henan | 洛阳Luoyang | 32.5 | 70.0 | 1320 | 2638 |
| 48 | 河南Henan | 太康Taikang | 60.0 | 62.5 | 266 | 600 |
| 49 | 河南Henan | 邓州Dengzhou | 65.0 | 85.0 | 1632 | 1850 |
| 50 | 河南Henan | 原阳Yuanyang | 55.0 | 60.0 | 1074 | 1498 |
| 51 | 河南Henan | 滑县Huaxian | 30.0 | 47.5 | 846 | 953 |
| 52 | 河南Henan | 南乐Nanle | 12.5 | 47.5 | 920 | 1233 |
| 53 | 河南Henan | 商丘Shangqiu | 2.5 | 42.5 | 776 | 995 |
| 54 | 河南Henan | 辉县Huixian | 53.3 | 45.0 | 812 | 1185 |
| 55 | 河南Henan | 新乡Xinxiang | 22.5 | 45.0 | 156 | 400 |
| 56 | 山东Shandong | 德州Dezhou | 16.0 | 70.0 | 264 | 1038 |
| 57 | 山东Shandong | 嘉祥Jiaxiang | 30.0 | 52.5 | 770 | 808 |
| 58 | 山东Shandong | 莘县Shenxian | 47.5 | 55.0 | 621 | 805 |
| 59 | 山东Shandong | 莱州Laizhou | 27.5 | 47.5 | 302 | 660 |
| 60 | 山东Shandong | 章丘Zhangqiu | 20.0 | 52.5 | 640 | 1363 |
| 61 | 山东Shandong | 菏泽Heze | 32.5 | 45.0 | 339 | 1240 |
| 62 | 山东Shandong | 泰安Taian | 12.5 | 85.0 | 430 | 418 |
| 63 | 山东Shandong | 冠县Guanxian | 5.0 | 62.5 | 230 | 812 |
| 64 | 山东Shandong | 莱阳Laiyang | 0.0 | 77.5 | 1550 | 1836 |
| 65 | 山东Shandong | 青岛Qingdao | 22.5 | 45.0 | 613 | 932 |
| 66 | 山东Shandong | 临沂Linyi | 15.0 | 65.0 | 333 | 350 |
| 67 | 山东Shandong | 济阳Jiyang | 55.0 | 85.0 | 418 | 444 |
| 68 | 山东Shandong | 齐河Qihe | 50.0 | 72.5 | 410 | 936 |
| 69 | 山东Shandong | 曲阜Qufu | 25.0 | 57.5 | 270 | 366 |
| 70 | 山东Shandong | 诸城Zhucheng | 15.0 | 92.5 | 443 | 408 |
| 71 | 山东Shandong | 平度Pingdu | 20.0 | 32.5 | 86 | 635 |
| 72 | 山东Shandong | 宁津Ningjin | 30.0 | 47.5 | 456 | 1043 |
| 73 | 山东Shandong | 莒县Juxian | 12.5 | 47.5 | 34 | 2228 |
| 74 | 山东Shandong | 郓城Yuncheng | 27.5 | 20.0 | 306 | 850 |
| 75 | 山东Shandong | 滨州Binzhou | 42.5 | 62.5 | 12 | 605 |
| 76 | 山东Shandong | 平原Pingyuan | 27.5 | 42.5 | 882 | 978 |
| 77 | 山东Shandong | 聊城Liaocheng | 20.0 | 45.0 | 204 | 520 |
| 续表2 Continued Table 2 | ||||||
| 编号 Number | 省 Province | 市/县 City/County | 籽粒带菌率Rate of grains with fungi (%) | 孢子负荷量(个/粒)Spore load | ||
| 乳熟期 Milk-ripening stage | 完熟期 Full-ripening stage | 乳熟期 Milk-ripening stage | 完熟期 Full-ripening stage | |||
| 78 | 山东Shandong | 济宁Jining | 20.0 | 42.5 | 1886 | 1948 |
| 79 | 山东Shandong | 茌平Chiping | 7.5 | 35.0 | 340 | 405 |
| 80 | 山东Shandong | 平邑Pingyi | 37.5 | 65.0 | 528 | 1308 |
| 81 | 山东Shandong | 临朐Linqu | 8.0 | 52.0 | 404 | 788 |
| 82 | 山东Shandong | 潍坊Weifang | 12.0 | 26.0 | 34 | 453 |
| 83 | 安徽Anhui | 阜阳Fuyang | 12.0 | 34.0 | 146 | 553 |
| 84 | 安徽Anhui | 泗县Sixian | 48.0 | 40.0 | 696 | 1233 |
| 85 | 安徽Anhui | 立辛Lixin | 18.0 | 64.0 | 224 | 775 |
| 86 | 安徽Anhui | 蒙城Mengcheng | 2.0 | 70.0 | 1250 | 1320 |
| 87 | 安徽Anhui | 濉溪Suixi | 6.0 | 70.0 | 18 | 308 |
| 88 | 安徽Anhui | 蚌埠Bengbu | 4.0 | 10.0 | 628 | 1458 |
| 89 | 安徽Anhui | 界首Jieshou | 40.0 | 54.0 | 284 | 290 |
| 90 | 安徽Anhui | 宿州Suzhou | 6.0 | 22.0 | 206 | 960 |
| 均值Average | 23.6 | 59.6 | 439 | 942 | ||
新窗口打开
同一地区的籽粒带菌率与孢子负荷量并未发现具有明显的相关性,以完熟期为例,安徽省蚌埠玉米籽粒带菌率仅为10.0%,而孢子负荷量却高达1 458个/粒;河南省新郑玉米籽粒带菌率为100.0%,籽粒表面的孢子负荷量仅为275个/粒。
不同省份和地区的玉米籽粒带菌情况不同。以完熟期为例,河南省睢阳市、新郑市玉米籽粒的带菌率达100.0%,山东省诸城、河北省滦平玉米籽粒的带菌率分别为92.3%和87.5%,而安徽省蚌埠、河南省商丘、山东省郓城、河北省新乐的籽粒带菌率较少,分别为10.0%、42.5%、20.0%和37.5%;河南省襄县、山东省莒县和河北省涿州市玉米籽粒的孢子负荷量分别为2 658、2 228和2 160个/粒,河南省淮阳、山东省临沂市和河北省武强县完熟期玉米籽粒的孢子负荷量较少,分别为18、350和33个/粒。不同省份总体带菌量也有差异,4个省份中乳熟期及完熟期孢子负荷量由大到小依次为河南、山东、河北、安徽。4个省份乳熟期籽粒带菌率由大到小依次为河南、山东、河北、安徽,完熟期籽粒带菌率由大到小依次为河南、河北、山东、安徽。
2.2 玉米籽粒携带病原菌的种类
2.2.1 玉米籽粒外部携带病原菌的种类 经检测玉米籽粒外部主要携带真菌有镰孢菌、青霉菌、曲霉菌、链格孢菌(Alternaria spp.)、木霉菌、根霉菌(Rhizopus spp.)、毛霉菌(Mucor spp.)、蠕孢菌(Hel-minthosporium spp.)等;镰孢菌的分离比例最大,其次是青霉菌,再次为曲霉菌。不同省份孢子负荷量及外部携带镰孢菌、青霉菌、曲霉菌的分离比例见表3。乳熟期镰孢菌的分离比例在53.7%—62.6%,均值为59.1%,青霉菌和曲霉菌的分离比例较小,分别在6.5%—13.8%与0—1.9%,均值分别为8.9%与0.7%。完熟期籽粒外部镰孢菌分离比例最大,在58.7%—83.3%,均值为71.9%;青霉菌分离比例次之,在11.6%—22.9%,均值为17.0%;曲霉菌分离比例在0.2%—2.2%,均值为0.9%。4个省份中,山东省镰孢菌所占分离比例最大,为83.3%,曲霉菌分离比例偏大,为2.2%。Table 3
表3
表3不同省份玉米籽粒外部携带主要真菌的分离比例
Table 3The isolation rate of main fungi in external testing of maize grains from different provinces
| 省份 Province | 乳熟期分离比例 Isolation rate at milk-ripening stage (%) | 完熟期分离比例 Isolation rate at full-ripening stage (%) | ||||||
|---|---|---|---|---|---|---|---|---|
| 孢子负荷量 (个/粒) Spore load | 镰孢菌 Fusarium spp. | 青霉菌 Penicillium spp. | 曲霉菌 Aspergillus spp. | 孢子负荷量 (个/粒) Spore load | 镰孢菌 Fusarium spp. | 青霉菌 Penicillium spp. | 曲霉菌 Aspergillus spp. | |
| 河北Hebei | 330 | 58.5 | 6.5 | 0.6 | 882 | 58.7 | 22.9 | 0.9 |
| 河南Henan | 527 | 62.6 | 8.6 | 0.2 | 1082 | 75.8 | 13.6 | 0.3 |
| 山东Shandong | 474 | 61.4 | 6.5 | 1.9 | 895 | 83.3 | 11.6 | 2.2 |
| 安徽Anhui | 432 | 53.7 | 13.8 | 0 | 862 | 69.7 | 19.9 | 0.2 |
| 均值Average | 441 | 59.1 | 8.9 | 0.7 | 930 | 71.9 | 17.0 | 0.9 |
新窗口打开
2.2.2 玉米籽粒内部主要病菌类群的种类鉴定及出现频率 通过对360份完熟期玉米穗样本内部带菌检测,发现镰孢菌、青霉菌、曲霉菌的分离频率较大,对其进行纯化培养,并经过形态学和分子生物学方法鉴定病原菌种类及分离频率(表4),发现优势菌属为镰孢菌属,主要分离到轮枝镰孢、层出镰孢(F. proliferatum)、禾谷镰孢(F. graminearum),其中轮枝镰孢所占分离频率最高,平均分离频率为29.7%,层出镰孢次之,平均分离频率为25.9%,禾谷镰孢分离频率较低,平均分离频率仅1.3%。青霉菌主要为绳状青霉(P. funiculosum)和草酸青霉(P. oxalicum),分离频率分别为5.0%和3.6%,除安徽省外,其余3省草酸青霉分离频率均大于绳状青霉,安徽省未分离到草酸青霉,仅分离到绳状青霉。曲霉菌主要为黄曲霉(A. flavus)和黑曲霉(A. niger),分离频率分别为1.4%和1.2%。黄曲霉产生黄曲霉毒素具有致癌性,河北省黄曲霉的分离比例最低,为0.6%,安徽省黄曲霉的分离比例较高,为2.0%。除镰孢菌、青霉菌、曲霉菌外,还检测到其他真菌,包括非洲哈茨木霉(T. harzianum)、链格孢(A. alternata)、玉米生离蠕孢菌(B. zeicola)、稻黑孢霉(N. oryzae)、紧密帚枝霉(S. strictum)等。
Table 4
表4
表4不同省份玉米籽粒内部分离病原菌种类及分离频率
Table 4The fungi species and isolation frequency inside the maize grains from different provinces (%)
| 省份 Province | 轮枝镰孢 F. verticillioides | 层出镰孢 F. proliferatum | 禾谷镰孢 F. graminearum | 绳状青霉 P. funiculosum | 草酸青霉 P. oxalicum | 黄曲霉 A. flavus | 黑曲霉 A. niger | 其他 Others |
|---|---|---|---|---|---|---|---|---|
| 河北Hebei | 23.2 | 23.7 | 0.3 | 3.3 | 4.1 | 0.6 | 2.5 | 42.3 |
| 河南Henan | 35.9 | 22.1 | 3.0 | 3.2 | 5.8 | 1.5 | 1.1 | 27.4 |
| 山东Shandong | 31.4 | 30.1 | 1.7 | 2.1 | 4.5 | 1.3 | 1.1 | 27.8 |
| 安徽Anhui | 28.1 | 27.5 | 0.0 | 11.5 | 0.0 | 2.0 | 0.0 | 30.9 |
| 均值Average | 29.7 | 25.9 | 1.3 | 5.0 | 3.6 | 1.4 | 1.2 | 32.1 |
新窗口打开
2.2.3 玉米籽粒内部主要病原菌的分离频率 经检测玉米籽粒内部主要携带真菌有镰孢菌、青霉菌、曲霉菌、链格孢菌、木霉菌、根霉菌、稻黑孢菌、帚枝霉菌、毛霉菌、蠕孢菌等。不同省份籽粒带菌率及内部携带镰孢菌、青霉菌、曲霉菌的分离频率见表5。结果显示镰孢菌的分离频率最大,青霉菌次之,曲霉菌最低,与籽粒外部带菌种类检测结果一致。乳熟期镰孢菌的分离频率在25.2%—43.7%,完熟期镰孢菌的分离频率在49.2%—65.2%,其中山东省完熟期镰孢菌的分离频率最大,为65.2%;乳熟期青霉菌的分离频率在4.0%—8.9%,完熟期青霉菌分离频率在7.6%—11.8%,安徽省完熟期青霉菌分离频率最大,为11.8%;曲霉菌在乳熟期与完熟期的分离频率分别在1.3%—3.1%与2.0%—3.1%,河北省乳熟期曲霉菌分离频率最大,为3.1%。
Table 5
表5
表5不同省份玉米籽粒内部携带主要真菌的分离频率
Table 5The isolation frequency of main fungi inside the maize grains from different provinces (%)
| 省份 Province | 乳熟期分离频率 Isolation frequency at milk-ripening stage | 完熟期分离频率 Isolation frequency at full-ripening stage | ||||||
|---|---|---|---|---|---|---|---|---|
| 籽粒带菌率 Rate of grain with fungi | 镰孢菌 Fusarium spp. | 青霉菌 Penicillium spp. | 曲霉菌 Aspergillus spp. | 籽粒带菌率 Rate of grain with fungi | 镰孢菌 Fusarium spp. | 青霉菌 Penicillium spp. | 曲霉菌 Aspergillus spp. | |
| 河北Hebei | 19.3 | 34.6 | 8.9 | 1.3 | 59.8 | 49.2 | 7.9 | 3.1 |
| 河南Henan | 30.3 | 40.7 | 4.0 | 3.1 | 68.7 | 63.0 | 10.0 | 2.7 |
| 山东Shandong | 23.6 | 43.7 | 6.8 | 1.9 | 54.9 | 65.2 | 7.6 | 2.4 |
| 安徽Anhui | 17.0 | 25.2 | 4.0 | 1.3 | 45.5 | 56.6 | 11.8 | 2.0 |
| 均值Average | 22.6 | 36.1 | 6.0 | 1.9 | 57.2 | 58.5 | 9.3 | 2.6 |
新窗口打开
3 讨论
通过对黄淮海夏玉米区90个市/县采集的玉米果穗进行带菌检测,结果表明不同熟期表面无症状籽粒均携带大量病原真菌,主要与病原菌的潜伏性有关。穗腐病是造成玉米籽粒带菌的主要原因,穗部虫害可加重穗腐病的发生,是造成病原菌侵染的重要因素[27,28],穗腐病是玉米生长后期发生的重要病害,由于在玉米生长后期,果穗迅速脱水,苞叶开始松散,病穗上、空气中的真菌孢子可通过气流传播到其他果穗的籽粒表面,因此,表面无症状的果穗上也可能携带大量病原菌。在玉米脱粒过程中,发生穗腐病的籽粒可能会被去除,剩余的无症状籽粒会被进一步加工成饲料等加工品,直接影响人畜安全。因此应加强对玉米籽粒真菌生长的细致性检测与鉴定,加强对玉米的储存方式、温度和湿度等因素良好的控制。玉米乳熟期是籽粒中各种营养物质迅速积累的时期,试验发现,乳熟期玉米籽粒仍有较高的带菌率。河北涿州、河南洛阳、平顶山、邓州、山东莱阳、济宁、安徽蒙城地区乳熟期孢子负荷量均大于1 200个/粒;河北无极、河南夏邑、太康、邓州、原阳、辉县;山东济阳、齐河乳熟期籽粒带菌率在50%以上。其中河南邓州不仅孢子负荷量较大(1 632个/粒),籽粒带菌率也较高(65%),表明病原菌在乳熟期之前就已经侵入,因此穗腐病防治需提前到抽雄吐丝期。在玉米吐丝期可用65%代森锰锌可湿性粉剂400—500倍液喷果穗,预防病原菌的入侵[29]。完熟期籽粒带菌量大于乳熟期,主要是因为玉米主要病害大多发生在生长后期,尤其玉米穗腐病在灌浆期开始发生,乳熟期至蜡熟期表现症状,且多从果穗顶端开始蔓延,逐渐向下侵染[4]。黄淮海地区属于温带季风气候,降雨集中在每年的6—8月份,此时正值夏玉米生长季节,适宜大多真菌的生长,很容易发生穗腐病,随着果穗慢慢成熟,霉菌的数量会逐渐增加,因此完熟期的玉米籽粒带菌量高于乳熟期。
本研究还发现,玉米籽粒内部和外部均携带的真菌种类包括镰孢菌、青霉菌、曲霉菌、链格孢菌、木霉菌、根霉菌、蠕孢菌、毛霉菌,其中镰孢菌、青霉菌、曲霉菌为分离获得的主要真菌。胡晓芬等[21]采用洗涤检测法对7个玉米品种进行了种子表面带菌检测,与本研究所用方法一致,结果表明供试种子表面携带的真菌主要为青霉菌、根霉菌、镰孢菌和链格孢菌,与本研究分离到的真菌种类部分重叠;蒋孟多等[22]采用滤纸培养基法和PDA培养基法同样对这7个玉米品种进行种子内部带菌检测,发现滤纸培养基法在检测过程中由于只有温度和光照条件,导致带菌种类单一,不能准确反应种子带菌情况;采用PDA培养基法,培养5—7 d均出现带菌情况,且带菌种类和带菌量各不相同,因此采用PDA培养基法检测种子内部带菌较好。
分子鉴定研究发现,镰孢菌属中轮枝镰孢为优势菌株,与前人[16,30-32]鉴定结果一致,禾谷镰孢也是引起玉米穗腐病的优势病原菌之一[33],但本研究中禾谷镰孢的分离比例仅为1.3%。轮枝镰孢在玉米上引起的穗腐病主要以粒腐为主,表面危害较小,但对于表面无病症但是带菌量较大的籽粒的危害不容忽视,在后续贮藏工作中,遇到适宜的条件仍可能会发生霉变,产生伏马毒素,伏马毒素是一种霉菌毒素,是由轮枝镰孢产生的代谢产物[34]。青霉菌的分离比例次之,青霉菌产生的展青霉素、桔青霉素、黄绿青霉素、红色青霉毒素等对玉米饲料安全存在威胁。曲霉菌的分离比例最小,但是其产生的黄曲霉毒素具有强烈的致癌、致畸和致突变作用,其毒性是砒霜的68倍,是氰化钾的10倍[35,36],黄曲霉毒素污染较为普遍[37,38,39]。
为了预防玉米籽粒真菌毒素污染,通过培育和种植抗病品种是解决毒素污染最为经济有效的措施。此外通过农艺措施如种植密度不宜过大,保证田间的通风透气,并且可以通过合理灌溉增加土壤湿度,最好在收获前3—5周内适当灌溉,避免遭受干旱胁迫,降低收获前真菌污染。同时应尽量避免由于玉米贮藏不当导致的带菌率高的现象,由于就地贮藏是玉米贮藏普遍采用的一种方法,玉米果穗堆积在一起,较长的一段时间内处于非通风状态,受污染或残留的霉菌会重新繁殖。因此玉米在收获后要进行充分晾晒,使玉米含水量不超过13%,并采用科学的方法安全贮藏。
4 结论
黄淮海夏玉米区玉米籽粒内外带菌量完熟期大于乳熟期,玉米籽粒在乳熟期仍有一定的带菌量,完熟期籽粒带菌量较大。玉米籽粒内部以及外部均携带的真菌有镰孢菌、青霉菌、曲霉菌、链格孢菌、木霉菌、根霉菌、蠕孢菌、毛霉菌,其中镰孢菌、青霉菌、曲霉菌为分离获得的主要真菌,镰孢菌属中轮枝镰孢为优势菌,青霉菌属中绳状青霉和草酸青霉为优势菌,曲霉菌主要为黑曲霉与黄曲霉。不同地区籽粒带菌量不同,河南省的玉米籽粒带菌量较大,安徽省带菌量最小,其余两省差异不明显。The authors have declared that no competing interests exist.
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | . . |
| [2] | [D]. [D]. |
| [3] | . 为明确辽宁省玉米镰孢穗腐病的病原菌种类及其分布特征,采用形态学与分子生物学鉴定方法,对2015年9月采自辽宁省13个地区的84份玉米穗腐病样品进行分离鉴定,同时依据镰孢菌分离频率确定其在辽宁省玉米生态区的分布特征。结果表明,从辽宁省84个玉米穗腐病样分离物中鉴定出3个种,即拟轮枝镰孢菌Fusarium verticillioides、禾谷镰孢菌F.graminearum和层出镰孢菌F.proliferatum,分别为67、9和8株,占79.77%、10.71%和9.52%。按照柯赫式法则,验证了3种镰孢菌代表菌株FV-39、FG-1和FP-2是玉米品种郑单958穗腐病的致病菌。拟轮枝镰孢菌为辽宁省玉米镰孢穗腐病的优势致病菌,广泛分布于辽东、辽南、辽中、辽北和辽西5个玉米生态区,分别占16.67%、11.90%、21.42%、10.72%和19.05%;禾谷镰孢菌主要分布于辽西地区,层出镰孢菌主要分布于辽中和辽北地区。 . 为明确辽宁省玉米镰孢穗腐病的病原菌种类及其分布特征,采用形态学与分子生物学鉴定方法,对2015年9月采自辽宁省13个地区的84份玉米穗腐病样品进行分离鉴定,同时依据镰孢菌分离频率确定其在辽宁省玉米生态区的分布特征。结果表明,从辽宁省84个玉米穗腐病样分离物中鉴定出3个种,即拟轮枝镰孢菌Fusarium verticillioides、禾谷镰孢菌F.graminearum和层出镰孢菌F.proliferatum,分别为67、9和8株,占79.77%、10.71%和9.52%。按照柯赫式法则,验证了3种镰孢菌代表菌株FV-39、FG-1和FP-2是玉米品种郑单958穗腐病的致病菌。拟轮枝镰孢菌为辽宁省玉米镰孢穗腐病的优势致病菌,广泛分布于辽东、辽南、辽中、辽北和辽西5个玉米生态区,分别占16.67%、11.90%、21.42%、10.72%和19.05%;禾谷镰孢菌主要分布于辽西地区,层出镰孢菌主要分布于辽中和辽北地区。 |
| [4] | . . |
| [5] | . . |
| [6] | . 玉米籽粒胚部大,营养丰富,并且我国玉米收获时原始水分普遍较高,如不进行干燥处理,在储藏过程中较易发生发热霉变现象。综述了储藏过程中玉米发生霉变的主要原因、营养成分的变化和预防治理方法,为玉米安全储藏以及减少储藏过程的经济损失提供依据。 . 玉米籽粒胚部大,营养丰富,并且我国玉米收获时原始水分普遍较高,如不进行干燥处理,在储藏过程中较易发生发热霉变现象。综述了储藏过程中玉米发生霉变的主要原因、营养成分的变化和预防治理方法,为玉米安全储藏以及减少储藏过程的经济损失提供依据。 |
| [7] | . Fungi in stored grains can cause harmful effects on the health of consumers due to the mycotoxins that they produce. aflatoxins are the most toxic and carcinogenic fungal metabolites that are frequently more found in nature. During 2014/2015 an investigation was conducted to analyze the interaction of storage conditions with the incidence of mycotoxigenic fungi and aflatoxin concentration in stored grain corn. 27 samples of stored corn grain from the main producers states of Mexico were taken, and the conditions in which they were stored were registered. Fungi and aflatoxins incidence were quantified in laboratory, and the interaction effect of seed conditions with those parameters. High incidence of Fusarium and Aspergillus species were found, with 32 and 8% respectively, but with low levels of Aflatoxins. Also, we found influence between the levels of aflatoxins with the storage time and Aspergillus incidence. A high influence of grain moisture and volumetric weight with Aspergillus incidence was observed. Also we found an influence with the level of aflatoxins, storage time and Aspergillus incidence. |
| [8] | . . |
| [9] | . . |
| [10] | . 本研究采用免疫亲和柱-高效液相色谱法测定了国内各省(市区)域的玉米、 玉米副产物、 小麦及麸皮、 粕类和全价饲料等1304个饲料及饲料原料样品中黄曲霉毒素(AFB1)、 玉米赤霉烯酮(ZEN)和呕吐毒素(DON)的含量,以了解中国饲料和原料中霉菌毒素污染情况.结果表明:玉米、 玉米副产物、 小麦及麸皮、 粕类和全价料中AFB1检出率分别为92.14%、91.48%、66.23%、97.53%和83.06%,超标率分别为31.94%、25.00%、7.79%、81.48%和11.29%;ZEN的检出率分别为79.93%、95.45%、76.62%、72.84%和88.98%,超标率分别达到4.35%、58.52%、10.39%、18.52%和7.26%;DON的检出率分别为96.49%、96.59%、100.00%、74.07%和90.32%,超标率分别达到51.17%、82.39%、83.12%、3.70%和42.20%.其中玉米副产物和小麦及麸皮是霉菌毒素污染最为严重的饲料原料,是霉菌毒素风险控制的主要关注对象. . 本研究采用免疫亲和柱-高效液相色谱法测定了国内各省(市区)域的玉米、 玉米副产物、 小麦及麸皮、 粕类和全价饲料等1304个饲料及饲料原料样品中黄曲霉毒素(AFB1)、 玉米赤霉烯酮(ZEN)和呕吐毒素(DON)的含量,以了解中国饲料和原料中霉菌毒素污染情况.结果表明:玉米、 玉米副产物、 小麦及麸皮、 粕类和全价料中AFB1检出率分别为92.14%、91.48%、66.23%、97.53%和83.06%,超标率分别为31.94%、25.00%、7.79%、81.48%和11.29%;ZEN的检出率分别为79.93%、95.45%、76.62%、72.84%和88.98%,超标率分别达到4.35%、58.52%、10.39%、18.52%和7.26%;DON的检出率分别为96.49%、96.59%、100.00%、74.07%和90.32%,超标率分别达到51.17%、82.39%、83.12%、3.70%和42.20%.其中玉米副产物和小麦及麸皮是霉菌毒素污染最为严重的饲料原料,是霉菌毒素风险控制的主要关注对象. |
| [11] | . . |
| [12] | . . |
| [13] | . . |
| [14] | . Abstract The potential toxic effects of bivalirudin (an anticoagulant) were evaluated in this intravenous infusion study in Sprague-Dawley rats. Bivalirudin was administered over a 24-hour period by continuous intravenous infusion to six groups of rats. Dose levels of 100, 500, and 2000 mg/kg/24 h were selected for the low-, mid-, and high-dose groups. Three bivalirudin-treated groups of 12 males and 12 females each were designated for toxicology assessment. Six animals/sex/group were euthanized at the completion of 24-hour infusion, and the remaining animals were assigned to a 14-day recovery period. Three additional groups of 10 rats/sex/group were designated for toxicokinetic assessment. This study included a saline control group and a vehicle control group. No bivalirudin-related toxicity was noted. There were no treatment-related effects on clinical pathology parameters. No definitive test article-related macroscopic, organ weight, or microscopic changes were identified. Three animals in the 500-mg/kg/24 h group, and 7 animals in the 2000-mg/kg/24 h group in the toxicokinetic assessment phase of the study were found dead or euthanized in extremis (following blood sampling). The concurrent clinical signs suggest that the animals hemorrhaged, which is consistent with the pharmacological action of bivalirudin. The extent of systemic exposure was similar in male and female rats, indicating a lack of a sex-related difference. Plasma concentrations of bivalirudin appeared to be linear and dose independent. Based on the results of this study, the no-observed-adverse-effect level (NOAEL) for bivalirudin, administered to rats via intravenous infusion over a 24-hour period, was 2000 mg/kg/24 h. However, the known pharmacological properties of bivalirudin could result in hemorrhage in the presence of an appropriate challenge (e.g., blood collection). |
| [15] | . |
| [16] | . Cereal grains are the most important food source for humans. As the global population continues to grow exponentially, the need for the enhanced yield and minimal loss of agricultural crops, mainly cereal grains, is increasing. In general, harvested grains are stored for specific time periods to guarantee their continuous supply throughout the year. During storage, economic losses due to reduction in quality and quantity of grains can become very significant. Grain loss is usually the result of its deterioration due to fungal contamination that can occur from preharvest to postharvest stages. The deleterious fungi can be classified based on predominance at different stages of crop growth and harvest that are affected by environmental factors such as water activity (aw) and eco-physiological requirements. These fungi include species such as those belonging to the generaAspergillusandPenicilliumthat can produce mycotoxins harmful to animals and humans. The grain type and condition, environment, and biological factors can also influence the occurrence and predominance of mycotoxigenic fungi in stored grains. The main environmental factors influencing grain fungi and mycotoxins are temperature and aw. This review discusses the effects of temperature and awon fungal growth and mycotoxin production in stored grains. The focus is on the occurrence and optimum and minimum growth requirements for grain fungi and mycotoxin production. The environmental influence on aflatoxin production and hypothesized mechanisms of its molecular suppression in response to environmental changes are also discussed. In addition, the use of controlled or modified atmosphere as an environmentally safe alternative to harmful agricultural chemicals is discussed and recommended future research issues are highlighted. |
| [17] | . Author information: (1)Agriculture and Food Research Council Institute of Arable Crops Research, Rothamsted Experimental Station, Harpenden, Hertfordshire, UK. |
| [18] | . 通过对我国辽宁、河北、河南、四川和广西5省区收集的88份玉米子粒携带的真菌种类进行检测,分离鉴定出12个属的真菌.结果表明:不同地区玉米子粒携带真菌的种类、分离频率有很大差异,引起玉米穗粒腐病的优势病原菌亦有差异,镰孢菌是玉米穗粒腐病的优势菌群.分离频率较高的还有青霉菌、曲霉菌、黑孢菌、木霉菌等. . 通过对我国辽宁、河北、河南、四川和广西5省区收集的88份玉米子粒携带的真菌种类进行检测,分离鉴定出12个属的真菌.结果表明:不同地区玉米子粒携带真菌的种类、分离频率有很大差异,引起玉米穗粒腐病的优势病原菌亦有差异,镰孢菌是玉米穗粒腐病的优势菌群.分离频率较高的还有青霉菌、曲霉菌、黑孢菌、木霉菌等. |
| [19] | . 为了解甘肃省玉米籽粒中病原镰孢菌的种类以及籽粒中伏马毒素的含量,通过形态学特征、分子生物学鉴定和高效液相色谱法对2011—2012年间采自甘肃省5个地区的225份玉米籽粒样品进行了镰孢菌的分离、鉴定和伏马毒素含量的测定。结果表明,分离获得的516株镰孢菌经鉴定分别属于拟轮生镰孢菌Fusarium verticillioides、层出镰孢菌F.proliferatum、禾谷镰孢复合种F.graminearum species complex、亚粘团镰孢菌F.subglutinans、藤仓镰孢菌F.fujikuroi、木贼镰孢菌F.equiseti、尖镰孢菌F.oxysporum和F.temperatum;其中拟轮生镰孢菌分离频率最高,属甘肃省的优势病原菌。2011和2012年,镰孢菌的分离频率分别为31.0%和10.7%,禾谷镰孢复合种和拟轮生镰孢菌为当年的优势种群。同时,2011和2012年样品中伏马毒素的污染率分别为30.5%和50.9%,平均含量分别为175μg/kg和224μg/kg,但未发现伏马毒素含量超过欧盟委员会限量标准(4 000μg/kg)的样品。 . 为了解甘肃省玉米籽粒中病原镰孢菌的种类以及籽粒中伏马毒素的含量,通过形态学特征、分子生物学鉴定和高效液相色谱法对2011—2012年间采自甘肃省5个地区的225份玉米籽粒样品进行了镰孢菌的分离、鉴定和伏马毒素含量的测定。结果表明,分离获得的516株镰孢菌经鉴定分别属于拟轮生镰孢菌Fusarium verticillioides、层出镰孢菌F.proliferatum、禾谷镰孢复合种F.graminearum species complex、亚粘团镰孢菌F.subglutinans、藤仓镰孢菌F.fujikuroi、木贼镰孢菌F.equiseti、尖镰孢菌F.oxysporum和F.temperatum;其中拟轮生镰孢菌分离频率最高,属甘肃省的优势病原菌。2011和2012年,镰孢菌的分离频率分别为31.0%和10.7%,禾谷镰孢复合种和拟轮生镰孢菌为当年的优势种群。同时,2011和2012年样品中伏马毒素的污染率分别为30.5%和50.9%,平均含量分别为175μg/kg和224μg/kg,但未发现伏马毒素含量超过欧盟委员会限量标准(4 000μg/kg)的样品。 |
| [20] | . . |
| [21] | . 本研究采用盆栽幼苗症状观察法、PDA培养基法对龙源3号、豫玉22号、酒单3号、沈单16号、金穗3号、金穗10号、Lima28号共7个玉米品种进行了种子表面带菌检测。结果表明:供试种子表面携带的真菌主要为青霉属(Penicillium spp.)、根霉菌属(Rhizopus spp.)、镰刀菌属(Fusarium spp.)和链格孢菌属(Alternaria spp.);携带的细菌为一种G-。玉米品种种子表面带菌量有差异,试验中不论以何种方法检验,7个品种中沈单16号和酒单3号这两个品种相对带菌率普遍低,为优良品种。 . 本研究采用盆栽幼苗症状观察法、PDA培养基法对龙源3号、豫玉22号、酒单3号、沈单16号、金穗3号、金穗10号、Lima28号共7个玉米品种进行了种子表面带菌检测。结果表明:供试种子表面携带的真菌主要为青霉属(Penicillium spp.)、根霉菌属(Rhizopus spp.)、镰刀菌属(Fusarium spp.)和链格孢菌属(Alternaria spp.);携带的细菌为一种G-。玉米品种种子表面带菌量有差异,试验中不论以何种方法检验,7个品种中沈单16号和酒单3号这两个品种相对带菌率普遍低,为优良品种。 |
| [22] | . 本研究采用PDA培养基法和滤纸培养基法对龙源3号、豫玉22号、酒单3号、沈单16号、金穗3号、金穗10号、Lima28号共7个玉米品种进行了种内带菌检测。结果表明:供试种子内部携带的真菌主要为青霉属(Penicillium spp.)、根霉菌属(Rhizopus spp.)、镰刀菌属(Fusarium spp.)和链格孢菌属(Alternaria spp.);携带的细菌为一种G+。种子内部带菌率在品种间差异不是很显著,豫玉22号最高为93.33%,沈单16号和酒单3号最低为66.67%。 . 本研究采用PDA培养基法和滤纸培养基法对龙源3号、豫玉22号、酒单3号、沈单16号、金穗3号、金穗10号、Lima28号共7个玉米品种进行了种内带菌检测。结果表明:供试种子内部携带的真菌主要为青霉属(Penicillium spp.)、根霉菌属(Rhizopus spp.)、镰刀菌属(Fusarium spp.)和链格孢菌属(Alternaria spp.);携带的细菌为一种G+。种子内部带菌率在品种间差异不是很显著,豫玉22号最高为93.33%,沈单16号和酒单3号最低为66.67%。 |
| [23] | . . |
| [24] | |
| [25] | |
| [26] | . |
| [27] | . 为明确桃蛀螟Conogethes punctiferalis(Guenée)为害夏玉米果穗对产量的影响,于2012—2013年通过人工接种法将桃蛀螟初孵幼虫接到吐丝期玉米果穗上调查果穗被害程度,分析接虫密度对产量构成因素、穗腐病发生及产量损失的影响。结果表明,桃蛀螟主要通过降低百粒重、缩短果穗长度和减少行粒数等影响产量;当接虫密度每穗为1、3、5和10头时,不同处理的百粒重均比对照显著降低0.65、1.03、1.07和1.60 g;当接虫密度为每穗5和10头时,果穗长度比对照分别显著缩短9.66 mm和13.17 mm,行粒数减少5.15和5.45粒;桃蛀螟为害可诱发穗腐病的发生,主要病原菌为轮枝镰孢菌、青霉菌和禾谷镰孢菌,引起穗腐病的发生率分别为84.91%、54.45%和40.97%;接虫密度为每穗1、3、5和10头时,平均单穗产量损失率分别为0.73%、4.19%、11.65%和17.71%。研究表明,桃蛀螟为害不仅直接造成产量损失,还可加重穗腐病发生,影响玉米的质量。 . 为明确桃蛀螟Conogethes punctiferalis(Guenée)为害夏玉米果穗对产量的影响,于2012—2013年通过人工接种法将桃蛀螟初孵幼虫接到吐丝期玉米果穗上调查果穗被害程度,分析接虫密度对产量构成因素、穗腐病发生及产量损失的影响。结果表明,桃蛀螟主要通过降低百粒重、缩短果穗长度和减少行粒数等影响产量;当接虫密度每穗为1、3、5和10头时,不同处理的百粒重均比对照显著降低0.65、1.03、1.07和1.60 g;当接虫密度为每穗5和10头时,果穗长度比对照分别显著缩短9.66 mm和13.17 mm,行粒数减少5.15和5.45粒;桃蛀螟为害可诱发穗腐病的发生,主要病原菌为轮枝镰孢菌、青霉菌和禾谷镰孢菌,引起穗腐病的发生率分别为84.91%、54.45%和40.97%;接虫密度为每穗1、3、5和10头时,平均单穗产量损失率分别为0.73%、4.19%、11.65%和17.71%。研究表明,桃蛀螟为害不仅直接造成产量损失,还可加重穗腐病发生,影响玉米的质量。 |
| [28] | . . |
| [29] | . 为解决山区村组粮烟争地矛盾,在有限的耕地上提高复种指数,保证粮食播种面积,增加粮食总产和拓宽农民收入,满足曼来镇粮食自给和畜牧业发展需求,元江县曼来镇农技站结合县委、县政府发展思路,根据云南省科技增粮行动中间套种项目的安排部署及玉溪市农业局《关于印发主要科技增粮措施实施方案的通矧》文件精神,在元江县曼来镇推广烟后套种玉米栽培模式.通过推广,有效地解决了山区粮、烟争地矛盾,确保了粮食安全,促进了农业发展、农村稳定,推进了山区农村全面快速发展.现将其栽培技术要点简述如下: . 为解决山区村组粮烟争地矛盾,在有限的耕地上提高复种指数,保证粮食播种面积,增加粮食总产和拓宽农民收入,满足曼来镇粮食自给和畜牧业发展需求,元江县曼来镇农技站结合县委、县政府发展思路,根据云南省科技增粮行动中间套种项目的安排部署及玉溪市农业局《关于印发主要科技增粮措施实施方案的通矧》文件精神,在元江县曼来镇推广烟后套种玉米栽培模式.通过推广,有效地解决了山区粮、烟争地矛盾,确保了粮食安全,促进了农业发展、农村稳定,推进了山区农村全面快速发展.现将其栽培技术要点简述如下: |
| [30] | [D]. [D]. |
| [31] | . 为明确我国黄淮海夏玉米主产区玉米穗腐病的病原菌种类、优势种群及虫害、年度、省份对病原菌的影响,以形态学为基础,结合分子生物学方法对2013、2015年随机采自河南、河北、山东3省的155份玉米穗腐病样品进行分离鉴定。结果表明,引起黄淮海夏玉米主产区玉米穗腐病的主要致病菌为镰孢菌Fusarium spp.,包括拟轮枝镰孢F.verticillioides、禾谷镰孢F.graminearum、层出镰孢F.proliferatum、木贼镰孢F.equiseti及藤仓镰孢F.fujikuroi,分离频率分别为49.7%、28.4%、12.3%、3.9%和1.3%;其次为木霉菌Trichoderma spp.,包括哈茨木霉T.harzianum、绿色木霉T.viride和棘孢木霉T.asperellum,分离频率分别为8.4%、3.2%和5.2%;青霉菌Penicillium spp.分离频率较低,为14.2%;曲霉菌Aspergillus spp.包括黑曲霉A.niger和黄曲霉A.flavus,分离频率分别为2.6%和1.9%。研究表明,黄淮海主产区玉米穗腐病优势病原菌为拟轮枝镰孢、禾谷镰孢和木霉菌,不同省份不同年度间病原菌种类及优势病原菌存在差异,虫害能加重玉米穗腐病的发生。 . 为明确我国黄淮海夏玉米主产区玉米穗腐病的病原菌种类、优势种群及虫害、年度、省份对病原菌的影响,以形态学为基础,结合分子生物学方法对2013、2015年随机采自河南、河北、山东3省的155份玉米穗腐病样品进行分离鉴定。结果表明,引起黄淮海夏玉米主产区玉米穗腐病的主要致病菌为镰孢菌Fusarium spp.,包括拟轮枝镰孢F.verticillioides、禾谷镰孢F.graminearum、层出镰孢F.proliferatum、木贼镰孢F.equiseti及藤仓镰孢F.fujikuroi,分离频率分别为49.7%、28.4%、12.3%、3.9%和1.3%;其次为木霉菌Trichoderma spp.,包括哈茨木霉T.harzianum、绿色木霉T.viride和棘孢木霉T.asperellum,分离频率分别为8.4%、3.2%和5.2%;青霉菌Penicillium spp.分离频率较低,为14.2%;曲霉菌Aspergillus spp.包括黑曲霉A.niger和黄曲霉A.flavus,分离频率分别为2.6%和1.9%。研究表明,黄淮海主产区玉米穗腐病优势病原菌为拟轮枝镰孢、禾谷镰孢和木霉菌,不同省份不同年度间病原菌种类及优势病原菌存在差异,虫害能加重玉米穗腐病的发生。 |
| [32] | [D]. . |
| [33] | . . |
| [34] | . |
| [35] | . The series of events that led to the discovery of aflatoxin as a potent carcinogen, its biosynthesis, mechanism of action, structure-function relationship provide interesting insight into the economical and technological factors involved in the development of an effective control measure for the toxin. Scientists all over the world are making continuous efforts to explore a generalized process of detoxification, which can bring down the toxin content in heterogeneous commodities to a threshold level. In this article biological control methods with special emphasis on in vivo and in vitro enzymatic detoxification of aflatoxin have been reviewed. Future areas of research involving large-scale enzymatic detoxification and modified atmosphere storage are also discussed. Referee: Dr. F. S. Chu, 16458 Denhave Court, Chino Hills, CA 91709 |
| [36] | . Abstract Aflatoxins remain as a threat to the health of livestock as well as humans by their continuing intermittent occurrence in both feeds and foods. The finding that aflatoxin-contaminated feeds, and eventually purified aflatoxins, were carcinogenic in rats and trout initiated a multitude of studies in search of the role of these toxins in human liver disease, especially cancer. Although aflatoxins have caused acute liver disease in humans, epidemiologic evidence of the involvement of aflatoxins in PLC has not been clarified. Earlier studies did not consider that the hepatitis B virus (HBV) may have contributed to the PLC in the selected populations. Although later studies that did include measurement of the HBV antigen in serum provided conflicting evidence for the role of aflatoxin in PLC in these populations, the latest and most comprehensive study found no association between aflatoxin exposure and PLC mortality. The technological advances and findings of the chemical, immunologic, and metabolic activities of aflatoxins such as binding to DNA and protein to form adducts, development of monoclonal antibodies, and mutational specificity of the genotoxic compounds will, it is hoped, help to clarify the role of aflatoxin as a risk factor, among many others, in the development of primary liver cancer in humans. Aflatoxicosis of animals is usually manifested by pathologic changes in the liver, but they have been found to be carcinogenic and teratogenic as well as causing impaired protein formation, coagulation, weight gains, and immunity. The importance of the carcinogenic effect in livestock is diminished because they are not fed contaminated diets for a sufficient time prior to marketing for slaughter. Animals are variably susceptible to aflatoxins, depending on such factors as age, species, breed, sex, nutrition, and certain stresses. Swine, cattle, and poultry are the domestic species of greatest economic concern in terms of aflatoxicosis. In all species, the evidence of disease is a general unthriftiness and reduction in weight gains, feed efficiency, immunity, and production. More conclusive evidence of aflatoxin involvement in disease includes acute to chronic liver disease with concomitant increases in specific liver enzymes in the serum. In cattle, milk production is affected, but of greater significance is that the aflatoxins in feeds can be rather efficiently converted to toxic metabolites in milk, with even small amounts being readily detectable. The poultry industry probably suffers greater economic loss than any of the livestock industries because of the greater susceptibility of their species to aflatoxins than other species.(ABSTRACT TRUNCATED AT 400 WORDS) |
| [37] | . 目的:调查中国玉米饲料原料中真菌及其毒素的污染状况。方法2014年2月份分别从安徽、河北、黑龙江、吉林、江苏、辽宁、内蒙古和山东8个省份采集玉米饲料原料样品,共计94份。采用高效液相色谱-串联质谱法同时检测样品中黄曲霉毒素(AF)、A类和B类单端孢霉烯族化合物、玉米赤霉烯酮(ZEN)共12种真菌毒素的含量;并对样品中的污染真菌进行鉴定和计数。结果36.2%(34/94)的样品受到不同程度的AF污染,以AFB1含量最高,含量范围为0.3~181.3μg/kg;其次为AFB2,含量范围为1.0~74.3μg/kg;7份样品(7.5%,7/94)AFB1含量超过我国规定的限量标准(50μg/kg)。A类单端孢霉烯族化合物的污染水平均较低,含量范围为0.1~10.5μg/kg。B类单端孢霉烯族化合物以脱氧雪腐镰刀菌烯醇(DON)的污染最为严重,检出率为100%,含量范围为0.7~606.6μg/kg,中位数为66.3μg/kg,但所有样品中DON的含量均低于我国规定的限量标准(1000μg/kg)。76.6%(72/94)的样品检出ZEN,中位数为36.9μg/kg;3份样品(3.2%,3/94)ZEN含量超过我国规定的限量标准(500μg/kg)。真菌污染调查表明,所有样品均受到不同程度的真菌污染(5.0~1.4×105 CFU/g),分别有18份和3份样品的带菌量超过限用标准和禁用标准。曲霉属、青霉属、镰刀菌属、木霉属和毛霉属是主要的污染真菌,其检出率分别为71.3%(67份)、60.6%(57份)、71.3%(67份)、27.7%(26份)和24.5%(23份)。串珠镰刀菌的检出率[73.4%(69/94)]高于黄曲霉的检出率[41.5%(39/94)]。结论本实验发现玉米原料受AF和A类单端孢霉烯族化合物污染的水平较低,主要受到B类单端孢霉烯族化合物DON及其衍生物和ZEN的污染;同时还受到曲霉属、青霉属、镰刀菌等多种真菌的污染。 . 目的:调查中国玉米饲料原料中真菌及其毒素的污染状况。方法2014年2月份分别从安徽、河北、黑龙江、吉林、江苏、辽宁、内蒙古和山东8个省份采集玉米饲料原料样品,共计94份。采用高效液相色谱-串联质谱法同时检测样品中黄曲霉毒素(AF)、A类和B类单端孢霉烯族化合物、玉米赤霉烯酮(ZEN)共12种真菌毒素的含量;并对样品中的污染真菌进行鉴定和计数。结果36.2%(34/94)的样品受到不同程度的AF污染,以AFB1含量最高,含量范围为0.3~181.3μg/kg;其次为AFB2,含量范围为1.0~74.3μg/kg;7份样品(7.5%,7/94)AFB1含量超过我国规定的限量标准(50μg/kg)。A类单端孢霉烯族化合物的污染水平均较低,含量范围为0.1~10.5μg/kg。B类单端孢霉烯族化合物以脱氧雪腐镰刀菌烯醇(DON)的污染最为严重,检出率为100%,含量范围为0.7~606.6μg/kg,中位数为66.3μg/kg,但所有样品中DON的含量均低于我国规定的限量标准(1000μg/kg)。76.6%(72/94)的样品检出ZEN,中位数为36.9μg/kg;3份样品(3.2%,3/94)ZEN含量超过我国规定的限量标准(500μg/kg)。真菌污染调查表明,所有样品均受到不同程度的真菌污染(5.0~1.4×105 CFU/g),分别有18份和3份样品的带菌量超过限用标准和禁用标准。曲霉属、青霉属、镰刀菌属、木霉属和毛霉属是主要的污染真菌,其检出率分别为71.3%(67份)、60.6%(57份)、71.3%(67份)、27.7%(26份)和24.5%(23份)。串珠镰刀菌的检出率[73.4%(69/94)]高于黄曲霉的检出率[41.5%(39/94)]。结论本实验发现玉米原料受AF和A类单端孢霉烯族化合物污染的水平较低,主要受到B类单端孢霉烯族化合物DON及其衍生物和ZEN的污染;同时还受到曲霉属、青霉属、镰刀菌等多种真菌的污染。 |
| [38] | . 黄曲霉毒素(aflatoxin,AFT)是由黄曲霉(Aspergillus flavus)和寄生曲霉(A. parasiticus)产生的一类强致癌真菌毒素。生物防治是防治黄曲霉毒素污染的经济和有效方法之一,近年来,生物防治黄曲霉毒素污染的研究取得较大进展,并在生产上得到广泛应用。本文就近年来生物防治黄曲霉毒素方面的研究进行综述。 . 黄曲霉毒素(aflatoxin,AFT)是由黄曲霉(Aspergillus flavus)和寄生曲霉(A. parasiticus)产生的一类强致癌真菌毒素。生物防治是防治黄曲霉毒素污染的经济和有效方法之一,近年来,生物防治黄曲霉毒素污染的研究取得较大进展,并在生产上得到广泛应用。本文就近年来生物防治黄曲霉毒素方面的研究进行综述。 |
| [39] | . . |
