0 引言
【研究意义】我国柑橘产业主要分布在南方丘陵山地,容易受到土壤干旱胁迫的影响。即使我国南方湿润地区也经常会在7—9月份发生区域性和季节性的干旱[1],此时正值柑橘果实膨大及品质产量形成的关键时期,如橘园不能有效地通过灌溉来解决干旱问题,则会给柑橘的安全生产带来较大压力。干旱胁迫影响氮素营养的吸收、运转和代谢[2]。氮素是作物生长发育所必需的大量元素之一,是植物体内许多重要有机化合物的组分,参与和调节植物在干旱逆境下的适应、伤害、修复和补偿等生理生化过程[3,4]。笔者所在研究团队前期研究表明,随着干旱胁迫的加剧,柑橘叶片叶绿素含量下降,柑橘体内吸收的氮素含量减少[5]。目前,随着全球气候变暖和生态环境的恶化,干旱发生的频率和强度均有所加剧[6,7],干旱胁迫给柑橘安全生产带来的压力越来越突出。柑橘的水分生理和营养吸收研究密不可分,在干旱条件下,研究柑橘对干旱胁迫的响应,以及氮素代谢机制等,对实际生产中调控柑橘生长发育、品质与产量具有重要意义。【前人研究进展】柑橘属于典型的亚热带树种,喜温暖、湿润的生态环境,对水分有较高的需求[8]。水分的缺失会使柑橘的形态发生变化,如植株生长缓慢或停止、叶片和嫩茎萎蔫、叶片枯死和脱落;使叶片气孔开度减小甚至关闭[9,10,11],与光合作用有关的细胞器受损,导致叶片光合速率下降[12,13,14,15];也影响根系对矿质元素(N、P、K等)吸收[5,16-17]。因此,干旱胁迫对柑橘的生长发育、果实品质与产量具有极为不利的影响[18]。研究发现,豆科植物根瘤形成依赖于起始结瘤基因(nodule inception,NIN)的存在,而在非豆科植物中,也有类似基因存在,参与硝酸盐的同化,命名为NLP(NIN-like protein)基因[19]。研究表明,拟南芥(Arabidopsis thaliana)NLP转录因子不仅在调控氮素吸收与同化中扮演着非常重要的角色[20,21,22,23],而且与拟南芥的抗旱性有关[24]。NIN-like家族蛋白具有感知硝酸盐信号的能力,能与硝酸盐响应顺式作用元件(nitrate-responsive cis-element,NRE)绑定,激活依赖NRE启动的基因表达[20,21]。另外研究人员发现,敲除了AtNLP7的拟南芥相比正常野生型表现出了较强的抗旱能力[24]。【本研究切入点】到目前为止,关于柑橘NLP转录因子参与氮素吸收与同化还未有深入研究,因此,本文针对枳(Poncirus trifoliata (L.) Raf.)氮素含量受干旱的影响,探讨枳NLP转录因子对干旱胁迫的响应,以及其与NRE的互作关系。【拟解决的关键问题】分析干旱条件下枳叶片和侧根中氮素含量的变化以及枳亚硝酸还原酶基因(PtNiR)和NLP转录因子的表达,克隆PtNiR启动子序列并进行顺式作用元件分析,运用酵母单杂交技术分析验证枳NLP转录因子与NiR启动子上硝酸盐响应顺式作用元件的互作关系。1 材料与方法
试验于2015—2017 年在湖南农业大学国家柑橘改良中心长沙分中心进行。1.1 试验材料
试验材料为枳播种实生苗,种子来源于湖南省洞口县洞口镇大田村同一棵母本株‘大田1号’,遗传基础一致。枳实生苗栽培于温室大棚中的塑料盆中(直径25 cm,高度23 cm),其中试验植株108株,树龄为1年生并生长一致,栽培基质由草炭、锯木屑及细河沙按照1﹕2﹕1的比例混匀而成。1.2 试验方法
1.2.1 枳干旱处理及采样 以植株统一浇透水为处理第1天,此后每天在上午9:00—10:00用土壤水分测量仪(TDR300,USA)监测栽培基质的持水量。干旱组的基质不再补充水分直到观察到植株叶片萎蔫,而对照组的基质相对持水量下降至55%—65%时,每2 d补充适量水分使对照基质保持在该范围。处理期间采集干旱组和对照组试验分析样本3次,即统一浇水后第7天基质相对持水量在55%—65%范围时采样一次;第27天干旱组基质相对持水量在18%—22%时采样一次;第37天干旱组观察到植株叶片萎蔫、基质相对持水量在12%—16%时采样一次,每次采样干旱组和对照组分别采集3组重复,每组6株,其中3株采集新梢顶部3—5片叶,以及根部幼嫩侧根,用于RNA提取和荧光定量PCR分析;另外3株采集全部叶片和侧根用于氮素含量的测定。1.2.2 氮素含量的测定 将待测枳叶片、侧根样品取好后,立即用水洗净,在烘箱中设置15 min 120℃,然后于65℃条件下烘干至恒重,研磨成粉后采用凯氏定氮仪测定全氮含量。
1.2.3 枳DNA提取 用液氮研磨叶片,参照CTAB法提取枳DNA。使用超微量分光光度计(Implen P330,德国)检测DNA浓度与纯度,同时用1.0%的琼脂糖电泳检测DNA的完整性,检测合格后,贮于-20℃备用。
1.2.4 RNA提取及cDNA制备 使用Trizol试剂盒(Invitrogen,USA)参照说明书的步骤提取枳叶片和侧根的总RNA,之后在超微量分光光度计(Implen P330,德国)上检测RNA浓度与纯度,同时用1.0%的琼脂糖电泳检测总RNA的完整性,检测合格后,使用反转录试剂盒(PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time),TaKaRa)制备实时荧光定量分析cDNA模板,完成后于-20℃保存备用。
1.2.5 引物设计 参照甜橙基因组数据库序列,使用Oligo 7.0软件设计枳NLP基因全长的PCR扩增引物[23],设计PtNiR的启动子扩增引物;使用Beacon Designer 8设计实时荧光定量PCR引物(表1)。
Table 1
表1
表1本试验设计的引物
Table 1Primers designed in this study
| 用途 Use | 基因 Gene | 序列 Sequence (5′-3′) | NCBI登录号 NCBI accession number | 备注 Note |
|---|---|---|---|---|
| 基因扩增 Gene amplification | PtNLP2 | F: GATTACGCTCATATGGATGATGGTAATTTTACGC R: GAGCTCGATGGATCCTTACGAGGGAGCATTGTTGTGG | KX056268 | |
| PtNLP4 | F: GATTACGCTCATATGGAAGATACTGTTTTTTTGCC R: GAGCTCGATGGATCCTCAGGAATTCCCACTGCT | KX056269 | ||
| PtNLP7 | F: GATTACGCTCATATGCCTGAACCGGACAAAGAGA R: GAGCTCGATGGATCCTCACAATTCTCCAGTGCTT | KX056270 | ||
| PtNLP8 | F: GATTACGCTCATATGGAACACCCCTTTTCACCT R: GAGCTCGATGGATCCCTATGAAACGCCCGCCAAG | KX056271 | ||
| PtNiR | F: AATGTCACTTTCATTGAAC R: GATTGAAATTGCAAGATGA | KX792147 | 扩增PtNiR启动子Amplification of PtNiR promoter | |
| 实时荧光定量PCR RT-qPCR | PtNLP2 | F: CACTTCGGAGCATAACCA R: GCATAGCAACAGACAATGAT | KX056268 | |
| PtNLP4 | F: CATTGCTGGTAGTGAGGAC R: CAGTAATAGTCTTGGTTCTTGA | KX056269 | ||
| PtNLP7 | F: CTACAACAATGAAGCGTATC R: CCTTGGACAGATTCAATTAC | KX056270 | ||
| PtNLP8 | F: ATTCCTTGGCTGCTGCTGAC R: TTGATGAGTCTGTCGTGTTTGAAG | KX056271 | ||
| PtNiR | F: GAGTGGTATGGACAATGTTAGA R: GCAAGTTAGTGACGGTAGG | KX792147 | ||
| ActinB | F: CCAATTCTCTCTTGAACCTGTCCTT R: TGACTGATGAGAACTGCCAGAAG | Cb250364 | 内参基因 Reference gene |
新窗口打开
1.2.6 荧光定量PCR分析 仪器采用BIO-RAD公司的CFX96 real-time PCR仪。扩增条件设置为两步法:95℃预变性30 s后,95℃变性5 s,58℃ 15 s,40个循环,每个样品3次重复。选择YAN等[25]报道的ActinB作为内参基因,分别以对照样品为参照分析基因的差异表达。根据LIVAK等[26]报道的2-ΔΔCT法分析枳叶与侧根的qPCR数据,并使用SPSS软件对基因相对样品的表达数据进行差异显著性分析。
1.2.7 基因克隆与酵母单杂交互作载体构建 使用高保真DNA聚合酶(PrimerSTAR Max DNA Polymerase,TaKaRa)PCR扩增枳NLP转录因子及PtNiR启动子,扩增的目的产物经1%的琼脂糖凝胶电泳后,把预期片段大小的目的条带切胶、回收纯化后,使用必克隆试剂盒(Ligation-Free Cloning Kit,abm),按照说明书进行连接转化,筛选培养,然后提取载体质粒进行测序验证。枳4×NRE序列由铂尚生物技术(上海)有限公司合成并连接至pHIS2载体。
1.2.8 酵母单杂交分析 按照酵母单杂交步骤将构建的pHIS2-4×NRE和pGADT7-Rec-NLP载体质粒共同转化到酵母菌株Y187中,在氨基酸缺失培养基SD/-Trp/-Leu(对照)以及SD/-His/-Trp/-Leu/ +120 mmol·L-1 3-氨基三唑(3-aminotriazole,3-AT)上30℃恒温培养3—5 d,观察酵母的生长情况,以共转化pHIS2-4×NRE和pGADT7-Rec空载体的Y187酵母为阴性对照。
2 结果
2.1 干旱条件下枳氮素含量的变化
在干旱组中,叶片全氮含量表现出先升高再下降的趋势,而侧根中全氮含量显著下降;在对照组中,枳叶片和侧根全氮含量均显著上升(图1)。以对照为参比,全氮含量在枳叶片和侧根中均随着干旱时间的延长而相对减少。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1干旱处理后枳叶和侧根中的全氮含量
不同小写字母表示显著差异(P<0.05)。下同
-->Fig. 1The total nitrogen content in leaves and lateral roots of P. trifoliata after drought treatment
Different lowercases indicate significant difference at P<0.05 level. The same as below
-->
2.2 干旱条件下PtNiR的表达
分析了干旱条件下亚硝酸还原酶PtNiR(NCBI登录号KX792147)在叶片和侧根的表达情况,结果表明,当第27天基质相对持水量在18%—22%时,叶PtNiR的表达水平上调超过处理第7天,但不显著,而侧根PtNiR的表达水平有所下调且显著低于处理第7天;当第37天观察到植株叶片萎蔫,基质相对持水量在12%—16%范围时,叶和侧根PtNiR的表达水平均显著下调至更低的水平(图2)。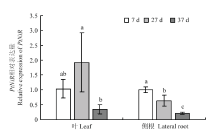 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2枳叶和侧根中PtNiR的相对表达量
-->Fig. 2The relative expression of PtNiR in leaves and lateral roots of P. trifoliata
-->
2.3 干旱胁迫下枳NLP基因的表达
分析了本试验条件下PtNLP2(NCBI登录号:KX056268)、PtNLP4(NCBI登录号:KX056269)、PtNLP7(NCBI登录号:KX056270)及PtNLP8(NCBI登录号:KX056271)在叶片和侧根的表达量(图3、图4)。结果发现,在叶片中,PtNLP2、PtNLP4及PtNLP7的表达趋势相似,干旱第27天(基质相对持水量在18%—22%时)的表达量相对干旱第7天(基质相对持水量在55%—65%时)显著上调,到干旱第37天(植株叶片萎蔫,基质相对持水量在12%—16%时),它们的表达量有所下调,其中,PtNLP4、PtNLP7下调至干旱第7天的表达量水平以下,但PtNLP2仍显著高于干旱第7天。PtNLP8的表达量在干旱第27天有所下调,低于第7天的表达量但无显著差异。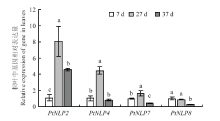 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3枳叶中NLP基因的相对表达量
-->Fig. 3The relative expression of NLP genes in leaves of P. trifoliata
-->
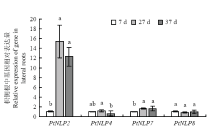 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4枳侧根中NLP基因的相对表达量
-->Fig. 4The relative expression of NLP genes in lateral roots of P. trifoliata
-->
而在枳侧根中,同样,PtNLP2、PtNLP4及PtNLP7在干旱第27天(基质相对持水量在18%—22%时)的表达量相对干旱第7天(基质相对持水量在55%—65%时)上调,其中PtNLP2、PtNLP7显著上调;到干旱第37天(植株叶片萎蔫,基质相对持水量在12%—16%时),它们的表达量有所变化,其中,PtNLP2表达下调但仍显著高于干旱第7天,PtNLP4表达下调至干旱第7天的表达水平以下,PtNLP7表达与干旱第7天无显著性差异。PtNLP8的表达量在干旱第27天、第37天相比第7天均有所下调但无显著差异。
从基因表达模式的角度分析,PtNLP2、PtNLP4及PtNLP7之间存在相似性,但与PtNLP8存在差异。NLP与PtNiR表达模式上具有一定的相关性,表明枳NLP转录因子与PtNiR表达可能存在关联,因此,克隆分析了PtNiR的启动子序列,并发现一段疑似NRE序列。
2.4 PtNiR启动子的克隆及序列分析
通过克隆测序获得了包括1 602 bp启动子的PtNiR序列(NCBI登录号KX792147)。通过检索比对分析,在PtNiR启动子区域-196至-154的位置发现了疑似NRE,该NRE由一个高保守motif(TG(A/G)C(C/T)CTT)以及另一个低保守motif组成(图5-A、5-B),枳NRE的第一个motif序列为“TGACCCTT”,第二个motif序列为“AAGAGTCC”,与菜豆(Phaseolus vulgaris)、菠菜(Spinacia oleracea)一致,与拟南芥、白桦(Betula pendula)、玉米(Zea mays)、高粱(Sorghum bicolor)、水稻(Oryza sativa)类似(图5-A)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5硝酸盐响应顺式作用元件(NRE)
-->Fig. 5Nitrate-responsive cis-element (NRE)
A:在编码NiR侧端区域的类似NRE的核苷酸序列,两组成部分分别用黄色和蓝色标出。其中菜豆、菠菜、拟南芥、白桦、玉米、高粱、水稻的编码NiR基因侧端区域的类似NRE的核苷酸序列分别来源于GenBank、MaizeSequence.org和Gramene database Nucleotide sequences of NRE and related sequences found in the flanking regions of genes encoding NiR, and the two half-sites are indicated by yellow and blue. Accession numbers for the sequences for the flanking regions of NiR from Phaseolus vulgaris, Spinacia oleracea, Arabidopsis thaliana, Betula pendula, Zea mays, Sorghum bicolor, and Oryza sativa are U10419, X17031, NM_127123, X60093, GRMZM2G079381, Sb04g034160, and Os01g0357100, respectively, in the GenBank, MaizeSequence.org, or Gramene database;B:NRE序列的一致性由WebLogo程序生成 The consensus sequence of NRE displayed using the sequence logo generation program WebLogo
-->
2.5 枳NLP转录因子与NRE互作分析
为分析和验证枳NLP转录因子与NRE的互作,构建了含有4×NRE-HIS3报告基因的pHIS2载体,并分别构建了融合PtNLP2、PtNLP4、PtNLP7及PtNLP8的表达载体pGADT7-Rec。分别将pHIS2-4× NRE-HIS3和pGADT7-Rec-NLP2、pHIS2-4×NRE- HIS3和pGADT7-Rec-NLP4、pHIS2-4×NRE-HIS3和pGADT7-Rec-NLP7、pHIS2-4×NRE-HIS3和pGADT7- Rec-NLP8、pHIS2-4×NRE-HIS3和pGADT7-Rec共同转化至酵母菌株Y187中,生长在对照(/-Trp/-Leu)及筛选(/-His/-Trp/-Leu/+120 mmol·L-1 3-AT)培养基上。结果如图6所示,转化pHIS2-4×NRE-HIS3载体和不含NLP的pGADT7-Rec空载体的Y187酵母在对照培养基(-Trp/-Leu)能正常生长,而在含有120 mmol·L-1 3-AT的三缺培养基(-His/-Trp/-Leu)上不生长,说明酵母单杂交系统工作正常;转化pHIS2-4×NRE-HIS3载体和pGADT7-Rec-NLP载体的Y187酵母在对照培养基(-Trp/-Leu)和含有120 mmol·L-1 3-AT的三缺培养基(-His/-Trp/-Leu)上均能正常生长。该结果表明在Y187酵母中,PtNLP2、PtNLP4、PtNLP7及PtNLP8均能与NRE绑定互作,暗示枳NLP转录因子能够通过绑定NRE结合位点调控PtNiR表达。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6酵母单杂交分析枳NLP转录因子与NRE的互作关系
-->Fig. 6Analysis of interaction between NLP transcription factor and NRE in P. trifoliata by Y1H assay
-->
3 讨论
研究表明,受干旱胁迫的影响,山下红温州蜜柑和纽荷尔脐橙的氮素吸收量显著低于正常浇灌处理,且随着土壤干旱程度的加深而减少[5]。本试验的全氮含量结果表明,从处理后第7天到叶片开始萎蔫的第37天,无论是叶片,还是与氮素吸收转运直接相关的侧根,其本身的全氮含量均显著减少,且相比对照,其相对含量也显著减少。因此可见,干旱胁迫显著影响柑橘的氮素营养,这可能与干旱胁迫能诱导或抑制氮代谢相关基因的表达有关。硝酸盐是高等植物中的主要氮源,也起到诱导生长和基因表达变化的信号分子的作用。硝酸盐的同化作用是一个受到高度调控的过程,其受到氮素代谢如亚硝酸还原酶(NiR)等相关基因表达的影响[19,27-28]。本研究分析结果表明,枳侧根中的亚硝酸还原酶PtNiR表达受到干旱胁迫的抑制,且随着干旱时间的延长其表达量显著下调。然而,PtNiR表达变化可能是受到干旱胁迫的直接影响,也可能是受到其他转录因子的调控。氮素代谢途径中存在一些在硝酸盐吸收以及同化的过程中起重要调控作用的转录因子[20-22,29-31]。研究发现,拟南芥中NLP转录因子的活性可以受硝酸盐信号的调节,其蛋白能与硝酸盐响应顺式作用元件(NRE)绑定结合,从而激活相关基因的表达[20,21]。另外,敲除AtNLP7后,拟南芥表现出明显的缺氮状态,也表现出更强的抗旱性[24]。原生质免疫共沉淀杂交技术分析也表明拟南芥AtNLP7参与到氮代谢及相关的途径中[23,32]。本研究发现,在氮素代谢中发挥着重要功能的NLP转录因子的表达响应干旱胁迫,这对于解析柑橘在干旱条件下氮素调控的分子机制非常重要。
KONISHI等分析了几种高等植物的NiR启动子的序列,鉴定出一个保守序列(5′-tGACcCTTN10 AAGagtcc-3′)作为NRE,而且在拟南芥NiR启动子中的NRE可以直接受硝酸盐应答转录,但突变了该保守序列后,启动子的硝酸盐响应活性显著降低,表明NRE是硝酸盐应答转录所必需的[33,34]。通过序列分析,在PtNiR启动子区域-196至-154的位置发现了疑似NRE,并且应用酵母单杂交分析确定了PtNLP2、PtNLP4、PtNLP7及PtNLP8转录因子均能与4×NRE 位点结合互作,激活下游基因的表达。这进一步在理论上表明NLP可以通过绑定NRE位点激活PtNiR的表达。因此,枳NLP转录因子在柑橘的氮素代谢中可能也起着非常重要的作用,其表达水平不仅影响柑橘对氮素的吸收与同化,也与柑橘的抗旱性有着某种联系。
4 结论
干旱胁迫影响枳的全氮含量以及PtNiR和NLP基因的表达,特别是侧根中全氮含量显著下降,其PtNiR表达受到干旱胁迫的抑制,且随着干旱时间的延长其表达量显著下调。PtNLP2、PtNLP4、PtNLP7及PtNLP8的表达均响应干旱胁迫但存在差异。在PtNiR启动子中发现了硝酸盐响应顺式作用元件(NRE),PtNLP2、PtNLP4、PtNLP7及PtNLP8转录因子均能与NRE位点绑定互作,从而激活下游基因的表达。The authors have declared that no competing interests exist.
