0 引言
【研究意义】籽粒灌浆是玉米籽粒形成的重要过程,灌浆速率快慢与灌浆持续时间长短直接决定了籽粒的最终产量[1-2],因此,具备合适的籽粒灌浆特性对玉米高产育种至关重要。中国多样的生态类型造就了玉米种质资源的广泛变异,对中国玉米基础种质资源,特别是对骨干亲本开展灌浆特性相关研究,解析其遗传基础,对于指导骨干亲本高效利用和玉米高产育种实践具有重要的理论研究价值与生产指导意义。【前人研究进展】籽粒灌浆是一个动态变化的过程,可分为缓增期、快增期及减缓期3个阶段[3]。缓增期主要完成库容建成,灌浆速率慢,有少量干物质的积累。快增期籽粒灌浆速率逐渐增加并达到最大值,完成大部分籽粒干物质的积累。减缓期籽粒灌浆速率持续降低,籽粒含水量下降达到生理成熟[4]。一般来讲,籽粒灌浆呈现慢-快-慢的非线性变化过程,可用Logistic模型和Richards模型描述灌浆的变化规律[5-6]。玉米籽粒的大小受到灌浆速率与灌浆持续时间的共同影响,BORRÁS等[7]研究表明,灌浆速率能够解释84%的粒重表型变异。秦泰辰等[2]研究亦表明,灌浆速率对粒重的贡献大于灌浆持续时间。但DAYNARD等[8]和YANG等[9]研究表明,粒重与灌浆持续时间显著相关。遗传基础研究方面,籽粒的灌浆过程受到诸多要素的影响,表现为复杂的数量性状特点。分子标记技术的发展和数量遗传学统计方法的建立,为解析复杂数量性状(包括籽粒灌浆特性)的遗传基础提供了有力支撑。在水稻中,TAKAI等[10]和LIU等[11]利用灌浆过程中不同阶段的灌浆特性表型值,分别运用连锁分析与关联分析方法检测到一些与灌浆特性相关位点。在小麦中,WANG等[12]利用连锁分析方法检测到39个灌浆特性相关QTL,其中包括17个平均灌浆速率相关QTL、16个最大灌浆速率相关QTL以及6个灌浆持续时间相关QTL。玉米方面,LIU等[13]利用黄C与许178构建的203个家系RIL群体,共检测到32个灌浆特性相关的QTL,分布于玉米除第9染色体外的其余染色体上。ZHANG等[14]利用黄C与许178构建的243个家系的永久F2群体,运用条件QTL分析方法,在4个环境6个取样时期共检测到47个灌浆特性相关的QTL,其中有多个QTL能够在不同环境下检测到。【本研究切入点】尽管在玉米籽粒灌浆特性遗传研究方面取得了一定进展,定位到了一些相关的QTL,但针对中国玉米骨干亲本灌浆特性开展的研究仍然较少,因此,需要利用高密度遗传图谱与玉米骨干亲本构建的遗传群体开展灌浆特性的遗传研究。【拟解决的关键问题】本研究以在灌浆特性方面具有显著差异的玉米骨干亲本黄早四与旅28构建的RIL群体为试验材料,比较Logistic模型及Richards模型在拟合玉米灌浆过程上的差异,研究不同灌浆特性相关性状间的相关关系,分析各性状对粒重的贡献,挖掘控制灌浆特性的重要遗传区段,为精细定位与候选基因的发掘提供基础,对指导中国玉米骨干亲本高效利用和高产育种提供参考和依据。1 材料与方法
1.1 试验材料与试验设计
黄早四是中国重要的玉米育种骨干亲本之一,具有早熟和灌浆速率快的优良特性[15-16];而旅28是旅大红骨类群中的代表性自交系,丰产性好,配合力高,但灌浆偏慢,生育期偏中晚[17]。2个亲本均在中国玉米育种中发挥了重要作用。本研究以玉米自交系黄早四与旅28配制杂交组合,以“单粒传法”连续自交7代,构建包含172个家系的重组自交系(recombination inbred line,RIL)群体为试验材料[18]。2015年在中国农业科学院作物科学研究所昌平试验基地(15CP:40°10′N,116°13′E)和顺义试验基地(15SY:40°13′N,116°35'E)及2016年在中国农业科学院作物科学研究所新乡试验基地(16XX:35°05′N,113°42′E),共3个环境下种植172个家系及其亲本。15CP和15SY 2个地点为春播,16XX为夏播。每份材料种植4行,行长3 m,行距0.6 m,株距25 cm。全部田间试验中施肥、灌溉、防虫与除草和当地生产上大田的田间管理一致。于各试验基地气象站收集最高温度、最低温度、平均温度等气象数据,以30℃为上限温度,以10℃为下限温度,计算每日有效温度,以有效积温作为灌浆的时间值拟合灌浆过程,计算灌浆参数[19]。
1.2 田间取样及表型鉴定
小区50%植株吐丝记为吐丝期(day to silking,DS),选择生育时期相对一致的植株挂牌标记。自授粉后10 d开始取样,取样间隔为5 d,直至果穗中部籽粒出现黑层,并记为生理成熟期(day to physiological maturity,DPM)。每个家系每次取2个果穗,剥取果穗中间籽粒,于105℃杀青30 min,75℃烘干72 h,调查粒数与籽粒干重,计算每个取样点百粒重。1.3 籽粒灌浆过程的拟合分析
以取样点有效积温为自变量,各取样点百粒重为因变量,利用Curve Expert 1.4软件中的Logistic模型W=A/(1+Be-kt)[5]和Richards模型W = A/(1+Be-kt)1/N[6,20]分别拟合籽粒的灌浆过程,式中A为最大百粒重(hundred kernel weight,HKW),t为取样点有效积温,B、k和N均为常数,通过比较分析确定玉米籽粒灌浆过程的最优拟合模型。根据Richards模型速率方程的2个拐点t1= -ln((N2+3N+N(N2+6N+5)1/2)/2B)/K,t2=-ln((N2+3N- N(N2+6N+5)1/2)/2B)/K以及达到95%最大百粒重时间t3=-ln (((100/95)N -1)/B)/K可将灌浆过程分为3个阶段(缓增期、快增期、减缓期),分别计算各阶段灌浆速率(缓增期灌浆速率,G1;快增期灌浆速率,G2;减缓期灌浆速率,G3)、灌浆持续时间(缓增期灌浆持续时间,T1;快增期灌浆持续时间,T2;减缓期灌浆持续时间,T3)以及籽粒生长量(缓增期籽粒生长量,W1;快增期籽粒生长量,W2;减缓期籽粒生长量,W3)。平均灌浆速率Gmean = 2(N+2)/AK以及最大灌浆速率Gmax[6]。
1.4 表型数据的统计分析
利用SAS软件进行表型数据的统计分析,采用“Proc TTest”程序比较不同灌浆模型以及不同灌浆阶段决定系数的差异,采用“Proc GLM”程序分析群体不同灌浆相关性状在不同环境中的差异。采用“Proc Mixed”程序计算多环境下各灌浆特性相关性状的最优线性无偏估计(best linear unbiased prediction,BLUP),并利用“Proc Corr”程序分析各灌浆相关性状间的相关关系,采用“Proc Reg”程序研究各灌浆特性相关性状对百粒重表型变异的贡献率,运用R软件绘制散点图与频数分布图。1.5 遗传图谱构建
基于GBS测序数据[21],在全基因组范围内筛选多态性SNP标记,将等位基因频率MAF<0.05的SNP标记过滤,使用隐马尔科夫模型(hidden markov model,HMM)对每个RIL家系进行基因型分型,基因型杂合位点设置为缺失。在所有多态性SNP标记中选择遗传距离为1 cM均匀分布的标记,构建遗传图谱[22-23]。1.6 QTL分析
利用QTL IciMapping V4.1软件,采用完备区间作图方法[24],在单环境以及联合环境下进行QTL检测。PIN值设置为0.001,步长(walking speed)为1 cM,在全基因组范围内对目标性状进行扫描,在P=0.05显著水平下将数据模拟运算(Permutation)1 000次来确定LOD阈值,当某位置检测到的LOD值大于阈值时,则确定该位置存在1个QTL。2 结果
2.1 不同灌浆模型的拟合度比较分析
Logistic模型W = A/(1+Be-kt)与Richards模型W = A/(1+Be-kt) 1/N在玉米灌浆相关研究中均有应用。利用2种模型分别对3个环境下不同RIL家系的灌浆过程进行拟合,通过比较不同参数最终确定最优模型。针对整个灌浆过程而言,基于Logistic模型与Richards模型的预测值与观测值间的决定系数均值分别为97.09%和97.48%,两者均可模拟籽粒的灌浆过程,但Richards方程的决定系数显著高于Logistic方程(P<0.05)。同时,还对3个灌浆阶段分段进行了模拟比较,结果发现,Logistic模型不同阶段的决定系数分别为54.47%(缓增期)、93.42%(快增期)和80.21%(减缓期),而Richards模型各阶段的决定系数分别为82.23%(缓增期)、95.28%(快增期)和80.74%(减缓期)。两模型缓增期的决定系数平均差值为27.76%,存在显著差异(P<0.05)。另外,还利用Logistic模型拟合计算不同阶段籽粒生长量占最大百粒重的比例,发现不同RIL家系所得比例为固定值,分别为20.23%(缓增期)、59.53%(快增期)和15.23%(减缓期),而Richards模型计算所得比值因材料而异,变化范围分别为7.57%—49.01%(缓增期)、41.97%—60.96%(快增期)和4.01%—26.47%(减缓期),该结果更加切合实际。因此,Richards模型更加适合玉米籽粒灌浆过程的拟合运算。2.2 玉米籽粒灌浆相关性状表型分析
籽粒物质积累随着灌浆过程的推进而不断增加,但亲本在各灌浆特性相关性状的变化幅度上存在不同程度的差异。3个环境平均条件下,黄早四在缓增期、快增期、减缓期的灌浆速率(每百粒灌浆速率)分别为0.018(G1)、0.061(G2)和0.027 g·100-kernel-1·℃day-1(G3),旅28在缓增期、快增期、减缓期的灌浆速率分别为0.016(G1)、0.050(G2)和0.022 g·100-kernel-1·℃day-1(G3),黄早四的平均灌浆速率是旅28的1.28倍(表1)。同时发现,黄早四在授粉后279 ℃day左右达到最大灌浆速率,而旅28授粉后333 ℃day左右才能达到最大灌浆速率,也就是旅28达到最大灌浆速率的时间(从授粉日期算起)较黄早四要推迟2—3 d。旅28灌浆持续时间长于黄早四,为黄早四的1.07倍。3个环境平均条件下,缓增期、快增期、减缓期黄早四的灌浆持续时间分别为190.53(T1)、240.30(T2)和195.44 ℃day(T3),旅28在缓增期、快增期、减缓期的灌浆持续时间分别为198.80(T1)、253.78(T2)和209.99 ℃day(T3)。且黄早四的吐丝期与生理成熟期均早于旅28。黄早四籽粒灌浆速率快但灌浆持续时间短,而旅28籽粒灌浆时间长但灌浆速率相对较慢(图1)。Table 1
表1
表13个不同环境下亲本灌浆特性与生育期相关性状的表型差异
Table 1Differences of the grain filling related and growth period related traits of the parents under three environments
| 性状 Trait | 2015昌平 15CP | 2015顺义 15SY | 2016新乡 16XX | |||
|---|---|---|---|---|---|---|
| 黄早四 HZS | 旅28 Lv28 | 黄早四 HZS | 旅28 Lv28 | 黄早四 HZS | 旅28 Lv28 | |
| 百粒重HKW (g·100-kernel-1) | 25.52 | 20.09 | 27.08 | 22.73 | 20.99 | 21.75 |
| 缓增期灌浆持续时间T1 (℃day) | 232.53 | 168.96 | 190.28 | 208.40 | 148.70 | 219.03 |
| 缓增期灌浆速率G1 (g·100-kernel-1·℃day-1) | 0.021 | 0.009 | 0.017 | 0.018 | 0.016 | 0.020 |
| 缓增期籽粒生长量W1 (g·100-kernel-1) | 4.85 | 1.58 | 3.33 | 3.74 | 2.47 | 4.68 |
| 快增期灌浆持续时间T2 (℃day) | 276.00 | 263.19 | 237.43 | 265.36 | 207.48 | 232.78 |
| 快增期灌浆速率G2 (g·100-kernel-1·℃day-1) | 0.054 | 0.047 | 0.069 | 0.051 | 0.061 | 0.053 |
| 快增期籽粒生长量W2 (g·100-kernel-1) | 14.94 | 12.25 | 16.28 | 13.50 | 12.52 | 12.24 |
| 减缓期灌浆持续时间T3 (℃day) | 184.27 | 268.30 | 207.97 | 194.64 | 194.09 | 167.04 |
| 减缓期灌浆速率G3 (g·100-kernel-1·℃day-1) | 0.024 | 0.020 | 0.030 | 0.022 | 0.027 | 0.025 |
| 减缓期籽粒生长量W3 (g·100- kernel-1) | 4.46 | 5.27 | 6.11 | 4.36 | 4.97 | 3.75 |
| 最大灌浆速率Gmax (g·100-kernel-1·℃day-1) | 0.062 | 0.054 | 0.079 | 0.058 | 0.071 | 0.061 |
| 平均灌浆速率Gmean (g·100- kernel·℃day-1) | 0.041 | 0.037 | 0.054 | 0.039 | 0.048 | 0.040 |
| 吐丝期DS (℃day) | 916.05 | 943.50 | 880.80 | 910.30 | 942.88 | 984.86 |
| 生理成熟期DPM (℃day) | 1594.05 | 1622.15 | 1545.22 | 1712.33 | 1506.79 | 1643.02 |
新窗口打开
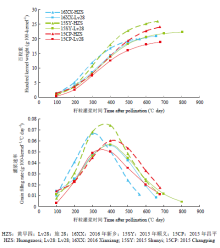 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1不同环境下黄早四与旅28灌浆过程中百粒重与灌浆速率变化
-->Fig. 1Changes of hundred-kernel weight and grain filling rate during grain filling of HZS and Lv28 across different environments
-->
在RIL群体中,生育期相关性状、灌浆特性相关性状和百粒重均存在较大的变异范围,大部分性状表型值峰度与偏度的绝对值均小于1,呈现正态分布或近似正态分布,满足QTL定位要求。方差分析发现,不同环境下百粒重(HKW)、快增期灌浆持续时间(T2)、快增期籽粒生长量(W2)、减缓期灌浆持续时间(T3)、减缓期籽粒生长量(W3)、吐丝期(DS)和生理成熟期(DPM)均存在显著性差异(P<0.01),但各阶段灌浆速率、平均灌浆速率(Gmean)及最大灌浆速率(Gmax)均无显著差异(表2)。不同阶段灌浆持续时间的广义遗传力分别为26.59%(缓增期灌浆持续时间,T1)、26.41%(快增期灌浆持续时间,T2)和5.41%(减缓期灌浆持续时间,T3),不同阶段灌浆速率的广义遗传力分别为33.53%(缓增期灌浆速率,G1)、67.50%(快增期灌浆速率,G2)和57.94%(减缓期灌浆速率,G3)。可见,灌浆持续时间受环境因素影响较大,遗传力较低,但灌浆速率相关性状在不同环境间的表现相对稳定,遗传力较高。
Table 2
表2
表2灌浆特性与生育期相关性状在RIL群体中的表现
Table 2Performance of grain filling related and growth period related traits in RILs
| 性状 Trait | 均值 Mean | 标准差 SD | 最大值 Max | 最小值 Min | 变异系数 CV (%) | 偏度 Skewness | 峰度 Kurtosis | F值 F value | 广义遗传力 H2 (%) |
|---|---|---|---|---|---|---|---|---|---|
| 百粒重 HKW (g·100-kernel-1) | 22.87 | 2.76 | 30.11 | 15.72 | 12.08 | 0.35 | 0.33 | 31.20** | 81.88 |
| 缓增期灌浆持续时间 T1 (℃day) | 204.61 | 9.28 | 240.02 | 184.64 | 4.54 | 0.80 | 1.43 | 2.52 | 26.59 |
| 缓增期灌浆速率 G1 (g·100-kernel-1·℃day-1) | 0.018 | 0.001 | 0.023 | 0.015 | 7.74 | 0.59 | 0.90 | 1.43 | 33.53 |
| 缓增期籽粒生长量W1 (g·100-kernel-1) | 3.83 | 0.52 | 6.50 | 3.03 | 13.65 | 1.44 | 3.79 | 0.13 | 35.93 |
| 快增期灌浆持续时间 T2 (℃day) | 232.79 | 12.98 | 286.08 | 204.06 | 5.58 | 0.80 | 1.86 | 18.84** | 26.41 |
| 快增期灌浆速率 G2 (g·100-kernel-1·℃day-1) | 0.059 | 0.006 | 0.079 | 0.045 | 10.89 | 0.37 | 0.52 | 0.24 | 67.50 |
| 快增期籽粒生长量W2 (g·100-kernel-1) | 13.29 | 1.41 | 17.20 | 9.83 | 10.64 | 0.40 | 0.53 | 33.33** | 69.74 |
| 减缓期灌浆持续时间 T3 (℃day) | 188.10 | 6.22 | 210.99 | 171.15 | 3.31 | 0.31 | 1.20 | 9.37** | 5.41 |
| 减缓期灌浆速率 G3 (g·100-kernel-1 ·℃day-1) | 0.026 | 0.003 | 0.037 | 0.021 | 10.65 | 0.65 | 1.18 | 0.57 | 57.94 |
| 减缓期籽粒生长量W3(g·100-kernel-1) | 4.55 | 0.24 | 5.23 | 3.84 | 5.32 | -0.12 | 0.54 | 13.29** | 23.79 |
| 最大灌浆速率Gmax (g·100-kernel-1·℃day-1) | 0.068 | 0.007 | 0.090 | 0.051 | 10.98 | 0.37 | 0.54 | 0.26 | 68.81 |
| 平均灌浆速率Gmean (g·100-kernel-1·℃day-1) | 0.045 | 0.005 | 0.061 | 0.034 | 11.03 | 0.38 | 0.67 | 0.34 | 70.75 |
| 吐丝期DS (℃day) | 948.02 | 31.24 | 1037.20 | 878.09 | 0.033 | 0.38 | 0.40 | 76.68** | 78.20 |
| 生理成熟期DPM (℃day) | 1609.71 | 35.89 | 1689.48 | 1424.47 | 0.022 | -0.78 | 3.23 | 100.75** | 63.04 |
新窗口打开
2.3 玉米灌浆特性相关性状相关性分析与回归分析
相关性分析结果表明(图2),除缓增期灌浆持续时间(T1)外,百粒重与其他灌浆特性相关性状均存在显著正相关关系,尤其与平均灌浆速率(Gmean,r=0.56,P<0.01)、快增期灌浆速率(G2,r=0.55,P<0.01)、缓增期灌浆速率(G1,r=0.49,P<0.01)、减缓期灌浆速率(G3,r=0.49,P<0.01)以及快增期灌浆持续时间(T2,r=0.30,P<0.01)达到了极显著水平。快增期灌浆持续时间(T2)、减缓期灌浆持续时间(T3)均与各阶段灌浆速率以及平均灌浆速率(Gmean)存在显著的负相关关系(P<0.01)。此外,将吐丝期(DS)、生理成熟期(DPM)与不同阶段灌浆持续时间作相关性分析发现,快增期灌浆持续时间(T2)与生理成熟期(DPM,r=0.17,P<0.01),吐丝期(DS)与生理成熟期(DPM,r=0.60,P<0.01),均存在显著的正相关关系。以百粒重为因变量,不同灌浆特性相关性状表型值为自变量,利用逐步回归方法,分析不同灌浆特性相关性状对粒重的贡献,所得最优回归方程为HKW = 462.076 G2** + 0.028 T1* + 0.264 T2** - 0.132 T3** - 29.440。回归分析表明,快增期灌浆持续时间(T2)、快增期灌浆速率(G2)、减缓期灌浆持续时间(T3)、缓增期灌浆持续时间(T1)均达到显著水平(P<0.05),分别能解释百粒重57.50%、30.00%、4.01%和0.22%的表型变异,其他灌浆特性相关性状均不显著。其中,快增期灌浆持续时间(T2)与快增期灌浆速率(G2)共解释百粒重变异的87.50%,且快增期内百粒重由3.83 g增加至17.11 g,重量增加量占最大百粒重的58.08%。可见,快增期对于百粒重形成具有决定性作用,且快增期灌浆持续时间对于粒重的贡献大于灌浆速率。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2RIL群体中灌浆特性相关性状的相关性分析与频数分布
-->Fig. 2Correlation analysis and frequency distribution of grain filling related traits of RILs
-->
2.4 玉米籽粒灌浆相关性状QTL分析
利用GBS技术,对RIL家系进行基因型分型,获得20万个高质量的多态性SNP标记,从中筛选出1 471个遗传距离为1 cM的标记,构建了总长度为 1 471 cM的遗传连锁图谱。利用QTL IciMapping V4.1软件,采用完备区间作图方法对灌浆特性相关性状进行QTL分析,3个环境共检测到26个灌浆特性相关QTL、3个百粒重相关QTL以及14个生育期相关的QTL,分布在玉米基因组除第7染色体之外的其余染色体上,单个QTL表型贡献率为5.97%—21.16%(表3)。同时,利用该软件的多环境联合分析模块(QTL mapping for multi-environmental trials,MET),共检测到18个灌浆特性相关QTL、3个百粒重相关QTL以及6个生育期相关QTL,分布在第1、2、3、4、5、7、9和10染色体上,单个QTL表型贡献率为4.00%—18.85%(表4)。2.4.1 百粒重 单环境下共检测到3个影响百粒重的QTL,分别在第4染色体(2个)、第5染色体(1个)上。其中,第4染色体上的QTL可以在15CP、15SY共同检测到,表型贡献率分别为13.02%和19.82%,增效基因均来自于黄早四(表3)。在联合环境分析中,第1、4、9染色体上各检测到1个百粒重相关QTL(qHKW1、qHKW4和qHKW9),表型贡献率分别为4.74%、14.02%和5.00%,分别增加百粒重0.62、1.12和0.70 g,除qHKW9外,其他QTL增效基因均来自黄早四(表4和图3)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3联合环境分析条件下灌浆特性与生育期相关性状QTL的染色体分布
-->Fig. 3Distributions of identified QTL under joint-environments for grain filling related and growth period related traits on genetic linkage maps
-->
Table 4
表4
表4联合环境下灌浆特性及生育期相关性状QTL分析
Table 4QTL analysis of grain filling related and growth period related traits under joint-environments
| 性状 Trait | QTL | 染色体 Chr. | 位置 Position (cM) | 标记区间 Marker interval | LOD值 LOD | 贡献率 PVE (%) | 加性效应 Additive |
|---|---|---|---|---|---|---|---|
| HKW (g·100-kernel-1) | qHKW1 | 1 | 93 | S1_150816131-S1_158110289 | 5.63 | 4.74 | -0.623 |
| qHKW4 | 4 | 72 | S4_159358250-S4_160783392 | 16.70 | 14.02 | -1.119 | |
| qHKW9 | 9 | 45 | S9_21329308-S9_21882312 | 6.68 | 5.00 | 0.698 | |
| Gmean (g·100-kernel-1·℃day-1) | qGmean1 | 1 | 89 | S1_92176157_S1_96062938 | 5.95 | 5.625 | -0.002 |
| qGmean4 | 4 | 60 | S4_103600817_S4_135727494 | 6.05 | 5.54 | -0.002 | |
| qGmean9 | 9 | 60 | S9_110404915_S9_113420650 | 5.40 | 5.05 | 0.002 | |
| Gmax (g ·100-kernel-1·℃day-1) | qGmax1 | 1 | 96 | S1_169790811-S1_172870806 | 4.80 | 4.53 | -0.002 |
| qGmax4 | 4 | 60 | S4_103600817-S4_135727494 | 6.64 | 6.06 | -0.003 | |
| qGmax7 | 7 | 96 | S7_160624665-S7_161111438 | 4.79 | 4.38 | -0.002 | |
| qGmax9 | 9 | 61 | S9_113420650-S9_114729542 | 5.54 | 5.07 | 0.002 | |
| G1 (g ·100-kernel-1·℃day-1) | qG14-1 | 4 | 57 | S4_48241786-S4_65820374 | 8.33 | 11.76 | -0.001 |
| qG14-2 | 4 | 115 | S4_222735411-S4_225665119 | 4.67 | 6.39 | -0.001 | |
| W1 (g ·100-kernel-1) | qW14-1 | 4 | 57 | S4_48241786-S4_65820374 | 8.10 | 8.35 | -0.487 |
| qW14-2 | 4 | 71 | S4_158423931-S4_159358250 | 4.55 | 4.89 | -0.371 | |
| G2 (g ·100-kernel-1·℃day-1) | qG24 | 4 | 60 | S4_103600817-S4_135727494 | 6.89 | 5.86 | -0.002 |
| qG27 | 7 | 96 | S7_160624665-S7_161111438 | 4.76 | 4.00 | -0.002 | |
| qG29 | 9 | 61 | S9_113420650-S9_114729542 | 5.48 | 4.58 | 0.002 | |
| W2 (g ·100-kernel-1) | qW21 | 1 | 90 | S1_96062938-S1_103241856 | 4.71 | 8.33 | -0.399 |
| qW24 | 4 | 73 | S4_160783392-S4_162208534 | 5.30 | 8.59 | -0.337 | |
| G3 (g ·100-kernel-1·℃day-1) | qG34 | 4 | 60 | S4_103600817-S4_135727494 | 5.70 | 7.69 | -0.001 |
| W3 (g· 100-kernel-1) | qW35 | 5 | 31 | S5_9415721-S5_9846124 | 4.82 | 6.94 | 0.271 |
| DS (℃day) | qDS2-1 | 2 | 54 | S2_21285732-S2_21888074 | 6.69 | 18.85 | 6.751 |
| qDS2-2 | 2 | 57 | S2_23094731-S2_24049806 | 5.99 | 6.51 | 5.147 | |
| DPM (℃day) | qDPM2-1 | 2 | 56 | S2_22564998-S2_23094731 | 7.47 | 13.49 | 10.021 |
| qDPM3-1 | 3 | 92 | S3_181708617-S3_182742189 | 5.42 | 8.08 | 11.844 | |
| qDPM6-1 | 6 | 69 | S6_153489498-S6_154100976 | 4.66 | 7.24 | -10.814 | |
| qDPM10-1 | 10 | 39 | S10_22979734-S10_30868206 | 6.47 | 11.00 | -13.080 |
新窗口打开
2.4.2 缓增期灌浆特性 利用3个环境下缓增期灌浆速率,灌浆持续时间以及籽粒生长量的表型值,在单环境下共检测到13个QTL,其中包含8个灌浆速率相关QTL,3个灌浆持续时间相关QTL以及2个籽粒生长量相关QTL,分别位于第1、3、4、5、8、9染色体上,可解释表型变异的7.61%—18.17%(表3)。在联合环境分析中,第4染色体上检测到2个灌浆速率相关的QTL和2个籽粒生长量相关的QTL,其表型贡献率为4.89%—11.76%,增效等位基因均来自于黄早四。其中,qG14-1和qW14-1共定位于48.24 Mb—65.82 Mb区间上,分别增加灌浆速率0.0012 g·100-kernel-1·℃day-1,增加籽粒生长量0.49 g(表4和图3)。
Table 3
表3
表3单环境条件下灌浆特性与生育期相关性状QTL定位结果
Table 3QTL analysis of grain filling related and growth period related traits under single environment
| 性状 Trait | 环境 Environment | 染色体 Chr. | 位置 Position (cM) | 标记区间 Marker interval | LOD值 LOD | 贡献率 PVE (%) | 加性效应 Additive |
|---|---|---|---|---|---|---|---|
| HKW (g·100-kernel-1) | 15CP | 4 | 72 | S4_159358250-S4_160783392 | 5.25 | 13.02 | -1.542 |
| 15SY | 4 | 72 | S4_159358250-S4_160783392 | 9.05 | 19.82 | -1.735 | |
| 15SY | 5 | 36 | S5_11567739-S5_11873332 | 3.86 | 7.78 | 1.116 | |
| Gmean (g·100-kernel-1·℃day-1) | 15CP | 3 | 97 | S3_187132839-S3_188250269 | 4.04 | 8.89 | -0.003 |
| 15SY | 4 | 60 | S4_103600817-S4_135727494 | 3.57 | 11.41 | -0.003 | |
| Gmax (g·100-kernel-1·℃day-1) | 15SY | 4 | 60 | S4_103600817-S4_135727494 | 3.89 | 12.31 | -0.004 |
| T1 (℃day) | 16XX | 4 | 55 | S4_36356063-S4_39862418 | 3.84 | 16.46 | -23.246 |
| 15CP | 4 | 59 | S4_79448096-S4_103600817 | 3.49 | 8.46 | -18.502 | |
| 15SY | 8 | 73 | S8_145371163-S8_146574795 | 3.27 | 7.69 | 15.313 | |
| G1 (g·100-kernel-1·℃day-1) | 16XX | 1 | 163 | S1_266526808-S1_267797711 | 3.51 | 10.70 | 0.003 |
| 16XX | 1 | 207 | S1_300219938-S1_300858882 | 4.43 | 13.81 | -0.003 | |
| 15CP | 3 | 48 | S3_19661002-S3_20437131 | 3.89 | 9.33 | -0.002 | |
| 15CP | 4 | 57 | S4_48241786-S4_65820374 | 7.18 | 18.17 | -0.003 | |
| 16XX | 4 | 71 | S4_158423931-S4_159358250 | 3.72 | 11.41 | -0.003 | |
| 15SY | 4 | 115 | S4_222735411-S4_225665119 | 4.00 | 9.02 | -0.002 | |
| 15SY | 5 | 1 | S5_1195364-S5_1565307 | 3.41 | 7.61 | 0.002 | |
| 15SY | 9 | 41 | S9_19232823-S9_19670296 | 3.81 | 8.56 | 0.002 | |
| W1 (g·100-kernel-1) | 15CP | 4 | 57 | S4_48241786-S4_65820374 | 5.84 | 15.61 | -0.925 |
| 16XX | 4 | 71 | S4_158423931-S4_159358250 | 4.44 | 15.03 | -1.165 | |
| T2 (℃day) | 15SY | 1 | 55 | S1_32805087-S1_33561318 | 3.70 | 12.16 | 17.166 |
| G2 (g·100-kernel-1·℃day-1) | 15SY | 4 | 60 | S4_103600817-S4_135727494 | 3.91 | 12.41 | -0.004 |
| W2 (g·100-kernel-1) | 15SY | 4 | 73 | S4_160783392-S4_162208534 | 4.86 | 12.55 | -0.855 |
| 15SY | 5 | 36 | S5_11567739-S5_11873332 | 4.09 | 10.44 | 0.801 | |
| 16XX | 9 | 25 | S9_11269872-S9_11594506 | 3.96 | 12.09 | 0.962 | |
| G3 (g·100-kernel-1·℃day-1) | 15SY | 4 | 60 | S4_103600817-S4_135727494 | 4.04 | 12.89 | -0.002 |
| 15CP | 4 | 78 | S4_167128403-S4_169852350 | 3.33 | 10.92 | -0.002 | |
| W3 (g·100-kernel-1) | 16XX | 1 | 165 | S1_269068613-S1_271225201 | 3.31 | 9.94 | -0.580 |
| 15CP | 5 | 40 | S5_13020190-S5_13487845 | 3.29 | 7.61 | 0.585 | |
| 16XX | 9 | 25 | S9_11269872-S9_11594506 | 4.66 | 14.46 | 0.684 | |
| DS (℃day) | 15SY | 1 | 106 | S1_188843858-S1_190087216 | 3.42 | 6.89 | -10.551 |
| 15SY | 2 | 51 | S2_19215955-S2_19958961 | 5.81 | 12.15 | 14.010 | |
| 15CP | 2 | 54 | S2_21285732-S2_21888074 | 6.70 | 15.62 | 20.979 | |
| 16XX | 2 | 58 | S2_24049806-S2_25444803 | 7.44 | 21.16 | 18.308 | |
| 15SY | 3 | 69 | S3_156934272-S3_158370125 | 3.81 | 7.70 | 11.157 | |
| 16XX | 5 | 54 | S5_24668030-S5_27564476 | 3.57 | 9.32 | 12.652 | |
| 15CP | 10 | 43 | S10_79389587-S10_83668426 | 4.09 | 9.15 | -16.211 | |
| 15SY | 10 | 43 | S10_79389587-S10_83668426 | 4.56 | 9.34 | -12.423 | |
| DPM (℃day) | 15SY | 2 | 52 | S2_19958961-S2_20316704 | 5.71 | 9.71 | 29.383 |
| 15CP | 2 | 56 | S2_22564998-S2_23094731 | 7.38 | 20.85 | 34.217 | |
| 15SY | 3 | 91 | S3_181074971-S3_181708617 | 7.17 | 12.55 | 33.564 | |
| 15SY | 6 | 3 | S6_18388385-S6_21351799 | 3.63 | 5.97 | 23.276 | |
| 15CP | 6 | 69 | S6_153489498-S6_154100976 | 3.39 | 8.97 | -22.586 | |
| 15SY | 10 | 36 | S10_14316080-S10_15690240 | 6.10 | 10.48 | -31.065 |
新窗口打开
2.4.3 快增期灌浆特性 利用3个环境下快增期灌浆特性相关性状的表型值,在单环境下共检测到5个QTL,其中包含1个灌浆速率相关QTL,1个灌浆持续时间相关QTL以及3个籽粒生长量相关QTL,分布于第1、4、5、9染色体上,表型贡献率均在10%以上,是控制相应性状的主效QTL(表3)。在联合环境分析中检测到5个灌浆特性相关QTL,分布于第1、4、7、9染色体上,表型贡献率为4.00%—8.59%,除qG29外,其他QTL的增效等位基因均来自于黄早四。
2.4.4 减缓期灌浆特性 利用3个环境下减缓期灌浆速率,灌浆持续时间以及籽粒生长量的表型值共检测到5个QTL,其中包含2个灌浆速率相关QTL和3个籽粒生长量相关QTL,分布在第1、4、5、9染色体上,表型贡献率为7.61%—14.46%,其中有3个QTL表型贡献率在10%以上,是影响相应性状的主效QTL(表3)。在联合环境分析中,分别在第4染色体上检测到1个灌浆速率相关的QTL,表型贡献率为7.69%;在第5染色体上检测到1个籽粒生长量相关的QTL,能够解释6.94%的表型差异(表4和图3)。
2.4.5 平均灌浆速率与最大灌浆速率 在3个环境条件下共检测到3个影响平均灌浆速率以及最大灌浆速率的QTL,分别在第3、4染色体上,相应表型贡献率分别为8.90%、11.41%和12.31%,增效基因均来自于黄早四(表3),其中第4染色体上影响平均灌浆速率及最大灌浆速率的QTL共定位于相同区间。在联合环境分析中,分别在第1、4、7、9染色体上,检测到7个与平均灌浆速率、最大灌浆速率相关的QTL,除qGmean9和qGmax9增效基因来源于旅28外,其他QTL增效基因均来自黄早四(表4,图3)。
2.4.6 生育期相关性状 在3个环境条件下共检测到8个吐丝期相关的QTL,6个生理成熟期相关的QTL,分别在第1、2、3、5、6、10染色体上,表型贡献率为5.97%—21.16%,其中有6个QTL表型贡献在10%以上,是影响相应性状的主效QTL(表3)。其中,第2染色体物理位置为21.29 Mb—24.05 Mb区间内同时检测到吐丝期与生理成熟期相关的QTL。第10染色体上与吐丝期相关的QTL可以在15CP和15SY中共同检测到。联合环境分析中,共检测到2个与吐丝期相关QTL,4个生理成熟期相关的QTL,其中qDS2-1、qDS2-2和qDPM2-1共定位于染色体相同或邻近位置,且增效基因均来源于旅28。
联合环境分析发现,控制不同性状的QTL成簇出现,形成了多个QTL富集区域。在第1染色体物理位置为92.17 Mb—172.29 Mb区间内检测到qHKW1、qGmean1、qGmax1和qW21,增效基因均来自于黄早四;在第2染色体物理位置为21.29 Mb—24.05 Mb区间内检测到qDS2-1、qDS2-2和qDPM2-1,增效基因来自于旅28;在第4染色体物理位置为48.24 Mb—135.73 Mb内检测到qG14-1、qW14-1、qGmean4、qGmax4、qG24和qG34,增效基因均来自于黄早四;物理位置为158.42 Mb—162.21 Mb区间内检测到qHKW4、qW14-2和qW24,这些QTL共定位到染色体相同区域,增效基因均来自于黄早四;在第9染色体物理位置为110.40 Mb—114.73 Mb区间范围内检测到qGmean9、qGmax9和qG29,增效基因均来自旅28。灌浆特性相关的QTL与生育期相关的QTL分别定位在不同的染色体上。
3 讨论
3.1 不同模型对灌浆过程的拟合分析
动植物生长一般呈现慢-快-慢的非线性变化趋势,Logistic模型以及Richards模型均广泛应用于描述动植物的生长发育规律,同时在玉米籽粒灌浆研究中均有应用[5, 25]。Logistic模型作为Richards模型的一种特殊形式,其曲线是以W = A/2为中心点旋转对称所得,而Richards模型曲线取决于参数N[6]。本研究通过比较分析发现,整个灌浆过程中,基于Richards模型的预测值与观测值间的决定系数都要高于Logistic模型,尤其在缓增期,基于Richards模型的决定系数为82.23%,而Logistic模型的决定系数仅为54.47%。同时,利用Logistic模型计算缓增期、快增期以及减缓期籽粒生长量占最大百粒重比例,发现不同RIL家系所得比值为固定值,而Richards模型计算所得比值却因材料而异。可见,Richards模型更加准确,且更能反映籽粒的真实灌浆进程,因此,更加适合玉米籽粒灌浆过程的拟合运算。3.2 灌浆速率与灌浆持续时间共同影响籽粒重量的形成
灌浆速率与灌浆持续时间共同决定粒重的形成,但不同阶段灌浆速率与灌浆持续时间对籽粒形成的贡献不尽相同。有研究表明灌浆速率对于粒重的贡献大于灌浆持续时间[2]。而李绍长等[26]的研究发现,同一品种粒重差异由灌浆速率决定,不同品种粒重差异由灌浆持续时间决定。本研究以包含172个家系的RIL群体为试验材料,进行相关性分析,结果显示,除缓增期灌浆持续时间外,其他灌浆特性相关性状对于粒重的增加均存在显著的正相关关系,与已有研究结果基本相同。在不同年代玉米品种的更替过程中(尤其在育种历史时期的前段),伴随着产量水平的逐步增加,选育品种的生育期也呈现一定的延长趋势[27]。而本研究结果表明,材料的生理成熟期与籽粒形成的最主要贡献因素—快增期灌浆持续时间(可解释生理成熟期表型变异的17.75%,可解释百粒重表型变异的57.50%)呈现显著的正相关关系。该结果在一定程度上解释了玉米前期育种进程中产量增益的生理学基础,即育种家通过对生理成熟期的间接选择(晚熟高产品种),相对延长了籽粒灌浆持续时间,从而不断提高了籽粒产量。
3.3 籽粒灌浆特性与生育期相关性状的QTL分析
灌浆特性与生育期相关性状都是多基因控制的数量性状,较易受环境因素的影响。本研究在单环境下检测到26个与灌浆特性相关的QTL和14个生育期相关的QTL,在多环境联合分析中检测到18个与灌浆特性相关QTL以及6个生育期相关的QTL。不同环境间灌浆速率的遗传力较高,表型较稳定,而灌浆持续时间的遗传力较低易受环境因素的影响。联合环境分析中仅能检测到灌浆速率与籽粒生长量相关QTL。LIU等[13]在bin 1.05检测到与授粉后16—23 d灌浆速率相关qGFR1b,bin 4.06、bin 5.02区间内分别检测到与授粉后32—40 d灌浆速率有关的qGF4b和qGFR5b,bin 9.04区间内检测到与授粉后32—40 d灌浆速率相关的qGFR9b以及与授粉后41—46 d灌浆速率相关的qGF9b,ZHANG等[14]在bin 7.03区间内检测到不同环境和不同灌浆阶段均与灌浆速率相关qGFR7b。本研究采用高密度遗传图谱在相同或邻近区间内亦检测到与灌浆速率以及籽粒生长量相关,且侧翼标记区间更小的QTL。本研究中,在第4染色体跨着丝粒的bin 4.05遗传区段(48.24 Mb—135.73 Mb)分别检测到平均灌浆速率、最大灌浆速率、缓增期灌浆速率、快增期灌浆速率以及减缓期灌浆速率相关的多个QTL,且增效等位变异全部来自黄早四。中国玉米骨干亲本遗传基础研究中发现,玉米骨干亲本黄早四的遗传改良中,该遗传区段可被84%以上的黄改系所保留[28]。CHEN等[29]在玉米染色体bin 4.05区间内发现了控制粒重以及籽粒体积相关QTL,LI等[18]也在bin 4.05区间内发现了控制粒重以及粒宽相关QTL。另外,在第9染色体bin 9.04(110.10 Mb—114.73 Mb)区间内检测到平均灌浆速率、最大灌浆速率以及快增期灌浆速率相关的QTL,且增效等位变异均来自旅28。PENG等[30]在bin 9.04区间内检测到籽粒产量相关QTL,ZHANG等[31]同样在该区间检测到灌浆速率相关位点。可见,该位点通过控制灌浆速率对玉米籽粒的形成同样具有重要的作用。
在玉米育种中,晚熟品种容易获得高产[5]。但在一定的光热条件下,玉米的产量增益,不可能仅仅依靠生育期的无限延长,因此,提高籽粒充实期间的灌浆速率对于高产育种更具现实意义。在此条件下,挖掘与熟期相关QTL相互独立的灌浆速率相关主效遗传位点,对提高育种选择效率意义重大。本研究中检测到的QTL呈现多个富集区域,但灌浆特性相关位点与生育期相关位点分别定位于不同染色体的不同区域,且增效等位变异分别来自不同的骨干亲本,这为不同骨干亲本灌浆速率相关优异等位变异的高效聚合提供了重要的信息。而相关位点的深入研究,将对揭示玉米籽粒灌浆特性遗传调控机制和候选基因挖掘奠定扎实的基础。
4 结论
以黄早四与旅28构建的RIL群体为试验材料,利用玉米灌浆特性相关性状与粒重的回归分析发现,快增期灌浆持续时间和快增期灌浆速率分别能解释百粒重表型变异的57.50%和30.00%,是玉米籽粒形成的决定性生理性状。QTL分析发现,仅能在单环境下检测到灌浆持续时间相关QTL,经联合环境分析发现,在第4染色体的bin 4.05及第9染色体的bin 9.04区段内定位了大量的灌浆速率相关QTL,且这些遗传区段与生育期相关QTL相互独立。The authors have declared that no competing interests exist.
