0 引言
【研究意义】化学农药对于保护作物免受真菌、昆虫和杂草等的损害具有重要作用。然而,大量农药的使用给环境带来很大压力。同时,由于光解、表面径流、化学降解等环境影响,造成农药活性成分的降解或者流失[1-3]。因此需要增加喷洒农药的次数以确保防治效果,这不仅增加了农药的损失,且增加了环境污染。近年来,控释技术受到人们越来越多的关注,对于有效利用农药,减少环境污染具有十分重要的意义[4-7]。微胶囊因其控释、持效期长、负载量高等优点,在农药剂型方面有很好的发展前景[8-14]。【前人研究进展】近年来,已有诸多基于聚合物载体的农药控释制剂的报道。例如通过聚乙烯醇水凝胶作为载体制备百草枯控释制剂,并研究其释放性能[15];乙基纤维素和木质素被使用作为壁材来制备氯草敏控释制剂(CRF)[16],其释放速率主要通过改变涂膜的颗粒尺寸和厚度来控制;在农药应用上,通过氮反应或硝化杂环反应制备酰胺类化合物用于微胶囊制剂研制[17];用聚脲作为微胶囊壁材,在水包油乳液中通过界面聚合法制得杀虫剂微胶囊[18];另外,在土壤-水系统中用乙基纤维素将除草剂氟草敏微囊化,并对其光稳定性进行了研究[19]。上述研究表明聚合物制剂具有良好的控制释放性能,然而,仍然集中在其制备及缓释性能研究方面,关于制剂的生物效应和环境效应关系研究较少。【本研究切入点】乙草胺是一种苗前选择性除草剂,用于控制一年生禾本科杂草及部分阔叶杂草、使用十分广泛[20],已有研究表明乙草胺对水生生物和植物有毒性风险[21-23];常规制剂在油菜田杂草防治中,往往出现持效期短等问题,需要加大用药量确保其土壤封闭杂草效果[24-26]。【拟解决的关键问题】将乙草胺溶解在苯乙烯和甲基丙烯酸丁酯中,通过与双丙酮丙烯酰胺共聚合反应,得到乙草胺(苯乙烯-甲基丙烯酸丁酯-双丙酮丙烯酰胺)微胶囊控释剂,并研究乙草胺微胶囊(MC)生物效应和环境行为之间的相互关系。1 材料与方法
1.1 试验材料
1.1.1 试剂 乙草胺原药(98%)、90%乙草胺乳油(EC)由江苏腾龙有限公司(中国江苏)提供。甲基丙烯酸丁酯(BMA)、苯乙烯(ST)、双丙酮丙烯酰胺(DAAM)、聚氧乙烯山梨醇酐硬脂酸酯(T-60)和过硫酸钾购自中国北京化工厂。乙腈和甲醇为HPLC级,购自J.T Baker(美国)。去离子水用于所有反应和处理过程。1.1.2 仪器 日立L-2000型高效液相色谱仪(日本株式会社日立高新技术那柯事业所);FA2004A电子天平(上海精天电子仪器有限公司);Coolsnap BK系列生物显微镜(重庆奥特光学仪器有限公司);IRAffinity-1傅立叶变换红外光谱仪(岛津国际贸易上海有限公司);FD-1冷冻干燥机(北京德天佑科技发展有限公司);SZCL-3A数显智能控温磁力搅拌器(巩义市予华仪器有限公司);德国蔡司SUPRA TM 55场发射扫描电子显微镜;Nicolet-210光谱仪;RISE-2006激光粒度分析仪(济南润之科技有限公司)。
1.2 试验方法
1.2.1 乙草胺微胶囊的制备 首先,将乙草胺(20.0 g)与苯乙烯(4.0 g)和甲基丙烯酸丁酯(2.0 g)混合,得到油相。然后,将油相分散到3% T-60的水相(总质量,100 g)中得到其乳液。将该体系在装有搅拌器、温度计和回流冷凝器的烧瓶中采用桨式搅拌器以200 r/min搅拌,加热至60℃,加入过硫酸钾引发聚合反应,继续升温至65℃反应2 h;然后加入0.1 g双丙酮丙烯酰胺,65℃再反应1.5 h。1.2.2 乙草胺微胶囊的表征 将之前制备的样品滤出沉淀,用蒸馏水洗涤3次,离心后在45℃下干燥,并用双蒸水为透析液,通过8000D透析袋透析48 h,每12 h换一次透析液,将透析袋中液体冷冻干燥后,对纯聚合物微胶囊进行表征。使用生物显微镜和场发射扫描电子显微镜来研究胶囊的形态和结构。使用红外光谱仪对其表面基团进行检测。
1.2.3 微胶囊前体含量测定方法 通过HPLC检查乙草胺、甲基丙烯酸丁酯、苯乙烯和双丙酮丙烯酰胺的浓度。方法如下:Kromasil C18反相色谱柱 (250 mm×4.6 mm内径,5 μm)用于分离;检测方法为甲醇与水的体积比为87﹕13,流速为1.0 mL·min-1,柱温为30℃,进样量20 μL,双丙酮丙烯酰胺、甲基丙烯酸丁酯、苯乙烯、乙草胺出峰时间分别为2.89、4.32、4.83、5.05 min,在乙草胺最大吸收波长(214 nm)下分析样品。使用外标法定量,对每样品进行3次重复。
1.2.4 乙草胺负载率及释放速率的测定方法 使用5 mL二氯甲烷溶解50 mg已制备的干燥样品,然后加入45 mL甲醇使聚合物沉淀,并且通过4 000 r/min高速离心2 h后用液相色谱测定乙草胺的负载量。乙草胺的负载效率为微胶囊中乙草胺与整个微胶囊的质量比。负载的乙草胺的释放曲线:称量每个样品并溶解在乙醇/水混合溶液(20﹕80,v/v)中。通过测量在不同时间溶解在乙醇/水混合物中的乙草胺的浓度计算制剂中乙草胺的累积释放速率,以评价其释放性能。
1.2.5 乙草胺土壤释放速率测定及药效试验 试验于2013年10—12月在重庆潼南实验站的油菜田(移栽后10 d苗期)中进行。将试验药剂20%乙草胺微胶囊和对照药剂90%乙草胺乳油分别设置为4个处理梯度(525、600、750、1 080 g ai·hm-2)进行土壤喷雾处理,并设置空白对照,每小区面积25 m2,每试验4个重复。分别计算得到在当天(4 h),20、40和60 d杂草控制效果。选择90%乙草胺EC作为对照药剂。在施用后当天(4 h),20、40和60 d对土壤进行取样,每小区随机取4个点,采样点相对分散。将10 g土壤样品浸入具有20 mL甲醇的100 mL离心管中。在210 r/min,25℃条件下离心30 min后,收集提取液。然后将提取的土壤用50 mL甲醇洗涤3次。随后,将总提取物在振荡器上振荡30 min,离心并过滤进一步提取活性成分,然后与上步提取液合并。将样品用无水硫酸钠柱干燥,通过蒸发,提取物的最终体积定容到2 mL。
1.2.6 数据统计与分析 调查的数据采用SPSS 18.0和Origin 6.0软件统计分析,绘制乙草胺的累积释放曲线;通过Origin 6.0软件拟合方程,得到k值,通过降解动力学方程,计算半衰期;通过SPSS软件对株防效和鲜重防效进行方差分析。
2 结果
2.1 乙草胺微胶囊的形成
乙草胺、甲基丙烯酸丁酯、苯乙烯和双丙酮丙烯酰胺的HPLC色谱图如图1所示。乙草胺、甲基丙烯酸丁酯、苯乙烯和双丙酮丙烯酰胺的峰较好地分离,检测不会相互影响。线性校准范围和回归方程如表1所示,乙草胺、甲基丙烯酸丁酯、双丙酮丙烯酰胺和苯乙烯均具有良好的线性且相对标准偏差较小。图2显示不同反应时间乙草胺、甲基丙烯酸丁酯、苯乙烯和双丙酮丙烯酰胺的含量。从0—4 h,乙草胺的含量差异不大。在约3.5 h时,甲基丙烯酸丁酯、苯乙烯和双丙酮丙烯酰胺含量逐渐降低。通过液谱检测反应单体的量,来追踪聚合反应的进程,从而更好地优化反应。乙草胺微胶囊的外观形态和尺寸通过场发射扫描电镜、生物显微镜和激光粒度分析仪进行检测分析(图3、图4)。图像显示大多数微胶囊为规则球状,颗粒尺寸为1.552 μm。最大负载率为60%。Table 1
表1
表1乙草胺、甲基丙烯酸丁酯、双丙酮丙烯酰胺和苯乙烯的线性校准范围、回归方程和检测限
Table 1Linear calibration range, regression equation and detection limit of acetochlor, butyl methacrylate, diacetone acrylamide and styrene
| 参数 Parameter | 乙草胺 Acetochlor | 甲基丙烯酸丁酯 Butyl methacrylate | 双丙酮丙烯酰胺 Diacetone acrylamide | 苯乙烯 Styrene |
|---|---|---|---|---|
| 校准范围 Calibration range (mg·L-1) | 1-100 | 1-100 | 1-100 | 1-100 |
| 回归方程 Regression equation (y=) | 460515x-127362 | 22088x-68833 | 20234x+40344 | 10243x+26141 |
| 相关系数 Coefficient regression (R2) | 0.9992 | 0.9990 | 0.9991 | 0.9994 |
| 相对标准偏差 RSD (%, n=6) | 0.37 | 0.45 | 0.75 | 0.12 |
| 检出限Limits of detection (mg·L-1) | 0.002 | 0.005 | 0.004 | 0.0045 |
新窗口打开
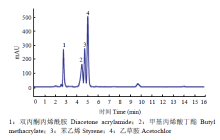 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1HPLC色谱图
-->Fig. 1HPLC chromatogram
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2不同反应时间含量变化动态
-->Fig. 2Variation of content with different reaction times
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图320%乙草胺微胶囊的生物显微镜和场发射扫描电镜图
-->Fig. 3The biological microscope and FESEM microscopy images of 20% acetochlor microcapsules
-->
图5为单独DAAM-BMA-ST纳米胶囊的红外光谱图。甲基丙烯酸丁酯的峰,由于酯C=O伸缩产生1 733 cm-1的峰,在1 126 cm-1显示C-O的峰。酰胺C=O伸缩(1 669 cm-1)和N-H伸缩(3 400 cm-1)的峰显示存在双丙酮丙烯酰胺。来自ST的峰包括由于=苯环C-H伸缩振动(3 035 cm-1)产生的峰和由于苯骨架振动(1 616、1 591、1 512、1 463 cm-1)产生的峰。聚合物红外光谱保留了纯聚合物的大部分主峰,表明甲基丙烯酸丁酯、苯乙烯和双丙酮丙烯酰胺之间发生反应,并获得聚合物。
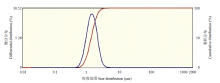 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图420%乙草微胶囊的粒度分布
-->Fig. 4The particle size distribution of 20% acetochlor microcapsules
-->
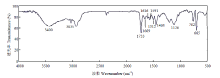 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5DAAM-BMA-ST纳米胶囊的红外光谱图
-->Fig. 5The infrared spectra of pure DAAM-BMA-ST nanocapsules
-->
2.2 pH和温度对乙草胺微胶囊释放的影响
保持pH恒定(pH=7.0)搅拌速度为100 r/min的条件下,测定温度(20、25、30、35、45℃)对乙草胺微胶囊释放行为的影响。乙草胺的累积释放率在第5天约为50%—70%,在第10天为60%—90%,第30天为80%至接近100%(图6-A)。在保持温度恒定(25℃),搅拌速度为100 r/min的条件下,通过改变pH(5.0、6.0、7.0、8.0和9.0)研究乙草胺微胶囊的释放行为。在pH 5.0—9.0范围内,乙草胺的累积释放率在第5天为60%—70%,在第10天从<70%至接近80%,在第30天为约80%,第40天近乎100%。在pH 5.0—9.0范围内,乙草胺的累积释放率随pH的升高影响不明显(图6-B)。由结果可知温度比pH更易影响乙草胺微胶囊的控制释放效果,可根据温度对释放率的影响合理施药。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6温度(A)、pH(B)对乙草胺释放的影响
-->Fig. 6Effects of temperatures (A) and pH (B) on the acetochlor release behaviors
-->
2.3 分析方法质量控制
在土壤样品中添加乙草胺浓度为0.01、0.1和1.0 mg·kg-1,结果表明土壤检测方法平均回收率在91.11%—97.07%,相对标准偏差4.32%—6.66% (表2)。Table 2
表2
表2土壤中乙草胺的回收率
Table 2Recovery rates of acetochlor in soil
| 土壤样品 Soil sample | 添加量 Addition level (mg·kg-1) | 回收率Recovery (%) | 平均回收率 Average recovery (%) | 相对标准偏差 Relative standard deviation (RSD, %) | ||||
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | ||||
| 0.01 | 90.45 | 96.62 | 87.06 | 93.38 | 88.03 | 91.11 | 4.32 | |
| 0.1 | 101.42 | 91.13 | 93.06 | 100.55 | 99.17 | 97.07 | 4.80 | |
| 1.0 | 96.73 | 87.95 | 87.31 | 88.48 | 100.84 | 92.26 | 6.66 | |
新窗口打开
2.4 乙草胺微胶囊和乳油在土壤中降解率对比
乙草胺的检测限(S/N=3)为0.008 mg·kg-1。图7为不同时间在土壤中乙草胺残留的变化动态。对于MC和EC,结果表明乙草胺的含量逐渐减少,半衰期分别为41.5—70.3 d和16.6—18.9 d。通过对检测结果进行分析得出,MC中乙草胺的降解速度低于EC,且MC延长了乙草胺的释放时间。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7室外不同时间乙草胺残留变化曲线
-->Fig. 7Variation of acetochlor residues at different times in the field
-->
2.5 乙草胺微胶囊与乳油药效对比
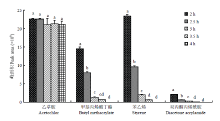
乙草胺微胶囊在杂草控制上具有良好的性能。在525—1 080 g ai·hm-2的浓度范围内,乙草胺微胶囊和乳油的杂草株防效及鲜重防效如图8所示。乙草胺微胶囊在施药20 d后,禾本科杂草和总杂草防治效果分别为80.2%—95.4%和67.8%—82.1%;施药后40 d为82.2%—92.4%和70.2%—80.9%,施药后60 d为87.0%—97.2%和62.6%—91.3%。在第60天鲜重控制效能为90.1%—98.0%和70.3%—88.7%。常规乙草胺乳油,在施药20 d后,禾本科杂草和总杂草防治效力为80.4%—90.2%和54.8%—76.1%;第40天为83.0%—91.2%和61.4%—79.8%;第60天为81.1%—88.3%和71.2%—84.0%;鲜重控制效能在第60天为80.3%—83.4%和65.9%—74.0%。结果表明,在施药20 d之后,乙草胺微胶囊与常规乙草胺乳油相比具有更好的防治效果,显示乙草胺微胶囊对杂草具有可持续的防治效果。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8乙草胺微胶囊和乳油对杂草的株防效及鲜重防效
-->Fig. 8Plant control efficacy and fresh weight control efficacy of acetochlor microcapsules and emulsifiable concentrate on weeds
-->
3 讨论
目前,乙草胺的使用十分普遍,但由于光解、微生物降解等环境因素影响[27-28],会造成活性成分的流失或分解,导致后期防效相对较差的问题,从而乙草胺常规制剂需加大开始施药量以延长药效,但对环境造成了很大影响。微胶囊因其持效期长、高效和安全等特点在农药剂型加工方面受到多数国内外研究者的关注。本试验使用苯乙烯、甲基丙烯酸丁酯和双丙酮丙烯酰胺作为壁材,通过界面聚合法制备了粒径均一的乙草胺微胶囊。通过研究pH和温度对乙草胺微胶囊释放的影响,可知pH和温度对乙草胺微胶囊的控制释放均有影响,且温度对其的影响比pH更大,这与在较高温度下高分子材料膨胀、囊壁变疏松有关,使药物更容易释放出来[29]。本研究结果对温敏型农药微胶囊制剂开发,
及精准施药等研究有一定参考价值。
通过田间试验和农药残留的试验结果可知,乙草胺微胶囊的药效与持效期明显优于乙草胺乳油。同时,乙草胺微胶囊处理过的土壤中药剂残留量比乳油制剂更高,这也保证了乙草胺微胶囊制剂具有更好防治效果,降低乙草胺有效成分在环境中的总量。通过高分子壁材包裹后有利于提高有效成分稳定性[30],明显降低乙草胺在环境中的降解,提高了其持效期、减少用药量,具有较好的开发前景。以往农药微胶囊研究主要集中在其制备及防治效果上,而本研究通过调查乙草胺微胶囊释放性能与在土壤中农药残留情况并结合防治效果,更好地明确了三者的关系,对药剂的减量增效及提高环境安全具有重要意义。
4 结论
通过苯乙烯、双丙酮丙烯酰胺和甲基丙烯酸丁酯之间的乳液界面聚合制备了新的微胶囊,负载率可达到60%,建立了温度和pH控释性能的释放动力学模型。总体上,该制剂呈现高负载率,较好的持续释放性能。因此,这种微胶囊载体可以在将来延伸到其他亲脂性农药。同时,与乳油相比,微胶囊持效期更长,可以提高控制杂草的效力。The authors have declared that no competing interests exist.
