0 引言
【研究意义】嫩度是肉品的重要品质特性之一,直接影响消费者的购买意向。宰后肌肉的嫩化主要发生在僵直后的解僵成熟阶段,大量研究表明,这一过程主要受钙蛋白酶系统的调控,尤其是μ-钙蛋白酶(μ-calpain),对宰后肌原纤维蛋白及细胞骨架蛋白降解引起的肌肉嫩化具有重要作用。因此,研究不同嫩度羊肉在宰后成熟过程中钙蛋白酶的差异,能够为以调控钙蛋白酶活性为途径的嫩化方法提供理论基础。【前人研究进展】TAYLOR等[1]在研究Z-线蛋白降解与嫩度的关系时发现,μ-钙蛋白酶在宰后早期被激活,而此期间内肌肉中关键的肌原纤维蛋白也在大量降解。LIU等[2]通过研究僵直前期不同温度对钙蛋白酶活性的影响,证明钙蛋白酶的激活程度与肌肉嫩度正相关。GOLL[3]、ZIMMERMAN[4]等研究发现,μ-钙蛋白酶发生自溶后会降低激活其活性所需的Ca2+浓度,使μ-钙蛋白酶的Ca2+需要量接近生理范围。ZHANG等[5]在对牛肉成熟过程品质特性的研究中发现,μ-钙蛋白酶自溶状态出现的越早,可检测到的肌间线蛋白、肌联蛋白等肌原纤维蛋白的降解情况会越早。MELODY等[6]在研究宰后早期影响猪肉嫩度和持水力的生化因素时发现,早期μ-钙蛋白酶的自溶与μ-钙蛋白酶的激活及关键蛋白的降解有关。μ-钙蛋白酶由80 kDa的大催化亚基和28 kDa的调节亚基组成,80 kDa的大亚基包括自溶域、催化域、调节域和Ca2+结合域,其发挥蛋白水解活性而自溶主要体现为80 kDa大亚基的逐渐降解。GEESINK等[7]以检测自溶状态的μ-钙蛋白酶来反映蛋白的水解情况,将μ-钙蛋白酶的自溶速率作为反映钙蛋白酶活性的理想指标。【本研究切入点】目前关于μ-钙蛋白酶与嫩度关系的研究主要集中在体外模型试验或间接的μ-钙蛋白酶活性与嫩度相关性的研究等方面,对嫩度差异样品中μ-钙蛋白酶的研究也大多仅以μ-钙蛋白酶活性或自溶状态中的一个指标来反映。而在宰后成熟过程中,嫩度差异样品的μ-钙蛋白酶活性及自溶状态的变化情况是否存在直观差异以及μ-钙蛋白酶活性与自溶状态的变化是否吻合目前并不清楚。【拟解决的关键问题】本研究以品种、年龄、性别、生长环境相同的乌珠穆沁大尾羊为试验材料,在将样品分为高、低嫩度组的基础上,研究不同嫩度羊肉中钙蛋白酶的差异,明确羊肉宰后成熟过程中μ-钙蛋白酶的变化特点及发挥水解作用的时间,为通过调控μ-钙蛋白酶活性改善宰后肌肉嫩度的方法途径提供理论依据。1 材料与方法
试验于2015年在中国农业科学院农产品加工研究所进行。1.1 试验材料
1.1.1 试验样品 选取50只月龄为7—8个月的乌珠穆沁大尾羊,按伊斯兰屠宰方式进行屠宰,宰后羊胴体重量约为17 kg。在宰后迅速取下双侧背最长肌,冷库中快速剔除表面筋膜及脂肪,分别于宰后30 min、1 h、2 h、6 h、12 h、24 h、48 h、72 h、5 d及7 d取等量样品分装到速冻管并放入液氮中速冻,保存于-80℃备用;并同时测定各时间点肉样的pH。1.1.2 试剂材料 蛋白浓度测定试剂盒、PVDF膜购自美国Thermo公司;μ-钙蛋白酶单克隆抗体、辣根过氧化酶标记的羊抗鼠IgG、亮抑酶肽、三羟甲基氨基甲烷(Tris Base)、十二烷基硫酸钠、丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵、四甲基乙二胺购自美国Sigma公司;ECL显色试剂盒购自美国Bio-Rad公司;甲醇、乙醇、乙酸等为国产分析纯试剂,购自国药集团化学试剂有限公司。
Testo 205便携式pH计,德国德图公司;Ultra TurraxDisperser S25分散器,德国IKA公司;Neofuge高效冷冻离心机,上海力申科学仪器有限公司;T6紫外可见分光光度计,北京普析通用仪器有限责任公司;ML204/02 电子天平,上海梅特勒-托利多有限公司;SpectraMax 190全波长酶标仪,美国Molecular Devices公司;电泳设备(Mini-PROTEAN Tetra System)、转膜设备(Mini Trans-Blot)及ChemiDocTM MP凝胶成像系统,美国Bio-Rad公司。
1.2 试验方法
1.2.1 蛋白提取 参考VEISETH等[8]的方法,取1 g冷冻的羊背最长肌样品,加入三倍体积的抽提液(100 mmol·L-1 Tris base,10 mmol·L-1 EDTA,0.05%巯基乙醇,6 mg·L-1亮抑酶肽,pH 8.3)后冰上匀浆30 s(每匀浆10 s,间隔30 s),所得的匀浆液在10 000×g、4℃条件下离心35 min,上清液即为所需的蛋白样品。BCA法(Pierce BCA Protein Assay Kit,Thermo)测定蛋白浓度,保存于-80℃备用。1.2.2 pH 取样过程中,使用便携式pH计(Testo 205,德图,德国)分别于宰后30 min、1 h、2 h、6 h、12 h、24 h、48 h、72 h、5 d及7 d测定各时间点肉样的pH。探头插入深度为2 cm,连续测定3次,结果取平均值。
1.2.3 肌原纤维小片化指数(MFI) 参考CULLER等[9]的方法,并稍作修改。称取0.5 g肉样,切碎后加入5 mL预冷的MFI缓冲液(100 mmol·L-1 KCl、20 mmol·L-1 K2HPO4、1 mmol·L-1 EDTA、1 mmol·L-1 MgCl2、1 mmol·L-1 NaN3),高速匀浆3次,每次30 s(中间间隔1 min),匀浆后3 000×g、4℃下离心15 min;将沉淀用5 mL预冷的MFI缓冲液悬浮,再在 3 000×g、4℃下离心15 min,弃去上清;用1.25 mL预冷的MFI缓冲液将沉淀充分悬浮,将悬浮液用20目筛网过滤除去结缔组织,再加1.25 mL MFI缓冲液清洗离心管并帮助肌原纤维通过筛孔。过滤后的悬浮液用双缩脲法测定蛋白浓度,然后用MFI缓冲液调整悬浮液蛋白浓度为(0.5±0.05)mg·mL-1,在540 nm测定吸光度,将所得结果乘200后即可得到MFI值。
1.2.4 蛋白质免疫印迹 参考LOMIWES[10]等的方法并稍作修改。提取的肌浆蛋白样品调整至统一浓度后,按1﹕1(v/v)加入SDS-PAGE上样缓冲液,沸水浴中加热5 min,冷却后12 000×g离心1 min,取上清液上样,上样量为60 μg。SDS-PAGE采用8%的分离胶和4%的浓缩胶(丙烯酰胺﹕甲叉双丙烯酰胺=37.5﹕l(w/w))。电泳初始电压为70 V,待蛋白进入分离胶后调整电压为110 V,至蛋白到达离凝胶底物5 mm处停止电泳。采用湿法将凝胶上的蛋白条带转移至PVDF膜上,100 V恒压冰浴转膜100 min。转膜结束后将PVDF膜在TBS缓冲液(0.01 mol·L-1 Tris、0.15 mol·L-1 NaCl,pH 7.5)中清洗3次,每次1 min。封闭液(含0.05% Tween-20,3%牛血清白蛋白的TBS溶液)中室温封闭1 h。免疫印迹的一抗使用μ-钙蛋白酶单克隆抗体(Sigma,C0355),稀释比为1﹕300,4℃过夜孵育;随后将膜用TBST1溶液(含0.1% Tween-20的TBS溶液)漂洗3次后与二抗(二抗为辣根过氧化酶标记的羊抗鼠IgG,稀释比为1﹕ 5 000)室温孵育1 h;孵育结束后用TBST2溶液(0.05 mol·L-1 Tris、0.15 mol·L-1 NaCl、0.1% Tween-20,pH 7.5)漂洗PVDF膜3次,ECL法显色曝光,并使用凝胶成像仪拍照。通过Phoretix 1D(CLIQS,1.1)软件分析蛋白免疫印迹条带的光密度值。
1.2.5 酪蛋白底物酶原分析法 参考VEISETH等[8]的方法并稍作调整。提取的肌浆蛋白样品调整至统一浓度后,按3﹕2(v/v)加入样品缓冲液(150 mmol·L-1 Tris-HCl(pH 6.8),20%甘油,0.75%巯基乙醇(MCE),0.02%(w/v)溴酚蓝),混匀后备用。采用12.5%的酪蛋白分离胶(丙烯酰胺﹕甲叉双丙烯酰胺=75﹕1(w/w),375 mmol·L-1 Tris-HCl(pH 8.8),0.05%的TEMED(w/v),0.05%的APS(w/v),2.1 mg·mL-1酪蛋白)和4%的浓缩胶(丙烯酰胺﹕甲叉双丙烯酰胺=37.5﹕l(w/w),125 mmol·L-1 Tris-HCl(pH 6.8),0.05%的TEMED(w/v),0.05%的APS(w/v),凝胶厚度为0.75 mm。上样前在4℃下100 V恒压预跑15 min,上样量为60 μg,相同电泳缓冲液(25 mmol·L-1 Tris-HCl、0.05% MCE、192 mmol·L-1甘氨酸、1 mmol·L-1 EDTA,pH 8.3)中4℃下100 V恒压电泳7 h。电泳结束后更换3次孵育缓冲液(50 mmol·L-1 Tris、0.05% MCE、4 mmol·L-1 CaCl2,pH 7.5)在室温下孵育1 h(每次20 min),同种缓冲液中室温孵育16 h。凝胶经考马斯亮蓝染色后脱色,使用凝胶成像系统照相,所得结果采用Phoretix 1D(CLIQS,1.1)软件进行分析。
1.3 数据处理及分析
采用IBM SPSS 17.0统计软件进行方差分析,用最小显著差异法(least significant difference,LSD)和邓肯氏总重比较法(Duncans Multiple-rang test)进行差异显著性分析。2. 结果
2.1 羊肉嫩度分析及分组
根据宰后24 h及48 h的肌原纤维小片化指数(MFI值),从采集的50只羊中选出了8只羊分为高、低嫩度两组,每组各4只羊。MFI值的测定结果显示,宰后24 h及48 h,高嫩度组的MFI值均显著高于低嫩度组(P<0.05)(表1)。Table 1
表1
表1肌原纤维小片化指数测定结果
Table 1Results of analysis of MFI
| 宰后时间 Postmortem time | 高嫩度组(平均值±标准差) Tender group (average±SD) | 低嫩度组(平均值±标准差) Tough group (average±SD) |
|---|---|---|
| 24 h | 58.38±2.73a | 30.08±5.32b |
| 48 h | 62.56±3.00a | 44.54±8.71b |
新窗口打开
2.2 高、低嫩度组羊肉宰后pH的变化
宰后成熟过程中,高、低嫩度组羊背最长肌的pH均呈现相同的变化趋势(图1),在达到极限pH值后,pH值逐渐增加。且在宰后各时间两组间的pH值均差异不显著(P>0.05)。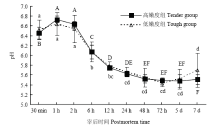 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1宰后高、低嫩度组羊肉pH的变化图中不同大写字母表示高嫩度组不同成熟时间的结果差异显著(P<0.05),不同小写字母表示低嫩度组不同成熟时间的结果差异显著(P<0.05)。下同
-->Fig. 1Changes of pH at postmortem in tender/tough groupsValues with different capital letters show significant difference in the results of different mature time of tender group (P<0.05), while values with different lowercases show significant difference in the results of different mature time of tough group (P<0.05). The same as below
-->
2.3 μ-钙蛋白酶免疫印迹分析
宰后成熟过程中,μ-钙蛋白酶80 kDa的大亚基逐渐降解(图2、3)。在宰后7 d内,随着μ-钙蛋白酶被激活并发挥活性,μ-钙蛋白酶的大亚基由80 kDa降解为78 kDa,最终降至76 kDa。宰后30 min,高嫩度组μ-钙蛋白酶80 kDa大亚基含量显著高于低嫩度组(P<0.05)。宰后6 h,高嫩度组μ-钙蛋白酶80 kDa大亚基开始降解,而低嫩度组μ-钙蛋白酶80 kDa大亚基在宰后2 h出现明显降解,但2—24 h基本保持不变。宰后48 h高嫩度组μ-钙蛋白酶80 kDa大亚基已基本完全降解,而低嫩度组μ-钙蛋白酶80 kDa大亚基在宰后5 d才基本降解完全。因此,高嫩度组μ-钙蛋白酶80 kDa大亚基的初始含量高,但降解速度快,导致其蛋白水解活性高,主要在宰后2—48 h内发挥作用。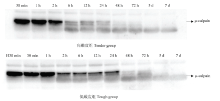 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2宰后高、低嫩度组羊肉中μ-钙蛋白酶的免疫印迹成像图中H30 min表示高嫩度组宰后30 min样品。下同
-->Fig. 2Western blots profiles showing the state of μ-calpain at postmortem in tender/tough groupsH30 min represents the muscle sample at 30 min postmortem in tender group. The same as below
-->
2.4 μ-/m-钙蛋白酶酪蛋白底物酶原分析
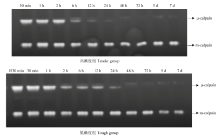
在酪蛋白底物酶原分析法检测肌肉中的μ-/m-钙蛋白酶时,在孵育过程使用了4 mmol·L-1的Ca2+,在此浓度条件下,凝胶上所有的μ-/m-钙蛋白酶均可被激活,发挥其活性进而降解所在条带位置处的酪蛋白,因此,本试验中,凝胶上检测到的为肌肉中尚未发挥蛋白水解活性/未自溶的μ-/m-钙蛋白酶的含量。由试验结果可知,宰后成熟过程中,高、低嫩度组羊背最长肌中未自溶的μ-钙蛋白酶的含量均逐渐降低(图4、5)。高嫩度组宰后12 h内未自溶μ-钙蛋白酶的含量快速下降,12 h后变化较为缓慢,而低嫩度组样品中未自溶的μ-钙蛋白酶在宰后12 h含量仍较高。宰后30 min、2 h高嫩度组未自溶的μ-钙蛋白酶含量显著高于低嫩度组(P<0.05),宰后12 h、5 d及7 d低嫩度组未自溶的μ-钙蛋白酶含量显著高于高嫩度组(P<0.05)。宰后成熟过程中,两组的m-钙蛋白酶酪蛋白水解活性变化不明显,m-钙蛋白酶并未在宰后7 d内发生自溶降解。因此,高嫩度组未自溶的μ-钙蛋白酶初始含量高,但自溶/失活速度快,导致其活性作用强,主要在宰后2—24 h发挥作用。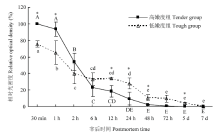 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3宰后高、低嫩度组羊肉中μ-钙蛋白酶80 kDa大亚基的变化*表示宰后同一成熟时间高嫩度组与低嫩度组的结果差异显著(P<0.05)。下同
-->Fig. 3Changes of 80 kDa large subunit of μ-calpain at postmortem in tender/tough groups* shows significant difference in the results between tender group and tough group at the same time of post-mortem (P<0.05). The same as below
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4宰后高、低嫩度组羊肉中μ-/m-钙蛋白酶酪蛋白底物酶原图谱
-->Fig. 4Casein zymography profiles presenting the μ-/m-calpain at postmortem in tender/tough groups
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5宰后高、低嫩度组羊肉中未自溶μ-钙蛋白酶含量的变化
-->Fig. 5Changes of the content of native μ-calpain at postmortem in tender/tough groups
-->
3 讨论
3.1 羊肉嫩度分析
MFI值是反映宰后肌原纤维蛋白、细胞骨架蛋白降解程度的一个重要标志[11],能体现宰后I带关键结构蛋白的降解及肌纤维连接作用的削弱程度,与宰后肌肉的嫩度显著正相关[12],是反映宰后肌肉嫩度的主要指标之一。本研究测定了50只羊宰后24 h和48 h背最长肌的MFI值,并对结果进行了排序。选择了24 h及48 h MFI值高和低的羊各4只作为高、低嫩度组的样品。试验结果表明,两组羊背最长肌样品的嫩度具有显著差异,可用于后续试验的进一步分析。3.2 不同嫩度羊肉宰后pH的变化
宰后肌肉的糖酵解作用消耗ATP并产生乳酸,乳酸的累积使得肌肉的pH逐渐下降,当乳酸含量趋于稳定后,pH也逐渐趋于稳定。MARSH等[13-14]研究表明,宰后pH的下降速率影响宰后肌肉的嫩度。此外,pH也是μ-钙蛋白酶活性和自溶程度的重要影响因素[15],许多研究证实,宰后pH下降速度快的肌肉中μ-钙蛋白酶失活的速率也快[16-18]。CLAEYS等[19] 在宰后低pH的肌肉中检测到的μ-钙蛋白酶活性也较低。POMPONIO等[20]在研究宰后早期猪肌肉中pH的下降对钙蛋白酶活性的影响时发现,宰后μ-钙蛋白酶自溶及失活的速度与pH的下降速度呈高度正相关性,且pH的下降速度快,肌原纤维小片化的速度也快。本研究中,高、低嫩度两组在宰后7 d内pH的变化趋势相同,且各时间点pH差异不显著,说明pH并不是造成两组样品嫩度差异的原因,宰后高、低嫩度两组样品中钙蛋白酶的生理生化状态也并不受pH的干扰。在本试验中,排除了pH对嫩度及钙蛋白酶的影响作用。3.3 不同嫩度羊肉宰后μ-/m-钙蛋白酶的差异
研究表明,宰后早期μ-钙蛋白酶的自溶与活性的激活及早期肌原纤维蛋白的降解有关[6],宰后大部分蛋白质的降解及肌肉嫩化进程由μ-钙蛋白酶的激活引起,μ-钙蛋白酶自溶的速度快,会更早的被激活并较快的失活。YUAN等[21]通过蛋白质免疫印迹法检测羊宰后成熟过程中μ-钙蛋白酶的自溶情况发现,μ-钙蛋白酶的自溶和激活程度与宰后蛋白降解有关,自溶程度越大,肌原纤维蛋白的降解程度也越大。CRUZEN等[22]在不同肌肉宰后蛋白降解的研究中发现,蛋白水解程度低的肌肉中μ-钙蛋白酶完整的80 kDa大亚基的存在比例高,肌肉的嫩度差。本试验通过对比宰后高、低嫩度两组样品μ-钙蛋白酶80 kDa大亚基的变化情况,明确μ-钙蛋白酶的激活状态及活性与羊肉嫩度的关系。由试验结果可知,宰后30 min,高嫩度组μ-钙蛋白酶80 kDa大亚基的含量显著高于低嫩度组,说明高嫩度组羊肉中μ-钙蛋白酶80 kDa大亚基的初始总量高。但随着宰后时间的延长,高嫩度组μ-钙蛋白酶自溶的速率显著高于低嫩度组,宰后6 h高嫩度组μ-钙蛋白酶出现明显的78、76 kDa的降解条带,在宰后12 h,高嫩度组μ-钙蛋白酶80 kDa大亚基的含量显著低于低嫩度组,表明高嫩度组μ-钙蛋白酶的激活程度及活性都明显高于低嫩度组。在酪蛋白底物酶原分析法对高、低嫩度组羊肉中未自溶μ-/m-钙蛋白酶含量的检测中发现,高、低嫩度两组羊背最长肌样品中未自溶的μ-钙蛋白酶的含量随宰后时间的延长均呈下降趋势,表明μ-钙蛋白酶在宰后成熟过程中通过自溶逐渐发挥其嫩化作用。研究表明,μ-钙蛋白酶对肌肉的嫩化作用主要发生在宰后前3 d,μ-钙蛋白酶因自溶而被激活,在发挥蛋白水解活性的同时,自身会降解失活,最终完全丧失活性。但宰后肌肉中Ca2+的浓度达不到m-钙蛋白酶激活所需的水平,故m-钙蛋白酶并不发挥作用[23-25]。O’HALLORAN等[26]研究表明,宰后3 h μ-钙蛋白酶活性低的肌肉更嫩,骨骼肌蛋白水解的程度更大,即μ-钙蛋白酶自溶失活速度快的肌肉嫩度更好。宰后30 min,高嫩度组未自溶μ-钙蛋白酶的含量显著高于低嫩度组,而宰后6 h,低嫩度未自溶μ-钙蛋白酶的含量高,高嫩度组μ-钙蛋白酶出现明显的自溶条带。至宰后12 h时,高嫩度组未自溶μ-钙蛋白酶含量显著低于低嫩度组,说明高嫩度组μ-钙蛋白酶自溶并发挥活性的速率更快,对肌肉嫩化的作用更为突出,这与蛋白质免疫印迹法检测到的宰后高、低嫩度组中μ-钙蛋白酶降解发挥蛋白水解活性的变化结果一致。在宰后7 d内,高、低嫩度两组样品中m-钙蛋白酶的活性没有明显变化,也未出现自溶降解现象,表明m-钙蛋白酶并未在这一过程中发挥作用。本试验中,高、低嫩度组嫩度的差异与m-钙蛋白酶的活性无关。
本研究中,高、低嫩度组嫩度的差异与宰后pH的变化无关,两组样品在宰后的贮藏温度及环境相同,表明温度和pH并不是引起两组样品嫩度差异的原因,也排除了温度及pH对高、低嫩度组整体μ-钙蛋白酶活性差异的影响。但在本研究中,高、低嫩度组μ-钙蛋白酶自溶激活的初始时间不同,高嫩度组μ-钙蛋白酶在宰后2—6 h变化显著,而低嫩度组在宰后1—2 h内已开始有明显变化,根据pH的测定结果可知,虽然宰后不同成熟时间高、低嫩度两组样品的pH均差异不显著,但宰后1 h及2 h低嫩度组样品的pH较低,可能较早的激活了μ-钙蛋白酶,造成两组样品μ-钙蛋白酶激活起始时间存在差异。但总体来看,高嫩度组的含量高于低嫩度组,其自溶及激活的程度却更大,引起两组样品中活性差异的主要调控因子仍需进一步研究确定。
4 结论
宰后高、低嫩度组羊肉中μ-钙蛋白酶80 kDa大亚基的存在状态及未自溶的μ-钙蛋白酶含量存在显著差异,高嫩度组μ-钙蛋白酶的自溶和激活程度显著高于低嫩度组。宰后30 min,高嫩度组初始的μ-钙蛋白酶含量高于低嫩度组,但随着宰后时间的延长,其降解的程度也快于低嫩度组。高、低嫩度组样品中的μ-钙蛋白酶在宰后6 h及12 h的差异最为显著。宰后24 h内,尤其是12 h内,μ-钙蛋白酶的变化状态对羊肉嫩度的影响最大。The authors have declared that no competing interests exist.
