 ,1,3, 卢明珠1, 于光夏3, 杨艳1, 耿静1, 曹子铖3, 李玉娜3
,1,3, 卢明珠1, 于光夏3, 杨艳1, 耿静1, 曹子铖3, 李玉娜3Responses of Soil Organic Carbon Fractionation and Microbial Community to Nitrogen and Water Addition in Artificial Grassland
XU Meng1, XU LiJun2, CHENG ShuLan3, FANG HuaJun ,1,3, LU MingZhu1, YU GuangXia3, YANG Yan1, GENG Jing1, CAO ZiCheng3, LI YuNa3
,1,3, LU MingZhu1, YU GuangXia3, YANG Yan1, GENG Jing1, CAO ZiCheng3, LI YuNa3通讯作者:
责任编辑: 林鉴非, 李云霞
收稿日期:2019-09-13接受日期:2019-12-8网络出版日期:2020-07-01
| 基金资助: |
Received:2019-09-13Accepted:2019-12-8Online:2020-07-01
作者简介 About authors
徐梦,Tel:15201029279;E-mail: xumeng@igsnrr.ac.cn。

摘要
关键词:
Abstract
Keywords:
PDF (1673KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
徐梦, 徐丽君, 程淑兰, 方华军, 卢明珠, 于光夏, 杨艳, 耿静, 曹子铖, 李玉娜. 人工草地土壤有机碳组分与微生物群落对施氮补水的响应[J]. 中国农业科学, 2020, 53(13): 2678-2690 doi:10.3864/j.issn.0578-1752.2020.13.016
XU Meng, XU LiJun, CHENG ShuLan, FANG HuaJun, LU MingZhu, YU GuangXia, YANG Yan, GENG Jing, CAO ZiCheng, LI YuNa.
0 引言
【研究意义】由于气候变化、过度放牧以及人类活动等因素的作用,目前我国接近90%的天然草地面临着退化的威胁[1],而建设优质高效的人工草地能够有效缓解天然草地的放牧压力,从而有助于退化草地以及区域生态环境的恢复。草地生态系统的土壤有巨大的固碳潜力[2],而施肥、灌溉等常见的草地管理方式对草地土壤有机碳(SOC)周转动态有显著影响,进而影响草地生态系统碳、氮等元素的生物地球化学循环过程[3,4]。土壤微生物是生态系统功能发挥和生物地球化学循环的驱动者,不同草地管理方式下土壤微生物群落数量和功能的差异可能对草地SOC固持以及土壤碳氮循环过程产生显著影响。因此,开展施肥、灌溉等管理方式对人工草地SOC组成以及土壤微生物群落组成和活性的研究,有助于深入认识和阐明不同管理方式在人工草地生产力、稳定性以及生态系统多功能性等方面的调控机制和相对重要性,并为逐步完善我国人工草地功能调控的理论基础提供科学试验依据。【前人研究进展】施肥(尤其是氮肥)有提升草地土壤有机碳固持的潜力[3,5-6],但是也有研究表明氮素富集对草地SOC的影响并不唯一[7]。通过物理或化学分组方法,SOC能够被分解为多个功能性或者生物组成上不同的组分[8],这些组分通常具有不同的周转速率[9],因而能够更加敏感的反映出管理方式对草地SOC的影响并有助于揭示其调控机制。例如,吸附在土壤矿物颗粒表面的有机碳(矿物结合态有机碳,MAOC)较难被微生物利用从而比较稳定,而颗粒态有机碳(POC)主要包含未分解或半分解的植物残体,因而较为容易被微生物分解利用[10]。RIGGS等[11]发现,施氮对SOC组分有显著影响,但是不同SOC组分的响应有差异。并且,近期研究发现SOC对氮素富集的响应主要取决于物理(团聚体结合态SOC)或化学保护机制(MAOC),而非SOC的化学组成(分子构成)[12,13]。因此,研究人工草地不同SOC组分对施氮的响应有助于深入理解管理措施对人工草地土壤碳固持和周转的影响。除了直接影响SOC组分,施氮能够通过影响土壤微生物数量、活性以及与碳循环的相关过程或功能,进而影响SOC的积累或耗损[14,15,16]。土壤微生物能够分为贫营养型(或者K-策略)以及富营养型(或者r-策略),而不同功能类型的微生物在生物量周转和SOC分解效率上有明显差异[17]。因此,不同土壤微生物功能类群对施肥和灌溉等管理方式的响应差异可能对草地土壤碳循环和SOC固持产生显著影响[18,19]。目前对施氮和灌溉对土壤微生物群落数量和组成的影响已有许多报道,但是结论不一。例如,施氮或补水能降低真菌和细菌的比值(F/B)[20,21]以及革兰氏阳性细菌和革兰氏阴性细菌的比值(G+/G-)[22],但是也有研究发现土壤微生物群落组成不受施氮和补水的影响[23,24]。除了数量和组成,土壤微生物分泌的胞外酶也会受到施氮或灌溉的影响[21,25]。土壤胞外酶是土壤有机质分解的关键媒介,其活性、产量以及酶生态化学计量比值(即获取碳、氮、磷的主要胞外酶比值)与碳源底物及氮、磷养分有效性密切相关,能够反映微生物群落的养分需求与环境养分之间的生物地球化学平衡状况[26]。目前对天然草地土壤微生物如何响应施氮和补水已有一定研究[15,21,27],但是对人工草地的关注十分有限,急需开展相应研究。【本研究切入点】作为常用的提升人工草地产量的重要管理措施,施肥和灌水能够通过改变土壤养分有效性而影响土壤微生物群落的组成或功能,进而影响微生物对SOC的分解作用,最终导致人工草地SOC的积累或耗损。然而,不同SOC组分以及微生物类群对施氮和补水的差异性响应,以及微生物群落特征(数量、组成及功能)与SOC周转动态的耦联关系,亟需要进行深入分析。【拟解决的关键问题】本研究在内蒙古呼伦贝尔人工草地水氮添加控制试验平台采集土壤样品,利用物理法对具有不同周转和稳定性的有机碳组分进行分组,同时利用磷脂脂肪酸法(PLFA)和酶标仪法测定土壤微生物群落组成和活性,明确施氮、补水及其交互作用对人工草地SOC组分及土壤微生物的影响,并探讨土壤微生物数量或活性与SOC组分的耦联关系,以阐明施氮和补水对呼伦贝尔人工草地土壤碳固持的影响及其作用机制。1 材料与方法
1.1 采样区域自然概况及试验设计
本研究在呼伦贝尔国家野外站(N 49°6′—49°32′,E 119°32′—120°35′)的人工草地试验平台进行。该地区属于中温带半干旱大陆性气候,年平均气温为-2.4℃,年平均降水量为320 mm(2000—2010年),主要集中于植物生长旺季(7—9月)。土壤以黑钙土为主,有机质含量约51 g·kg-1。水氮添加控制试验平台建立于2015年,使用双因素裂区试验设计。主区处理为牧草种植模式:(1)紫花苜蓿(Medicago sativa L.)单种;(2)无芒雀麦(Bromus inermis Leyss)单种;(3)紫花苜蓿和无芒雀麦1﹕1混播。副区为水氮处理:(1)对照CK(N0+W0),未施氮和补水;(2)N(N150+W0),施氮肥150 kg N·hm-2·a-1,无补水;(3)W(N0+W15),旱季补水(年平均降水量的15%),不施氮;(4)N+W(N150+W15),施氮肥150 kg N·hm-2·a-1,且旱季补水。4次重复,随机排列,共48个试验小区。每个试验小区的面积为7 m×10 m,行距0.5 m。使用氮肥为尿素(化学纯,含氮量46%),每年在牧草返青期和开花期分别施50%。补水的处理小区在6、7、8月每月补水20 mm,全年共补水60 mm。1.2 土壤样品采集
本研究中土壤样品的采集在2018年7月进行。在每个试验小区中,使用土钻(直径2.5 mm,深10 mm)随机采集5—10钻土壤混合为一个样品。将采集的土壤样品挑出可见的石块、土壤动物和植物残体后,过2 mm筛并混合均匀。分取一部分混合均匀的土壤样品,用于提取微生物磷脂脂肪酸的保存在-20℃;用于测定土壤酶活性、土壤NH4+-N、NO3--N及总可溶性氮(TDN)含量的保存在4℃冰箱里;用于测定SOC分组及其他指标的在室温下风干后保存。1.3 试验方法
1.3.1 土壤理化性质测定 土壤pH使用pH计(Mettler Toledo,Switzerland)测定,土水比为1﹕2。土壤有机碳(SOC)和总氮(TN)含量用元素分析仪(vario EL III, Elementa,Germany)测定。土壤NH4+-N、NO3--N及总可溶性氮(TDN)含量的测定使用2 mol·L-1 KCl浸提,用Whatman #1滤纸进行过滤,之后使用流动分析仪(AA3,SEAL,Germany)进行测定。土壤水分用105℃烘干前后土壤重量的变化进行计算。1.3.2 土壤有机碳(SOC)分组方法 使用湿筛法将SOC根据颗粒大小分为不同的组分,具体操作根据CAMBARDELLA等[10]的方法进行。首先,将50 g土壤风干样品装入聚碳酸酯硬塑料瓶中,加入100 mL 1%六偏磷酸钠溶液,密封后于200 r/min转速下振荡过夜。将土壤分散液置于250 μm和53 μm的套筛上,下面放置一个大烧杯,用去离子水冲洗筛上样品直至水流清晰不含细土颗粒为止。留在250 μm筛上的为粗颗粒有机碳(coarse POC,>250 μm),留在53 μm筛上的为细颗粒有机碳(fine POC,53—250 μm),颗粒态有机碳(POC)即为两个组分之和;冲洗进大烧杯的为矿物结合态有机碳(MAOC,<53 μm)。用去离子水冲洗各级筛子上的残留样品至预先称重的容器中,于60℃烘干并称重。各有机碳组分的碳含量使用元素分析仪测定。
1.3.3 磷脂脂肪酸(PLFA)测定 土壤中PLFAs的提取根据FROSTEG?RD和B??TH[28]的方法进行并稍作改进。首先将5 g冻干土壤样品用19 mL提取液(氯仿﹕甲醇﹕柠檬酸缓冲液(pH 4.0)= 1﹕2﹕0.8)提取土壤样品中的全部脂肪酸。将提取的脂肪酸样品加入硅胶固相萃取柱,分别用6 mL氯仿、6 mL丙酮和3 mL甲醇对硅胶萃取柱进行连续洗脱,PLFA组分被收集在甲醇相中。之后用1 mL的1﹕1甲醇甲苯溶液和1 mL KOH甲醇溶液(0.2 mol·L-1)将PLFA组分进行甲基化,反应生成磷脂脂肪酸甲酯(FAME)。制备好的磷脂脂肪酸甲酯样品在上样前加入脂肪酸19:0作为内标,使用气相色谱仪测定脂肪酸含量,并用微生物鉴定系统 MIDI Sherlock 6.1(MIDI Inc., Newark, DE)标定每种脂肪酸的名称。
各种PLFA指示的微生物类群参考FROSTEG?RD和B??TH[28]。提取PLFAs的总量用来表征总的微生物量。革兰氏阳性细菌用同型(iso-)和异型(anteiso-)的支链饱和脂肪酸(i14:0、i15:0、a15:0、i16:0、i17:0、a17:0)表征;革兰氏阴性细菌用直链饱和脂肪酸(14:0、15:0、17:0)、单不饱和脂肪酸(16:1ω7c、18:1ω5c)以及环丙基脂肪酸(cy17:0、cy19:0)表征;真菌用脂肪酸18:2ω6, 9c和18:1ω9c表征,丛枝菌根(AM)真菌用16:1ω5c表征。
1.3.4 土壤酶活性测定 使用酶标仪法测定β-葡萄糖苷酶(βG)、纤维二糖水解酶(CB)、β-N-乙酰氨基葡萄糖苷酶(NAG)和酸性磷酸酶(AP)的活性,使用伞形酮(MUB)作为标示底物(表1)。称取1 g土壤于广口瓶中,加入125 mL 50 mmol·L-1 醋酸缓冲液(pH=5.0),用磁力搅拌器搅拌5 min。搅拌后用移液器取200 μL悬浮液加入到96孔微平板中,在黑暗中20℃下培养4 h。培养结束后,向每个微孔中加入10 μL 1 mol·L-1 NaOH溶液终止反应,之后用多功能酶标仪测定每个微孔的荧光度。
Table 1
表1
表1土壤酶测定种类及其底物
Table 1
| 酶 Enzyme | 缩写 Abbreviation | 底物 Substrate |
|---|---|---|
| β-葡萄糖苷酶β-glucosidase | βG | 4-MUB-β-D-glucoside |
| 纤维二糖水解酶 Cellobiohydorlase | CB | 4-MUB-β-D-cellobioside |
| β-N-乙酰氨基葡萄糖苷酶β-N-acetylglucosidase | NAG | 4-MUB-N-acetyl-β-D-glucosaminide |
| 酸性磷酸酶 Acid phosphatase | AP | 4-MUB-phosphate |
新窗口打开|下载CSV
1.3.5 数据分析 使用单因素方差分析(ANOVA)分析不同水氮添加处理对土壤理化性质、SOC组分、土壤微生物PLFA以及酶活性的影响,并用双因素方差分析比较施氮、补水以及两者的交互作用对这些指标的影响。使用配对T检验(Paired t-test)检验两个处理之间差异的显著性(在P<0.05水平下)。使用Pearson相关性分析不同水氮处理下SOC组分变化与土壤微生物PLFA及酶活性变化的相关性,以揭示土壤微生物数量和功能与SOC组分的耦联关系。所有统计分析均使用IBM SPSS Statistics(version 22.0)进行。
2 结果
2.1 土壤氮素有效性及理化性质
在3种种植模式的人工草地经过3年水氮处理,其土壤中SOC、TN、NH4+-N的含量,以及土壤水分含量均没有显著变化,但是均显著提高了土壤中NO3--N和可溶性氮(TDN)含量(表2)。在苜蓿单播和苜蓿-无芒雀麦混播草地,N处理和N+W处理的土壤NO3--N含量均显著高于对照处理CK,平均分别增加了1.0—1.4倍和1.6—1.9倍,而在无芒雀麦单播草地,仅N处理的土壤NO3--N含量比CK平均增加了1.8倍。W处理下土壤NO3--N含量在3种人工草地中均与CK处理之间没有显著差异(P>0.05)。土壤TDN含量的变化与NO3--N含量变化大体相同。Table 2
表2
表23种牧草种植模式下不同水氮处理的土壤理化特征
Table 2
| 处理 Treatment | pH | 有机碳 SOC (g·kg-1) | 总氮 TN (g·kg-1) | 硝态氮 NO3--N (mg·kg-1) | 铵态氮 NH4+-N (mg·kg-1) | 总可溶性氮 TDN (mg kg-1) | 土壤水分 Soil moisture (%) |
|---|---|---|---|---|---|---|---|
| 苜蓿单播 Alfalfa monoculture | |||||||
| CK | 7.0±0.4a | 21.6±1.5a | 2.1±0.1a | 27.0±2.6c | 4.6±0.4a | 51.3±1.2c | 12.4±0.3a |
| N | 7.1±0.4a | 20.2±0.7a | 2.0±0.1a | 52.9±6.9b | 6.1±0.8a | 78.8±6.8b | 12.8±0.4a |
| W | 6.6±0.5a | 22.0±1.0a | 2.1±0.1a | 28.7±1.8c | 5.4±0.8a | 54.3±3.3c | 13.6±0.6a |
| N+W | 6.4±0.5a | 21.3±1.0a | 2.2±0.1a | 78.3±11.4a | 6.6±1.4a | 103.8±11.4a | 12.7±0.8a |
| 无芒雀麦单播 Smooth bromegrass monoculture | |||||||
| CK | 7.2±0.2a | 20.6±0.1a | 2.1±0.0a | 28.6±2.2b | 4.7±0.8a | 54.7±2.9b | 12.5±0.9a |
| N | 6.6±0.2a | 21.4±0.5a | 2.2±0.0a | 81.3±19.4a | 6.4±0.9a | 121.2±26.1a | 13.0±0.9a |
| W | 7.2±0.2a | 19.6±1.3a | 2.0±0.1a | 40.4±9.0b | 4.9±0.4a | 67.1±10.0b | 13.0±1.1a |
| N+W | 7.0±0.3a | 20.4±0.8a | 2.0±0.1a | 55.4±7.6ab | 4.8±0.9a | 80.9±9.0ab | 12.2±0.5a |
| 苜蓿-无芒雀麦混播 Mixed cultivation | |||||||
| CK | 6.8±0.2a | 21.6±1.2a | 2.1±0.1a | 29.9±3.0b | 5.6±1.0a | 55.7±4.7b | 12.9±0.5a |
| N | 6.8±0.3a | 21.8±1.4a | 2.2±0.1a | 72.3±7.8a | 6.0±1.7a | 104.6±6.8a | 13.1±0.7a |
| W | 7.0±0.2a | 22.5±0.8a | 2.2±0.1a | 25.8±3.8b | 6.0±0.9a | 54.4±4.3b | 12.4±0.3a |
| N+W | 7.1±0.3a | 21.8±2.3a | 2.2±0.2a | 78.1±10.3a | 5.8±0.7a | 109.1±11.6a | 12.4±0.4a |
新窗口打开|下载CSV
2.2 土壤有机碳组分
在3种种植模式的人工草地,不同水氮处理对SOC总量没有产生显著影响(表2)。通过湿筛法分离出的3种SOC组分中,MAOC的含量在3种人工草地土壤中平均为11.5 mg·kg-1,约占SOC总量的50%以上;而coarse POC和fine POC的含量平均分别为3.2 mg·kg-1和6.9 mg·kg-1,明显低于MAOC。在苜蓿单播草地,3个水氮处理下coarse POC含量均显著低于CK处理,平均减少了27.3%—38.2%;fine POC和MAOC的含量均在N处理下与CK有显著差异,分别平均增加了64.6%和降低了20.7%(图1)。在无芒雀麦单播草地,coarse POC组分含量在W处理下显著高于CK处理,平均增加了98.7%,而其余两个SOC组分在不同水氮处理下没有显著差异。在苜蓿-无芒雀麦混播草地,coarse POC组分含量在N处理下显著高于CK处理,平均增加了一倍;MAOC组分含量在N处理下最低,且显著低于N处理,但与CK处理没有显著差异(P>0.05),相比于CK平均减少了38.3%。图1
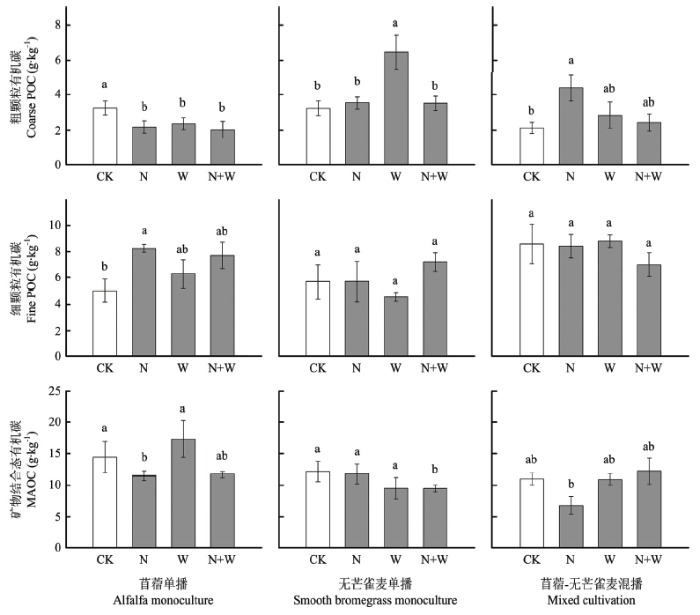 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图13种牧草种植模式下不同水氮处理土壤有机碳组分的变化
不同的小写字母表示各SOC组分在不同水氮处理之间有显著差异(P<0.05)
Fig. 1Reponses of different SOC fractions to N and water treatments under three forage cultivation types
Different lowercase letters indicate significant differences in individual SOC fraction among different N and water addition treatments by Duncan’s multiple range tests (P<0.05)
2.3 土壤微生物数量及其群落组成
在两种单播模式的人工草地,不同水氮处理下其土壤微生物群落总PLFA含量以及各微生物类群PLFA含量均无显著差异(表3)。在苜蓿-无芒雀麦混播草地,土壤微生物总PLFA、革兰氏阳性细菌、革兰氏阴性细菌以及丛枝菌根真菌PLFA含量均以N处理的最高,但与CK处理并无显著差异,均以N+W处理的最低,并且均显著低于N处理。水氮处理后尽管土壤F/B和G+/G-均没有显著差异,但在苜蓿单播和苜蓿-无芒雀麦混播草地,施氮倾向于增加F/B和降低G+/G-,无芒雀麦单播则倾向于降低F/B。Table 3
表3
表33种牧草种植模式下不同水氮处理中土壤PLFA含量(μmol·g-1)
Table 3
| 处理 Treatment | 总磷脂脂肪酸含量 Total PLFA | 革兰氏阳性细菌 Gram-positive bacteria | 革兰氏阴性细菌 Gram-negative bacteria | 真菌 Fungi | 丛枝菌根真菌 AMF | 真菌细菌比 F/B | 革兰氏阳性/ 阴性细菌比 G+/G- |
|---|---|---|---|---|---|---|---|
| 苜蓿单播 Alfalfa monoculture | |||||||
| CK | 25.1±1.7a | 10.2±0.8a | 8.3±0.5a | 2.5±0.2a | 0.86±0.07a | 0.137±0.003a | 1.23±0.05a |
| N | 21.7±2.7a | 8.7±1.1a | 7.3±0.8a | 2.4±0.4a | 0.72±0.09a | 0.147±0.006a | 1.19±0.03a |
| W | 25.6±3.2a | 10.3±1.2a | 8.6±1.1a | 2.6±0.4a | 0.87±0.12a | 0.137±0.006a | 1.21±0.04a |
| N+W | 26.0±2.3a | 10.5±0.9a | 8.6±0.8a | 2.7±0.3a | 0.83±0.09a | 0.143±0.002a | 1.22±0.03a |
| 无芒雀麦单播 Smooth bromegrass monoculture | |||||||
| CK | 23.9±2.6a | 9.7±1.1a | 7.8±0.8a | 2.4±0.3a | 0.88±0.10a | 0.138±0.008a | 1.24±0.02a |
| N | 22.8±2.3a | 9.5±0.8a | 7.4±0.8a | 2.2±0.2a | 0.79±0.14a | 0.128±0.003a | 1.28±0.02a |
| W | 21.7±1.6a | 8.8±0.6a | 7.1±0.6a | 2.3±0.2a | 0.75±0.06a | 0.143±0.001a | 1.25±0.04a |
| N+W | 22.6±1.8a | 9.2±0.7a | 7.5±0.6a | 2.2±0.2a | 0.79±0.04a | 0.133±0.004a | 1.22±0.02a |
| 苜蓿-无芒雀麦混播 Mixed cultivation | |||||||
| CK | 22.1±1.1ab | 9.1±0.5ab | 7.3±0.3ab | 2.2±0.1a | 0.73±0.03ab | 0.132±0.004a | 1.25±0.04a |
| N | 25.9±1.6a | 10.2±0.7a | 8.8±0.5a | 2.6±0.2a | 0.95±0.07a | 0.135±0.003a | 1.16±0.02a |
| W | 21.2±2.4ab | 8.7±0.9ab | 6.9±0.7ab | 2.1±0.3a | 0.73±0.10ab | 0.135±0.005a | 1.26±0.05a |
| N+W | 19.8±1.4b | 7.8±0.6b | 6.8±0.5b | 3.0±0.2a | 0.69±0.06b | 0.144±0.002a | 1.15±0.04a |
新窗口打开|下载CSV
2.4 土壤酶活性及酶化学计量比
在3种种植模式的人工草地,在不同水氮处理下参与土壤碳(βG、CB)、氮(NAG)和磷(AP)转化的4种土壤胞外酶的活性均有显著差异,但是其影响的程度和方向则不尽相同(图2)。对于碳转化相关胞外酶,在苜蓿单播草地,旱季补水显著降低βG和CB的活性,W处理和N+W处理的βG和CB活性均与CK处理差异显著,平均分别降低了31.4%—67.5%和45.5%—88.6%;在苜蓿-无芒雀麦混播草地,CB活性在N+W处理显著高于CK,平均提高了72%。对于氮转化酶,在苜蓿单播草地,3个水氮处理下NAG活性均显著低于CK,平均降低了35.7%—71.5%;在无芒雀麦单播草地,N处理下NAG活性显著高于CK,平均增加了31.4%,而W处理则显著降低NAG活性,平均降低了40.5%;而在苜蓿-无芒草地雀麦混播草地,N+W处理下NAG的活性最高,且显著高于W处理,但是与CK差异不显著(P>0.05)。对于酸性磷酸酶(AP),其活性在苜蓿单播和苜蓿-无芒雀麦混播草地不同水氮处理下没有显著差异,但是在无芒雀麦单播草地其活性在N处理下最高,且显著高于W处理,但与CK差异不显著(P>0.05)。在苜蓿单播和苜蓿-无芒雀麦混播草地,不同水氮处理下土壤酶化学计量比差异显著,但在无芒雀麦单播草地无显著差异(表4)。在苜蓿单播草地,N处理的βG/NAG和CB/NAG显著高于CK处理,平均增加了91.7%和97.0%;W处理的βG/NAG也显著高于CK,平均增加了57.2%。在苜蓿-无芒雀麦混播草地,N+W处理下CB/AP最高,且显著高于CK处理,平均增加了73.5%;CB/NAG也在N+W处理下最高,但是与CK处理没有显著差异,仅显著高于N处理。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图23种牧草种植模式下不同水氮处理土壤酶活性的变化
柱状图表示为平均值±标准误差。不同的小写字母表示各土壤酶活性在不同水氮处理之间有显著差异(P<0.05)
Fig. 2Responses of extracellular enzyme activity to different N and water treatments under three forage cultivation types
Bars indicate mean value ± SE. Different lowercase letters indicate significant differences in individual enzyme activity among different N and water addition treatments by Duncan’s multiple range tests (P<0.05)
Table 4
表4
表43种牧草种植模式下不同水氮处理后的土壤酶化学计量比
Table 4
| 处理 Treatment | 土壤酶C/N比 Enzyme C/N | 土壤酶C/P比 Enzyme C/P | |||
|---|---|---|---|---|---|
| βG/NAG | CB/NAG | βG/AP | CB/AP | ||
| 苜蓿单播 Alfalfa monoculture | |||||
| CK | 6.5±0.6c | 0.33±0.11b | 0.58±0.05a | 0.033±0.004a | |
| N | 12.4±0.6a | 0.65±0.11a | 0.75±0.06a | 0.035±0.006a | |
| W | 10.2±1.6ab | 0.30±0.02b | 0.77±0.14a | 0.037±0.006a | |
| N+W | 7.7±1.3bc | 0.15±0.04b | 0.61±0.13a | 0.032±0.001a | |
| 无芒雀麦单播 Smooth bromegrass monoculture | |||||
| CK | 7.7±0.3a | 0.30±0.05a | 0.84±0.07a | 0.057±0.010a | |
| N | 6.4±0.1a | 0.32±0.01a | 0.70±0.07a | 0.052±0.009a | |
| W | 8.0±1.0a | 0.32±0.07a | 1.47±0.33a | 0.069±0.006a | |
| N+W | 6.8±0.6a | 0.28±0.08a | 1.25±0.27a | 0.087±0.027a | |
| 苜蓿-无芒雀麦混播 Mixed cultivation | |||||
| CK | 9.9±0.7a | 0.32±0.03ab | 0.86±0.12a | 0.034±0.003b | |
| N | 9.0±0.4a | 0.26±0.05b | 0.75±0.08a | 0.036±0.002b | |
| W | 9.5±1.5a | 0.40±0.05a | 0.91±0.10a | 0.038±0.006ab | |
| N+W | 8.9±0.5a | 0.40±0.04a | 1.15±0.20a | 0.059±0.012a | |
新窗口打开|下载CSV
2.5 土壤PLFA含量和酶活性与SOC组分的耦联关系
相关分析结果表明,水氮处理后3种种植模式的人工草地土壤总PLFA含量的相对变化量(Δ)与POC相对变化量有显著正相关关系(r=0.486,P<0.05),而与MAOC呈显著负相关关系(r= -0.657,P<0.01),且在补水和不补水情况表现一致(表5)。其他土壤微生物类群PLFA的相对变化量与SOC组分的相关关系与总PLFA大体相同。两种碳转化相关土壤酶βG和CB活性的相对变化量与coarsePOC(不补水情况下)和POC(补水情况下)的相对变化量显著负相关,而与MAOC显著正相关。土壤酶生态化学计量比的变化主要与POC组分的变化有相关性关系:coarse POC的变化与CB/NAG显著负相关(不补水情况下r=-0.691,P<0.05);fine POC的变化与βG/AP显著负相关(r= -0.463,P<0.05),且在补水情况下相关性更高(r= -0.797,P<0.01)。在补水情况下,βG/AP和CB/AP的变化与POC显著负相关,且βG/NAG和CB/NAG的变化也与POC有负相关关系(边缘显著P<0.1)。回归分析结果也表明,土壤酶C/N、C/P的平均变化在补水情况下均与POC的平均变化有正相关关系(图3)。Table 5
表5
表5水氮处理下土壤PLFA含量、酶活性及SOC组分相对变化量的相关性分析
Table 5
| 项目 Item | 全部处理 All treatments | 不补水 No water addition | 补水 With water addition | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Coarse POC | Fine POC | POC | MAOC | Coarse POC | POC | MAOC | Coarse POC | Fine POC | POC | MAOC | |||
| 土壤微生物量 Soil microbial biomass | |||||||||||||
| PLFA总量 Total PLFA | — | 0.424* | 0.486* | -0.657** | — | 0.554? | -0.679* | — | 0.679* | 0.534? | -0.767** | ||
| 革兰氏阳性细菌 G+ | — | 0.426* | 0.461* | -0.628** | — | 0.520? | -0.616* | — | 0.682* | — | -0.781** | ||
| 革兰氏阴性细菌 G- | 0.390? | 0.366? | 0.435* | -0.629** | — | 0.538? | -0.772** | — | 0.585? | — | -0.635* | ||
| 真菌 Fungi | — | 0.419* | 0.498* | -0.623** | — | 0.574? | -0.660* | 0.585? | 0.564? | 0.550? | -0.733* | ||
| 丛枝菌根真菌 AMF | 0.464* | 0.378? | 0.508* | -0.632** | — | 0.558? | -0.710* | 0.617* | 0.627* | 0.563? | -0.596? | ||
| 土壤酶活性 Extracellular enzyme activity | |||||||||||||
| βG | — | — | — | — | -0.642* | — | 0.685* | — | — | -0.709* | — | ||
| CB | — | — | — | — | -0.651* | — | 0.711* | — | — | -0.748* | — | ||
| 土壤酶化学计量比 Enzyme stoichiometric ratio | |||||||||||||
| βG/NAG | — | — | — | — | — | — | — | — | — | -0.581? | — | ||
| CB/NAG | — | — | — | — | -0.691* | — | 0.607? | — | — | -0.540? | — | ||
| βG/AP | — | -0.463* | -0.476* | 0.404? | — | — | — | — | -0.797** | -0.821** | — | ||
| CB/AP | — | — | — | — | — | — | 0.572? | — | -0.572? | -0.667* | — | ||
新窗口打开|下载CSV
图3
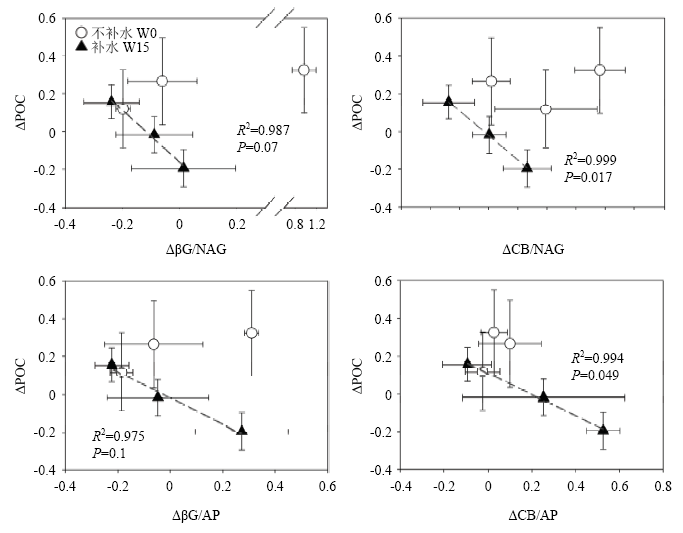 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3水氮处理下颗粒态有机碳含量与土壤酶化学计量比相对变化量(Δ)的关系
Fig. 3Relationships between relative changes (Δ) in POC content and enzyme stoichiometric ratios
3 讨论
前人研究表明,施氮能够显著影响天然草地土壤微生物群落的数量和组成[15,21,27]。然而,在呼伦贝尔半干旱地区经过3年的施氮试验并没有对人工草地土壤微生物总量以及各微生物类群生物量产生显著的影响(表3)。这可能是由于施氮没有对土壤pH值产生显著影响(表2),而土壤pH值是调控土壤微生物群落组成和活性的重要环境因子之一[20]。除了土壤pH值,土壤碳源有效性也是调控微生物数量和活性的关键因子。我们发现,土壤总PLFA含量和各微生物类群PLFA含量的变化与易分解的有机碳(例如POC)含量变化有显著正相关关系(表5)。CHENG等[29]在长白山温带森林增氮控制试验的研究也表明,土壤微生物群落的数量显著受到土壤易分解有机碳含量的调控。尽管施氮没有对土壤微生物群落数量产生显著影响,但在无芒雀麦单播草地施氮倾向于降低F/B,而在苜蓿单播和苜蓿-无芒雀麦混播草地施氮倾向于增加F/B(表3)。以往研究结果表明,施氮对F/B的影响不一,增加[22]、降低[20,21]或没有显著影响[25]的结果均有报道。通常认为,土壤细菌群落对施氮的响应比真菌敏感,因为相比于真菌,细菌属于“富营养型”,具有更高的碳源和养分的需求[17],因此土壤氮素有效性增加时,细菌的生长速率往往高于真菌,从而导致F/B降低。而F/B在苜蓿单播和苜蓿-无芒雀麦混播草地倾向于增加,表明在混播草地豆科植物(苜蓿)在土壤微生物类群对氮的响应上起着主导作用,其作用机理需要进一步研究。除了施氮,本研究中旱季补水也没有对人工草地土壤微生物群落数量和组成产生显著影响(表3)。以往许多在草地生态系统的研究也报道了类似的结果[23,30-31]。这个结果的产生可能是经过3年的旱期补水,土壤微生物对水分增加产生了适应性[32]。另外,在苜蓿-无芒雀麦混播模式下,水氮同时添加时土壤总PLFA和细菌PLFA含量均比单独施氮显著降低(表3),这可能是由于旱期补水加剧了植物和微生物的氮素竞争而导致的。研究表明,水分是半干旱地区植物生长的关键限制因子之一,水分增加对植物地上部和地下部生物量有明显促进作用[33]。植物根系对养分元素的吸收有扩散、截获、主动吸收等多种方式,而土壤微生物尤其是细菌则主要靠土壤溶液的扩散作用,因而在土壤氮素有效性提高的情况下,植物相对于微生物对氮素吸收更有竞争优势,从而可能是导致土壤微生物尤其是细菌数量下降的原因。
相比于微生物PLFA含量,土壤酶活性在不同水氮处理下有显著差异(图2)。以往研究认为,增氮会导致与碳周转相关的水解酶活性增加[21,34]。与这些研究结果类似,本研究中单施氮(N)或补水后施氮(N+W)处理均增加了βG和CB活性,但是N+W处理显著降低了苜蓿单播土壤的βG和CB的活性。对于氮转化相关酶,施氮(N处理)显著降低了苜蓿单播草地土壤中的NAG活性,但是显著提高了无芒雀麦单播草地土壤的NAG活性(图2)。目前对氮转化相关酶对氮素富集的响应不一,促进[35]和抑制[36]的结果均有报道。本研究中,NAG对氮素富集的不同响应可能与牧草类型以及植物、微生物对氮素的竞争有关。豆科植物通常具有固氮能力,因此对外源氮素添加的响应很可能不如禾本科植物敏感。在无芒雀麦单播草地,施氮后植物在氮素吸收竞争中占据优势,从而导致微生物生长代谢受到氮素限制,因而NAG的活性增加;而在苜蓿单播草地,施氮能够同时满足植物和微生物的氮素需求,因此从酶经济学的角度微生物不需要耗费更多能量来分泌获取氮素的酶[37]。相比于施氮,补水对土壤酶活性的影响基本为抑制作用或者无显著影响,除了在苜蓿-无芒雀麦混播草地补水显著提高了CB的活性(图2)。这个结果与以往许多研究相吻合[25,35]。此外,除了NAG,其他跟土壤氮素周转相关的胞外酶(例如蛋白酶和脲酶)也表现出随水分增加而活性下降[38,39]。
经过3年的水氮处理,尽管人工草地SOC总量没有显著变化,SOC的颗粒组成(POC以及MAOC)对施氮产生了显著的差异性响应(图1)。在苜蓿单种和苜蓿-雀麦混播模式下,施氮(N处理)促进了POC(粗颗粒有机碳或细颗粒有机碳)的积累。这一结果与SILVEIRA等[40]在放牧草场和CHENG等[29]在温带森林的研究结果一致。施氮导致的POC的变化与土壤酶活性以及酶化学计量比的变化密切相关: POC(coarse POC或fine POC)的相对变化量与βG(或CB)活性、βG/NAG(CB/NAG)、βG/AP(CB/AP)的相对变化量均有负相关关系(表5,图3)。土壤βG(或CB)、NAG、AP活性之间比值能够反映出土壤微生物对碳、氮、磷养分需求的差异[26]。这一结果说明,土壤微生物对不同养分需求的差异是调控POC周转的重要驱动力:当微生物生长代谢受到氮(磷)限制时,微生物会增加获取氮(磷)的投入,从而表现出氮(磷)转化相关酶活性相对于碳转化酶活性增加(即酶C/N或C/P比降低),导致活性有机碳(例如POC)的累积;而当碳是微生物群落的主要限制因子时,微生物会相应地增加获取碳的投入,表现为碳转化相关酶活性相对于氮(磷)转化酶活性的增加(即酶C/N或C/P比增加),导致活性有机碳消耗。与POC的变化相反,施氮导致MAOC含量显著降低(图1),而ZAK等[13]的研究则发现施氮促进了MAOC的积累。LIANG等[14]的研究发现长期施氮能够降低土壤微生物残体生物量(氨基糖),而微生物残体生物量对于MAOC含量有重要影响[16]。本研究中施氮条件下MAOC的降低是否是由于土壤微生物残体生物量变化导致的,还需要深入研究。相比于POC,有机碳和矿物颗粒之间的相互作用使得MAOC更加稳定(即惰性有机碳),并且对SOC固持更为重要[8]。因此,施氮导致的MAOC减少可能会导致SOC稳定性下降,不利于人工草地土壤碳的长期固持。此外,施氮对SOC稳定性的负面效应在苜蓿单播草地土壤最为明显(无论补水还是不补水),而苜蓿-无芒雀麦混播草地旱季补水能够缓解这种负面影响(图1)。以往研究表明,不同植物功能群(例如豆科和禾本科)在地下的生态位互补和互惠作用有助于促进土壤微生物活性、提高生态系统对外界环境变化的稳定性[41,42]。因此,相比于单播模式,苜蓿-无芒雀麦混播的种植方式可能提升人工草地土壤碳固持以及生态系统稳定性,对人工草地高效、优质化管理有重要意义。
4 结论
在呼伦贝尔人工草地,3年的施氮和补水对土壤有机碳含量和土壤微生物群落数量未产生显著影响,但是显著影响了与碳、氮、磷周转相关的土壤酶活性、酶化学计量比以及不同SOC组分。施氮对土壤酶活性的影响相对复杂,并且在不同牧草种植模式下有明显区别,而补水则总体上降低土壤酶活性。施氮能够促进活性有机碳组分(coarse POC或fine POC)的积累,降低惰性有机碳组分(MAOC)的数量,不利于土壤有机碳库的稳定性。在苜蓿单种模式下各SOC组分对施氮的响应最为敏感,而苜蓿-雀麦混播在旱季补水条件下有助于缓解施氮对SOC稳定性的负面效应。不同水氮处理下POC含量的相对变化与土壤酶C/N比(或C/P比)有显著负相关关系,说明土壤微生物对不同养分需求的差异是调控活性有机碳组分周转的重要驱动力。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 3]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 6]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 3]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
