 ,河北省农林科学院植物保护研究所/河北省农业有害生物综合防治工程技术研究中心/农业农村部华北北部作物有害生物综合治理重点实验室, 河北保定 071000
,河北省农林科学院植物保护研究所/河北省农业有害生物综合防治工程技术研究中心/农业农村部华北北部作物有害生物综合治理重点实验室, 河北保定 071000Control Efficacy of Broccoli Residues on Cotton Verticillium Wilt and Its Effect on Soil Bacterial Community at Different Growth Stages
ZHAO WeiSong, GUO QingGang, LI SheZeng, WANG YaJiao, LU XiuYun, WANG PeiPei, SU ZhenHe, ZHANG XiaoYun, MA Ping ,Plant Protection Institute of Hebei Academy of Agricultural and Forestry Sciences/IPM Centre of Hebei Province/Key Laboratory of IPM on Crops in Northern Region of North China, Ministry of Agriculture and Rural Affairs, Baoding 071000, Hebei
,Plant Protection Institute of Hebei Academy of Agricultural and Forestry Sciences/IPM Centre of Hebei Province/Key Laboratory of IPM on Crops in Northern Region of North China, Ministry of Agriculture and Rural Affairs, Baoding 071000, Hebei通讯作者:
责任编辑: 岳梅
收稿日期:2019-06-3接受日期:2019-06-28网络出版日期:2019-12-16
| 基金资助: |
Received:2019-06-3Accepted:2019-06-28Online:2019-12-16
作者简介 About authors
赵卫松,Tel:0312-5927076;E-mail:zhaoweisong1985@163.com。

摘要
关键词:
Abstract
Keywords:
PDF (1010KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
赵卫松, 郭庆港, 李社增, 王亚娇, 鹿秀云, 王培培, 苏振贺, 张晓云, 马平. 西兰花残体还田对棉花黄萎病防治效果及其对不同生育时期土壤细菌群落的影响[J]. 中国农业科学, 2019, 52(24): 4505-4517 doi:10.3864/j.issn.0578-1752.2019.24.006
ZHAO WeiSong, GUO QingGang, LI SheZeng, WANG YaJiao, LU XiuYun, WANG PeiPei, SU ZhenHe, ZHANG XiaoYun, MA Ping.
0 引言
【研究意义】棉花黄萎病(cotton verticillium wilt)是由大丽轮枝菌(Verticillium dahliae)侵染引起的真菌性维管束病害,是导致棉花减产和纤维品质下降的主要病害[1,2],已成为限制我国棉花产业可持续发展的重要瓶颈。目前,有关棉花黄萎病防治的研究主要集中在抗性品种、轮作及微生物菌剂和化学药剂应用等方面[1,3-5]。由于大丽轮枝菌具有致病力分化严重、变异速度快、传播途径多和在土壤中存活时间长等特点[2,6],导致抗病品种出现抗性丧失的现象[7,8];过去防治土传病害主要依靠化学药剂进行熏蒸处理,不仅降低了棉花的品质,还破坏了土壤的生态系统,影响环境。因此,亟需寻找环境友好型的黄萎病防控技术。【前人研究进展】利用植物及其残体是有效防治作物土传病害的途径之一[9,10]。西兰花(Brassica oleracea var. italic)残体(broccoli residues,BR)还田能够有效降低花椰菜[11,12]、茄子[13,14]、马铃薯[15,16]、草莓[17]等黄萎病的发生,SHETTY等[11]研究表明,西兰花及其他部分十字花科作物体内含有硫代葡萄糖甙,其在芥子酶水解作用下降解为异硫氰酸酯,从而可控制土传病害的发生;许多****研究发现,西兰花残体还田后降低了茄子、花椰菜和马铃薯黄萎病的发生,其防病机理主要是通过向环境中释放具有抑菌功能的次生代谢物质,改变土壤微生物多样性,降低土壤病原菌或微菌核数量、增加土壤中有益微生物菌群丰度[12,13,14,15,16]。近年来,随着测序技术的快速发展,高通量测序技术具有测序深度深和获得数据量大等优点,能更真实地揭示微生物群落的复杂性和多样性。【本研究切入点】关于西兰花残体还田对棉花黄萎病的防控研究尚少,笔者课题组前期研究发现,土壤中添加一定比例的西兰花残体对棉花黄萎病具有较好的防治效果[18],但关于西兰花残体对棉花黄萎病及其不同生育时期土壤细菌群落结构的影响尚缺乏系统的研究。【拟解决的关键问题】以西兰花残体还田深翻后对棉花黄萎病的防治效果为研究主线,以棉花不同生育时期的土壤为研究对象,采用Illumina MiSeq高通量测序技术,分析西兰花残体还田后棉花不同生育时期土壤细菌多样性和群落组成的变化,揭示土壤微生物对西兰花残体处理的响应机制,阐释棉花黄萎病与土壤微生物间的互作关系,为深入研究西兰花残体防治棉花黄萎病的生态机制提供理论依据和技术指导,为棉花黄萎病的绿色防控和化学农药的减量施用提供新途径和思路。1 材料与方法
1.1 试验材料
以西兰花品种‘炎秀’、棉花品种‘邯686’(耐黄萎病品种)为供试材料,由河北省邯郸市农业科学院提供,用于田间试验。1.2 试验区域概况、试验设计与土壤样品采集
河北省邯郸市成安县位于冀南平原,东经114°29'—114°53',北纬36°18'—36°30',是全国棉花生产百强县、优质棉基地县。20世纪90年代初,该地区棉花黄萎病重病田发病率达89.9%,之后利用抗病品种、农业措施(如轮作)等手段,在一定程度上达到了防治黄萎病的目的,但该病原菌主要由土壤和种子传播,寄主范围广,流行性强,近年来常有发生的报道。2017年3—11月在成安县道东堡乡大堤西村进行西兰花残体还田防治棉花黄萎病的试验(N:36º28′17″,E:114º45′55″)。选取地势平坦、肥力相对均匀、连续多年种植棉花的地块作试验田。2017年3月上旬,将西兰花幼苗(三叶一心)移栽到田间,行距70 cm,株距35 cm,种植密度约为2 720株/666.7 m2;2017年5月中旬收获西兰花,之后将剩余的植株地上部分和地下部分经粉碎机粉碎、旋耕机深翻25—30 cm作为处理区(T,施入西兰花残体约为3 500—3 800 kg/666.7 m2),未种植西兰花的地块作为空白对照区(CK)。2017年6月1日分别在处理区和对照区播种棉花,每个处理3次重复,每小区面积为45 m2(行长60 m,每行宽0.75 m),行距75 cm,株距35 cm。在棉花生长期间,按照当地生产技术进行水肥、植株虫草害管理。分别在播种前期、苗期、蕾期、花铃期和吐絮期,按照“W”形采用多点取样法,用取土器在棉花行间距离棉花根部10 cm采集0—20 cm耕作层的土壤,每小区采集约500 g土壤混匀装于自封袋中,于-80℃冰箱保存,用于后续土壤细菌群落分析。
1.3 测定项目及方法
1.3.1 黄萎病发生调查在黄萎病发生时期,按照李社增等[19]分级标准于8月10日、8月21日、8月31日、9月12日和9月21日分别调查统计发病率和病情指数,分别记作DIT1、DIT2、DIT3、DIT4和DIT5。病情调查标准如下,0级:棉株健康,无病叶,生长正常;1级:棉株1/4以下叶片发病,变黄萎蔫;2级:棉株1/4以上,1/2以下叶片发病,变黄萎蔫;3级:棉株1/2以上,3/4以下叶片发病,变黄萎蔫;4级:棉株3/4以上叶片发病,或叶片全部脱落,棉株枯死。
为明确西兰花残体还田在整个棉花生育期内对黄萎病的防治效果,建立病情指数-时间的病程发展曲线图并计算病程发展曲线下面积(area under disease progress curve,AUDPC),进一步计算平均防治效果。
发病率(%)=(发病株数/调查总株数)×100;病情指数(DI)=∑(相应病级×各级病株数)/(最高病级×总株数)×100;AUDPC=1/2×[(DIT1+DIT2)/(T2-T1+1)+(DIT2+DIT3)/(T3-T2+1)][18];平均防治效果(%)=(对照的AUDPC-处理的AUDPC)/对照的AUDPC×100。
1.3.2 土壤细菌群落结构的高通量测序
采用FastDNATM SPIN Kit for Soil(MP Biomedicals,Solon,OH,USA)试剂盒提取土壤基因组DNA,利用NanoDrop 2000分光光度计(Thermo Fisher Scientific Inc.,Waltham,MA,USA)检测DNA的纯度和浓度。DNA于-20℃保存。
PCR扩增:以上述基因组DNA为模板,土壤细菌16S rDNA的V3-4区扩增采用引物为338F(5′-ACT CCTACGGGAGGCAGCA-3′)和806R(5′-GGACTAC HVGGGTWTCTAAT-3′)[20],根据序列中的保守区域设计相应引物,并添加样本特异性Barcode序列,采用NEB公司的Q5高保真DNA聚合酶进行PCR扩增。PCR扩增产物通过2%琼脂糖凝胶电泳进行检测,采用AXYGEN公司的凝胶回收试剂盒对目标片段进行切胶回收。
文库构建和测序:由上海派森诺生物科技有限公司完成。采用Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备测序文库,采用Agilent High Sensitivity DNA Kit在Agilent Bioanalyzer上对文库进行质检,并采用Quant-iT PicoGreen dsDNA Assay Kit在Promega QuantiFluor荧光定量系统上对文库进行定量,合格后,使用MiSeq高通量测序技术进行上机测序。
1.3.3 土壤中大丽轮枝菌数量的测定
DNA的提取、重组质粒的制备和鉴定:采用CTAB法提取大丽轮枝菌的基因组DNA。利用大丽轮枝菌特异性引物DB19(CGGTGACATAATACTGAGAG)/DB20(GACGATGCGGATTGAACGAA)扩增ITS部分序列。将PCR产物与pMD19-T Vector(宝生物工程(大连)有限公司)16℃连接4 h后,转化于DH5α感受态细胞中,37℃过夜培养,挑选白色菌落转接于含100 μg·mL-1氨苄青霉素的LB液体培养基中,37℃,200 r/min振荡培养12 h。提取重组质粒,利用NanoDrop 2000分光光度计测定浓度,计算单位体积质粒所含的DNA拷贝数。将重组质粒送生工生物工程(上海)股份有限进行插入片段的序列测定。测序结果显示,重组质粒中插入片段序列与大丽轮枝菌ITS序列同源性为100%。
质粒拷贝数=
$\frac{\text{ }\!\!\mu\!\!\text{ g}\cdot \text{ }\!\!\mu\!\!\text{ }{{\text{L}}^{\text{-1}}}\times \text{ }\!\!\mu\!\!\text{ L}\times 6.02\times {{10}^{23}}}{[\text{bp}+\text{bp}]\times 660\ \text{g}\cdot \text{mo}{{\text{l}}^{\text{-1}}}}$
实时荧光定量PCR反应及标准曲线的建立:将提取的质粒10倍梯度稀释,将其作为模板进行实时荧光定量PCR扩增。反应体系:2×Master Mix(德国DBI Bioscience公司)10 μL,大丽轮枝菌ITS上下游引物[21](F:CCCGCCGGTCCATCAGTCTCTCTG;R:CGGGACTCCGATGCGAGCTGTAAC)各1 μL,DNA 1 μL,ROX 0.4 μL,ddH2O补至20 μL。扩增程序:95℃预变性30 s,95℃变性5 s,60℃退火并延伸30 s,扩增40个循环。以质粒拷贝数的对数值为横坐标,以循环阈值Ct值为纵坐标建立标准曲线。
土壤中大丽轮枝菌数量的测定:在棉花的不同生育时期,按照1.2方法采集耕作层土壤,提取DNA,并将其作为模板进行实时荧光定量PCR反应,每个样品重复3次,得到不同时间样本的循环阈值,根据上述建立的标准曲线计算土壤中大丽轮枝菌的拷贝数。
1.4 数据分析
试验数据采用Microsoft Excel 2010进行整理,Origin 8.6进行作图,采用SPSS 17.0软件进行单因素方差分析、独立样本T检验和邓肯新复极差法(DMRT)多重比较统计分析。采用Canoco 4.5软件对样本微生物群落进行主成分分析(PCA),并利用CanoDraw软件进行作图;利用软件Mothur计算Alpha多样性指标,包括丰富度指数(ACE和Chao1)和均匀度指数(Shannon和Simpson)。2 结果
2.1 西兰花残体还田对棉花黄萎病发生的影响
由图1可知,西兰花残体(BR)处理与空白对照(CK)相比,前者降低了黄萎病的发病率和病情指数。在8月底9月初,黄萎病的发生达到高峰,其中西兰花残体还田后发病率和病情指数分别为6.75%和1.80,而空白对照的发病率和病情指数分别为24.62%和6.76。空白对照7月30日开始发病并表现症状,而西兰花残体还田后开始发病时间和发病高峰推迟。图1
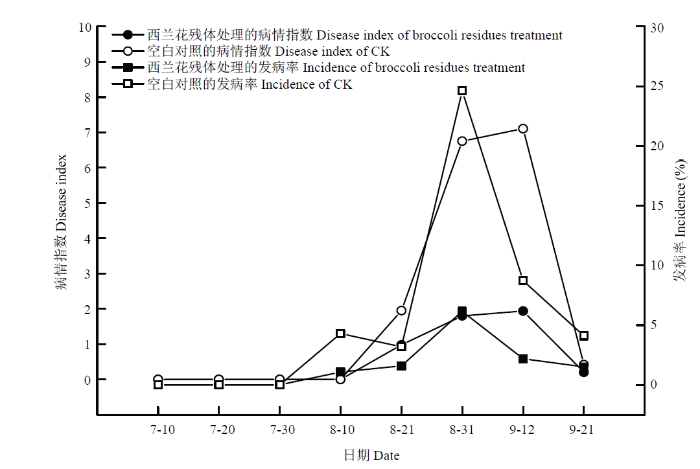 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1棉花黄萎病发生的动态变化
Fig. 1Dynamic changes of cotton verticillium wilt
2.2 全生育期内对棉花黄萎病的防治效果
西兰花残体还田后对棉花黄萎病的田间防治试验结果表明,在调查时间范围内(7月10日至9月21日)不同处理的棉花黄萎病病情指数呈上升趋势。从8月10日开始发病,在发病高峰期(8月31日)西兰花残体处理对黄萎病的防治效果达到70.77%,为了客观评价西兰花残体在整个生育期内对棉花黄萎病的防治效果,建立了病情指数-时间病程发展曲线,平均防治效果为57.21%(图2)。图2
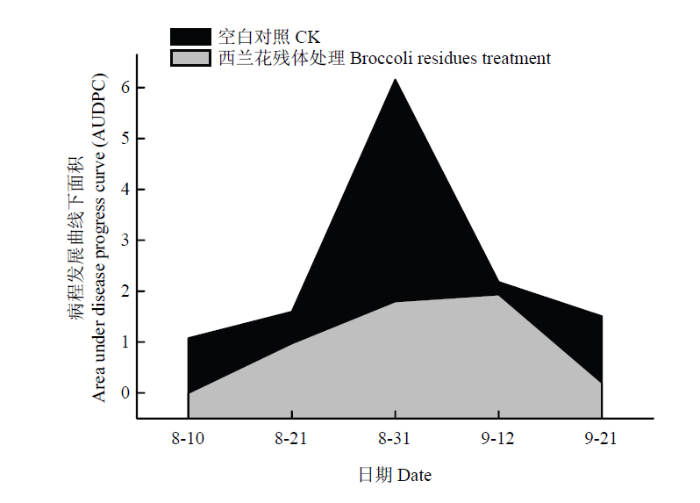 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2棉花黄萎病病情指数-时间的AUDPC
Fig. 2AUDPC of disease index and time of cotton verticillium wilt
2.3 西兰花残体还田对土壤中病原菌数量的影响
利用实时荧光定量PCR建立了定量检测大丽轮枝菌的标准曲线,其方程为y=-3.4309x+46.756,相关系数R2=0.9993,表明建立的标准曲线线性好、扩增效率高。西兰花残体处理后在棉花生长季和非生长季的不同时间土壤中病原菌数量的变化结果表明,在发病初期(7月11日),西兰花残体处理土壤样品中的大丽轮枝菌与空白对照差异不显著,在其他3个时间(8月21日、10月19日和11月28日),西兰花残体处理显著降低了土壤中大丽轮枝菌DNA拷贝数,与空白对照相比,土壤中病原菌的数量分别下降了11.11%、25.95%和11.25%(图3)。图3
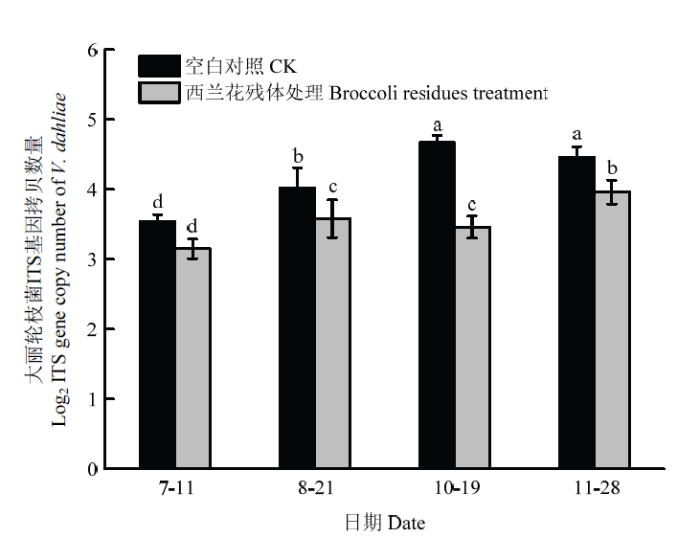 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3棉花土壤中大丽轮枝菌实时荧光定量PCR测定
Fig. 3Quantification of V. dahliae in soil of cotton by real- time PCR
2.4 西兰花残体还田对细菌群落多样性的影响
由表1可知,独立样本的T检验结果表明,与空白对照相比,西兰花残体处理后在棉花不同生育时期土壤细菌的Chao1指数均显著上升,ACE指数在播种前期、花铃期和吐絮期显著上升,而Shannon和Simpson指数差异不显著。Table 1
表1
表1西兰花残体还田对棉花不同生育时期细菌测序量和群落多样性的影响
Table 1
| 时期 Stage | 处理 Treatment | 测序 Reads | 丰富度Richness | 均匀度Evenness | ||
|---|---|---|---|---|---|---|
| Chao1指数 Chao1 index | ACE指数 ACE index | 辛普森指数 Simpson index | 香浓指数 Shannon index | |||
| 播种前期 Pre-sowing stage | 对照CK | 38251.50±293.50a | 2814.33±14.34a | 2813.33±69.14a | 0.9986±0.0002a | 10.67±0.13a |
| 西兰花残体BR | 39434.67±2787.82a | 3339.07±262.21b | 3419.18±147.49b | 0.9970±0.0007a | 10.18±0.10a | |
| 苗期 Seedling stage | 对照CK | 38800.00±206.00a | 2703.00±12.25a | 2669.00±41.67a | 0.9984±0.0001a | 10.56±0.08a |
| 西兰花残体BR | 42364.67±3689.72a | 2795.04±64.96b | 2691.80±68.21a | 0.9984±0.0000a | 10.56±0.06a | |
| 蕾期 Bud stage | 对照CK | 42593.50±495.50a | 3039.57±46.12a | 3143.00±80.87a | 0.9985±0.0002a | 10.67±0.21a |
| 西兰花残体BR | 41670.00±2906.67a | 3624.21±223.84b | 3173.46±99.20a | 0.9983±0.0000a | 10.16±0.44a | |
| 花铃期 Flowering and boll stage | 对照CK | 36694.00±35.00a | 2861.00±36.34a | 2861.00±31.38a | 0.9987±0.0000a | 10.71±0.25a |
| 西兰花残体BR | 41284.67±3638.72a | 3763.18±167.23b | 3946.36±97.67b | 0.9982±0.0002a | 10.49±0.11a | |
| 吐絮期 Boll-opening stage | 对照CK | 36369.50±75.50a | 2543.33±57.97a | 2558.00±60.21a | 0.9965±0.0006a | 10.33±0.33a |
| 西兰花残体BR | 34275.33±2063.41a | 2665.31±259.75b | 2813.93±279.95b | 0.9974±0.0001a | 10.12±0.34a | |
Different lowercases after the data indicate significant differences (P<0.05). The same as below
新窗口打开|下载CSV
2.5 西兰花残体还田对细菌群落结构的影响
对不同生育时期样本的细菌群落结构进行主成分分析,由图4可知,所有样品在主成分坐标中位于不同的象限,说明不同生育时期样品的细菌群落结构存在差异。通过对不同生育时期的样品进一步分析,对于空白对照样品,分别位于4个象限,播种前期和苗期位于相同象限,蕾期、花铃期和吐絮期分别位于不同象限,说明细菌群落结构存在差异。对于西兰花残体处理样品,分别位于4个象限,其中播种前期和花铃期位于相同象限,苗期、蕾期和吐絮期分别位于不同象限。图4
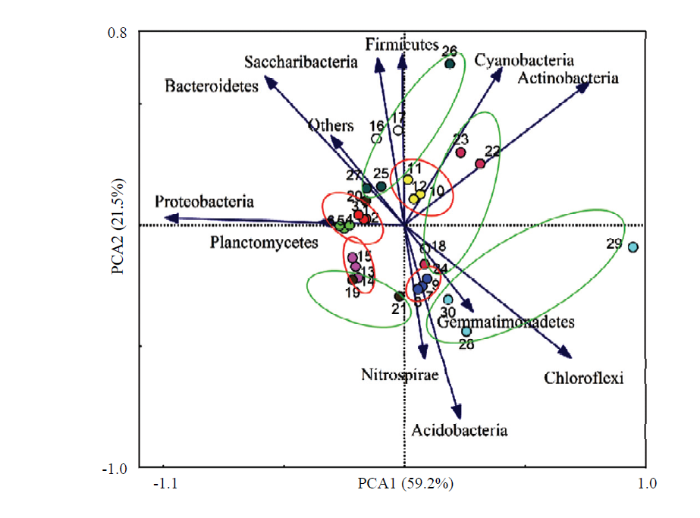 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4棉花不同生育时期土壤细菌群落结构的主成分分析
红色椭圆代表空白对照(1—15),绿色椭圆代表西兰花残体处理(16—30)The red ellipse represents the blank control (1-15), the green ellipse represents the broccoli residues treatment (16-30)。1—3、16—18:播种前期Pre-sowing stage;4—6、19—21:苗期Seedling stage;7—9、22—24:蕾期Bud stage;10—12、25—27:花铃期Flowering and boll stage;13—15、28—30:吐絮期Boll-opening stage。Proteobacteria:变形菌门;Actinobacteria:放线菌门;Acidobacteria:酸杆菌门;Gemmatimonadetes:芽单孢菌门;Chloroflexi:绿弯菌门;Planctomycetes:浮霉菌门;Nitrospirae:硝化螺旋菌门;Bacteroidetes: 拟杆菌门;Firmicutes:厚壁菌门;Cyanobacteria:蓝藻细菌门;Others:其他
Fig. 4Principal component analysis of soil bacterial community structure at different growth stages of cotton
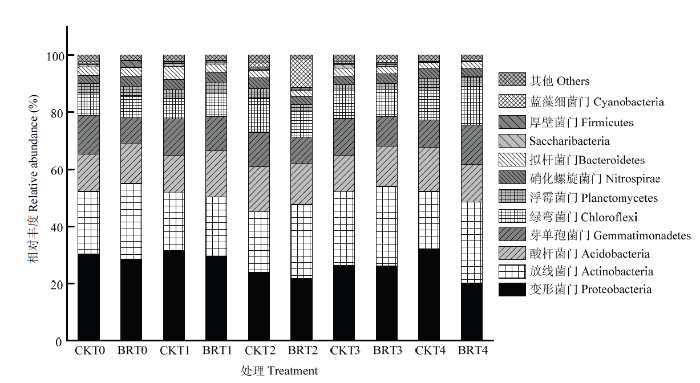
门水平下西兰花残体还田在不同生育时期对土壤中细菌群落结构的影响结果表明,在播种前期(T0),空白对照处理(CKT0)获得30个菌群,其中有8个优势菌群。西兰花残体处理(BRT0)获得25个菌群,其中有9个优势菌群,相对丰度占总体的95%以上。变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、芽单孢菌门(Gemmatimonadetes)、绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)、拟杆菌门(Bacteroidetes)和硝化螺旋菌门(Nitrospirae)为两个处理共同的优势菌群,其相对丰度分别为30.31%和28.53%、21.96%和26.59%、12.99%和13.87%、13.54%和9.07%、7.36%和7.48%、3.96%和3.57%、2.90%和3.14%、2.77%和3.31%,其中西兰花残体处理后放线菌门、酸杆菌门、绿弯菌门、拟杆菌门和硝化螺旋菌门增幅分别为21.08%、6.77%、1.63%、8.28%和19.49%。此外,西兰花残体处理后厚壁菌门(Firmicutes)菌群上升为优势菌群,其相对丰度由0.55%升至2.17%(图5)。
图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5西兰花残体在棉花不同生育时期对细菌群落结构的影响
Fig. 5Effect of broccoli residues on bacterial taxonomic composition at different growth stages of cotton
在苗期(T1),空白对照处理(CKT1)和西兰花残体处理(BRT1)分别获得27个菌群,分别得到9个和8个主要优势菌群,相对丰度占总体的97.09%和96.81%。变形菌门、放线菌门、酸杆菌门、芽单孢菌门、绿弯菌门、浮霉菌门、拟杆菌门和硝化螺旋菌门为共同的优势菌群,其相对丰度分别为31.66%和28.59%、20.07%和20.77%、13.20%和16.22%、12.77%和12.84%、7.11%和8.07%、3.02%和3.81%、3.49%和3.54%、4.76%和2.97%,其中西兰花残体处理后放线菌门、酸杆菌门、芽单孢菌门、绿弯菌门、浮霉菌门和拟杆菌门均呈现不同程度的上升,其增幅分别为3.49%、22.88%、0.55%、13.50%、26.16%和1.43%。此外,西兰花残体处理后厚壁菌门菌群上升为优势菌群,其相对丰度由0.51%升至0.79%,Saccharibacteria门菌群由1.01%降至0.34%(图5)。
在蕾期(T2),空白对照处理(CKT2)和西兰花残体处理(BRT2)分别获得25个和26个菌群,分别得到9个主要优势菌群,相对丰度占总体的96.01%和97.70%。变形菌门、放线菌门、酸杆菌门、芽单孢菌门、绿弯菌门、浮霉菌门、拟杆菌门、硝化螺旋菌门和蓝藻细菌门(Cyanobacteria)为共同的优势菌群,其相对丰度分别为24.13%和21.88%、21.12%和25.76%、15.79%和14.45%、11.87%和9.03%、11.80%和9.00%、3.49%和2.60%、2.68%和2.21%、3.78%和2.73%、1.36%和9.81%,其中西兰花残体处理后放线菌门和蓝藻细菌门增幅分别为21.97%和621.32%(图5)。
在花铃期(T3),空白对照处理(CKT3)和西兰花残体处理(BRT3)分别获得28个菌群,分别得到9个主要优势菌群,相对丰度占总体的96.53%和97.27%。变形菌门、放线菌门、酸杆菌门、芽单孢菌门、绿弯菌门、浮霉菌门、拟杆菌门和硝化螺旋菌门为两个处理共同的优势菌群,其相对丰度分别为26.44%和26.21%、25.76%和27.81%、12.62%和14.01%、12.97%和10.25%、9.63%和9.47%、2.24%和2.15%、2.76%和2.70%、3.08%和3.41%,其中西兰花残体处理后放线菌门、酸杆菌门和硝化螺旋菌门增幅分别为7.96%、11.01%和10.71%。此外,空白对照中的Saccharibacteria门成为优势菌群,而西兰花残体处理后蓝藻细菌门菌群成为优势菌群(图5)。
在吐絮期(T4),空白对照处理(CKT4)和西兰花残体处理(BRT4)分别获得26个菌群,分别得到8个主要优势菌群,相对丰度分别占总体的97.22%和97.75%。变形菌门、放线菌门、酸杆菌门、芽单孢菌门、绿弯菌门、浮霉菌门、拟杆菌门和硝化螺旋菌门为共同的优势菌群,其相对丰度分别为32.23%和19.55%、20.18%和28.74%、15.31%和12.76%、9.62%和14.13%、10.51%和13.85%、4.11%和3.47%、1.83%和2.12%、3.42%和3.13%,其中西兰花残体处理后放线菌门、芽单孢菌门、绿弯菌门和拟杆菌门增幅分别为42.42%、46.88%、31.78%和15.85%(图5)。
细菌属水平研究结果表明(表2),在播种前期(T0),西兰花残体处理后(BRT0)土壤细菌组成占优势的前5类菌群为Nonomuraea、鞘脂单胞菌属(Sphingomonas)、芽孢杆菌属(Bacillus)、Iamia和硝化螺菌属(Nitrospira),相对丰度分别为2.58%、1.57%、1.29%、1.16%和1.03%,与空白对照相比,鞘脂单胞菌属和Iamia 菌群相对丰度降幅分别为27.98%和9.38%,而Nonomuraea、芽孢杆菌属和硝化螺菌属菌群相对丰度分别为对照的9.92、3.91和1.27倍。
Table 2
表2
表2属水平棉花不同生育时期细菌菌群相对丰度(10组中至少1组相对丰度>1%)
Table 2
| 属 Genus | 时期Stage | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 播种前期 Pre-sowing stage | 苗期 Seedling stage | 蕾期 Bud stage | 花铃期 Flowering and boll stage | 吐絮期 Boll-opening stage | ||||||
| CKT0 | BRT0 | CKT1 | BRT1 | CKT2 | BRT2 | CKT3 | BRT3 | CKT4 | BRT4 | |
| Haliangium | 1.93b | 0.96a | 2.16b | 1.58a | 0.75b | 0.54a | 1.21b | 1.07a | 1.48b | 0.87a |
| 鞘脂单胞菌属Sphingomonas | 2.18b | 1.57a | 2.73a | 2.66a | 2.13a | 2.32b | 2.51b | 2.33a | 1.24b | 1.16a |
| Iamia | 1.28a | 1.16a | 0.40a | 0.65b | 0.51a | 0.90b | 0.82a | 1.01b | 0.63a | 1.66b |
| 芽单胞菌属Gemmatimonas | 0.98b | 0.34a | 1.08b | 0.88a | 1.49b | 0.81a | 2.27b | 1.01a | 0.57a | 1.12b |
| 硝化螺菌属Nitrospira | 0.81a | 1.03b | 1.34a | 1.32a | 0.70b | 0.51a | 1.07a | 0.93a | 1.03b | 0.61a |
| 红色杆菌属Rubrobacter | 0.72b | 0.55a | 1.11b | 0.82a | 1.20b | 0.68a | 0.93b | 0.75a | 0.85a | 0.84a |
| Pontibacter | 0.77b | 0.22a | 1.36b | 0.61a | 0.96b | 0.56a | 0.96b | 0.47a | 0.20a | 0.13a |
| 游动放线菌属Actinoplanes | 0.40b | 0.28a | 0.48a | 0.55b | 0.67a | 1.74b | 1.81b | 0.50a | 0.76a | 0.76b |
| Bryobacter | 0.55b | 0.45a | 0.98b | 0.73a | 0.76b | 0.50a | 1.20b | 0.61a | 0.53a | 0.58a |
| 气微菌属Aeromicrobium | 0.83b | 0.48a | 1.68b | 1.16a | 0.67a | 0.82b | 0.60b | 0.47a | 0.17a | 0.58b |
| 玫瑰弯菌属Roseiflexus | 0.29a | 0.43b | 0.53a | 0.65b | 0.63b | 0.30a | 1.13b | 0.67a | 0.61a | 0.87b |
| Solirubrobacter | 0.46b | 0.35a | 0.60a | 0.62a | 0.50a | 0.54a | 1.01b | 0.70a | 0.54a | 0.53a |
| 类诺卡氏属Nocardioides | 0.53a | 0.69b | 0.42a | 0.40a | 0.56a | 0.68b | 0.84a | 1.03b | 0.34a | 0.63b |
| 溶杆菌属Lysobacter | 0.65a | 0.67a | 0.98b | 0.55a | 0.19a | 0.50b | 0.23a | 0.57b | 0.20a | 0.75b |
| 链霉菌属Streptomyces | 0.29a | 0.83b | 0.23a | 0.35b | 0.48a | 1.16b | 0.39a | 0.55b | 0.27a | 0.55b |
| 芽孢杆菌属Bacillus | 0.33a | 1.29b | 0.23a | 0.62b | 0.40a | 0.53b | 0.29a | 0.61b | 0.20a | 0.19a |
| Nonomuraea | 0.26a | 2.58b | 0.01a | 0.07b | 0.14a | 0.30b | 0.06a | 0.07a | 0.07a | 0.74b |
| 其他Others | 86.75a | 86.10a | 83.66a | 85.77b | 87.25b | 86.61a | 82.67a | 86.65b | 90.64b | 87.43a |
新窗口打开|下载CSV
在苗期(T1),西兰花残体处理后(BRT1)土壤细菌组成占优势的前5类菌群为鞘脂单胞菌属、Haliangium、硝化螺菌属、气微菌属(Aeromicrobium)和芽单胞菌属(Gemmatimonas),与空白对照相比,鞘脂单胞菌属和硝化螺菌属菌群相对丰度差异不显著,而Haliangium、气微菌属和芽单胞菌属菌群相对丰度显著下降,降幅分别为26.85%、30.95%和18.52%。
在蕾期(T2),西兰花残体处理后(BRT2)土壤细菌组成占优势的前5类菌群为鞘脂单胞菌属、游动放线菌属(Actinoplanes)、链霉菌属(Streptomyces)、Iamia和气微菌属,与空白对照相比,上述前5类菌群的相对丰度显著上升,其增幅分别为8.92%、159.70%、204.16%、76.47%和22.39%。
在花铃期(T3),西兰花残体处理后(BRT3)土壤细菌组成占优势的前5类菌群为鞘脂单胞菌属、Haliangium、类诺卡氏属(Nocardioides)、Iamia和芽单胞菌属,与空白对照相比,类诺卡氏属和Iamia菌群的相对丰度显著上升,其增幅分别为22.62%和23.17%,鞘脂单胞菌属、Haliangium和芽单胞菌属的相对丰度显著下降,降幅分别为7.18%、11.57%和55.51%。
在吐絮期(T4),西兰花残体处理后(BRT4)土壤细菌组成占优势的前5类菌群为Iamia、鞘脂单胞菌属、芽单胞菌属、Haliangium和玫瑰弯菌属(Roseiflexus),与空白对照相比,Iamia、芽单胞菌属和玫瑰弯菌属菌群相对丰度显著上升,其增幅分别为163.49%、96.49%和42.62%,鞘脂单胞菌属和Haliangium菌群相对丰度显著下降,降幅分别为6.45%和41.22%。
3 讨论
3.1 作物残体还田对植物病害的影响
目前国内外很多研究表明,作物残体或秸秆还田对病害具有积极的防治效果[12-13,22-24]。SUBBARAO等[12]研究发现,西兰花残体还田后能够抑制花椰菜黄萎病的发生,降低了土壤中大丽轮枝菌微菌核的数量;INDERBITZIN等[13,14]研究表明,西兰花残体还田后降低了茄子黄萎病的发生和病原菌数量;DAVIS等[15]研究表明,甜玉米秸秆还田后能够降低马铃薯黄萎病的发生,防治效果达到60%—70%,进一步研究表明秸秆还田后土壤中大丽轮枝菌的数量没有直接受到影响,但减少了地上部和根部病原菌的定殖。国内****发现,芥菜混入土壤中对茄子黄萎病的发生具有良好的防治效果[22];玉米秸秆还田能够降低番茄枯萎病的发生[23];小麦秸秆还田能够降低赤霉病菌(Fusarium graminearum)的存活率,减少病害的发生[24]。然而某些植物残体或秸秆还田能够增加病害的发生[25,26],如花生秸秆还田对棉花种子萌发具有抑制作用,且秸秆用量与棉花黄萎病的发生呈正相关关系,其能够为病原菌的繁殖提供场所,导致土壤中大丽轮枝菌微菌核数量的增加[25];水稻秸秆还田后能够增加稻瘟病、鞘腐病和纹枯病的发生[26]。然而有关西兰花残体还田对棉花黄萎病的影响鲜有报道。棉花黄萎病是由大丽轮枝菌引起的土传病害,防治较为困难。本研究以‘邯686’为供试棉花品种,系统研究了西兰花残体还田对黄萎病的影响,结果表明西兰花残体还田降低了黄萎病的发病率和病情指数,且能够使发病高峰期推迟,在高峰期对黄萎病的防治效果为70.77%,在全生育期平均防效为57.21%。同时,比较了西兰花残体处理对大丽轮枝菌数量的影响,发现西兰花残体还田降低了大丽轮枝菌数量,土壤中病原菌的数量与其发病程度相关,进一步验证了SUBBARAO等[12-13,22]的观点。由此推测其防治黄萎病的原因之一是能够降低病原菌的数量。
3.2 西兰花残体还田对土壤细菌群落多样性、组成和结构的影响
微生物群落结构多样性是维持土壤生态系统稳定和可持续的重要保障,是影响土壤微生态环境中生理活性最重要的因子,也是衡量土壤微生态环境质量和土壤生产力的重要指标[27,28,29,30]。许多****研究表明,作物秸秆还田、有机肥料或绿肥等处理措施不仅对作物生长具有促生作用,而且能够改变根际微生物数量、促使活性增强,对土壤生态环境起到修复作用[31,32,33]。INDERBITZIN等[13]研究表明,西兰花残体还田后土壤微生物区系由“真菌型”向“细菌型”占主导趋势的方向转化;刘建国等[34]研究发现,棉花秸秆还田后不仅降低了土壤有害真菌的数量,而且增加了可培养微生物的数量,提高了土壤微生物的多样性指数、丰富度指数和均匀度指数,土壤微生物区系向着细菌占主导的趋势发展。本研究结果表明,土壤中添加西兰花残体后在棉花不同生育时期与空白对照相比,土壤细菌多样性增加,其中Chao1指数均显著上升,ACE指数在播种前期、花铃期和吐絮期显著上升,Shannon和Simpson指数差异不显著。在细菌组成和结构方面,在不同生育时期,西兰花残体处理和空白对照中土壤细菌占优势的门水平菌群相似,其优势菌群为变形菌门、放线菌门、酸杆菌门、芽单孢菌门、绿弯菌门、浮霉菌门、拟杆菌门和硝化螺旋菌门。主成分分析表明,不同生育时期土壤细菌群落结构存在不同程度的差异,除了在播种前期外,在苗期、蕾期、花铃期和吐絮期西兰花残体处理与空白对照相比门水平菌群的微生物群落结构差异显著。由表2可知,属水平细菌随着生育时期变化,其优势种群发生改变。如西兰花残体还田后土壤中鞘脂单胞菌属菌群的相对丰度呈现出先上升后下降的趋势。此外,在相同生育时期,西兰花残体还田后土壤细菌优势菌群发生改变,其相对丰度呈现出上升或下降的趋势,如在吐絮期,Iamia和芽单胞菌属菌群相对丰度显著上升,其他菌群如鞘脂单胞菌属和Haliangium相对丰度显著下降。
通过西兰花残体还田对棉花黄萎病防治效果的研究,结合其对不同生育时期土壤细菌群落的影响,得出西兰花残体还田后能够通过改变土壤细菌菌群的相对丰度,且不同生育时期主要优势菌群的相对丰度存在差别。
3.3 西兰花残体还田对土壤细菌有益种类的影响
链霉菌属、芽孢杆菌属、溶杆菌属菌群大多属于有益微生物,是重要的拮抗微生物种类,对植物病害的生物防治方面具有重要的作用[35,36,37]。本研究发现,在不同生育时期,西兰花残体还田后与空白对照相比,链霉菌属菌群的相对丰度呈显著上升趋势,在播种前期、苗期、蕾期、花铃期和吐絮期增幅分别为186.21%、52.17%、141.67%、41.03%和103.70%;对于芽孢杆菌属菌群而言,除了在吐絮期西兰花残体还田和空白对照之间差异不显著外,在其他时期菌群的相对丰度均呈现显著上升趋势,在播种前期、苗期、蕾期和花铃期增幅分别为290.91%、169.57%、32.50%、110.34%。此外,溶杆菌属菌群的相对丰度在蕾期、花铃期和吐絮期呈显著上升趋势。由此推测,西兰花残体还田后在一定程度上增加了有益微生物的相对丰度,进而对黄萎病起到防治作用。已有研究表明,不同种植年限土壤微生物群落结构多样性具有明显差异,并且土壤微生物群落结构受土壤养分、pH、温度、水分和通气等环境条件的影响,因此能够通过改变土壤理化性质的管理措施,在一定程度上改变土壤微生物群落结构[38,39],此外,微生物群落结构还与土壤类型、作物品种及类型等因素存在相关性[40,41]。本研究由于时间的局限性,仅从作物不同生育时期方面对土壤微生物群落结构进行了研究,西兰花残体处理与空白对照相比,在苗期、蕾期、花铃期和吐絮期门水平菌群的微生物群落结构差异显著。
此外,土壤微生物不仅是土壤有机质和养分转化与循环的动力,本身也是土壤养分的储存库,对土壤养分的转化与供应起着重要作用,是土壤肥力水平的有效指标[39]。研究表明,植物秸秆或残体还田能够改变土壤养分,与秸秆或残体类型、还田量、还田时间以及还田土壤类型有关[42]。开展西兰花残体还田对土壤理化性质的变化及其相关性研究,可为进一步衡量和评价西兰花残体还田对棉田土壤肥力和土壤质量的影响提供依据。
4 结论
西兰花残体还田是一种操作简便且节约成本的棉花黄萎病防治方法,既有效解决了西兰花残体资源浪费的问题,又杜绝了西兰花残体随意处置所造成的环境问题。通过利用西兰花残体还田,可改善土壤微生物群落结构,降低土壤中病原菌数量,增加有益微生物的相对丰度,从而达到对黄萎病菌的抑制作用,是一种有效的控制棉花黄萎病的措施。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 5]
[本文引用: 6]
[本文引用: 3]
[本文引用: 3]
[本文引用: 2]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
