 , 马景勇
, 马景勇 , 刘文国
, 刘文国
* 通讯作者(Corresponding authors): 马建, E-mail:majian19790106@163.com; 刘文国, E-mail:liuwenguo168@163.com 第一作者联系方式: E-mail:wangypbio@163.com
收稿日期:2014-04-16 基金:
摘要
关键词:宏基因组; 水稻; 农杆菌; 遗传转化
Cloning of New Herbicide Resistant Gene in Soil Metagenomics and Generation of Transgenic Rice Plants
WANG Yun-Peng
 , MA Jing-Yong
, MA Jing-Yong , LIU Wen-Guo
, LIU Wen-Guo
Fund:
Abstract
Keyword:Metagenomics; Rice;
Show Figures
Show Figures










提高农作物对除草剂耐受性的研究历来是通过遗传工程改良农作物的重要研究内容[ 1]。通过田间喷洒除草剂及提高农作物对除草剂的耐受限度能够十分有效地提高大规模农场化的田间除草。目前使用的除草剂按其作用性质分为灭生性除草剂和选择性除草剂, 而按其在植物体内的转移方式又可分为触杀型、内吸传导型、内吸传导触杀综合型。草甘膦[N-(磷酞基甲基)甘氨酸, glyphosate], 是孟山都公司开发的一种内吸传导型广谱灭生性除草剂[ 2], 自20世纪70年代开始使用至今已成为世界上使用面积最广的除草剂[ 3, 4, 5]。
占自然界微生物中90%以上的微生物无法人工培养[ 6, 7], 而宏基因组学[ 8]以某一环境中的微生物群体为研究对象, 不依赖基因序列信息, 筛选到的基因与数据库中已知的基因往往具有较低同源度; 同时由于一般采用极端环境来源的宏基因组DNA构建文库和具有极强的目的性进行筛选的条件, 因此所获得基因的性状较其他手段获得的更好。例如, 刘玉焕等[ 9]从来自中国吐鲁番盆地土壤宏基因组文库中成功筛选到一个同时具备耐高温(最适温度为78℃)和耐葡萄糖, 并具有较高酶活性的β-半乳糖苷酶基因。Culligan等[ 10]从人结肠微生物宏基因组文库中筛选获得3个耐盐基因, 并通过实验证实所获得的基因具有极强的耐盐力。
本研究通过对不同来源的土壤宏基因组文库的筛选, 获得了携带草甘膦抗性基因的大肠杆菌, 经序列分析后构建含有抗草甘膦基因的植物表达载体并通过农杆菌介导法转化水稻, 再经过对获得抗草甘膦转基因水稻的不同转化事件的分子鉴定以及对后代草甘膦的抗性分析, 获得目标性状与农艺性状俱佳的抗草甘膦转基因水稻新种质资源, 为进一步创建抗除草剂转基因水稻新品种提供了基础。
1 材料与方法1.1 实验材料水稻( Oryza sativa subsp. japonica)品种吉农大878和大肠杆菌Mach1、质粒pEAZY-syth、质粒pUC19、质粒pAG35、农杆菌EHA105均为本实验室保存。
T4 DNA连接酶、 fast pfu酶均购自北京全式金生物技术有限公司, PCR回收试剂盒、胶回收试剂盒均购自生工生物工程(上海)有限公司, M9培养基、草甘膦粉末购自北京鼎国生物公司。
1.2 抗草甘膦EPSPS基因的获得依照赵裕栋等[ 11]的方法提取土壤总DNA, 并通过琼脂糖凝胶电泳去除腐殖酸等杂质。将限制性内切酶 BamH I稀释至0.01 U µL-1后, 进行不完全酶切, 依次在反应15、30、45、60、75和90 min加热终止反应, 直接使用PCR回收试剂盒回收酶切反应产物, 连接到经相同酶切的载体pUC19上, 在含有100 mmol L-1草甘膦的M9培养基上筛选。经过37℃培养48 h后, 挑取具有草甘膦抗性单菌落, 交由生工生物工程(上海)有限公司测序, 并用DNAMAN、DNASIS、blast等软件对其进行序列分析, 寻找与草甘膦抗性相关的开放式阅读框。
1.3 EPSPS基因的原核表达与分析根据测序分析结果设计引物Primer1、Primer2, 通过PCR扩增获得片段中的 soilEPSPS基因, 引物序列为:
Primer1: 5'-acgtATGCATaTGGCCACCCCACCG ACAAC-3'
Primer2: 5'-acgtCTCGAGCACTGATCTATAGAA ATAAC-3'
下画线部分为限制性内切酶位点; 小写部分为保护性碱基; 方框内为碱基突变, 即将GTG转变为ATG。
PCR程序为94℃预变性5 min; 94℃ 30 s, 58.5℃ 30 s, 72℃ 2 min, 30个循环; 72℃延伸10 min。用PCR回收试剂盒回收PCR产物, 经 NsiI、 XhoI酶切后, 连入相同酶切的载体pEAZY-syth中, 命名为pSYTH- soilEPSPS。
将含有载体pEAZY-syth、pSYTH-CP4和pSYTH- soilEPSPS的大肠杆菌Mach1细胞在液体LB培养基中培养至OD值0.8后按照1∶200分别接种于含有0、100、200、300、400和500 mmol L-1草甘膦的M9液体培养基, 培养12 h后测定其OD值。
1.4 植物表达载体的构建利用 NsiI、 Xho I, 将pSYTH-soilEPSPS上的 soilEPSPS基因切下, 连接到用 NsiI、 Xho I酶切的pAG35大片段上。经测序验证正确, 命名为pAE35, 以冻融法转化农杆菌EHA105。
1.5 转化与筛选根据薛勇彪等[ 12]的方法, 利用农杆菌法转化水稻愈伤组织, 并在含0.5%草甘膦的继代培养基上继代2周, 将经筛选后增殖的抗性愈伤组织转移到含2%草甘膦的预分化培养基和分化培养基中分化培养, 将抗性再生植株转移到含0.5%草甘膦的生根培养基上继续培养, 同时对其进行PCR和Southern杂交检测, 将经检测为单拷贝的阳性植株培养至10 cm高, 移栽至大盆, 在温室条件下继续培养直至结实。
1.6 T0代转基因植株的分子检测 采用CTAB法提取抗性再生水稻植株的总DNA进行PCR检测, 设计 soilEPSPS基因检测引物Primer3 (5'-GGAGTGACGTTGGGGCATC-3')和Primer4 (5'-ACTCGTGTGACGGCAGGAC-3'), 目的片段746 bp。PCR程序为94℃预变性5 min; 94℃ 30 s, 58℃ 30 s, 72℃ 2 min, 30 个循环; 72℃延伸10 min。
选取来自不同抗性愈伤组织且PCR检测为阳性的植株, 提取基因组DNA用 Hind III、 EcoR I酶切后电泳, 并利用20 × SSC转移至尼龙膜上, 以引物Primer3、Primer4扩增植物表达载体pAE35的PCR产物为探针, 按照Roche公司的DIG High Primer Labeling and Detection Starter Kit I说明书固定、标记和杂交。
1.7 T1代转基因植株的遗传分析与纯合体转基因植株的获得 将经过检测为阳性且单拷贝的T0代转基因株系种子种植于10 cm × 10 cm的营养钵中, 待株高达到10 cm左右, 喷洒200 mmol L-1的草甘膦溶液进行草甘膦抗性鉴定并统计分离比例。从鉴定为抗性的不同转化事件的T1植株中随机取10株继续培养并收获种子, 各接种100粒于含有200 mmol L-1草甘膦的MS培养基上, 观察是否出现分离。
1.8 T1、T2代转基因植株的分子鉴定 用TransZol Up Plus RNA Kit分别提取3个不同转基因水稻株系的T1、T2代植株的总RNA, 并用TransScript One-Step RT-PCR SuperMix进行RT-PCR检测, 以Primer3、Primer4为引物检测目的基因; 以水稻内源 actin基因为内参, 设计引物Primer5 (5'-CCTGAGAAACGGCTACCAT-3')、Primer6 (5'-CGTGTCAGGATTGGGTAAT-3')扩增该内源基因, 分析不同转化事件后代植株中 soilEPSPS基因的转录水平。分别提取3个不同转基因水稻株系的T1、T2代植株的总DNA, 按照1.6描述方法进行Southern杂交分析。
1.9 T2代转基因植株的草甘膦抗性鉴定 分别取野生型植株和3个单拷贝转基因事件的T1代种子各10枚播种于6 cm × 6 cm营养钵中, 共计5组, 每组3个重复。待植株生长至10 cm高时分别喷洒200、300、400、500和600 mmol L-1的草甘膦溶液, 2周后观察结果。
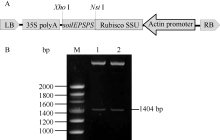
2 结果与分析2.1 片段的克隆与序列分析比较经筛选获得的抗草甘膦阳性克隆菌落, 选直径最大的测序, 分析插入序列。序列分析结果表明, 该段序列共计4.86 kb, 包含5个大于500 bp的开放式阅读框, 经Blast分析发现, 其中一个1404 bp的基因(图1-A)为 EPSPS家族成员, 该基因以GTG为起始密码子, 其密码子上游存在一个典型的SD序列。尽管该基因编码蛋白与EPSPS CP4蛋白序列之间有68.7%同源性, 但其不含有已经公布的专利[ 2, 13, 14, 15, 16]中保护的氨基酸序列或结构域, 将该基因命名为 soilEPSPS。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 soilEPSPS基因的序列分析Fig. 1 Sequence analysis of soi lEPSPSgene |
与已发表其他 EPSPS家族成员对比发现, 其与II型的EPSPS基因 EPSPS CP4同源性最高, 达57%的基因; 而与玉米、大豆等来源的I型的 EPSPS基因同源性低于31%。由于I型和II型EPSPS家族来源于不同的 EPSPS基因, 不同家族间基因同源性低于50%, 因此推断, 克隆的 soilEPSPS基因属于II型 EPSPS家族。系统进化分析(图1-B)进一步证明了该基因为Class II型的 EP SPS基因。
2.2 EPSPS基因的功能验证如图2-C所示, 在含有200 mmol L-1草甘膦的M9固体培养基上, 携带3种不同载体的大肠杆菌生长状况表明, soilEPSPS基因和 EPSPS CP4基因能够提高宿主细胞的草甘膦抗性。图2-B显示, 当草甘膦浓度大于200 mmol L-1时, 携带pSYTH-soilEPSPS的大肠杆菌菌液OD值明显高于携带pSYTH-CP4的大肠杆菌菌液OD值, 表明在原核启动子Prrn驱动下的 soilEPSPS基因较 EPSPS CP4基因能够赋予其宿主细胞更高浓度草甘膦的抗性。
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 利用原核表达验证 soilEPSPS基因的功能Fig. 2 Prokaryotic expression of soilEPSPS in E. coli |
2.3 pAE35植物表达载体的构建如图3-A所示, 通过亚克隆将 soilEPSPS基因替换pAG35上的 smGFP基因, 由 actin启动子驱动并与水稻叶绿体定位引导肽Rubisco SSU融合表达以确保 soilEPSPS基因编码的蛋白能够进入水稻叶绿体中执行功能。用 NsiI、 XhoI酶切鉴定释放出长约1.4 kb的片段(图3-B), 测序结果进一步证实插入序列方向正确、无变异, 将该重组载体命名为pAE35。
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 植物表达载体的构建Fig. 3 Construction of plant expression vector |
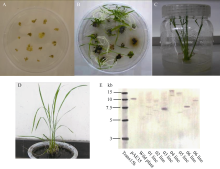
2.4 抗性植株的获得如图4-A所示, 经过2周筛选共获得7块抗性愈伤组织, 将其置含2%草甘膦的分化培养基上, 共获得26株草甘膦抗性水稻再生植株(图4-B, C), 将其移至生根培养基上同时剪取叶片进行分子鉴定(图4-E), 移栽阳性单拷贝转化植株, 并在温室中培养(图4-D)。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 水稻抗性植株的获得及分子检测Fig. 4 Regenerated resistant plants and their identification through Southern blotting assay |
2.5 T0代转基因植株的分子检测 经PCR鉴定所有抗性植株均为转基因阳性植株, 由于同一块抗性愈伤组织分化出的再生植株可能为同一转化事件, 因此选择不同来源的7株水稻再生植株进行Southern分析, 结果如图4-E所示, 编号03、06、07的3个转基因株系为单拷贝转化事件。
2.6 T1代转基因植株的遗传分析与纯合体转基因植株的获得 如表1所示, 3个不同的T0代水稻转基因株系T1代的分离均符合孟德尔等位基因遗传规律, 即符合3∶1的分离比。随机取10株T1收获种子, 播种于含200 mmol L-1的草甘膦MS培养基上, 保存其后代不发生性状分离的植株种子, 即转 soilEPSPS基因纯合植株种子。
表1
Table 1
表1(Table 1)
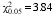 | 表1 T1转基因植株后代的分离比 Table 1 Segregation ratio of T1 transgenic plants |
2.7 T1、T2代转基因植株的分子鉴定 RT-PCR结果表明, soilEPSPS基因在3个转基因株系的后代中均能够正常转录, 其中编号为06的转基因株系的转录水平明显高于其他2个株系(图5-A)。Southern 杂交结果表明, soilEPSPS基因在染色体上的整合能够在其后代稳定遗传(图5-B)。
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 纯合植株的分子检测Fig. 5 Detection of Homozygote transformants |
2.8 T2代转基因植株的草甘膦抗性鉴定 经过不同浓度的草甘膦溶液喷洒2周后观察, 当草甘膦浓度达到200 mmol L-1时, 野生型植株已经彻底死亡, 而3个不同株系的T2代转基因水稻植株在500 mmol L-1草甘膦溶液喷洒后仍能正常生长(图6), 说明该株系可以耐受500 mmol L-1草甘膦。
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 转基因水稻的草甘膦抗性鉴定Fig. 6 Resistance verification of transgenic rice by spraying glyphosate |
3 讨论自20世纪80年代孟山都公司将农杆菌来源的 EPSPS CP4基因应用于农作物转基因研究[ 17]至今, 其转基因农作物已经占据全世界近百万公顷土地[ 18, 19]。获得具有自主知识产权的抗草甘膦 EPSPS基因对我国开展抗草甘膦转基因农作物的研发与市场推广具有十分重要的意义。本研究中克隆的 soilEPSPS基因不含有已公布专利中涉及到的特殊氨基酸位点, 同时原核功能验证表明其较 EPSPS CP4基因能够为宿主细胞提供更强的草甘膦耐受能力, 是进行转基因研究开发自主知识产权转基因农作物的重要基因。
赵海铭等[ 20]将外源 EPSPS基因与高粱 EPSPS基因的叶绿体转运肽相连, 能够取得良好的草甘膦抗性, 当缺失叶绿体转运肽时, 尽管转基因植株中 EPSPS CP4基因能够以较高水平表达, 但转基因植株并不具备草甘膦抗性。本研究中, 将克隆到的 soilEPSPS基因与水稻Rubisco SSU引导肽连接, 使其表达产物定位到水稻质体确保转基因水稻获得更高的草甘膦耐受性。Daniell等[ 21]将矮牵牛的 EPSPS基因稳定整合到烟草的叶绿体中表达, 在赋予烟草草甘膦抗性的同时防止外源基因通过花粉传播造成环境问题。我们计划是将 soilEPSPS基因转化到水稻叶绿体中, 并比较细胞核表达该基因编码的EPSPS蛋白转移至叶绿体中和该基因直接在叶绿体内表达对水稻抗草甘膦能力的差异, 进一步探究转基因水稻抗草甘膦的不同策略。
4 结论分离得到土壤宏基因组来源的 EPSPS基因, 证实该基因对草甘膦具有较好的耐受性。通过农杆菌侵染的方法将携带该基因的植物表达载体pAE35导入水稻基因组后能够极大地提高其对草甘膦的耐受能力。成功获得了3个具有较强草甘膦抗性并能够稳定遗传的水稻转化事件, 为转基因抗除草剂水稻新品种的培育奠定了基础。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] |
