 , 亓宝秀
, 亓宝秀
* 通讯作者(Corresponding authors): 亓宝秀, E-mail:qbx126@sdau.edu.cn, Tel: 0538-8246205; 李新征, E-mail:lxz@sdau.edu.cn, Tel: 0538-8246205
第一作者联系方式: E-mail: liujiang2582006@126.com
** 对本文有相同贡献.
收稿日期:2013-09-16 基金:本研究由国家转基因生物新品种培育科技重大专项(2009ZX08005-024B), 国家自然科学基金项目(30970222)和山东省现代农业产业技术体系建设专项资金资助。
摘要从球等鞭金藻、眼虫、高山被孢霉和拟南芥中分别克隆到Δ9链延长酶、Δ8去饱和酶、Δ5去饱和酶和Δ15去饱和酶基因, 利用我们的多基因聚合方法, 将这4个基因聚合到植物表达载体pCambia2300上, 其中每个基因都含有独立的CaMV35S启动子和Tnos终止子。利用农杆菌介导法将该表达载体转入棉花, 通过卡纳霉素和PCR筛选获得转基因阳性植株, 提取转基因阳性植株叶片总脂肪酸, 用气相色谱分析法检测到花生四烯酸(AA, 20:4Δ5,8,11,14)和二十碳五烯酸(EPA, 20:5Δ5,8,11,14,17)含量分别达1.0%和5.0%。表明通过基因代谢工程在棉花中异源合成EPA是可行的, 为进一步在棉籽中生产VLCPUFAs奠定了基础。
关键词:去饱和酶; 链延长酶; 转基因; EPA; 棉花
Production of Very Long Chain Polyunsaturated Fatty Acids in Cotton
LIU Jiang
 , QI Bao-Xiu
, QI Bao-Xiu
** Contributed equally to this work
AbstractWe have isolated four genes encoding a Δ9 elongase, a Δ8 desaturase, a Δ5 desaturase, and a Δ15 desaturase from
Keyword:Desaturase; Elongase; Transgenes; Eicosapentaenoic acid; Cotton
Show Figures
Show Figures










超长链多不饱和脂肪酸(very long chain poly unsaturated fatty acids, VLCPUFAs)是指含有4~6个双键且碳链长度大于等于20个碳原子的直链脂肪酸[ 1]。VLCPUFAs根据双键的位置通常分为ω3脂肪酸和ω6脂肪酸。深海鱼油是公认的保健品, 其有效成分为EPA (20:5, eicosapentaenoic acid)和DHA (22:6, docosahexaenoic acid)等ω3脂肪酸。EPA是哺乳动物细胞膜的组分, 也是前列腺素、白三烯和血栓素等激素的前体, 对调节血压、炎症反应以及信号转导有重要作用, 从而有效防止多种心血管疾病和炎症的发生[ 2, 3]。DHA对胎儿神经系统的形成至关重要[ 4], 但人体内合成EPA/DHA的效率比较低, 因此在日常饮食中补充足够的EPA/DHA对维持身体健康极为重要。
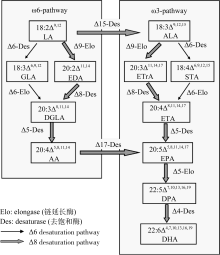
VLCPUFAs的合成主要包括两条途径(图1), 第一条为经典的Δ6途径, 亚油酸(LA, 18:2Δ9,12)和α-亚麻酸(ALA, 18:3Δ9,12,15)在Δ6去饱和酶作用下生成γ-亚麻酸(GLA, 18:3Δ6,9,12)和十八碳四烯酸(SDA, 18:4Δ6,9,12,15), 然后经过Δ6链延长生成二高-γ-亚麻酸(DGLA, 20:3Δ8,11,14)和二十碳四烯酸(ETA, 20:4Δ8,11,14,17), 而后再经过Δ5去饱和生成AA和EPA。EPA又可经Δ5链延长和Δ4去饱和生成DHA, 并且ω6脂肪酸可在Δ15和Δ17去饱和酶作用下生成ω3脂肪酸。在某些微藻如球等鞭金藻中, VLCPUFAs的合成还存在另一条“替代途径”, LA和ALA先经Δ9链延长生成二十碳二烯酸(EDA, 20:2Δ11,14)和二十碳三烯酸(ETrA, 20:3Δ11,14,17), 然后经Δ8去饱和以及Δ5去饱和生成花生四烯酸(AA, 20:4Δ5, 8,11,14)和二十碳五烯酸(EPA, 20:4Δ5,8,11,14,17)[ 1, 5]。
图
Fig
| Figure OptionViewDownloadNew Window | |
 | 图 1 超长链多不饱和脂肪酸合成途径依据Qi等[ 5]和Abbadi等[ 1]。Fig . 1 VLCPUFA biosynthetic pathwaysAccording to Qi et al.[ 5] and Abbadi et al.[ 1]. |
高等植物由于缺乏VLCPUFAs合成途径中的去饱和酶以及链延长酶, 一般只能合成亚油酸和亚麻酸, 不能合成VLCPUFAs, 通过转基因技术将VLCPUFAs合成相关酶转入高等植物, 来生成VLCPUFAs已成为研究热点[ 5, 6, 7, 8, 9]。2004年, Qi等[ 5]将球等鞭金藻中的Δ9链延长酶、眼虫的Δ8去饱和酶以及高山被孢霉的Δ5去饱和酶转入拟南芥中, 在转基因拟南芥叶片中生成3.0%的EPA, 首次证明了高等植物通过基因代谢工程合成VLCPUFAs是可行的。
棉花是重要的纤维作物, 其副产品棉籽是食用植物油脂的重要来源之一。精炼的棉籽油是一种优质的食用植物油, 含有大量人体必需的脂肪酸, 如亚油酸和亚麻酸, 其中亚油酸的含量可达50%[ 10]。与菜籽油和大豆油相比, 棉籽油虽然产量高, 但价值相对较低, 在不影响纤维产量和质量的条件下, 可以通过改良棉籽中的脂肪酸成分来提高其营养和经济价值。本研究旨在探索棉花中合成EPA的可能性, 为此构建了含有Δ9链延长酶[ 11]、Δ8去饱和酶[ 12]、Δ5去饱和酶[ 13]和Δ15去饱和酶[ 14]4个基因的植物表达载体, 以农杆菌介导法转化棉花, 通过气相色谱检测转基因棉花叶片中的脂肪酸成分, 研究在棉花中异源合成EPA的可行性, 为进一步在棉籽中生产VLCPUFAs奠定基础。
1 材料与方法1.1 试验材料及试剂大肠杆菌XL10 (Stratagene)、植物表达载体pCambia2300、辅助载体pAUX2为实验室保存; Taq酶、限制性内切酶、T4DNA连接酶和琼脂糖凝胶回收试剂盒等均购自TAKARA公司; 脂肪酸底物等购自Nuchek公司; PCR引物由上海生工生物工程技术服务有限公司合成。
1.2 引物设计根据NCBI上已经提交的Δ9链延长酶基因(AF390174)、Δ8去饱和酶基因(AF139720)、Δ5去饱和酶基因(AF054824)、Δ15去饱和酶基因(AT3G 11170)设计D9L ( Xho I)-D9R ( Xho I)、D8L ( Xho I)-D8R ( Xho I)、MortD5L ( Xho I)-MortD5R ( Xho I)和AtD15L-AtD15R ( Xho I) 4对引物(两端分别引入适宜的酶切位点)(表1), 分别扩增4个基因。
表1
Tabl
表1(Tabl)
| 表1 基因扩增与检测引物 Tabl e 1 Primer for genes amplification detection |
1.3 多基因表达载体的构建我们分别克隆了4个基因(Δ9链延长酶基因、Δ8去饱和酶基因、Δ5去饱和酶基因、Δ15去饱和酶基因)的cDNA片段, 并亚克隆到辅助载体pAUX2中。首先以D9L ( Xho I)、D9R ( Xho I)为引物, 以含有球等鞭金藻Δ9链延长酶基因的质粒pCR2.1-Δ9Elo为模板, PCR扩增出约0.8 kb的条带, 获得Δ9链延长酶基因; 以D8L ( Xho I)、D8R ( Xho I)为引物, 以含有眼虫( Euglena gracilis) Δ8去饱和酶基因的pESC-TrpΔ8质粒为模板, PCR扩增出大约1.3 kb的条带, 获得Δ8去饱和酶基因; 以转基因拟南芥的基因组DNA为模板, 用高山被孢霉( Mortierella alpine) Δ5去饱和酶的引物MortD5L ( Xho I)和MortD5R ( Xho I)进行PCR扩增, 得到大约1.4 kb的条带, 获得Δ5去饱和酶基因; 以反转录的野生型拟南芥第一链cDNA为模板, 用拟南芥Δ15去饱和酶基因引物AtD15L和AtD15R ( Xho I)进行PCR扩增, 得到大约1.4 kb的条带, 获得Δ15去饱和酶基因。利用多基因载体构建的方法[ 15], 将5个基因表达盒串联起来; 用 XbaI将4个基因表达盒从pAUX2-4EC上切下, 酶切产物进行琼脂糖凝胶电泳纯化回收, 用T4 DNA连接酶将线性化载体pCambia2300与4个基因表达盒片段按摩尔比1∶3~1∶9连接, 得到pCambia2300-4EC后转化大肠杆菌XL10, 提取质粒, 经酶切及测序验证后, 转化农杆菌GV3101。
1.4 农杆菌转化及抗性植株再生将质粒pCambia2300-4EC转入农杆菌菌株GV3101, 挑取重组农杆菌GV3101单菌落于YEP (含50 mg L-1利福平和 50 mg L-1卡那霉素)液体培养基中, 28℃、180转 min-1振荡培养过夜; 取过夜活化后的菌液5 mL加至100 mL新鲜的 YEP液体培养基中, 28℃、180转min-1培养过夜, 至菌液OD600为0.6~0.8, 于4℃、5000转 min-1离心 5 min 收集菌体, 用 MS 液体培养基洗涤一次后悬浮于MS液体培养基, 调节OD600至0.4~0.6。用农杆菌侵染无菌的棉花子叶, 将侵染后的子叶置于共培养基(MS+2,4-D 0.1 mg L-1+KT 0.1 mg L-1)中培养3 d, 然后将其转移到诱导培养基中(MS+2,4-D 0.1 mg L-1+KT 0.1 mg L-1+Km 100 mg L-1+Cef 500 mg L-1), 在黑暗条件下培养2个月后, 将诱导出的愈伤组织放入增殖培养基(MS+MgCl2 0.9 g L-1+Celrit 2.0 g L-1+葡萄糖30 g L-1, pH 5.8)分化, 愈伤组织继代3~5次后转入分化培养基中(MS+谷氨酰氨1.0 g L-1+ MgCl2 0.9~1.5 g L-1+ Celrit 2.0~3.0 g L-1+葡萄糖20~30 g L-1, pH 5.8), 分化成胚状体, 进一步长成小苗, 将小苗嫁接到新的植株。
1.5 转基因棉花的筛选与鉴定用SDS法提取转基因棉花基因组, 利用基因特异性引物99JC-L和99JC-R、8JC-L和8JC-R、MortD5JC-L和MortD5JC-R、AtD15L和AtD15R ( Xho I)进行PCR检测(表1)。
1.6 脂肪酸提取及气相色谱分析取转基因棉花叶片0.5 g, 烘干并加液氮研磨, 置于3 mL的玻璃瓶中, 添加1 mL甲基化溶液(含甲醇0.85 mL, 2,2-二甲氧丙烷 0.05 mL, 盐酸0.1 mL), 85℃甲基化反应1 h; 冷却后, 添加1%氯化钠1 mL和正己烷0.5 mL, 漩涡振荡后于室温放置10 min或更长时间; 离心取上层液相, 进行气相色谱分析[ 5]。
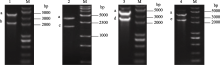
2 结果与分析2.1 植物表达载体pCambia2300-4EC的构建将高等植物中丰富的油酸LA或亚麻酸ALA转化成EPA, 需要至少3个酶催化, 即Δ9链延长酶、Δ8去饱和酶和Δ5去饱和酶, 为了增加目的产物EPA的最终产量, 还可以增加ω3去饱和酶基因, 即可将油酸转化成亚麻酸的Δ15去饱和酶。我们将这4个基因分别亚克隆到辅助载体pAUX2中, 经酶切鉴定, 获得1.9、2.3、2.5和2.6 kb的目的片段(图2), 分别含有35s启动子、目的基因和终止子。
图2
Fig.2
| Figure OptionViewDownloadNew Window | |
 | 图2 Δ9、Δ8、Δ5、Δ15基因辅助载体单酶切鉴定M: DNA分子量; 1~4: pAUX2-Δ9、pAUX2-Δ8、pAUX2-Δ5和pAUX2-Δ15载体 XbaI单酶切; a~e: 线性化的pAUX2片段, E9表达盒, D8表达盒, D5表达盒, D15表达盒。Fig.2 Verification of vectors containing individual transgenes of Δ9, Δ8, Δ5, Δ15 with XbaI digestionM: DNA marker; 1-4: pAUX2-Δ9, pAUX2-Δ8, pAUX2-Δ5 and pAUX2-Δ15 digested with Xba I, respectively; a-e: fragment of pAUX2, fragment of E9 expression cassette, fragment of D8 expression cassette, fragment of D5 expression cassette, and fragment of D15 expression cassette. |
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 辅助载体pAUX2-Δ9Δ8Δ5Δ15的构建Fig. 3 Construction of the plant expression vector pAUX2-Δ9Δ8Δ5Δ15 |
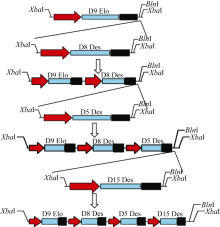
利用本实验室多基因表达载体构建专利技术[ 15], 构建由Δ8去饱和途径中Δ9链延长酶、Δ8去饱和酶、Δ5去饱和酶及Δ15去饱和酶4个基因组成的辅助表达载体pAUX2-Δ9Δ8Δ5Δ15 (图3), 首先将pAUX2- Δ8中的Δ8基因的表达盒(35S/Δ8/Tnos) XbaI切下, 连接到经限制性内切酶 AvrII线性化的质粒pAUX2-Δ9中, 鉴定方向后, 获得质粒pAUX2- Δ9Δ8。然后, 用 XbaI将Δ5基因的表达盒在质粒pAUX2-Δ5上切下来, 连接到用 AvrII线性化的质粒pAUX2-Δ9Δ8中, 鉴定方向后, 获得pAUX2- Δ9Δ8Δ5。接着, 将pAUX2-Δ9Δ8Δ5用 AvrII线性化, 来接受用 XbaI在pAUX2-Δ15上切下的Δ15基因的表达盒, 获得带有4个基因表达盒的过渡质粒pAUX2-Δ9Δ8Δ5Δ15。对各个中间质粒用 XbaI酶切验证, 每个过渡载体除能切出3.9 kb的辅助载体的骨架片段外, 还能分别切出带有1~4个基因表达盒的片段(图4), 其中每个基因都含有独立的CaMV35S启动子和Tnos终止子, 最后将4个基因的表达盒酶切连入植物表达载体pCambia2300, 以抗 kan基因作为选择标记。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 重组载体pAUX2-Δ9、pAUX2-Δ9Δ8、pAUX2-Δ9Δ8Δ5和pAUX2-Δ9Δ8Δ5Δ15的 XbaI酶切检测所有的质粒都用 XbaI酶切, 并在0.8%的琼脂糖电泳上分离。a: pAUX3-E9D8D5载体的结构示意图; b: 中间载体的酶切检测, 红色箭头所指是载体主干(3.9 kb); c: 各个独立表达盒的大小。Fig. 4 Recombinant plasmids pAUX2-Δ9, pAUX2-Δ9Δ8, pAUX2-Δ9Δ8Δ5, and pAUX2-Δ9Δ8Δ5Δ15 digested by XbaIAll the intermediate constructs were digested by XbaI and separated on a 0.8% agarose gel. a: diagram of pAUX2-Δ9Δ8Δ5Δ15, showing the arrangement and linkage of individual cassette; b: restriction digestion of all intermediate vectors. Red arrow indicates the position of the vector backbone (3.9 kb); c: sizes of individual inserts. |
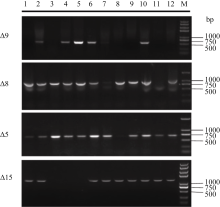
2.2 多基因载体的转化以及转基因棉花的筛选与鉴定利用农杆菌介导法, 转化棉花珂201子叶(图5), 获得46个再生克隆, 嫁接367棵再生苗, 以PCR鉴定筛选到阳性植株37棵, 其中12株收获棉籽。SDS法提取T2代转基因株系叶片基因组DNA, 利用基因特异性引物进行PCR检测, 在琼脂糖凝胶电泳图上有目的条带(图6), 在大部分植株中能检测到目的基因, 初步确定这些株转基因株系为阳性株系。
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 棉花的再生过程A: 叶片诱导出初级愈伤组织; B: 分化中的愈伤组织; C: 愈伤分化形成的小苗; D: 小苗嫁接到新的植株。Fig. 5 Regenerative process of transgenic cottonA: primary calli from the leaf; B: differentiating calli; C: regenerated plantlets calli; D: new plant grafted. |
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 转基因棉花的PCR检测M: marker; 1~12: 转基因植株。M: marker; 1-12: transgenic lines.Fig. 6 Detection of transgenic lines by PCR |
2.3 转基因棉花叶片脂肪酸检测分别提取上述12株转基因棉花以及非转基因棉花叶片的脂肪酸, 并利用气相色谱进行脂肪酸含量分析(图7)。其中6号和10号株转基因棉花叶片在18 min左右产生了2个明显的峰, 与标样对比, 鉴定这2个峰分别为AA和EPA, 平均含量分别为1.0%和5.0% (表2)。通过与非转基因棉花叶片比较可以看出, 转基因棉花叶片中其他脂肪酸成分及含量也发生了变化, 其LA、ALA的含量明显下降, 其他脂肪酸变化不大。表明转化的EPA合成途径中的这4个基因已经整合到棉花基因组中并成功表达, 其编码产物即4种酶在棉花中成功组建了EPA的合成代谢途径, 并以棉花内源LA和ALA为底物经过多步连续酶促反应生成了AA和EPA。
表2
Tabl
表2(Tabl)
| 表2 转基因棉花叶片脂肪酸组成分析 Tabl e 2 Total fatty acid composition of leaves from transgenic cotton | |||||||||||||||||||||||||||||
图
Fig
| Figure OptionViewDownloadNew Window | |
 | 图 7 6号转基因棉花叶片脂肪酸气相色谱分析Fig . 7 GC profiles of the sixth transgenic cotton leaf fatty acid methyl esters |
3 讨论棉花是我国重要的农作物, 精炼的棉籽油是我国重要的食用油来源之一, 其含有丰富的必需脂肪酸, 为了进一步改良棉籽油, 可以通过转基因技术改变棉籽油的成分, 培育出优质的棉花新品种, 理论上所有外源基因都可以转入棉花[ 16]。目前, 向棉花中转入的基因主要涉及抗虫、抗除草剂和耐盐等基因。
在棉花中生产EPA, 至少需要转化3个酶基因才能实现, 目前常用的就是分次转化法[ 17], 每次转化都要一个新的筛选标记基因来筛选转基因植株, 同时需要筛选纯合体, 来进行下一个基因的转化。由于高等植物生长周期长、转化困难, 因此较难运用于实践, 同时分次转化获得的植株后代容易发生基因分离, 导致性状不稳定, 因此需要寻找更简单快捷的转化方法。
本研究中, 为在高等植物中重组EPA合成代谢途径, 我们分别从球等鞭金藻、眼虫、高山被孢霉和拟南芥中克隆到Δ9链延长酶、Δ8去饱和酶、Δ5去饱和酶和Δ15去饱和酶基因, 利用我们自己的多基因表达载体构建专利技术, 将EPA合成途径中的4个基因串联在一起, 一次性转化棉花, 通过卡那霉素筛选, 获得12株转基因株系。提取转基因植株叶片基因组, 利用基因特异性引物检测, 确定转基因株系为阳性株系, 从图2可以看出, 在12株转基因株系中, 均能扩增出Δ8和Δ5去饱和酶基因, 而Δ9链延长酶基因和Δ15去饱和酶基因却只在部分植株中扩增出来, 部分原因可能是这些基因都具有相同的启动子与终止子, 且方向相同, 在基因整合到染色体过程中发生重组而丢失掉了。提取12株转基因棉花叶片脂肪酸进行气相色谱检测, 在转基因棉花叶片中, 可以明显看出亚油酸和亚麻酸的含量比野生型含量低, 其中有2株生成了AA和EPA, 平均含量达到1.0%和5.0%。在转基因棉花叶片中并没有检测到中间产物的生成, 这可能是本研究将EPA合成途径的4个基因表达盒串联在一个基因片段上, 转入棉花中, 由于基因之间紧密连锁, 相同的启动子使其表达量也相同, 而且由于在EPA合成中, 催化第一步反应的酶一般都是限速酶, 其他酶活性相对较高, 因此不会造成中间产物积累, 所以在转基因棉花叶片中检测不到中间产物是正常的; 这与一些富含EPA的微藻和真菌中情况类似, 如马铃薯治病疫霉, 含有丰富的EPA, 占总脂肪酸的15.2%, 但EPA合成途径的中间产物含量却极低, 有的甚至检测不到[ 18]。
转基因植物合成VLCPUFAs后, 需要将其转化为三酰甘油(TAG)才能被利用, 种子是TAG储存的主要部位, 因此选择强的种子特异性启动子来实现外源基因在种子中的超表达, 是提高VLCPUFAs在植物中含量的有效方法之一。2010年, Cheng等[ 19]以含有Napin启动子的多基因载体转化埃塞俄比亚芥( Brassica carinata), 在转基因种子中检测到EPA, 含量达到总脂肪酸的20%, 是迄今为止, 在转基因植物中合成的EPA含量最高记录, 这与埃塞俄比亚芥自身脂类代谢及Napin启动子的高效表达相关。为了进一步提高棉花中EPA含量, 我们将克隆棉花种子特异性启动子及高活性的酶, 从而促进EPA的积累。EPA可以通过Δ5链延长和Δ4去饱和生成DHA, 因此在棉花中生产DHA还需转入Δ5链延长酶基因和Δ4去饱和酶基因, 我们将进一步克隆高催化活性的Δ5链延长酶基因和Δ4去饱和酶基因以及调控脂肪酸合成的转录因子 WRI1和 LEC1等[ 20], 一起转入可以高效合成EPA的转基因棉花中, 来促进外源基因在棉花种子中的表达以及脂肪酸的合成, 从而提高VLCPUFAs的产量。当棉籽油中AA、EPA和DHA的含量各占总脂肪酸的5%, 10 g这样的油脂就能满足1个人1天对VLCPUFAs的需求量[ 21]; 转基因植物就有可能作为鱼油的良好替代资源应用于生产, 为更多的人提供廉价且高品质的食用油, 从而大大增进人类健康。
4 结论通过转基因技术, 将Δ9链延长酶、Δ8去饱和酶、Δ5去饱和酶和Δ15去饱和酶4个基因转化棉花, 在转基因棉花叶片中检测到1.0%和5.0%的AA和EPA, 没有检测到其他非特异性脂肪酸, 证明在棉花中异源合成EPA是可行的, 为进一步在棉籽中生产VLCPUFAs奠定基础。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] |
