
X射线激发光动力(X?PDT)通过利用高穿透性X射线作为激发源有望实现传统光动力(PDT)在肿瘤治疗上的革新,使其具备可用于深部肿瘤治疗的潜能。纳米闪烁体作为X射线能量吸收的基体和将其转换为可被光敏剂吸收的紫外?可见光的媒介在X?PDT治疗过程起着重要的作用,但是目前大多数报道的纳米闪烁体均从传统闪烁体材料纳米化而来,由于纳米化导致其表面缺陷增多,使得纳米闪烁体的发光性能(或闪烁性能)不尽如人意,影响了它们的进一步生物应用,因此设计并制备出高性能纳米闪烁体成为该领域的研究热点和难点。 此外,目前大多数抗癌纳米药物在临床试验中表现不佳,其中一个原因是目前临床前研究尚缺乏关于诊断和靶向、疾病进展分层和选择最佳治疗策略的有效生物标志物的信息,而代谢组学分析有望提供一种有效的解决方案。
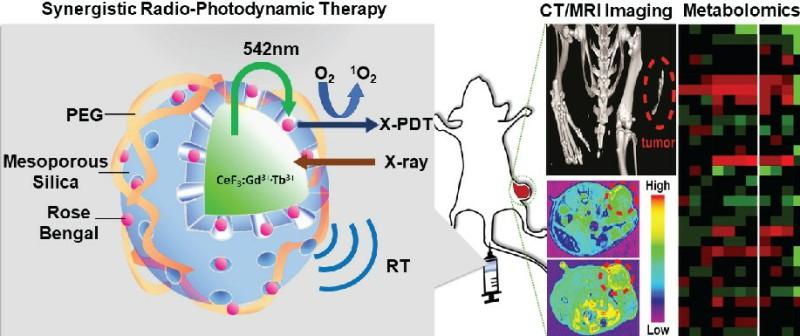
图1 研究工作的设计思路
为此,李万万研究团队针对目前传统纳米闪烁体发光性能差的现象,提出通过共掺杂铽和钆离子来增强其在可见区域的辐射发光,以一种简单、通用的方式提供了有效的解决方案。他们对传统闪烁体CeF3纳米粒子进行了研究,发现了CeF3纳米粒子的闪烁机理是通过有效的能量传递,而通过适当掺杂稀土元素可以改善其闪烁性能。结果表明,在CeF3:Gd3+,Tb3+体系中,由于Gd3+的能级介于Ce3+和Tb3+之间,共掺Gd3+和Tb3+可大幅提高其闪烁性能。此外,Gd3+共掺杂不仅可以促进从Ce3+到Tb3+捕获能量的有效迁移,而且由于其固有的磁性能和高原子序数特性,还可以用于计算机断层扫描(CT)和磁共振成像(MRI)诊断,因此该纳米闪烁体可用于构建多功能纳米诊疗试剂应用于癌症的诊断与治疗。
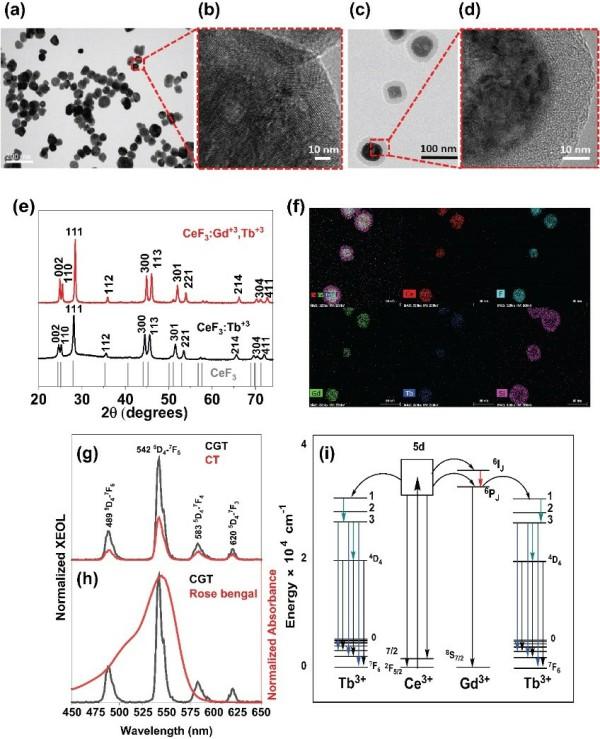
图2对纳米闪烁体的表征
为了有利于该多功能纳米闪烁体的进一步生物应用,该工作将共掺杂纳米闪烁体尺寸控制在~80nm,然后在其表面修饰非常薄的(~10nm)介孔二氧化硅,用于装载FDA批准的临床用光敏剂Rose Bengal,以实现光动力疗法。动物实验表明,该多功能纳米闪烁体可以通过单次低剂量X射线辐射实现协同的放射治疗(RT)和光动力治疗(XPDT)来清除体内深层肿瘤。即使在3Gy的一次性X射线剂量下也表现出良好的肿瘤治疗效果,且未发现肿瘤转移现象。通过肿瘤和血清的整体代谢组学分析鉴定和证实,XPDT与RT协同治疗的生物毒性较低,表明改性纳米闪烁体在深部肿瘤的诊断和治疗中具有广阔的应用前景。
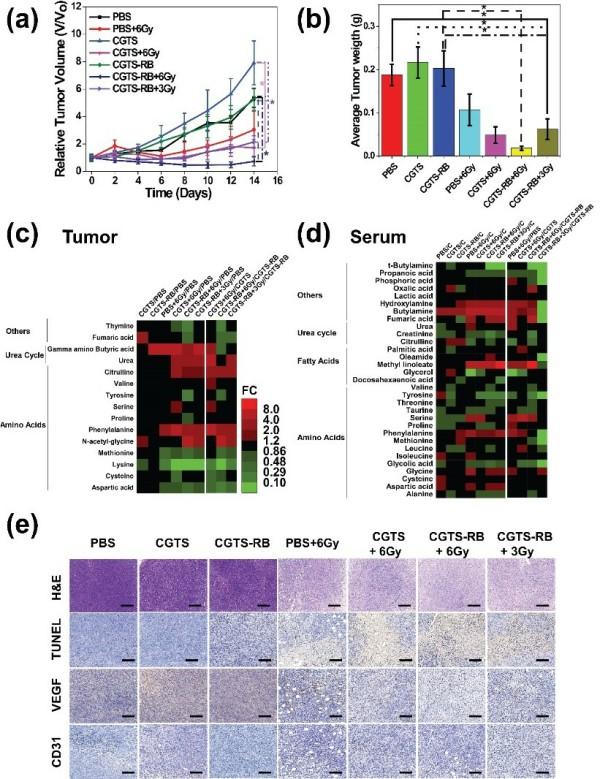
图3 X射线介导的体内放疗和光动力联合治疗
为了进一步探讨血管受损和肿瘤消退的原因,该工作采用了基于气相色谱-质谱联用
(GC/MS)的代谢组学技术作为诊断和预后工具,研究显示XPDT与RT协同治疗是通过减少参与细胞团发育的非必需氨基酸的供应,并且影响治疗期间血管损伤的修复,从而促进肿瘤的消退。而重要器官的组织病理学分析与血清代谢物分析表明,CGTS-RB NPS在给药和治疗过程中没有引入毒性。因此,采用全谱代谢组学的方法研究肿瘤的纳米治疗,有望更全面地反映载药纳米材料及其协同治疗方式对细胞生理、毒理、疾病进展和肿瘤消退的作用。
论文共同第一作者为Farooq Ahmad博士后和系统生物医学研究院王晓艳副研究员,李万万研究员为论文的通讯作者。这项工作得到了美国国立卫生研究院((National Institutes of Health, NIH) 陈小元教授的帮助。同时,研究工作得到了国家重点研发计划纳米专项、国家自然科学基金面上项目和上海市科委基金项目等的资助。
论文链接:https://pubs.acs.org/doi/10.1021/acsnano.9b04213
