

内蒙古农业大学 乳品生物技术与工程教育部重点实验室 农业农村部奶制品加工重点实验室 内蒙古自治区乳品生物技术与工程重点实验室,内蒙古 呼和浩特 010018
收稿日期:2020-12-01;接收日期:2021-03-25
基金项目:内蒙古自治区科技重大专项(No. ZDZX2018018) 资助
作者简介:孙志宏??博士、内蒙古农业大学乳品生物技术与工程教育部重点实验室研究员、博士研究生导师,国家优青。主要从事乳酸菌生物多样性、基因组学和肠道微生物等方面的基础研究,主持承担国家自然科学基金项目、863计划、内蒙古自治区自然科学基金项目,入选内蒙古自治区“草原英才”工程、内蒙古自治区“321人才工程”。发表学术论文128篇,其中以第一作者和通讯作者发表学术论文55篇;授权发明专利19项,参编学术专著2部,参与起草质量安全地方标准5项。获教育部技术发明一等奖、内蒙古自治区科学技术进步一等奖、教育部科学技术进步二等奖、内蒙古自治区自然科学二等奖等科技奖励,荣获内蒙古青年创新人才奖、内蒙古优秀科技工作者称号.
摘要:肠道微生物对神经系统疾病(如帕金森病、抑郁症和阿尔兹海默症等) 的治疗具有辅助治疗的作用。其主要通过神经通路、免疫通路以及微生物代谢物等途径在肠-脑轴的作用下影响大脑功能和宿主行为。因此,文中结合国内外的研究进展,就微生物-肠-脑轴在神经系统疾病中的主要作用进行探讨,以期为神经退行性疾病的治疗提供新思路。
关键词:肠-脑轴神经系统疾病肠道微生物粪菌移植益生菌/益生元疗法
Microbe-gut-brain axis and neurological disorders: a review
Xin Shen, Zhihong Sun


Inner Mongolia Key Laboratory of Dairy Biotechnology and Engineering, Key Laboratory of Dairy Products Processing, Ministry of Agriculture and Rural Affairs, Key Laboratory of Dairy Biotechnology and Engineering, Ministry of Education, Inner Mongolia Agricultural University, Hohhot 010018, Inner Mongolia, China
Received: December 1, 2020; Accepted: March 25, 2021
Supported by: Major Science and Technology Project of Inner Mongolia Autonomous Region, China (No. ZDZX2018018)
Corresponding author: Zhihong Sun. Tel: +86-471-4308703; E-mail: sunzhihong78@163.com.
Abstract: Intestinal microbes have an adjuvant therapeutic effect on neurological disorders (such as Parkinson's, depression, and Alzheimer's disease). It affects brain function and host behavior through the neural pathways, the immune pathways and the microbial metabolites, the so-called gut-brain axis. This article summarizes the recent advances in the role of the microbe-gut-brain axis in neurological disorders, in order to provide new ideas for the treatment of neurodegenerative diseases.
Keywords: gut-brain axisneurological disordersintestinal microbesfecal bacteria transplantationprobiotic/prebiotic therapy
肠道微生物群是动态而复杂的,其定居在人类的肠道中,形成一个包含集体基因组(如细菌、古菌、真菌以及病毒等) 的蓄水池。婴儿刚出生的时候,就从母亲的阴道、皮肤及周围的环境中获得了早期的肠道菌群。每个人的肠道菌群都具有稳定性和独特性,被认为是个人微生物指纹或肠道类型[1]。研究发现,肠道菌群具有重要的生理功能,可直接影响宿主的代谢、肠道黏膜屏障和大脑发育以及局部和全身的免疫功能。一般情况下,肠道中的有益菌和有害菌会处于一个相互制约的平衡状态,当这种平衡被打破时,各种疾病也会随之而来,如代谢综合征、肥胖、肠道相关炎症疾病和神经退行性疾病等[2]。这一非人类基因组的协同进化引起宿主与肠道菌群之间双向关系的建立,特别是胃肠道、肠神经系统以及中枢神经系统之间的双向沟通,这个将胃肠道功能和中枢神经系统连接在一起复杂而精细的系统,称为肠-脑轴[3]。在这个通路中,肠道微生物群具有重要的作用,能调节营养物质的代谢和合成分泌神经递质。现在,肠道微生物已经成为神经退行性疾病等各种慢性疾病生物治疗的研究热点。益生菌疗法主要是通过平衡菌群以及促进有利代谢的方法,创造健康的肠道环境。基于现代医学的发展,近年来已有大量的研究开始揭示微生物-肠-脑轴的作用机制,然而,目前大多数研究都集中关注肠道菌群与各类神经系统疾病之间的相关性,对二者间因果关系探讨甚少。鉴于以上所述,本综述的目的是结合最新的研究进展,探讨微生物-肠-脑轴在神经系统疾病中的主要作用,并展望了未来相关研究的方向。
1 微生物-肠-脑轴人体早期免疫系统的成熟和发展都与肠道微生物群相关,微生物-肠-脑轴的失调会引起代谢性疾病、精神疾病以及神经退行性疾病等。目前,****们提出了微生物-肠-脑轴这一新的理念来解释肠道微生物和宿主之间复杂的关系[4]。有趣的是,肠道菌群广泛参与各种激素、活性代谢产物和神经递质等活性化合物的合成和释放,进而影响大脑功能和宿主行为。由此可见,肠道菌群与宿主的健康具有一定的关系。目前,研究认为肠道微生物主要通过神经通路[5]、免疫通路[6]以及微生物代谢物[7]等途径直接或者间接地对肠-脑轴进行调控(图 1)。
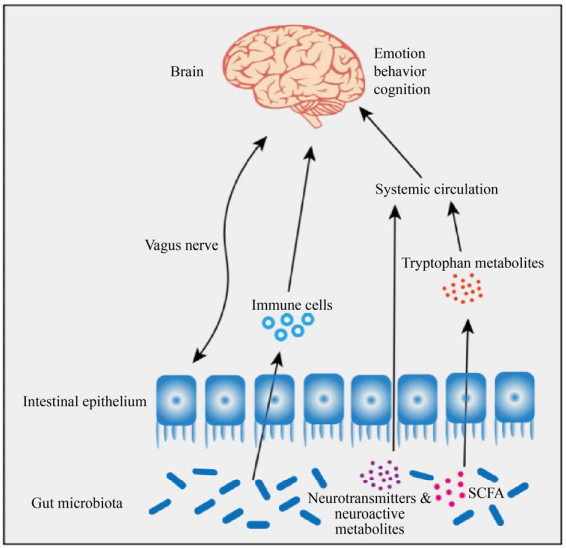 |
| 图 1 微生物-肠-脑轴机理图 Fig. 1 Schematic diagram of the microbe-gut-brain axis. |
| 图选项 |
1.1 神经通路神经通路是神经系统内传导某一特定信息的通路,其对肠-脑轴的调控主要是依靠迷走神经。人体消化道中存在大量的迷走神经,能够感知微生物群的变化,将肠道的信息传递整合到中枢神经系统,从而产生了适应性/不适应性等反应,其中不适应的反应主要体现为消化道病理和神经退行性疾病[8]。Bravo等在小鼠临床试验中发现,鼠李糖乳杆菌可降低小鼠体内皮质酮水平以及应激产生的焦虑和抑郁。然而,在切断迷走神经的小鼠身上并没有发现行为效应,且其食用鼠李糖乳杆菌后也不表现出抗抑郁和抗焦虑的现象[9]。基于迷走神经与大脑之间的关系与临床结果,迷走神经刺激(Vagus nerve stimulation,VNS) 这种神经调节的治疗方式已在1997年和2005年被美国食品药品监督管理局(Food and Drug Administration,FDA) 批准用于辅助治疗难治性癫痫和难治性抑郁[10]。
1.2 免疫通路肠道微生物群也可通过调节宿主的免疫系统进而影响神经系统疾病。小胶质细胞是神经中枢系统内固有的免疫效应细胞,受到外界刺激后会引起神经炎症,对肠道菌群进行干预能够影响小胶质细胞的成熟和功能,有效抑制神经炎症的发生。Erny等发现,由于无菌(Germ-free,GF) 小鼠在小胶质细胞中表现出一定缺陷,细胞比例改变、表型不成熟,导致先天免疫反应受损,而暂时消灭微生物群会严重改变小胶质细胞的特性。相反,具有复杂微生物区系的再殖化可以部分恢复小胶质细胞的生理特征,且研究发现短链脂肪酸、微生物发酵产物能够调节小胶质细胞的稳态[11]。由此可见,小胶质细胞能够通过肠道微生物群在一定程度上得到纠正,对改善神经退行性疾病和神经疾病的病理具有积极意义。
1.3 微生物代谢物肠道微生物对宿主生理和行为的调控具有重要作用,在这个过程中,肠道菌群的代谢物是其中一种重要途径。短链脂肪酸(Short-chain fatty acids,SCFA)、色氨酸(Tryptophan,Trp)、5-羟色胺(5-hydroxytryptamine,5-HT)、褪黑素以及肽类等肠道菌群代谢物可通过体液循环和神经等途径作用于大脑,从而对宿主的行为进行调控。目前对于肠道菌群代谢的研究主要是SCFA,其可与G蛋白偶联受体或组蛋白去乙酰化酶互作[12-13],并经体液、免疫等途径作用于大脑,此外,SCFA还可影响炎症和激素调节,并与迷走神经相互作用从而对宿主产生影响。
Trp是一种重要的氨基酸,与5-HT和犬尿氨酸(Kynurenine,Kyn) 等关键化合物的合成有关,而芳香烃(Aromatic hydrocarbon,AhR) 受体是Trp代谢产物到大脑信号的关键[14],这些被Trp代谢物激活的AhR充当化学信使,介导肠道微生物与中枢神经系统(Central nervous system,CNS) 之间的双向关系,并可以通过免疫、代谢和迷走神经交流等途径调节宿主体内稳态[15]。
5-HT是一种由肠嗜铬细胞分泌的抑制性神经递质,在神经发育和突触形成过程中有重要作用[16]。外周的5-HT不能穿过血脑屏障,其主要是通过激发特定的5-HT受体参与多种人体生理功能。即5-HT是一种重要的胃肠道信号分子,其将信号从肠道传递到内在或外在神经元,从而影响肠道蠕动、分泌反射和吸收营养等[17]。
此外,一些肽类也可作为信号传递的媒介,如多肽YY激素(Peptide YY,PYY) 是一种饱腹症的信号,其对大脑皮质区和高皮质区以及稳态脑区的神经活动都有调节作用[18]。而PYY和胰多肽能够向大脑发出信号,以减少进食、焦虑和抑郁等行为[19]。因此,这些微生物代谢产物对于肠-脑轴的调控具有重要作用。
2 微生物-肠-脑轴与神经性疾病2.1 微生物-肠-脑轴与帕金森病帕金森病(Parkinson’s disease,PD) 又称震颤麻痹,是一种常见的中老年人神经系统变性疾病。其特征包括运动症状和非运动症状。运动症状包括震颤、运动迟缓和僵硬,但随着时间的推移,也有一些非运动症状发生并影响PD患者的生活质量。胃肠道功能障碍在PD患者中普遍存在,并且是在运动症状之前出现的初始症状[20]。研究认为,肠道菌群在α-突触核蛋白(α-Synuclein,αSyn) 的聚集和神经炎症中起着关键的功能作用[21]。
近年来,研究认为遗传因素、衰老、氧化应激以及环境因素均能够对神经元变性死亡产生影响。而神经炎症被认为是PD发病机制的因素之一,肠道微生物的失调会引起肠上皮细胞损伤,激活Toll样受体4 (TLR4)/肿瘤坏死因子(TNF-α)信号通路,TNF-α和一些促炎因子能够穿过血脑屏障从而引起神经炎症。研究人员通过粪菌移植(Fecal microbiota transplantation,FMT) 技术将正常小鼠的肠道菌群移植给PD小鼠发现,PD小鼠体内SCFA含量以及肠道和大脑中TLR4/TNF-α信号通路表达降低,PD小鼠症状改善。因此,肠道菌群可通过微生物-肠-脑轴抑制TLR4/TNF-α信号通路表达发挥神经保护作用[22]。目前,大量研究证明肠道微生物的失调与帕金森患者的临床症状相关。Cirstea等将PD患者和健康人的粪便和血清分别进行测序和代谢组分析发现,PD患者粪便菌群组成的变化与血清蛋白水解产物的增加与患者的粪便硬度及便秘有关[23]。Heinzel等发现帕金森的前驱标志物与肠道微生物组成有关[24]。而且肠道微生物组成的改变会导致临床症状的改变。因此调节肠道菌群,改善肠道菌群-肠-脑轴的功能,可能对帕金森的预防和治疗具有重要作用。
2.2 微生物-肠-脑轴与抑郁症抑郁症是一种常见的精神障碍,是神经科自杀率最高的疾病。全球的抑郁症的发病率居高不下,使抑郁症逐渐成为给全球人类带来巨大负担的疾病。但是现在医学上对于抑郁症的发病原因及其机制等方面的了解并不完全,常见的原因是心理和环境等常见的因素,传统治疗抑郁症的主要方法是药物以及心理治疗[25]。近年来,研究人员将注意力逐渐转移到肠道微生物群,其可与大脑进行复杂的双向交流。
目前越来越多的试验也都围绕肠道菌群与精神障碍的关系进行。Kelly等通过对抑郁症患者和健康人的肠道菌群组成进行研究发现,抑郁症患者肠道菌群的丰富度和多样性显著降低,将抑郁症患者的粪便移植给无菌小鼠,小鼠出现狂躁症和焦虑症等与抑郁症相关的行为改变,且色氨酸代谢等生理特征也出现改变[26],说明肠道菌群与抑郁症具有一定的相关性。Yu等采用16S rRNA基因测序技术结合代谢组学方法对慢性可变应激(Chronic variable stress,CVS) 大鼠抑郁模型进行研究发现,抑郁症能够改变肠道菌群并影响宿主的代谢表型[27]。而在人类临床方面,Lai等通过对抑郁症患者和健康人的粪便样品进行鸟枪法基因组测序发现,肠道微生物群可能参与了抑郁症的发病机制,且肠道菌群的改变可能是区分抑郁症患者和健康人的生物标志物[28]。Valles-Colomer等发现抑郁症的患者的肠道微生物组中缺少粪球菌属Coprococcu和小杆菌属Dialister两种微生物[29],且其发现56种能够对肠道微生物产生或分解影响神经系统功能的可疑生化代谢物。大脑脂质在神经元功能中有着重要作用,中枢神经系统包含磷脂、鞘脂和胆固醇等脂质,其中鞘脂与神经元的发育有关,磷脂是神经元膜和髓鞘形成的重要物质。Zheng等对食蟹猴抑郁模型的肠道菌群和肠脑轴代谢特征进行分析发现,患抑郁症的猴子的甘油磷脂出现紊乱,肠道微生物与富含鞘脂和甘油磷脂代谢的富集通路显著相关,因此肠道微生物可能通过微生物-肠-脑轴调节外周和中枢甘油磷脂代谢参与抑郁症的发生[30]。由此可见,明确肠道菌群和神经之间的关系可能会产生新的治疗抑郁症等精神类疾病的新方法。
2.3 微生物-肠-脑轴与阿尔兹海默症阿尔兹海默症(Alzheimer’s disease,AD) 是一种以记忆力丧失、无法进行正常日常生活和行为产生障碍的中枢神经退行性疾病,是老年人最为常见的痴呆形式[31]。AD的病理特征主要有两个,一是β-淀粉样蛋白(Amyloid β-protein,Aβ) 沉淀形成的老年斑,二是由过度磷酸化的Tau蛋白组成的神经原纤维缠结(Neurofibrillary tangles,NFT)[32]。一般认为是环境和遗传等因素参与了致病,但AD的根本原因还不清楚。有研究显示,肠道菌群能够产生淀粉样蛋白、脂多糖和其他免疫原性化合物,促进神经炎症和大脑Aβ沉积,进而导致AD的发生[33]。因此,对肠道微生物和炎症细胞的分子机制进行研究有助于深入了解阿尔兹海默症的发病机理,对AD新的治疗方式和预防策略的提出有重要意义。
Kim等[32]将健康小鼠的粪便移植给AD小鼠发现,AD小鼠的脑部β淀粉样蛋白斑块沉淀、Tau蛋白病理学、神经胶质反应和认知障碍等均有所改善,且肠道菌群可影响肠道巨噬细胞活性和血液炎性单核细胞相关基因的表达,炎症单核细胞可直接对大脑产生信号分子影响AD发病。由此可见,肠道微生物群是AD发病机制中的关键因素[34],肠道微生物对外周系统的调节可能为治疗AD提供新的治疗靶点。
2.4 微生物-肠-脑轴与自闭症自闭症(Autism spectrum disorder,ASD) 是广泛性发育障碍的代表性疾病,在每个阶段会出现不同程度的人际交往、兴趣狭窄以及行为方式刻板。但是自闭症的病因现在还不清楚,目前自闭症的发病因素主要是遗传、感染和免疫调节异常以及孕期理化因子的刺激。其中最重要的是遗传因素,已经有研究指出通过变异筛选和SNP分析已鉴定出几种ASD的候选基因和大量的遗传突变引起ASD的易感性[34]。但是对于自闭症的病因还需要继续探索,且目前由于缺少生物标志物,对于自闭症的判断仅仅是行为观察。
自闭症患者还会出现一系列并发症,会对睡眠状况、进食状况和代谢状况均产生一定的影响,其中便秘和腹泻在自闭症的并发症中最为常见,现在已经有研究证明肠道菌群通过调节免疫系统、中枢神经系统以及细菌代谢产物进而影响自闭症的发生和发展。Pulikkan等通过对印度自闭症患者的粪便微生物群进行分析,发现ASD儿童的肠道微生物组中相对丰富度较高的细菌科是乳杆菌科(Lactobacillaceae)、双歧杆菌科(Bifidobacteraceae) 和韦荣球菌科(Veillonellaceae),并且ASD患者肠道菌群中乳杆菌属的含量显著高于健康人[35]。研究表明,肠道菌群失调能够增加肠黏膜的通透性,肠道微生物的代谢产物和某些细胞因子进入循环系统,损伤中枢神经系统,导致患者早期神经发育迟缓[36]。研究者使用16S rRNA测序对ASD患者与健康儿童的肠道微生物群进行评估发现,ASD患者的菌群发育处于相对停滞的状态,且ASD患者肠道菌群的多样性降低[37]。然而特定细菌相对丰度较高是自闭症的原因还是结果的问题仍需进一步的研究。最近一项研究显示,口服鼠李糖乳杆菌(JB-1) 能够促进γ-氨基丁酸(GABA)、N-乙酰天冬氨酸和谷氨酸等脑功能代谢产物的增加,进一步证明了微生物可以通过代谢途径影响大脑的活动[38]。Sharon等通过将ASD患者和正常人的肠道菌群移植给无菌小鼠发现,移植ASD患者的小鼠子代出现自闭症行为,5-氨基戊酸和牛磺酸在ASD子代小鼠中含量降低,而牛磺酸可延迟神经元从兴奋到抑制的发育转换,通过给ASD母鼠口服缺乏的具有神经活性的菌群代谢物5-氨基戊酸或牛磺酸,可改善子代小鼠行为异常,调节大脑神经元兴奋性。由此可见,肠道菌群可通过产生神经活性代谢物调节大脑中的兴奋-抑制平衡进而影响ASD行为[39]。
3 FMT和益生菌/益生元疗法肠道菌群现在已经成为细菌或细胞生物疗法的目标,包括代谢综合征和神经退行性疾病。针对这个治疗靶点提出了多种治疗方案,其中最热点的研究是粪菌移植和益生菌或益生元辅助治疗。FMT是为了恢复受损的肠道菌群而将粪便从健康的供体转移到接收者的肠道的过程[40]。FMT现在被认为是恢复肠道微生物,阻止临床疾病进展的有效方法,已有研究证明FMT能够治疗自闭症、帕金森病等中枢神经系统疾病。Kang等通过对患有自闭谱系障碍的儿童接受2周抗生素治疗后进行粪菌移植,结果发现患者的胃肠道症状得到明显改善且自闭症谱系障碍的行为症状也得到明显改善[41]。除了FMT外,由于帕金森病和阿兹海默症等神经系统的疾病会发生胃肠道合并症,而益生元和益生菌可以创造健康的肠道环境并通过平衡细菌种群促进其繁殖和代谢作用,因此,大量的试验也集中于研究益生菌对于神经系统疾病的辅助治疗方面[42]。目前,临床试验已经证实了益生菌、益生元可以调节肠道菌群的组成,改善啮齿动物的自闭症等神经系统疾病。
4 总结与展望综上所述,肠道微生物群通过改变其组成和多样性及其代谢产物沿着肠-脑轴间的双向通路调节大脑发育从而改变宿主的行为,影响疾病的发生和发展。因此,肠-脑轴这一概念的提出是从一个全新的方面对神经系统的疾病进行解释,有助于找到病因,为改善和治疗这些疾病提供了新的方案。目前研究者的主要方向都集中于关注肠道菌群与各类神经系统疾病之间的相关性,对二者间因果关系探讨甚少,且无法对药物、饮食等方面进行控制,而神经系统疾病的病因极其复杂,不同年龄人群以及不同的疾病程度均有所差异。虽然已有FMT和益生菌等新方法的提出,但FMT对无菌操作的要求较高,而益生菌菌株的特异性、剂量以及干预时间等均存在问题。因此,未来可采用多组学手段深入探究肠道菌群与神经系统疾病之间的关系,同时开展大规模益生菌治疗/辅助治疗神经系统疾病的临床研究,以期筛选出能够改善神经系统疾病的优良菌株。
参考文献
| [1] | Costea PI, Hildebrand F, Manimozhiyan A, et al. Enterotypes in the landscape of gut microbial community composition. Nat Microbiol, 2018, 3(1): 8-16. DOI:10.1038/s41564-017-0072-8 |
| [2] | Jackson MA, Serena V, Maxan ME, et al. Gut microbiota associations with common diseases and prescription medications in a population-based cohort. Nat Commun, 2018, 9(1): 2655-2663. DOI:10.1038/s41467-018-05184-7 |
| [3] | Bennett G, Talley NJ. Irritable bowel syndrome in the elderly. Best Pract Res Clin Gastroenterol, 2012, 16(8): 63-76. |
| [4] | Labus JS, OsadchiyV, Hsiao EY, et al. Evidence for an association of gut microbial Clostridia with brain functional connectivity and gastrointestinal sensorimotor function in patients with irritable bowel syndrome, based on tripartite network analysis. Microbiome, 2019, 7(1): 45-60. DOI:10.1186/s40168-019-0656-z |
| [5] | Jameson KG, Olson CA, Kazmi SA, et al. Toward understanding microbiome-neuronal signaling. Mol Cell, 2020, 78(4): 577-583. DOI:10.1016/j.molcel.2020.03.006 |
| [6] | Jacobson A, Yang D, Vella M, et al. The intestinal neuro-immune axis: crosstalk between neurons, immune cells, and microbes. Mucosal Immunol, 2021. DOI:10.1038/s41385-020-00368-1 |
| [7] | Hulme H, Meikle LM, Strittmatter N, et al. Microbiome-derived carnitine mimics as previously unknown mediators of gut-brain axis communication. Sci Adv, 2020, 6(11): eaax6328. DOI:10.1126/sciadv.aax6328 |
| [8] | Eisenstein M. Microbiome: bacterial broadband. Nature, 2016, 533(7603): S104-S106. DOI:10.1038/533S104a |
| [9] | Bravo JA, Forsythe P, Chew MV, et al. Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve. Proc Natl Acad Sci USA, 2011, 108(38): 16050-16055. DOI:10.1073/pnas.1102999108 |
| [10] | Dugan, Patricia, Devinsky, et al. Guidelines on vagus nerve stimulation for epilepsy. Na Rev Neurol, 2013, 9(11): 611-612. DOI:10.1038/nrneurol.2013.211 |
| [11] | Erny D, de Angelis ALH, Jaitin D, et al. Host microbiota constantly control maturation and function of microglia in the CNS. Nat Neurosci, 2015, 18(7): 965-977. DOI:10.1038/nn.4030 |
| [12] | Yang L, Lin H, Lin W, et al. Exercise ameliorates insulin resistance of type 2 diabetes through motivating short-chain fatty acid-mediated skeletal muscle cell autophagy. Biology, 2020, 9(8): 203. DOI:10.3390/biology9080203 |
| [13] | Ren Y, Su SP, Liu XY, et al. Microbiota-derived short-chain fatty acids promote BMP signaling by inhibiting histone deacetylation and contribute to dentinogenic differentiation in murine incisor regeneration. Stem Cells Dev, 2020, 29(18): 1201-1214. DOI:10.1089/scd.2020.0057 |
| [14] | Sun MG, Ma N, He T, et al. Tryptophan (Trp) modulates gut homeostasis via aryl hydrocarbon receptor (AhR). Crit Rev Food Sci Nutrit, 2020, 60(10): 1760-1768. DOI:10.1080/10408398.2019.1598334 |
| [15] | Ma N, He T, Johnston LJ, et al. Host-microbiome interactions: the aryl hydrocarbon receptor as a critical node in tryptophan metabolites to brain signaling. Gut Microbes, 2020, 11(5): 1203-1219. DOI:10.1080/19490976.2020.1758008 |
| [16] | Kwon YH, Wang HQ, Denou E, et al. Modulation of gut microbiota composition by serotonin signaling influences intestinal immune response and susceptibility to colitis. Cell Mol Gastroenterol Hepatol, 2019, 7(4): 709-728. DOI:10.1016/j.jcmgh.2019.01.004 |
| [17] | Yano J, Yu K, Donaldson G, et al. Indigenous bacteria from the gut microbiota regulate host serotonin biosynthesis. Cell, 2015, 161(2): 264-276. DOI:10.1016/j.cell.2015.02.047 |
| [18] | Batterham RL, Ffytche DH, Rosenthal JM, et al. PYY modulation of cortical and hypothalamic brain areas predicts feeding behaviour in humans. Nature, 2007, 450(7166): 106-109. DOI:10.1038/nature06212 |
| [19] | Holzer P, Reichmann F, Farzi A. Neuropeptide Y, peptide YY and pancreatic polypeptide in the gut-brain axis. Neuropeptides, 2012, 46(6): 261-274. DOI:10.1016/j.npep.2012.08.005 |
| [20] | Sung HY, Park JW, Kim JS. The frequency and severity of gastrointestinal symptoms in patients with early Parkinson's disease. J Mov Disord, 2014, 7(1): 7-12. DOI:10.14802/jmd.14002 |
| [21] | Sampson T, Debelius J, Thron T, et al. Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson's disease. Cell, 2016, 167(6): 1469-1480. DOI:10.1016/j.cell.2016.11.018 |
| [22] | Sun MF, Zhu YL, Zhou ZL, et al. Neuroprotective effects of fecal microbiota transplantation on MPTP-induced Parkinson's disease mice: gut microbiota, glial reaction and TLR4/TNF-α signaling pathway. Brain Behavior Imm, 2018, 70: 48-60. DOI:10.1016/j.bbi.2018.02.005 |
| [23] | Cirstea MS, Yu AC, Golz E, et al. Microbiota composition and metabolism are associated with gut function in Parkinson's disease. Mov Disord, 2020, 35(7): 1208-1217. DOI:10.1002/mds.28052 |
| [24] | Heinzel S, Aho VTE, Suenkel U, et al. Gut microbiome signatures of risk and prodromal markers of Parkinson's disease. Ann Neurol, 2020, 88(2): 320-331. DOI:10.1002/ana.25788 |
| [25] | Kim J, Suh YH, Chang KA. Interleukin-17 induced by cumulative mild stress promoted depression-like behaviors in young adult mice. Mol Brain, 2021, 14(1): 11-24. DOI:10.1186/s13041-020-00726-x |
| [26] | Kelly JR, Borre Y, O'Brien C, et al. Transferring the blues: depression-associated gut microbiota induces neurobehavioural changes in the rat. J Psychiatr Res, 2016, 82: 109-118. DOI:10.1016/j.jpsychires.2016.07.019 |
| [27] | Yu M, Jia HM, Zhou C, et al. Variations in gut microbiota and fecal metabolic phenotype associated with depression by 16S rRNA gene sequencing and LC/MS-based metabolomics. J Pharmaceut Biomed Anal, 2017, 138(10): 231-239. |
| [28] | Lai WT, Deng WF, Xu SX, et al. Shotgun metagenomics reveals both taxonomic and tryptophan pathway differences of gut microbiota in major depressive disorder patients. Psychol Med, 2019, 5: 1-12. |
| [29] | Valles-Colomer M, Falony G, Darzi Y, et al. The neuroactive potential of the human gut microbiota in quality of life and depression. Nat Microbiol, 2019, 4(4): 623-632. DOI:10.1038/s41564-018-0337-x |
| [30] | Zheng P, Wu J, Zhang HP, et al. The gut microbiome modulates gut-brain axis glycerophospholipid metabolism in a region-specific manner in a nonhuman primate model of depression. Mol Psych, 2021, 26(6): 2380-2392. DOI:10.1038/s41380-020-0744-2 |
| [31] | Alzheimer's Association. Alzheimer's disease facts and figures. Alzheimer's Dement, 2017, 13(4): 325-373. DOI:10.1016/j.jalz.2017.02.001 |
| [32] | Kim MS, Kim Y, Choi H, et al. Transfer of a healthy microbiota reduces amyloid and Tau pathology in an Alzheimer's disease animal model. Gut, 2020, 69(2): 283-294. DOI:10.1136/gutjnl-2018-317431 |
| [33] | Hao Y, Dua P, Lukiw WJ. Microbial sources of amyloid and relevance to amyloidogenesis and Alzheimer's disease (AD). J Alzheimers Dis Parkinsonism, 2015, 5(1): 177. |
| [34] | Kraneveld AD, Szklany K, De Theije CGM, et al. Gut-to-brain axis in autism spectrum disorders: central role for the microbiome. Int Rev Neurobiol, 2016, 131: 263-287. |
| [35] | Pulikkan J, Maji A, Dhakan DB, et al. Gut microbial dysbiosis in indian children with autism spectrum disorders. Microb Ecol, 2018, 76(4): 1102-1114. DOI:10.1007/s00248-018-1176-2 |
| [36] | 袁莉娟, 刘爱民, 李艺, 等. 微生态制剂的应用研究进展. 临床合理用药杂志, 2018, 11(15): 178-181. Yuan LJ, Liu AM, Li Y, et al. Application and research progress of microecologics. Chinese Journal of Clinical Rational Drug Use, 2018, 11(15): 178-181 (in Chinese). |
| [37] | Dan Z, Mao XH, Liu QS, et al. Altered gut microbial profile is associated with abnormal metabolism activity of autism spectrum disorder. Gut Microbes, 2020, 11(5): 1246-1267. DOI:10.1080/19490976.2020.1747329 |
| [38] | Janik R, Thomason LAM, Stanisz AM, et al. Magnetic resonance spectroscopy reveals oral Lactobacillus promotion of increases in brain GABA, N-acetyl aspartate and glutamate. Neuroimage, 2016, 125: 988-995. DOI:10.1016/j.neuroimage.2015.11.018 |
| [39] | Sharon G, Cruz NJ, Kang DW, et al. Human gut microbiota from autism spectrum disorder promote behavioral symptoms in mice. Cell, 2019, 177(6): 1600-1618. DOI:10.1016/j.cell.2019.05.004 |
| [40] | Le Bastard Q, Ward T, Sidiropoulos D, et al. Fecal microbiota transplantation reverses antibiotic and chemotherapy-induced gut dysbiosis in mice. Sci Rep, 2018, 8(1): 6219. DOI:10.1038/s41598-018-24342-x |
| [41] | Kang DW, Adams JB, Gregory AC, et al. Microbiota transfer therapy alters gut ecosystem and improves gastrointestinal and autism symptoms: an open-label study. Microbiome, 2017, 5(1): 10. DOI:10.1186/s40168-016-0225-7 |
| [42] | Wang Y, Li N, Yang JJ, et al. Probiotics and fructo-oligosaccharide intervention modulate the microbiota-gut brain axis to improve autism spectrum reducing also the hyper-serotonergic state and the dopamine metabolism disorder. Pharmacol Res, 2020, 157: 104784. DOI:10.1016/j.phrs.2020.104784 |
