

中国农业大学 食品科学与营养工程学院 国家果蔬加工工程技术研究中心, 北京 100083
收稿日期:2021-06-04;接收日期:2021-09-09
作者简介:马晨 ??博士,讲师,中国农业大学食品科学与营养工程学院,国家果蔬加工工程技术研究中心,农业部果蔬加工重点实验室,果蔬加工教育部工程研究中心团队。研究方向:围绕果蔬食品营养与功能开展了果蔬天然产物的绿色高效提取技术与功能成分的分子作用机制研究;基于肠道微生物的果蔬精准营养与人体慢性病干预研究.
摘要:肠道菌群与人体共同协作,菌群在帮助宿主对食物中的营养成分进行深入消化与利用的同时,也一同分享宿主为其提供的生存空间与营养物质,这是微生物与宿主之间形成的一种互利共生的特殊共存方式。这样的精妙结合,不仅使得微生物在人体中形成了固有的菌群结构,得到赖以生存的生物基位,也通过自身的功能代谢以及群体信号,为宿主在免疫、营养等方面提供所必需的调节与支撑。围绕药食同源天然植物的健康作用研究,目前大多着眼于对其功能组分的分离提取与活性评价。如植物多糖、多酚与黄酮等活性功能成分。然而在传统中医药中,植物多以全食态进行复配应用。目前在菌群水平研究中发现,对于影响人体健康水平的菌群模式并非固定且依赖于某一单菌种变化,微生物之间的生态竞争与代谢调控均以群体的方式与宿主持续进行共进化。药食同源天然植物,对菌群的调节作用主要还是依靠其全食态,这也从菌群这个微观生态环境的角度为传统中医学理论中对于中药食材即天然植物全食状态下的药效提供了重要佐证。因此,对于药食同源天然植物的开发与利用,应当结合菌群整体的调控进行分析,并对其全食状态与活性功能组分有充分的认识与评价。
关键词:药食同源益生元肠道菌群天然植物全食
The health benefits of the active ingredients and whole food components of natural plants through regulating the flora
Chen Ma


National Engineering Research Centre for Fruits and Vegetables Processing, College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China
Received: June 4, 2021; Accepted: September 9, 2021
Corresponding author: Chen Ma. E-mail: machen21@sina.com.
Abstract: With the cooperation of bacteria and the human body, the nutrients in food are deeply digested, utilized, and shared. In addition, symbiosis is formed between microorganisms and hosts. Such a delicate combination makes the microorganisms form the inherent flora in the human body. They obtain the biological basis for survival, and provide the necessary regulation and support for the host in terms of immunity and nutrition, through their functional metabolism and population signals. At present, most of the researches focus on the isolation and evaluation of the functional components of plants, such as plant polysaccharides, polyphenols, flavonoids, and other active functional components. However, in traditional Chinese medicine, plants are often used with whole food components. To date, studies have found that the dynamics of flora affecting human health are not fixed, nor dependent on the change of a single strain. The ecological competition and metabolic regulation between microorganisms are usually coevolved with the host. The regulatory effect of natural plants for both medicine and food mainly depends on their whole food components. This provides evidence to support the role of whole food components played in promoting the efficacy of traditional Chinese medicine from the perspective of microenvironment. Therefore, the development and utilization of medicinal and edible natural plant activities should be fully understood and evaluated with flora regulation.
Keywords: medicinal and edibleprebioticsgut microbiomenatural plantswhole food components
人、动物、植物与微生物是地球上主要的生命形式,这些生命形式作为单独的生命体,看似是由单个乃至多细胞集合而成的复杂生物体,似乎对于探究生命活动规律的研究主要着眼于对于承担复杂生理活动的细胞水平乃至分子水平的变化规律。然而对于复杂细胞间的相互构成与交流,共同执行拟合生理活动的进程,则并非只存在于个体分生细胞之间,从生命宏观角度来看,动物体、植物与微生物彼此之间均构成以自然生存为纽带的有机生命活动关系。因此,对于生命科学领域的研究,着眼于生物分子水平与单体之间的结合转导则是两条平行且互为佐证的探究方向。作为单体间的结合与转导,亦可最终剖析为细胞之间的能量与信息的传导。因此,对于关注人体健康与疾病的研究中,也需要协同关联与人类所共生的植物、微生物,如若将人体看作一个枢纽,而寄生其中的微生物与环境、与饮食所摄入的植物和外源微生物,均在这个复杂且庞大的枢纽中不间断地陷进行着不同单体间的细胞交流与互作。而与人体结合更为紧密的,则是自其诞生之初即开始与之共生发育的共生微生物群。人体的共生微生物主要集中于皮肤、口腔、胃肠道和生殖道等腔体与表皮系统。这些共生微生物与人体构成有机的生命共同体,同时也协同对食物以及环境中所接触到的植物细胞进行有序的互作。以饮食为例,食物首先通过口腔微生物与口腔消化腺的粗加工,继而进入胃肠道,在菌群与人体的共同协作下,对食物中的营养成分进行深入消化与利用,一同分享食物所带来的营养物质之外,微生物与宿主之间也形成了一道互利共生的特殊共存方式。这样的精妙结合,不仅使得微生物在人体中形成了固有的菌群结构,得到赖以生存的生物基位,也通过自身的功能代谢以及群体信号,为宿主在免疫、营养等方面提供所必需的调节与支撑。因此,围绕人体共生微生物的研究在生命科学领域持续递增,在众多研究者的竞相挖掘之下,基于目前的科学技术手段与知识的局限性,人类对于自身共生微生物的了解尚停留在表面。即便如此,对于共生微生物重要性的共识以及目前的研究进展,仍旧可以为我们在健康与营养乃至膳食评价中提供新的视角,同时也为传统的营养学与药学尤其是我国中药的药理分析,从共生菌群的角度提供更为科学的解析与效果的评价。
1 基于菌群水平的植物活性成分评价:以植物多糖为例近年来,随着经济与科技的发展,人类对于自身健康状态的关注提高,导向也从治疗逐渐向预防转变,尤其是在日常饮食与保健中对于所摄入的食品及营养物越来越趋于具备个体针对性。因此,具有不同生理功能的“药食同源”天然产物备受关注。我国地域广阔,包括中药材在内的药食两用天然植物种类繁多,目前共有110种药食同源中药。围绕药食同源天然植物健康作用的研究,目前大多着眼于对其功能组分的分离提取与活性评价。如植物的多糖、多酚与黄酮等活性功能成分[1]。天然植物多糖作为主要的生物活性大分子,广泛存在于果蔬、菌类和食源性中草药里,被证明具有免疫调节、抗氧化和抗炎等多种药理作用[2-3]。植物多糖与肠道菌群相关性的研究现状,为植物多糖的开发和在人体相关疾病中的应用提供科学依据。研究表明,植物多糖大多具有益生元特性而有益于肠道健康,在改善和治疗肠道炎症性疾病方面具有显著作用,如黄芪多糖、当归多糖、马齿苋多糖、枸杞多糖、香菇多糖、猴头菌多糖等。肠道菌群参与碳水化合物和胆汁酸等物质的代谢,合成维生素等人体必需营养物质,抑制致病微生物,维持肠道微生态平衡,调节人体免疫系统,在人体健康中发挥着重要的作用[4]。研究发现,肠道菌群在大分子多糖的利用及降解中起到关键作用,弥补宿主所缺乏的消化生理功能。肠道菌群产生的活性酶将多糖降解转化为短链脂肪酸(Short-chain fatty acids,SCFA) 等代谢产物[5]。SCFA具有能修复结肠上皮细胞、参与机体能量代谢和抑制致病菌定殖等作用;乙酸和丁酸在结肠内被吸收,是结肠上皮细胞的主要能量来源,为肌肉提供能源或促进脂肪组织的合成;丙酸可抑制3-羟基-3-甲基戊二酸单酰辅酶A的活性,从而调节机体胆固醇含量;异丁酸为纤维分解菌的生长因子,可促进纤维素的消化[6-7]。肠道菌群可通过参与多糖的代谢,使多糖的活性成分发生变化,从而在多糖治疗疾病的机制方面起到介导作用。
植物多糖对肠道菌群的调节作用,主要定位于改善菌群结构,调节菌群功能代谢,通过与菌群的互作从而发挥其在人体诸如代谢疾病、炎症性疾病、肠屏障功能以及免疫调节等方面的重要生理功能。研究中发现多糖能使肠道内的双歧杆菌Bifidobacterium等有益菌数量保持在较高水平,有效促进肠道内SCFA的产生,增加肠黏膜屏障功能[8]。其机制可能是植物多糖能阻止细菌与肠黏膜上皮细胞结合,抑制条件致病菌定殖,维持肠黏膜的通透性,降低细菌移位风险,从而避免机体发生炎性反应[9-10]。多糖调节肠道微生态失调状态,减少肠黏膜屏障的损伤,预防与治疗肠易激综合征,其可能机制是植物多糖能促进Bifidobacterium与乳杆菌Lactobacillus等肠道有益菌的增殖,抑制有害菌繁殖,维持正常肠道菌群的肠屏障功能。多糖由菌群酵解和利用,产生SCFA、五羟色胺等,对机体产生抗氧化、缓解炎症反应等作用。其中,SCFA可上调紧密连接蛋白和闭合蛋白等的表达,恢复肠黏膜正常通透性,减少内毒素,降低炎性反应,维护机体健康[11]。利用代谢组学研究手段分析铁皮石斛多糖对肠道菌群生长过程中代谢产物的影响,发现铁皮石斛多糖可有效提升肠道中SCFA和支链氨基酸等多糖代谢物的代谢水平,证明铁皮石斛多糖益生元效应的机制与干预肠道菌群代谢水平相关[12]。
高脂饮食是诱发产生胰岛素抵抗的因素之一。脂多糖(Lipopolysaccharide,LPS) 是肠道内革兰氏阴性菌的重要组成部分,肠道内的革兰氏阴性菌死亡后产生的LPS被吸收入循环系统,与固有免疫细胞表面的复合体相结合,分泌大量炎症因子,触发肠道产生慢性炎性反应,从而干预胰岛素受体信号通路,引起胰岛素抵抗[13-14]。实验发现,海带中提取的多糖可能通过改变厚壁菌门(Firmicutes) 与拟杆菌门(Bacteroides) 细菌的比例改善高脂膳食诱导小鼠的胰岛素抵抗;通过提高肠道内阿克曼氏菌细菌的数量改善小鼠的肠道紧密性;通过增加小鼠肠道内Bifidobacterium的数量改善小鼠内毒素血症;通过上调Lactobacillus的丰度改善肠道通透性,抑制了TNF-α等细胞因子对肠道屏障功能的损伤[15]。高血脂异常小鼠肠道中葡萄球菌Staphylococcus具有较高丰度,经岩藻多糖干预后,其数量明显减少;拟普雷沃氏菌属Alloprevotella的丰度与肥胖、糖尿病和代谢综合征呈负相关,而岩藻多糖可以显著升高Alloprevotella的丰度[16]。肠道屏障由肠道微生物屏障和肠道物理屏障、化学屏障、免疫屏障共同构成[17]。肠道菌群与肠黏膜机械屏障和免疫屏障互相协同,调控肠黏膜紧密连接,参与宿主免疫,调节黏膜树突状细胞蛋白量,激活NF-κB信号通路,抑制促炎因子的产生。岩藻多糖对二羟甲基丁酸(Dimethylolbutanoic acid,DMBA) 诱发的乳腺癌大鼠的肠道屏障损伤也具有一定的保护作用,使大鼠肠道紧密连接蛋白Occludin和ZO-1的表达增加,逐渐恢复损伤的肠绒毛形态和结构[18]。此外岩藻多糖能调节肠道辅助性T细胞Th1/Th2的比值,增加IgA的表达,缓解环磷酰胺造成的肠道黏膜损伤,维护肠道屏障的完整性,降低炎症因子的表达,具有增强机体免疫力的作用[19]。
研究发现,人体肠道菌群也存在与年龄相对应的“菌龄”,伴随机体的衰老,菌群也发生结构与功能上的改变,以双歧杆菌为代表的有益菌显著减少,活力降低,同时老年人菌群的数量和多样性明显降低[20]。研究发现羊栖菜多糖可在一定程度上改善衰老小鼠肠道菌群的组成与结构,恢复因衰老引起的有益菌的降低,抑制致病菌的定殖,提高衰老小鼠肠道菌群的丰度和多样性,使衰老小鼠的肠道菌群年轻化,推测羊栖菜多糖调节肠道菌群紊乱和改善肠道菌群结构是其延缓衰老的作用机制之一[21]。植物多糖可通过调节肠道菌群来延缓衰老和改善代谢性疾病的症状,作为一种功能食品的新应用,从肠道菌群的角度,为植物多糖发挥系统治疗作用的机制提供了新的见解。
2 植物全食组分对菌群的调节作用:以生姜为例生姜是姜科植物的鲜嫩茎,属多年生草本植物,具有强烈的芳香气味和药用价值,是在世界范围内广为食用的根茎类香辛调味料及食物。生姜在我国作为中药应用历史悠久,中医认为姜性属味辛,微热,有解表散寒、温中止痛、化痰止咳、助消化、利分泌和解毒之功效。现代药理研究显示,生姜具有促进消化液分泌、保肝利胆、抗氧化、抗衰老、抗肿瘤、抗炎、抑制致病菌、抗辐射和保护心血管等作用[22]。1987年我国卫生部将生姜列为首批公布为药食兼用植物资源之一。生姜富含多种营养物质,已鉴定的活性成分约有400种,研究较多的包括姜辣素、姜烯酚、姜油酮和姜酮酚,其中姜酮酚由姜烯酚经微生物代谢合成。生姜的主要活性成分之一6-姜辣素,可通过改变脂肪酸合成酶(Fatty-acid synthase,FAS)、乙酰辅酶A羧化酶(Acetyl CoA carboxylase,ACC)、β-羟-β-甲基戊二酸单酰辅酶A还原酶(HMG CoA reductase,HMGR)、卵磷脂胆碱酰基转移酶(Lecithin choline acyl transferase,LCAT)和脂蛋白脂肪酶(Lipoprotein lipase,LPL) 等脂质代谢标志性酶的活性和基因表达达到抗肥胖的作用。此外,6-姜辣素还可以抑制淀粉酶和胰脂肪酶的活性,降低血浆和组织中的脂质浓度。生姜的抗肥胖作用还与其抗炎特性密切相关,生姜提取物和6-姜辣素均可显著下调高脂饮食导致的肥胖小鼠脂肪组织中IL-6和TNF-α的基因表达水平。在细胞水平下,6-姜辣素可有效抑制前脂肪细胞分化为脂肪细胞,还可通过下调3T3-L1脂肪细胞中脂肪合成相关的转录因子和合成酶的蛋白表达以降低脂质积累。生姜中另一主要的活性成分6-姜烯酚也可通过降低各种脂质合成相关蛋白的表达抑制3T3-L1前脂肪细胞的分化和脂肪合成[23-24]。生姜在降血脂、降血压,预防心肌梗塞,防治胆囊炎和胆结石、调节前列腺的机能等方面有特殊作用[25]。
2.1 传统中医药中生姜全食组分的健康功效目前对生姜中功能组分如姜辣素等的研究发现其具有调节脂代谢、抗氧化、增强能量代谢、抑菌等功效,而以上病变于衰老机体的生理现象中出现。围绕生姜开展的研究主要针对单一功效组分,缺乏对于生姜全食状态下的健康评价,而生姜在传统中医药及日常饮食中均以全食状态进入人体。借鉴传统中药理论,结合肠道微生态的研究,宿主肠道中菌群种类与功能复杂且呈动态平衡,对于肠道微生态环境中菌群对于生姜全食组分的消化与利用存在特定的对应结构与相互制衡的网络关系。因此,从菌群角度分析,单一功效成分对于肠道微生态的调节无法用以评估全食中复杂组分的集成生物学效应。
生姜的抗衰老作用在我国传统中医理论中均有提及。衰老是伴随生命发生、发展过程中的一种生理活动,表现为结构的退行性变异和机能的衰退,适应性和抵抗力减退。在生理水平,衰老导致骨骼肌流失及骨密度下降,从而导致运动能力不足;神经内分泌反馈的敏感性下降,激素与神经递质分泌不足,导致认知功能障碍。在细胞水平,营养物质的吸收与代谢显著减缓,导致对营养的利用能力下降。分子水平上,参与基因转录与复制的酶类功能易发生障碍,端粒在衰老细胞中显著缩短,因此对端粒长度的衡量也是评价细胞衰老的重要生物学标记。生姜可抑制体内自由基作用于皮肤引起的“锈斑”与脏器中的“体锈”。自由基是生物体新陈代谢过程中产生的一类具有氧化活性负电的离子,化学性质相当活跃,可以和细胞膜的多不饱和脂肪酸细胞内的蛋白质以及核酸等生物大分子发生反应,对细胞造成不可逆的损伤,最终导致细胞发生衰老和死亡。人体内自由基的产生和清除的动态平衡与人体的生理、病理、生长发育、疾病和衰老密切相关。生姜可抑制自由基产生,具有抗脂褐素的生物作用。此外,生姜可以加速血液流动,促使排汗,带走体内多余的热量,具有排毒、养颜、减脂的作用[26]。然而部分人群在生姜食用过多后,产生口干、喉痛、便秘等“上火”症状,因此,推测生姜对不同人群经肠道消化后生理反应的差异与其个体肠道菌群差异有关,而对于生姜与宿主肠道菌群的互作研究还未有明确深入的解析。
2.2 生姜对肠道菌群的调节作用生姜主要通过饮食摄入发挥其健康功效,因此生姜对肠道中菌群的调节作用,是探究其生理功能的主要靶点。生姜在中医药中有抗衰老的应用体现,而基于现代菌群水平研究发现,衰老宿主肠道微生物的多样性降低,以Bifidobacterium为代表的有益菌减少为主要特点。研究表明,肠道中Bifidobacterium通过激活腺苷酸激活蛋白激酶(Adenosine 5′-monophasphate (AMP)-activated protein kinase,AMPK) 信号通路、阻止端粒缩短、降低脂质过氧化和增强身体耐力来减缓因能量代谢减少导致的行动不便、血浆氧化、免疫系统损伤等衰老迹象[27]。γ-氨基丁酸(Gamma-aminobutyric acid,GABA) 是人体中枢神经系统中一种主要的抑制性神经递质。研究表明,当肠道微生物菌群中Bifidobacterium数量减少时,中枢神经系统中的GABA水平降低。淀粉样蛋白是由错误折叠形成的不溶性蛋白质的聚集体,如芽孢杆菌Bacillus、金黄色葡萄球菌Staphylococcus aureus、链霉菌Streptomyces和大肠杆菌Escherichia coli,都能分泌淀粉样蛋白诱导氧化应激反应,进一步激活小胶质细胞,释放TNF-α、IL-1、IL-6等炎症因子,随着老化过程,肠上皮层通透性增加,这些产物可通过血脑屏障进一步诱发阿尔茨海默病[28]。而生姜对Bacillus、S. aureus和E. coli等均有良好的抑菌作用。生姜提取物可提高肠道黏膜与小肠组织中SIgA与IL-2的水平,预防衰老导致的免疫系统退化。同时,生姜能促进脾细胞抗体的生成、增加小鼠腹腔巨噬细胞的吞噬活性与NK细胞的杀伤活性等,明显改善机体免疫功能低下的状态[29]。
研究表明,宿主在较高Bifidobacterium比例的菌群平衡态下,菌群所产生的一些代谢物对健康有益,特别是对宿主的新陈代谢有益。例如其中一种代谢物5-羟脯氨酸,也称为焦谷氨酸。5-羟脯氨酸是由多种肽经酶水解产生。促甲状腺素释放激素(Thyrotropin releasing hormone,TRH) 又称普罗瑞林,是一种由5-羟脯氨酸、组氨酸和脯氨酸组成的三肽,用于治疗脊髓小脑共济失调。在因衰老导致的相关记忆衰退的受试者中,5-羟脯氨酸可改善某些言语记忆功能。5-羟脯氨酸也被发现是许多神经肽和激素的N末端修饰,其中也包括阿尔茨海默病和家族性痴呆症中积累的肽。因此,5-羟脯氨酸具有抗衰老作用[7]。另一种重要的肠道代谢物是抗坏血酸,它是维生素C生物合成的前体。维生素C是一种存在于皮肤水平的天然抗氧化剂,具有一定的抗氧化、抗炎、光保护特性,是已知的胶原合成的生物刺激剂[30]。因此,抗坏血酸具有促进新陈代谢和皮肤健康的潜力。琥珀酸具有抗氧化特性,有助于治疗皮肤老化和显著恢复由细胞衰老和全身老化导致的功能丧失状况。苯甲酸能减少氯化物和增加骨骼中的镁,增加骨骼重量,增加骨骼中的钙和磷的滞留。此外苯甲醛对宿主来说还具有抗肿瘤和抗病毒的特性[31]。因此,调节肠道菌群并促进其功能代谢物的产生,对机体抗衰老以及提高机体健康态具有不可忽视的作用。
2.3 生姜促进肠道中Bifidobacterium生长Bifidobacterium作为人体肠道中重要的共生有益菌,对人体免疫疾病、炎症性疾病、神经系统疾病、退行性病变等均有积极作用[32-33]。而在肠道菌群研究中多发现,由于衰老,人体肠道中Bifidobacterium的比例显著下降,因此,有效提升肠道中Bifidobacterium数量是通过菌群抵御衰老的潜在途径。围绕生姜对肠道菌群调节作用的研究中发现,生姜活性物质可显著提升肠道中Bifidobacterium的数量[34],而针对生姜对于双歧杆菌定向增殖的生物学机制并未有进一步研究。影响肠道中Bifidobacterium定殖的主要因素有碳源、胆盐、酸、免疫反应、与其他微生物的竞争以及肠道黏膜清除。功能基因组分析揭示,双歧杆菌能够在人类肠道中定殖依赖于其自身碳水化合物代谢相关的基因丰度,提升其碳源的竞争优势可增强Bifidobacterium成为优势菌的能力。此外,Bifidobacterium定殖还与其菌毛结构有关,菌毛结构是Bifidobacterium粘附于肠道的关键,在宿主的定殖中起着关键作用。
研究表明,Bifidobacterium分泌的多糖物质通过诱导小鼠体内的超氧化物歧化酶、过氧化氢酶和谷胱甘肽巯基转移酶活性,刺激机体IL-6与IL-10的产生,发挥抗氧化和免疫调节的作用[35]。高丰度Bifidobacterium的肠道菌群结构,其代谢物可通过AMPK通路,降低了局部腓肠肌和胫骨中p53基因的表达,p53基因是端粒应激诱导衰老的关键标志物,参与细胞周期阻滞、DNA修复、凋亡和细胞衰老。提升AMPK磷酸化可降低p53基因表达,诱导线粒体相关基因表达上调,进而改善衰老个体的运动功能[36-37]。AMPK是细胞和机体能量平衡中发挥重要作用的蛋白激酶。在高脂肪高碳水化合物饮食诱导的代谢综合征小鼠模型中,生姜提取物通过肠道菌群可增强骨骼肌组织中AMPK磷酸化和总AMPK的表达,显著改善胰岛素敏感性[38]。AMPK激活还可以通过促进葡萄糖转运体GLUT4进入细胞膜增加葡萄糖的摄取,增强机体能量代谢[39-40]。天然药食两用植物在其已研究的活性功能组分之外,其复杂的化学成分是构成全食态下能够通过肠道菌群进而发挥其在免疫调节、营养等生理作用的重要方面,其机理概括如图 1所示,因此,对于植物全食态下的菌群互作也是对新型植物益生元的科学全面评价[41]。
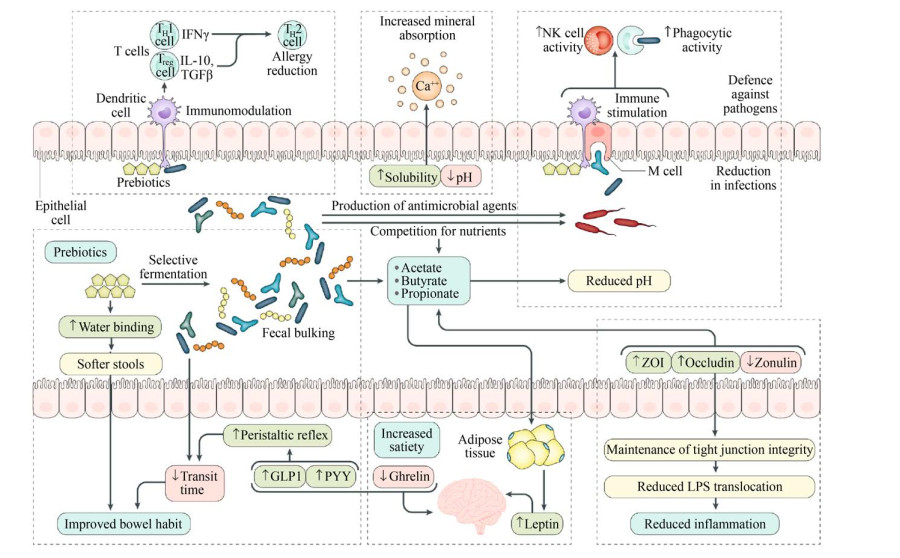 |
| 图 1 天然植物性益生元的作用机理[41] Fig. 1 The mechanisms of natural plant prebiotics[41]. |
| 图选项 |
3 展望目前围绕药食同源天然植物生理功效的研究多集中于对其中活性物质的分离提取与功效验证。然而在传统中医药中,植物多以全食组分进行复配应用。从菌群角度分析,人体肠道菌群结构复杂,包括细菌、真菌在内的微生物共生结合体构成了人体所赖以生存的消化系统。微生物之间的差异导致其对不同植物乃至同种植物中各成分的有效利用与互作呈现出交互式的网状结构。目前的菌群水平研究多发现,对于影响人体健康水平的菌群动态并非为固定且依赖于某一单一菌种变化,微生物之间的生态竞争与代谢调控均以群体的方式与宿主持续进行共进化。因此,从现代菌群研究的角度分析,对于健康有效作用的药食同源天然植物,对菌群的调节作用主要还是依靠全食状态下的复合体,这也从菌群这个集合体的角度为传统中医药中对于中药食材即全食组分下的药效提供了微生态研究的重要佐证。因此对于药食同源天然植物类活性的开发与利用,应当结合菌群的调控,对其全食组分有充分科学的评价,这也为天然植物类益生元调控肠道菌群与宿主代谢的生物活性,及其与有益菌协同执行其健康功效的代谢途径与机制提供新的出发点与挑战性。
参考文献
| [1] | Zhang L, Wang PP, Shi MX, et al. The modulation of Luffa cylindrica (L.) Roem supplementation on gene expression and amino acid profiles in liver for alleviating hepatic steatosis via gut microbiota in high-fat diet-fed mice: insight from hepatic transcriptome analysis. J Nutr Biochem, 2020, 80: 108365. DOI:10.1016/j.jnutbio.2020.108365 |
| [2] | Zhang L, Yue YS, Shi MX, et al. Dietary Luffa cylindrica (L.) Roem promotes branched-chain amino acid catabolism in the circulation system via gut microbiota in diet-induced obese mice. Food Chem, 2020, 320: 126648. DOI:10.1016/j.foodchem.2020.126648 |
| [3] | Wang P, Li D, Ke W, et al. Resveratrol-induced gut microbiota reduces obesity in high-fat diet-fed mice. Int J Obes (Lond), 2020, 44(1): 213-225. DOI:10.1038/s41366-019-0332-1 |
| [4] | Li D, Wang P, Wang P, et al. Gut microbiota promotes production of aromatic metabolites through degradation of barley leaf fiber. J Nutr Biochem, 2018, 58: 49-58. DOI:10.1016/j.jnutbio.2018.05.001 |
| [5] | Bajaj JS, Reddy KR, O'Leary JG, et al. Serum levels of metabolites produced by intestinal microbes and lipid moieties independently associated with acute-on-chronic liver failure and death in patients with cirrhosis. Gastroenterology, 2020, 159(5): 1715-1730. e12. DOI:10.1053/j.gastro.2020.07.019 |
| [6] | Wang P, Ji R, Ji J, et al. Changes of metabolites of acrylamide and glycidamide in acrylamide-exposed rats pretreated with blueberry anthocyanins extract. Food Chem, 2019, 274: 611-619. DOI:10.1016/j.foodchem.2018.08.058 |
| [7] | McCarthy MI. Biological and translational insights from T2DM genetics. Nat Rev Endocrinol, 2017, 13(2): 71-72. DOI:10.1038/nrendo.2016.212 |
| [8] | Ke WX, Wang P, Wang XH, et al. Dietary Platycodon grandiflorus attenuates hepatic insulin resistance and oxidative stress in high-fat-diet induced non-alcoholic fatty liver disease. Nutrients, 2020, 12(2): 480. DOI:10.3390/nu12020480 |
| [9] | Clarke SF, Murphy EF, O'Sullivan O, et al. Exercise and associated dietary extremes impact on gut microbial diversity. Gut, 2014, 63(12): 1913-1920. DOI:10.1136/gutjnl-2013-306541 |
| [10] | Zhao M, Zhao L, Xiong X, et al. TMAVA, a metabolite of intestinal microbes, is increased in plasma from patients with liver steatosis, inhibits γ-butyrobetaine hydroxylase, and exacerbates fatty liver in mice. Gastroenterology, 2020, 158(8): 2266-2281. e27. DOI:10.1053/j.gastro.2020.02.033 |
| [11] | Rooks MG, Garrett WS. Gut microbiota, metabolites and host immunity. Nat Rev Immunol, 2016, 16(6): 341-352. DOI:10.1038/nri.2016.42 |
| [12] | 张俊楠. 体外发酵法研究铁皮石斛多糖对人肠道菌群的影响[D]. 厦门: 厦门大学, 2018. Zhang JN. Effect of polysaccharide from Dendrobium officinale on human intestinal flora in vitro fermentation[D]. Xiamen: Xiamen University, 2018 (in Chinese). |
| [13] | Drall KM, Field CJ, Haqq AM, et al. Vitamin D supplementation in pregnancy and early infancy in relation to gut microbiota composition and C. difficile colonization: implications for viral respiratory infections. Gut Microbes, 2020, 12(1): 1799734. DOI:10.1080/19490976.2020.1799734 |
| [14] | Wan Y, Tang J, Li J, et al. Contribution of diet to gut microbiota and related host cardiometabolic health: diet-gut interaction in human health. Gut Microbes, 2020, 11(3): 603-609. DOI:10.1080/19490976.2019.1697149 |
| [15] | Huang Y, Jiang H, Mao XZ, et al. Laminarin and laminarin oligosaccharides originating from brown algae: preparation, biological activities, and potential applications. J Ocean Univ China, 2021, 20(3): 641-653. DOI:10.1007/s11802-021-4584-8 |
| [16] | Liu M, Ma L, Chen QC, et al. Fucoidan alleviates dyslipidemia and modulates gut microbiota in high-fat diet-induced mice. J Funct Foods, 2018, 48: 220-227. DOI:10.1016/j.jff.2018.07.006 |
| [17] | Zhao R, Coker OO, Wu J, et al. Aspirin reduces colorectal tumor development in mice and gut microbes reduce its bioavailability and chemopreventive effects. Gastroenterology, 2020, 159(3): 969-983. e4. DOI:10.1053/j.gastro.2020.05.004 |
| [18] | 张婷, 薛美兰, 刘佳, 等. 褐藻糖胶对乳腺肿瘤大鼠肠道屏障损伤的保护作用. 营养学报, 2018, 40(1): 59-63. Zhang T, Xue ML, Liu J, et al. Protective effect of fucoidan on intestinal barrier in rats with breast cancer. Acta Nutr Sin, 2018, 40(1): 59-63 (in Chinese). |
| [19] | Shi H, Chang Y, Gao Y, et al. Dietary fucoidan of Acaudina molpadioides alters gut microbiota and mitigates intestinal mucosal injury induced by cyclophosphamide. Food Funct, 2017, 8(9): 3383-3393. DOI:10.1039/C7FO00932A |
| [20] | Mueller S, Saunier K, Hanisch C, et al. Differences in fecal microbiota in different European study populations in relation to age, gender, and country: a cross-sectional study. Appl Environ Microbiol, 2006, 72(2): 1027-1033. DOI:10.1128/AEM.72.2.1027-1033.2006 |
| [21] | Shang QS, Song GR, Zhang MF, et al. Dietary fucoidan improves metabolic syndrome in association with increased Akkermansia population in the gut microbiota of high-fat diet-fed mice. J Funct Foods, 2017, 28: 138-146. DOI:10.1016/j.jff.2016.11.002 |
| [22] | Becattini S, Sorbara MT, Kim SG, et al. Rapid transcriptional and metabolic adaptation of intestinal microbes to host immune activation. Cell Host Microbe, 2021, 29(3): 378-393. e5. DOI:10.1016/j.chom.2021.01.003 |
| [23] | 吴嘉斓, 王笑园, 王坤立, 等. 生姜营养价值及药理作用研究进展. 食品工业, 2019, 40(2): 237-240. Wu JL, Wang XY, Wang KL, et al. Research progress on nutritional value and pharmacological action of ginger. Food Ind, 2019, 40(2): 237-240 (in Chinese). |
| [24] | Wang J, Ke WX, Bao R, et al. Beneficial effects of ginger Zingiber officinale Roscoe on obesity and metabolic syndrome: a review. Ann N Y Acad Sci, 2017, 1398(1): 83-98. DOI:10.1111/nyas.13375 |
| [25] | Zhao EY, Zhang WF, Geng B, et al. Intestinal dysbacteriosis leads to kidney stone disease. Mol Med Rep, 2020, 23(3): 180. DOI:10.3892/mmr.2020.11819 |
| [26] | 张军, 曾颜, 靳雅倩, 等. 生姜提取物调节骨骼肌CD36和PPARα改善高果糖饮食大鼠胰岛素敏感性. 中药新药与临床药理, 2020, 31(6): 621-626. Zhang J, Zeng Y, Jin YQ, et al. Improvement of liquid fructose-induced skeletal muscle insulin sensitivity in rats by ginger treatment is associated with CD36 and PPARα. Tradit Chin Drug Res Clin Pharmacol, 2020, 31(6): 621-626 (in Chinese). |
| [27] | Wang J, Zhang L, Dong L, et al. 6-gingerol, a functional polyphenol of ginger, promotes browning through an AMPK-dependent pathway in 3T3-L1 adipocytes. J Agric Food Chem, 2019, 67(51): 14056-14065. DOI:10.1021/acs.jafc.9b05072 |
| [28] | Goldstein N, McKnight AD, Carty JRE, et al. Hypothalamic detection of macronutrients via multiple gut-brain pathways. Cell Metab, 2021, 33(3): 676-6877. e5. DOI:10.1016/j.cmet.2020.12.018 |
| [29] | Schoenknecht C, Andersen G, Schmidts I, et al. Quantitation of gingerols in human plasma by newly developed stable isotope dilution assays and assessment of their immunomodulatory potential. J Agric Food Chem, 2016, 64(11): 2269-2279. DOI:10.1021/acs.jafc.6b00030 |
| [30] | Marasco G, Cirota GG, Rossini B, et al. Probiotics, prebiotics and other dietary supplements for gut microbiota modulation in celiac disease patients. Nutrients, 2020, 12(9): 2674. DOI:10.3390/nu12092674 |
| [31] | Abot A, Wemelle E, Laurens C, et al. Identification of new enterosynes using prebiotics: roles of bioactive lipids and mu-opioid receptor signalling in humans and mice. Gut, 2021, 70(6): 1078-1087. DOI:10.1136/gutjnl-2019-320230 |
| [32] | Marx W, Scholey A, Firth J, et al. Prebiotics, probiotics, fermented foods and cognitive outcomes: a meta-analysis of randomized controlled trials. Neurosci Biobehav Rev, 2020, 118: 472-484. DOI:10.1016/j.neubiorev.2020.07.036 |
| [33] | Paiva IHR, Duarte-Silva E, Peixoto CA. The role of prebiotics in cognition, anxiety, and depression. Eur Neuropsychopharmacol, 2020, 34: 1-18. DOI:10.1016/j.euroneuro.2020.03.006 |
| [34] | Wang J, Li D, Wang P, et al. Ginger prevents obesity through regulation of energy metabolism and activation of browning in high-fat diet-induced obese mice. J Nutr Biochem, 2019, 70: 105-115. DOI:10.1016/j.jnutbio.2019.05.001 |
| [35] | Xia CF, Cao XY, Cui LY, et al. Anti-aging effect of the combination of Bifidobacterium longum and B. animalis in a d-galactose-treated mice. J Funct Foods, 2020, 69: 103938. DOI:10.1016/j.jff.2020.103938 |
| [36] | Hor YY, Lew LC, Jaafar MH, et al. Lactobacillus sp. improved microbiota and metabolite profiles of aging rats. Pharmacol Res, 2019, 146: 104312. DOI:10.1016/j.phrs.2019.104312 |
| [37] | Hor YY, Ooi CH, Khoo BY, et al. Lactobacillus strains alleviated aging symptoms and aging-induced metabolic disorders in aged rats. J Med Food, 2019, 22(1): 1-13. DOI:10.1089/jmf.2018.4229 |
| [38] | Shi N, Chen F, Zhang XL, et al. Suppression of oxidative stress and NFκB/MAPK signaling by lyophilized black raspberries for esophageal cancer prevention in rats. Nutrients, 2017, 9(4): E413. DOI:10.3390/nu9040413 |
| [39] | Liu L, Yao L, Wang S, et al. 6-gingerol improves ectopic lipid accumulation, mitochondrial dysfunction, and insulin resistance in skeletal muscle of ageing rats: dual stimulation of the AMPK/PGC-1α signaling pathway via plasma adiponectin and muscular AdipoR1. Mol Nutr Food Res, 2019, 63(6): e1800649. DOI:10.1002/mnfr.201800649 |
| [40] | Deng X, Zhang S, Wu J, et al. Promotion of mitochondrial biogenesis via activation of AMPK-PGC1α signaling pathway by ginger (Zingiber officinale roscoe) extract, and its major active component 6-gingerol. J Food Sci, 2019, 84(8): 2101-2111. DOI:10.1111/1750-3841.14723 |
| [41] | Sanders ME, Merenstein DJ, Reid G, et al. Probiotics and prebiotics in intestinal health and disease: from biology to the clinic. Nat Rev Gastroenterol Hepatol, 2019, 16(10): 605-616. DOI:10.1038/s41575-019-0173-3 |
