
 , 张志谦1
, 张志谦1

1. 重庆医科大学 检验医学院临床检验诊断学教育部重点实验室, 重庆 400016;
2. 北京大学 临床肿瘤学院 细胞生物学研究室 恶性肿瘤发病机制及转化研究教育部重点实验室, 北京 100142
收稿日期:2021-02-26;接收日期:2021-07-23;网络出版时间:2021-07-29
基金项目:国家重点研发计划(No. 2016YFC1303400),国家自然科学基金(No. 81730075) 资助
摘要:肿瘤干细胞的存在被认为是肿瘤耐药和复发转移的根本原因,因此研发肿瘤干细胞的活体标记示踪技术动态监测该类细胞的存在具有重要的科学价值。实验室前期发现电压门控钙离子通道α2δ1亚基是肝细胞癌干细胞的特异表面标志物,文中研究探讨利用针对α2δ1的单克隆抗体1B50-1的单链可变域与新型荧光素酶NanoLuc形成融合蛋白1B50-1scFv-NanoLuc,在体外验证其对α2δ1阳性肝癌细胞结合的特性和荧光素酶活性。1B50-1scFv和NanoLuc序列通过重叠PCR技术扩增获得1B50-1scFv-NanoLuc的融合片段,并在C端添加Flag标签肽(命名为1B50-1scFv-NanoLucFlag),然后采用常规DNA克隆技术将融合片段克隆到真核表达载体。利用聚乙烯亚胺(Polyethyleneimine,PEI) 将1B50-1scFv-NanoLucFlag真核表达载体转染至悬浮型人胚肾293细胞(FreeStyle 293F)。蛋白免疫印记实验证明融合蛋白在FreeStyle 293F细胞培养上清中表达,其分子量约为50 kDa。融合蛋白经ANTI-FLAG? M2亲和层析柱纯化后,经流式细胞仪法测定融合蛋白1B50-1scFv-NanoLucFlag对高表达α2δ1的Hep-12肝癌细胞具有高亲和活性。进一步,1B50-1scFv-NanoLucFlag与高表达α2δ1的肝癌细胞结合后显示出强的荧光素酶活性。这些结果表明融合蛋白1B50-1scFv-NanoLucFlag可用于α2δ1阳性肝癌干细胞的标记并可通过荧光素酶化学发光法进行示踪。
关键词:α2δ1单克隆抗体NanoLuc融合蛋白
Expression, purification and characterization of anti-α2δ1/NanoLuc fusion protein
Lina Ma1, Qi He1, Jiangli Xu2

 , Zhiqian Zhang1
, Zhiqian Zhang1

1. Key Laboratory of Clinical Laboratory Diagnostics of Ministry Education, Faculty of Laboratory Medicine, Chongqing Medicine University, Chongqing 400016, China;
2. Key Laboratory of Carcinogenesis and Translational Research (Ministry of Education), Department of Cell Biology, Peking University Cancer Hospital and Institute, Beijing 100142, China
Received: February 26, 2021; Accepted: July 23, 2021; Published: July 29, 2021
Supported by: National Key Research and Development Program, China (No. 2016YFC1303400), National Natural Science Foundation of China (No. 81730075)
Corresponding author: Jiangli Xu. Tel: +86-10-88196770; E-mail: xujiangli1230@126.com;
Zhiqian Zhang. Tel: +86-10-88196792; E-mail: zlzqzhang@bjmu.edu.cn.
Abstract: The existence of cancer stem cells is regarded as the major cause for therapeutic resistance and relapse of a variety of cancer types including hepatocellular carcinoma (HCC). However, the tracing of such a subpopulation in vivo has been challenging. We have previously demonstrated that the isoform 5 of the voltage-gated calcium channel α2δ1 subunit, which can be recognized specifically by a monoclonal antibody 1B50-1, is a bona fide surface marker for HCC stem cells. Here we developed a strategy for optical imaging of α2δ1-positive cells by using a fusion protein containing the single chain variable fragment (scFv) of Mab1B50-1 and the luciferase NanoLuc which was tagged with Flag in the C-terminal. The scFv of Mab1B50-1 was fused to the N-terminal of NanoLucFlag using overlap PCR, and the recombinant fragment, which was named as 1B50-1scFv-NanoLucFlag, was subsequently cloned into a eukaryotic expression vector. The resulting construct was transfected into FreeStyle 293F cells in suspension using PEI reagent. The expression of the fusion protein was identified as a protein with molecular weight about 50 kDa by Western blotting. After purification by ANTI-FLAG? M2 affinity chromatography, 1B50-1scFv-NanoLucFlag was demonstrated to bind to α2δ1 positive cells specifically with a Kd value of (18.62±1.84) nmol/L. Furthermore, a strong luciferase activity of 1B50-1scFv-NanoLucFlag was detected in α2δ1 positive cells following incubation with the fusion protein, indicating that the presence of α2δ1 could be quantified using this fusion protein. Hence, 1B50-1scFv-NanoLucFlag provides a potential tool for optical imaging of α2δ1 positive cancer stem cells both in vitro and in vivo.
Keywords: α2δ1monoclonal antibodyNanoLucfusion protein
肝癌(Hepatocellular carcinoma,HCC) 是世界上最常见、最致命的癌症之一。据估计HCC是全球第四大最常见的癌症相关死亡原因[1-2]。长期以来,肝癌治疗的主要挑战包括复发、转移和耐药,是肝癌患者预后不良的主要原因[3-4]。肝癌的复发、转移和耐药通常与肿瘤起始细胞(Tumor-initiating cells,TICs) 或肿瘤干细胞(Cancer stem cell,CSCs) 的存在相关,这些细胞被认为具有癌细胞和干细胞样特征,包括具有自我更新、分化、高成瘤性和对传统的放、化疗抵抗等特性[5-6]。靶向肿瘤干细胞的治疗被认为是肿瘤“治愈”的希望所在[7-8]。我们课题组前期工作发现电压门控钙离子通道亚基α2δ1 (由CACNA2D1基因编码) 的亚型5是一个功能性的肝CSCs标记物,且α2δ1在手术切缘的存在是HCC复发和预后不良的独立危险因素。针对α2δ1亚型5的单克隆抗体1B50-1可以特异性靶向α2δ1清除CSCs从而减缓HCC的生长[9]。
尽管单克隆抗体在治疗癌症方面取得了临床成功,但由于肿瘤穿透力差和制造成本高等限制,其在治疗发展中的应用仍然受到阻碍[10]。近年来,分子工程技术已被用于修饰抗体的结构,以改善其分子大小、靶标结合特异性、药代动力学和结合亲和力等[11]。其中最常见的一种修饰是单链可变片段(Single-chain variable fragment,scFv),它由轻链可变域(VL) 和重链可变域(VH) 通过一个柔性的肽链连接构成[12]。研究表明,scFv结构中的可变区片段是唯一参与抗原结合的区域[13]。由于它们的体积比完整的IgG小,而且大多数scFv在血清中的半衰期短,这使它们成为一种强有力的成像工具[14]。生物发光是一种依靠酶和底物相互作用产生光的化学过程。甲虫(如萤火虫) 和腔肠动物荧光素酶(例如海肾和高斯) 是两个主要类型的荧光素酶,常作为成像的研究工具[15-16]。但是,有研究表明其应用受限于光吸收和体内不稳定的条件如温度、pH值和尿素浓度变化等[17]。为了克服这些问题,我们采用了一种来自深海虾的新型荧光素酶NanoLuc。NanoLuc是一种分子量小(19 kDa)、高度稳定和不依赖ATP的生物发光蛋白。它显示出极度明亮的光,比萤火虫和海肾荧光素酶亮150倍以上,并且NanoLuc具有物理稳定性,其信号半衰期超过2 h[18-20]。文献中常用的方法是将NanoLuc编码基因导入目的细胞后再加入其底物Furimazine进行化学发光对由目的细胞形成的肿瘤进行监测[21],然而这种方法需要对要测试的每种细胞预先建立稳定表达NanoLuc的细胞系,但这对于追踪特定细胞亚群如肿瘤干细胞的显像则较为困难。本研究探讨将抗α2δ1的抗体1B50-1的单链可变域与NanoLuc荧光素酶融合重组表达1B50-1scFv-NanoLucFlag融合蛋白,并通过体外试验验证1B50-1scFv-NanoLucFlag结合α2δ1的特性以及荧光素酶活性,以期为未来利用该融合蛋白特异结合α2δ1阳性细胞和催化底物化学发光反应进行体内α2δ1阳性细胞光学化学发光成像奠定基础。
1 材料与方法1.1 实验材料人肝癌Hep-11和Hep-12细胞系为本实验室和合作者从同一肝癌病人原发和复发组织分别经原代培养所建细胞系,PLC/PRF/5肝癌细胞系来自美国模式培养物保藏中心(American Type Culture Collection,ATCC),FreeStyle 293F细胞系购自Invitrogen公司,均由本实验室保存。大肠杆菌DH5α感受态细胞购自北京全式金公司。
RPMI-1640培养基、Free-style 293 Expression培养基、Opti-MEM、胎牛血清(FBS)、100×双抗及10×胰蛋白酶(Trypsin)均购自美国Gibco公司;Phusion?超保真DNA聚合酶、限制性内切酶均购自NEB公司;T4 DNA连接酶和Nano-Glo? Luciferase Assay试剂盒均购自Promega公司;1 kb DNA ladder购自Gen Star公司;QIAquick PCR Purification Kit和QIAquick Gel Extraction Kit购自QIAGEN公司;高纯度质粒小提中量快速提取试剂盒购自博迈德公司;NucleoBond Xtra Midi购自MACHEREY-NAGEL公司;ANTI-FLAG? M2 Affinity Gel购自Sigma公司;Anti-FLAG? M2 Antibody购自CST公司;3× FLAG peptide购自GL Biochem公司;蛋白预染marker购自Thermo公司;Hoechst33342荧光染料购自北京索莱宝科技有限公司;FITC标记山羊抗兔IgG (H+L)、罗丹明标记山羊抗兔IgG (H+L) 和辣根酶标记山羊抗兔IgG (H+L) 购自北京中杉金桥生物技术有限公司;Amicon Ultra-15 mL超滤离心管(10 kDa) 购自Millipore公司;转染试剂聚乙烯亚胺(Polyethylenimine,PEI) 购自Peprotech公司。
1.2 方法1.2.1 重组质粒的构建实验室保存有包含小鼠1B50-1和对照IgG单链可变区序列的质粒;C端含Flag标签的NanoLuc序列由南京金斯瑞生物科技有限公司合成。1B50-1和对照IgG单链可变区序列与NanoLucFlag的连接采用重叠延伸PCR (overlap PCR) 技术:分别以1B50-1、对照IgG单链可变区序列与NanoLucFlag质粒为模板,分别用引物对1B50-1scFv F和1B50-1scFv R、IgG scFv F和IgG scFv R、NanoLuc F和NanoLuc R (引物顺序见表 1,由生工生物工程(上海) 股份有限公司合成) 和超保真DNA聚合酶扩增出1B50-1scFv片段、IgG scFv片段和NanoLucFlag片段,然后将适量的1B50-1scFv、IgG scFv PCR扩增产物分别与NanoLucFlag片段混合作为模板,分别加入1B50-1scFv F和NanoLuc R、IgG scFv F和NanoLuc R引物,用超保真DNA聚合酶PCR扩增获得1B50-1scFv-NanoLucFlag片段、IgG scFv-NanoLucFlag片段,再经限制性内切酶EcoR Ⅰ和Sal Ⅰ酶切后用T4 DNA连接酶连接到真核表达载体。重组质粒经酶切鉴定和DNA测序验证正确后,用低内毒素质粒提取试剂盒大量提取。
表 1 实验所用引物Table 1 Primers used in this study
| Primer names | Primer sequences (5′–3′) |
| 1B50-1scFv F | CCGGAATTCGCCACCATGGTGTCCACCCCCCAG |
| 1B50-1scFv R | ACCGGAGCCGCCGCCGCCAGAACCACCACCACCACTAGACACGGTGACCAGAG |
| IgG scFv F | CCGGAATTCGCCACCATGGTGTCCACCCCCCAG |
| IgG scFv R | ACCGGAGCCGCCGCCGCCAGAACCACCACCACCGCTAGACACTGTCACGGA |
| NanoLuc F | CTGGCGGCGGCGGCTCCGGTGGTGGTGGTTCTGTCTTCACACTCGAAGATTT |
| NanoLuc R | CGCGTCGACTTAACCGGCCTTATCATCGTCATCCTTGTAAT |
| Note: underlined sequences are restriction enzyme sites. | |
表选项
1.2.2 细胞培养与质粒转染Hep-11、Hep-12和PLC/PRF/5肝癌细胞采用添加10%胎牛血清和双抗的RPMI-1640培养液,于37 ℃、5% CO2恒温培养箱中培养。FreeStyle 293F细胞采用无血清、无双抗的FreeStyle 293 Expression培养液,于37 ℃、8% CO2、130 r/min恒温培养箱中旋转培养。
转染当天,用新鲜的FreeStyle 293表达培养液将生长状态良好的FreeStyle 293F细胞稀释至1×106个细胞/mL。然后,将100 μg重组质粒和300 μg PEI溶液加到10 mL的Opti-MEM减血清培养液中,充分混匀后于室温静置20 min,以形成转染复合物。最后,将准备好的10 mL转染复合物均匀滴加到100 mL的FreeStyle 293F细胞悬液中,轻轻混匀,放回孵育箱正常培养。
1.2.3 免疫印迹杂交(Western blotting) 实验收集质粒转染的悬浮FreeStyle 293F细胞,离心沉淀细胞(3 600 r/min、5 min),取适量上清液,加入5倍体积的6×上样缓冲液,100 ℃煮沸变性5 min,经10% SDS-PAGE分离,电转到PVDF膜上,5%脱脂奶粉/TBST室温封闭1 h;随后,用TBST稀释的Anti-FLAG? M2 Antibody (1︰4 000) 在室温条件下孵育1 h,TBST洗膜(10 min×3次),每次10 min;接着,加入TBS稀释的辣根酶标记山羊抗兔IgG (1︰100 000),室温孵育1 h,TBST洗膜3次后,使用超灵敏化学发光液(Immobilon Western HRP底物) 显色,用SageCreation化学发光图像仪扫描化学发光信号条带。
1.2.4 融合蛋白纯化收集转染后的FreeStyle 293F细胞悬液,离心沉淀细胞(3 600 r/min、10 min),收集培养上清,依次使用0.45 μm滤膜和0.22 μm滤膜过滤,再用Amicon Ultra-15 mL超滤离心管(10 kDa) 浓缩过滤后,装载到预平衡好的ANTI-FLAG? M2亲和树脂柱中。经5倍柱体积的TBS缓冲液洗去树脂上的非特异结合蛋白后,用3倍柱体积的3× FLAG peptide (200 ng/μL) 洗脱液洗脱结合在树脂上的特异性融合蛋白。
1.2.5 细胞免疫荧光染色贴壁培养的细胞经胰酶/EDTA消化后,取1×106个细胞加到1.5 mL微量塑料离心管中,经磷酸缓冲盐溶液(Phosphate buffered saline,PBS) 洗涤2次,实验组加入200 μL 1B50-1scFv- NanoLucFlag融合蛋白(10 μg/mL),对照组加入200 μL IgG scFv-NanoLucFlag融合蛋白(10 μg/mL),混合均匀,4 ℃孵育1 h。离心沉淀细胞(1 000 r/min、5 min),弃上清,用PBS洗涤细胞3次,再加入200 μL PBS稀释的Anti-FLAG? M2 Antibody (1︰800),4 ℃孵育1 h。经PBS洗涤离心后,加入200 μL PBS稀释的罗丹明标记山羊抗兔IgG (1︰100),4 ℃避光孵育1 h。再次离心和清洗细胞,用200 μL浓度为100 ng/mL的Hoechst 33342进行细胞核染色,PBS洗涤后,用200–300 μL PBS重悬细胞并将细胞悬液转移到超薄的96孔板中,用激光共聚焦显微镜观察照相。
1.2.6 流式细胞分析术将1×106个生长状态良好的Hep-11、Hep-12和PLC/PRF/5细胞分别加至不同的EP管中,PBS清洗细胞2次,4 ℃离心沉淀细胞(1 000 r/min、5 min),弃上清。实验组加入200 μL FITC标记的1B50-1抗体,对照组加入等量的FITC标记的对照IgG抗体,充分混匀,4 ℃避光孵育1 h。离心沉淀细胞(4 ℃、1 000 r/min、5 min),弃上清,PBS清洗细胞2次。最后,用PBS重悬细胞,使用流式细胞仪(BD Accuri C6) 检测不同细胞中α2δ1的表达情况。
为检测融合蛋白与α2δ1的亲和活性,将不同浓度的1B50-1scFv-NanoLucFlag和IgG scFv- NanoLucFlag (0 μg/mL、0.125 μg/mL、0.25 μg/mL、0.50 μg/mL、1.0 μg/mL、2.0 μg/mL、4.0 μg/mL和8.0 μg/mL) 分别加至高表达α2δ1的Hep-12肝癌细胞中(1×106个/EP管),充分混匀,4 ℃孵育1 h。离心沉淀细胞(4 ℃、1 000 r/min、5 min),弃上清,PBS清洗细胞后,加入200 μL用PBS稀释的Anti-FLAG? M2 Antibody (1︰1 600),充分混匀,4 ℃孵育1 h。重复离心和清洗步骤,加入200 μL用PBS稀释的FITC标记的山羊抗兔IgG,4 ℃避光孵育1 h。离心沉淀细胞,弃上清,用PBS重悬细胞,使用流式细胞分析仪(BD Accuri C6) 检测各管细胞的荧光强度。
1.2.7 NanoLuc荧光素酶活性测定融合蛋白的荧光素酶活性测定严格按照Nano-Glo? Luciferase Assay试剂盒说明书推荐的方式进行。具体实验步骤如下:将1×106个经胰酶/EDTA消化的细胞加至EP管中,经PBS洗涤离心后,加入200 μL不同浓度的1B50-1scFv- NanoLucFlag和IgG scFv-NanoLucFlag (0 μg/mL、0.1 μg/mL、0.5 μg/mL、1.0 μg/mL、2.0 μg/mL和4.0 μg/mL),4 ℃孵育1 h。4 ℃离心沉淀细胞(1 000 r/min、5 min),经PBS洗涤离心后,用PBS重悬细胞并将细胞悬液转移至96孔板,然后加入PBS稀释的Nano-Glo萤光素酶检测底物(1︰400)。将96孔板置于FLUOstar OPTIMA多功能酶标仪上,读取并记录生物发光强度值。每组实验至少重复3次。
1.2.8 数据分析实验结果采用GraphPad Prism7软件进行统计学分析。计数变量经检验符合正态分布条件下采用t-检验,P≤0.05被认为差异具有统计学意义(*代表P < 0.05;**代表P < 0.01;***代表P < 0.001)。
2 结果与分析2.1 重组质粒构建及鉴定1B50-1抗体或对照IgG的scFv片段通过重叠PCR技术与带有Flag标签的NanoLuc序列进行连接,中间插入(G4S)3连接子序列(图 1A)。重叠PCR产物经酶切后将其克隆到真核表达载体上。重组质粒经EcoR Ⅰ和Sal Ⅰ限制性内切酶酶切后,含有1B50-1scFv-NanoLucFlag的质粒获得6 893 bp和1 383 bp两条带(图 1B),含有IgG scFv- NanoLucFlag的质粒得到6 611 bp和1 395 bp两条带(图 1C)。酶切鉴定正确的质粒经Sanger法测序进一步确认序列正确。
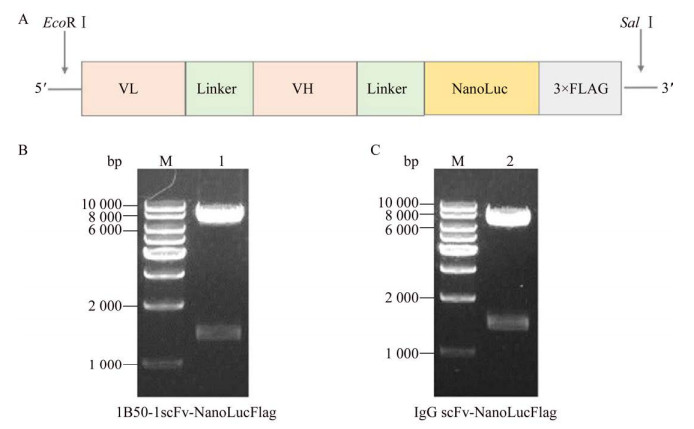 |
| 图 1 重组质粒的结构示意图和酶切鉴定 Fig. 1 Schematic diagram of the recombinant plasmids (A) and the EcoRⅠ and SalⅠ digestion of the DNA fragment encoding the fusion protein of 1B50-1scFv-NanoLucFlag (B) and IgG-scFv-NanoLucFlag (C). M: 1 kb DNA ladder; 1 and 2: double digestion products of 1B50-1scFv-NanoLucFlag and IgG scFv-NanoLucFlag, respectively. |
| 图选项 |
2.2 融合蛋白表达和纯化将重组质粒1B50-1scFv-NanoLucFlag和IgG scFv-NanoLucFlag分别转染FreeStyle 293F细胞,收集转染后不同时间点的细胞上清液进行免疫印迹实验。结果显示,融合蛋白1B50-1scFv-NanoLucFlag在转染后的第5天表达最高。因此,我们选择在重组质粒转染FreeStyle 293F细胞后的第5天收集细胞上清液,进行ANTI-FLAG? M2亲和层析纯化。将纯化后的融合蛋白1B50-1scFv-NanoLucFlag和IgG scFv-NanoLucFlag分别进行SDS-PAGE分离和考马斯亮蓝染色,结果显示:融合蛋白条带清晰,无明显杂带,分子量约50 kDa,符合预期大小(图 2)。这表明纯化后的融合蛋白可以达到电泳纯,适合进行下一步实验。
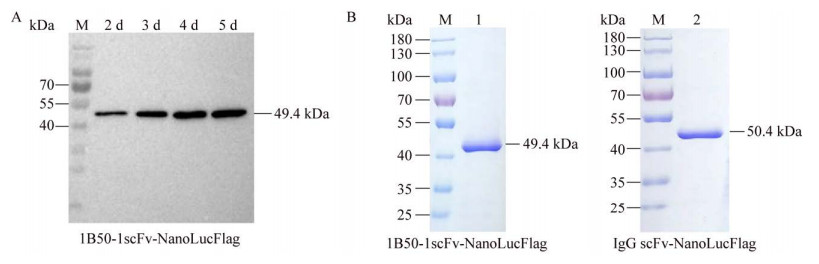 |
| 图 2 融合蛋白表达和纯化 Fig. 2 Expression and purification of fusion protein. (A) Western blotting analysis of 1B50-1scFv-NanoLucFlag fusion protein in the culture medium obtained at the indicated days after transient transfection in FreeStyle 293F cells. The filter was blotted with anti-Flag antibody. (B) SDS-PAGE analysis of the purified fusion protein. Lane M: prestained protein marker; lane 1: 1B50-1scFv-NanoLucFlag; lane 2: IgG scFv-NanoLucFlag. |
| 图选项 |
2.3 肝细胞癌细胞系中α2δ1的表达为检测α2δ1在肝细胞癌细胞系中的表达情况,笔者利用流式细胞仪对人肝细胞癌细胞系Hep-11、Hep-12和PLC/PRF/5中α2δ1的表达进行了检测,结果如图 3所示。α2δ1在Hep-12细胞中的表达最高,阳性率接近100%;其次是PLC/PRF/5细胞,阳性率在30%左右;α2δ1在Hep-11细胞中几乎不表达,只有少量细胞呈现阳性。
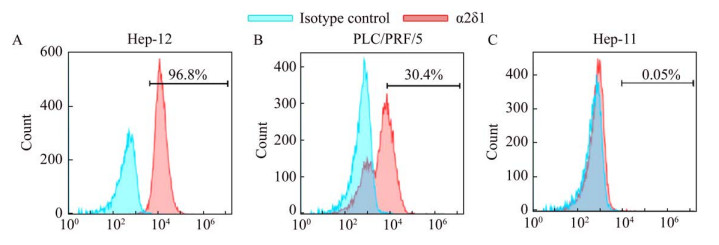 |
| 图 3 α2δ1在肝癌细胞中的表达流式细胞分析 Fig. 3 Expression of α2δ1 in hepatocellular carcinoma as detected by flow cytometry. |
| 图选项 |
2.4 融合蛋白1B50-1scFv-NanoLucFlag与肝细胞癌细胞的结合特性为探讨融合蛋白1B50-1scFv-NanoLucFlag与α2δ1结合的特异性,笔者首先用免疫荧光染色检测了融合蛋白与肝细胞癌细胞株Hep-11、Hep-12和PLC/PRF/5的结合特性。实验结果如图 4所示,融合蛋白1B50-1scFv-NanoLucFlag能够与几乎全部的Hep-12细胞结合,只结合一部分PLC/PRF/5细胞,然而与Hep-11细胞几乎不结合;对照融合蛋白IgG scFv-NanoLucFlag则与所有检测的细胞都不结合。这一结合实验结果与细胞表面α2δ1的表达呈正相关,提示融合蛋白1B50-1scFv-NanoLucFlag能特异性结合α2δ1。
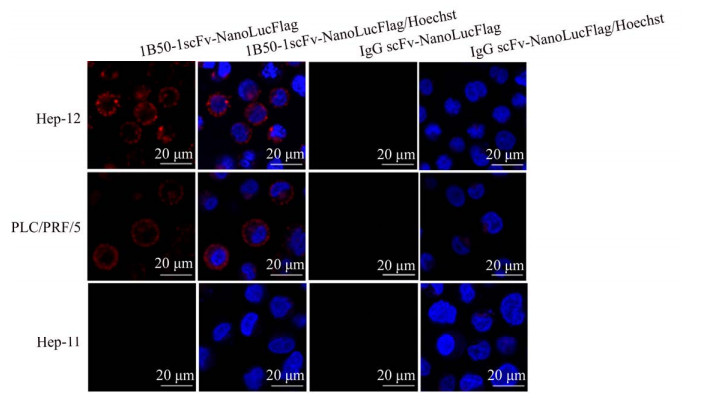 |
| 图 4 融合蛋白1B50-1scFv-NanoLucFlag和IgG scFv-NanoLucFlag与肝细胞癌细胞结合免疫荧光染色分析 Fig. 4 Representative micrographs showing the binding of 1B50-1scFv-NanoLucFlag and IgG scFv-NanoLucFlag with the indicated cells as demonstrated by immunofluorescent staining. |
| 图选项 |
进一步实验中,笔者利用流式细胞术检测了融合蛋白与表达α2δ1的细胞Hep-12的亲和力。结果表明,1B50-1scFv-NanoLucFlag与Hep-12结合后的荧光强度随着融合蛋白的浓度升高而增加,而对照融合蛋白的荧光强度不随蛋白浓度升高而变化。融合蛋白1B50-1scFv-NanoLucFlag与Hep-12细胞结合的亲和常数Kd值为(18.62±1.84) nmol/L,而对照融合蛋白IgG scFv-NanoLucFlag则无法拟合出Kd值(图 5)。
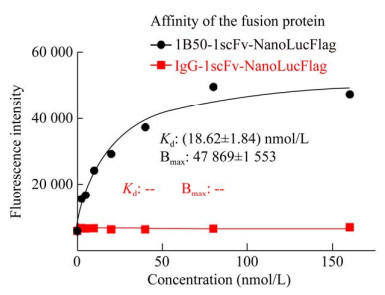 |
| 图 5 融合蛋白亲和力定量分析结果 Fig. 5 Quantitative analysis of the affinity of the fusion proteins to Hep-12 cells. |
| 图选项 |
2.5 融合蛋白的荧光素酶活性测定为了探讨融合蛋白1B50-1scFv-NanoLucFlag与肝癌细胞表面α2δ1结合后荧光素酶是否可催化底物发光以用于生物化学发光成像,笔者对融合蛋白在体外与不同肝癌细胞孵育后的荧光素酶活性进行了检测。结果显示,1B50-1scFv-NanoLucFlag和IgG scFv-NanoLucFlag分别与Hep-12和PLC/PRF/5细胞孵育后,实验组1B50-1scFv- NanoLucFlag在两种细胞都呈现较强的荧光素酶活性,与对照组IgG scFv-NanoLucFlag之间有极显著的差异。相反,两种融合蛋白与Hep-11细胞孵育后,荧光素酶活性则无显著的差异(图 6A、B和C)。这些结果表明,融合蛋白1B50-1scFv- NanoLucFlag与α2δ1阳性的细胞结合后有荧光素酶活性,可以产生化学发光,有望应用于α2δ1阳性细胞的化学发光光学成像。
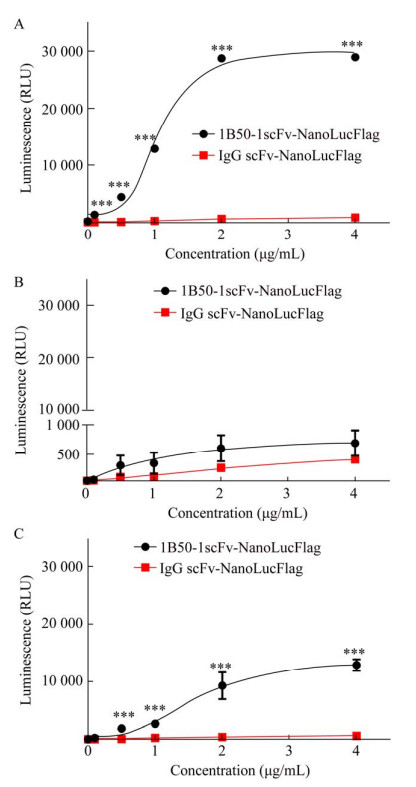 |
| 图 6 1B50-1scFv-NanoLucFlag和IgG scFv-NanoLucFlag融合蛋白荧光素酶活性检测 Fig. 6 Luciferase activity assay of the 1B50-1scFv- NanoLucFlag and IgG scFv-NanoLucFlag fusion protein. (A) Hep-12 cells. (B) PLC/PRF/5 cells. (C) Hep-11 cells. |
| 图选项 |
3 讨论肿瘤干细胞常表现为对治疗的耐受,被认为是肿瘤复发转移和治疗失败的根本原因,其含量在异质性肿瘤群体中一般较低,且常随微环境和治疗与否发生动态改变,因此实现对这类细胞的实时示踪检测具有重要的科学价值和广阔的应用前景[22-24]。文中我们将针对肝细胞癌干细胞表面标志物α2δ1的抗体1B50-1的scFv片段与新型荧光素酶NanoLuc形成融合蛋白,由1B50-1scFv将荧光素酶NanoLuc标记在α2δ1阳性肝细胞癌干细胞表面,加入NanoLuc的化学发光底物后,可以使α2δ1阳性肝细胞癌干细胞存在的地方产生化学发光,从而实现对α2δ1阳性肝细胞癌干细胞的化学发光示踪,有望应用于体内的α2δ1阳性肝细胞癌干细胞化学发光成像。笔者通过体外实验结果证明,与对照融合蛋白IgG scFv-NanoLucFlag相比,融合蛋白1B50-1scFv-NanoLucFlag对α2δ1的亲和力高,且与α2δ1阳性细胞结合后能表现出高的荧光素酶活性;而且1B50-1scFv-NanoLucFlag与肝细胞癌细胞结合后的化学发光强度与细胞α2δ1表达的水平呈正相关,这些结果说明1B50- 1scFv-NanoLucFlag能够定量反映α2δ1阳性肝细胞癌干细胞的存在,为进一步开展α2δ1阳性肝细胞癌干细胞的体内光学发光成像奠定了基础。
该方法由于不需要预先将NanoLuc基因表达在目的细胞内,仅利用抗体对抗原的亲和力从而靶向表达特定抗原的细胞[25],因而简便易行,可以适用于所有表达目的抗原细胞的光学发光成像,使对只占异质性肿瘤群体一部分肿瘤干细胞的光学化学发光成像成为了可能,可以在动物体内监测肿瘤的生长、转移和对治疗的反应,因而有广阔的应用前景。
当然本研究只进行了体外实验,下一步需要在动物体内对融合蛋白1B50-1scFv-NanoLucFlag作为探针示踪α2δ1阳性肝癌细胞的特异性和敏感性进行系统研究,以对1B50-1scFv-NanoLucFlag在α2δ1阳性肝癌细胞的活体化学发光光学成像中的应用价值作出完整评价。总之,该研究为α2δ1阳性肝癌细胞的活体化学发光光学成像提供了一种潜在的免疫检测探针。
参考文献
| [1] | Yang JD, Hainaut P, Gores GJ, et al. A global view of hepatocellular carcinoma: trends, risk, prevention and management. Nat Rev Gastroenterol Hepatol, 2019, 16(10): 589-604. DOI:10.1038/s41575-019-0186-y |
| [2] | Fitzmaurice C, Global Burden of Disease Cancer Collaboration. Global, regional, and national cancer incidence, mortality, years of life lost, years lived with disability, and disability-adjusted life-years for 29 cancer groups, 2006 to 2016: a systematic analysis for the Global Burden of Disease study. J Clin Oncol, 2018, 36(15_suppl): 1568. DOI:10.1200/JCO.2018.36.15_suppl.1568 |
| [3] | Lencioni R. Loco-regional treatment of hepatocellular carcinoma. Hepatology, 2010, 52(2): 762-773. DOI:10.1002/hep.23725 |
| [4] | Anwanwan D, Singh SK, Singh S, et al. Challenges in liver cancer and possible treatment approaches. Biochim Biophys Acta Rev Cancer, 2020, 1873(1): 188314. DOI:10.1016/j.bbcan.2019.188314 |
| [5] | Visvader JE, Lindeman GJ. Cancer stem cells: current status and evolving complexities. Cell Stem Cell, 2012, 10(6): 717-728. DOI:10.1016/j.stem.2012.05.007 |
| [6] | Clevers H. The cancer stem cell: premises, promises and challenges. Nat Med, 2011, 17(3): 313-319. DOI:10.1038/nm.2304 |
| [7] | Clara JA, Monge C, Yang Y, et al. Targeting signalling pathways and the immune microenvironment of cancer stem cells-a clinical update. Nat Rev Clin Oncol, 2020, 17(4): 204-232. DOI:10.1038/s41571-019-0293-2 |
| [8] | Sun JH, Luo Q, Liu LL, et al. Liver cancer stem cell markers: progression and therapeutic implications. World J Gastroenterol, 2016, 22(13): 3547-3557. DOI:10.3748/wjg.v22.i13.3547 |
| [9] | Zhao W, Wang L, Han H, et al. 1B50-1, a MAb raised against recurrent tumor cells, targets liver tumor-initiating cells by binding to the calcium channel α2δ1 subunit. Cancer Cell, 2013, 23(4): 541-556. DOI:10.1016/j.ccr.2013.02.025 |
| [10] | Liu M, Li L, Jin D, et al. Nanobody-a versatile tool for cancer diagnosis and therapeutics. Wiley Interdiscip Rev Nanomed Nanobiotechnol, 2021, 13(4): e1697. |
| [11] | Safavi A, Emamzadeh R, Nazari M, et al. Super RLuc8-sFv; a new luciferase-labeled probe for detection of human CD4+ cells. Mol Biosyst, 2017, 13(3): 470-475. DOI:10.1039/C6MB00652C |
| [12] | Sato R, Obonai T, Tsumura R, et al. Preparation and characterization of anti-tissue factor single-chain variable fragment antibody for cancer diagnosis. Cancer Sci, 2014, 105(12): 1631-1637. DOI:10.1111/cas.12557 |
| [13] | Jain M, Kamal N, Batra SK. Engineering antibodies for clinical applications. Trends Biotechnol, 2007, 25(7): 307-316. DOI:10.1016/j.tibtech.2007.05.001 |
| [14] | Weisser NE, Hall JC. Applications of single-chain variable fragment antibodies in therapeutics and diagnostics. Biotechnol Adv, 2009, 27(4): 502-520. DOI:10.1016/j.biotechadv.2009.04.004 |
| [15] | Kim MA, Yoon HS, Park SH, et al. Engineering of monobody conjugates for human EphA2-specific optical imaging. PLoS ONE, 2017, 12(7): e0180786. DOI:10.1371/journal.pone.0180786 |
| [16] | Venisnik KM, Olafsen T, Gambhir SS, et al. Fusion of Gaussia luciferase to an engineered anti-carcinoembryonic antigen (CEA) antibody for in vivo optical imaging. Mol Imaging Biol, 2007, 9(5): 267-277. DOI:10.1007/s11307-007-0101-8 |
| [17] | Hall MP, Unch J, Binkowski BF, et al. Engineered luciferase reporter from a deep sea shrimp utilizing a novel imidazopyrazinone substrate. ACS Chem Biol, 2012, 7(11): 1848-1857. DOI:10.1021/cb3002478 |
| [18] | Schaub FX, Reza MS, Flaveny CA, et al. Fluorophore-NanoLuc BRET reporters enable sensitive in vivo optical imaging and flow cytometry for monitoring tumorigenesis. Cancer Res, 2015, 75(23): 5023-5033. DOI:10.1158/0008-5472.CAN-14-3538 |
| [19] | Yan C, Du L, Li M. Novel NanoLuc-type substrates with various C-6 substitutions. Bioorg Med Chem Lett, 2020, 30(9): 127085. DOI:10.1016/j.bmcl.2020.127085 |
| [20] | Dixon AS, Schwinn MK, Hall MP, et al. NanoLuc complementation reporter optimized for accurate measurement of protein interactions in cells. ACS Chem Biol, 2016, 11(2): 400-408. DOI:10.1021/acschembio.5b00753 |
| [21] | Taylor A, Sharkey J, Plagge A, et al. Multicolour in vivo bioluminescence imaging using a NanoLuc-based BRET reporter in combination with firefly luciferase. Contrast Media Mol Imaging, 2018, 2018: 2514796. |
| [22] | Abbaszadegan MR, Bagheri V, Razavi MS, et al. Isolation, identification, and characterization of cancer stem cells: a review. J Cell Physiol, 2017, 232(8): 2008-2018. DOI:10.1002/jcp.25759 |
| [23] | Eun K, Ham SW, Kim H. Cancer stem cell heterogeneity: origin and new perspectives on CSC targeting. BMB Rep, 2017, 50(3): 117-125. DOI:10.5483/BMBRep.2017.50.3.222 |
| [24] | Najafi M, Mortezaee K, Majidpoor J. Cancer stem cell (CSC) resistance drivers. Life Sci, 2019, 234: 116781. DOI:10.1016/j.lfs.2019.116781 |
| [25] | Sharma P, Marada VVVR, Cai Q, et al. Structure-guided engineering of the affinity and specificity of CARs against Tn-glycopeptides. Proc Natl Acad Sci USA, 2020, 117(26): 15148-15159. DOI:10.1073/pnas.1920662117 |
