

南开大学 生命科学学院 分子微生物学与技术教育部重点实验室,天津 300071
收稿日期:2020-05-23;接收日期:2020-09-04;网络出版时间:2020-11-04
基金项目:天津市自然科学基金(No. 19JCZDJC33800),国家自然科学基金(No. 31870139) 资助
摘要:内质网作为真核细胞内极为重要的细胞器,在生物大分子合成与加工、物质转运、离子稳态维持、信号转导、细胞器间物质与信号交流等诸多方面发挥关键作用,其功能异常与癌症、自身免疫疾病、病原微生物感染、神经退行性疾病、糖尿病等诸多重大疾病紧密相关。随着纳米技术的不断发展,内质网靶向纳米药物的开发与应用逐渐成为生物工程、纳米医学、材料化学等领域的研究热点。文中结合近年来国内外相关研究进展,对内质网功能紊乱与疾病发生的关系、内质网靶向纳米药物的设计原理、内质网靶向纳米药物的应用进行了综述。内质网靶向纳米药物基于纳米药物载体或生物活性分子自组装原理进行设计。它们以主动或被动方式靶向内质网,通过破坏或维持内质网功能而发挥作用,在癌症靶向治疗、免疫调节、神经系统功能修复等诸多方面具有广泛的应用前景。
关键词:内质网纳米药物分子自组装纳米载体癌症
Advance in endoplasmic reticulum-targeting nanodrugs
Yan Zhao, Qilin Yu


Key Laboratory of Molecular Microbiology and Technology, Ministry of Education, College of Life Sciences, Nankai University, Tianjin 300071, China
Received: May 23, 2020; Accepted: September 4, 2020; Published: November 4, 2020
Supported by: Natural Science Foundation of Tianjin, China (No. 19JCZDJC33800), National Natural Science Foundation of China (No. 31870139)
Corresponding author: Qilin Yu. Tel: +86-22-23508506; Fax: +86-22-23508300; E-mail: yuqilin@mail.nankai.edu.cn.
Abstract: As an extremely important organelle in eukaryotic cells, endoplasmic reticulum (ER) plays a key role in the synthesis and processing of biomacromolecules, material transport, ion homeostasis maintenance, signal transduction, exchange of materials and signals between organelles. Many important human diseases, such as cancers, autoimmune diseases, pathogenic infections, neurodegenerative diseases and diabetes, are closely related to ER dysfunction. With the development of nanotechnology, the exploration and application of ER-targeted nanodrugs gradually become a research hotspot in the field of nanomedicine, bioengineering, material chemistry and other fields. In this paper, the relationship between ER dysfunction and disease occurrence, the principle of designing ER-targeted nanodrugs and their biomedical application are reviewed. ER-targeted nanodrugs are designed based on nanodrug carriers or self-assembly of bioactive molecules. These nanodrugs could target the ER in an active or passive manner and function by disrupting or maintaining the ER functions. The ER-targeting nanodrugs have a wide application prospect in cancer therapy, immune regulation, nervous system repairment, and so on.
Keywords: endoplasmic reticulumnanodrugmolecular self-assemblynanocarriercancer
内质网(Endoplasmic reticulum,ER) 作为真核细胞中极为重要的膜性细胞器之一,是蛋白折叠与转运、脂质合成、囊泡运输、钙离子储存的主要场所,并且参与多种信号转导途径的调控过程[1-2]。不仅如此,内质网还通过其发达的延伸结构,建立与质膜、线粒体、内吞体、溶酶体等其他膜性结构的连接位点,在胞内细胞器及质膜的信息、物质及能量交流过程中扮演重要角色[3-5]。鉴于内质网对真核细胞生长代谢过程的极端重要性,其结构与功能的紊乱将对真核细胞及生物机体产生重大影响。大量研究发现,内质网功能紊乱与迄今发现的众多人类重大疾病,如癌症、自身免疫疾病、病原微生物感染、神经退行性疾病、糖尿病等均存在紧密联系。随着精准医学理论与技术的不断发展,开发具有精准内质网靶向的药物成为预防与攻克相关疾病的重要趋势[6-8]。
纳米材料是指3个维度内至少有一个维度处于纳米尺度(100 nm以下) 的材料,以及这些材料形成的组装体[9]。纳米材料可通过自下而上的原子/分子聚集方法,或者自上而下的物料破碎方法而制备[10]。由于纳米材料具有卓越的表面活性、可修饰性、结构可调节性、组织渗透性等性能,其在生物医药领域具有广泛的应用前景[11-13]。随着纳米技术的不断发展,纳米药物逐渐成为生物工程及材料化学研究关注的热点。越来越多的研究着眼于整合无机化学、有机化学、物理化学、合成生物学的原理与技术,得到具有特定生物活性的纳米药物,进而拓展纳米药物在人类重大疾病的诊断、预防及治疗中的应用。
在纳米药物表面进行靶向性修饰,可得到靶向纳米药物。与传统药物相比,靶向纳米药物除了保护非特异性化合物不被降解外,还克服了药物简单胞质内化存在的许多问题,如造成亚细胞器毒性、药物使用剂量过高等。由于许多疾病都与细胞器和亚细胞结构的损伤有关,因此靶向特定细胞器有助于细胞代谢紊乱和人类疾病的治疗[14-25]。
由于内质网功能异常与人类的诸多重大疾病存在紧密联系,因此,开发内质网靶向纳米药物有着极其重要的意义[26]。这类药物基于在纳米载体及药物自组装体表面共价修饰或非共价嵌合内质网靶向分子而设计,能够特异性靶向内质网并调节该细胞器的功能,从而达到治疗相关疾病的目的。
1 内质网功能与疾病发生1.1 内质网的结构与功能内质网是由单层膜包裹的腔结构。内质网膜与细胞核外膜是连续的,实现了核腔与内质网腔的相互联系。内质网一般分为粗糙内质网(Rough endoplasmic reticulum,RER)和光滑内质网(Smooth endoplasmic reticulum,SER),分别取决于膜胞质表面核糖体的存在与否。SER和RER既可相互连接,也可以作为空间分离的隔间存在。细胞器之间的接触位点对于胞内物质交流、细胞完整性维持至关重要,而这些接触位点大多是由内质网与其他细胞器或膜结构的接触而形成的。据此,内质网可细分为多种功能膜区,如线粒体相关的内质网膜(Mitochondria-associated ER membranes,MAMs)、内质网质量控制室(ER quality-control compartment,ERQC)、内质网释放位点(ER exit Sites,ERES) 和质膜相关膜(Plasma membrane-associated membranes,PAMs)[27-28]。粗糙内质网参与蛋白质的合成、折叠、糖基化修饰、分泌和降解等诸多过程;光滑内质网与脂质合成、碳水化合物代谢和钙离子储存紧密相关。考虑到内质网功能的多样性与重要性,其结构与功能的紊乱可能对细胞产生严重甚至致死的影响[27]。
1.2 内质网压力与内质网压力应答蛋白质在内质网腔内的正常折叠对于众多蛋白质的功能至关重要。蛋白质折叠对内质网腔内环境的改变极为敏感,钙离子水平波动、氧化还原状态变化、营养缺乏、蛋白质合成速度的增加以及病原菌感染或炎症信号刺激等因素均能使蛋白质的正常折叠过程紊乱,导致非折叠或错误折叠蛋白的积累,从而造成内质网压力。
为缓解内质网压力给细胞生理过程造成的损伤,真核细胞进化出保守的内质网压力应答机制,即非折叠蛋白应答(Unfolded protein response,UPR)[29]。在该应答过程中,非折叠蛋白与内质网腔中的免疫球蛋白重链结合蛋白(Immunoglobulin heavy-chain binding protein,BIP,即GRP78/HSP5A)结合,导致自由型BIP水平降低。这种结合具有两种功能:一方面,BIP将非折叠蛋白转变为可折叠状态,便于GRP94等其他伴随物的重新折叠或从内质网中释放而得以降解;另一方面,BIP与非折叠蛋白的结合导致该蛋白分别从定位于内质网膜的3种信号蛋白上解离,UPR下游通路得以激活。UPR由此分为3个分支途径:1) 肌醇必需蛋白1α (Inositol requiring enzyme 1,IRE1α)-X盒结合蛋白1 (X-box binding protein 1,XBP1) 途径;2) 激活型转录因子6α (Activating transcription factor 6α,ATF6α) 途径;3) PRKR样内质网激酶(PRKR-like ER kinase,PERK)-真核翻译延伸因子2α (Eukaryotic translation initiation factor 2α,eIF2α) 途径(图 1)。UPR的激活最终增强蛋白质折叠、转运以及内质网相关蛋白降解(ER-associated degradation,ERAD)等细胞生物学过程,同时降低蛋白合成[29]。如果内质网压力长时间得不到缓解,细胞将启动凋亡途径,诱发细胞死亡。此外,未折叠蛋白还可以通过BIP非依赖性的方式调节UPR过程[30-33]。
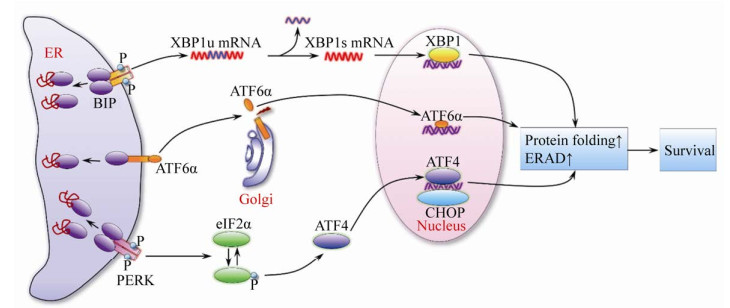 |
| 图 1 UPR途径的组成与激活示意图[29] Fig. 1 The composition and activation of UPR pathway[29]. |
| 图选项 |
除UPR外,细胞还通过ERAD途径缓解内质网压力。在该途径中,错误折叠蛋白被内质网降解增强α-甘露糖苷酶样蛋白(ER degradation- enhancing alpha-mannosidase-like Protein,EDEM) 家族蛋白捕获,后者介导错误折叠蛋白的反向易位及蛋白酶体降解过程[29]。
1.3 内质网功能紊乱与疾病发生的关系1.3.1 内质网功能紊乱与癌症的关系在抗肿瘤过程中,内质网压力诱导剂会导致内质网压力过度增强,从而诱导癌细胞死亡。然而,内质网压力将激活癌细胞的UPR,提高细胞对逆境的耐受能力。因此,抑制UPR激活可使癌细胞对其他疗法更为敏感,从而增强后者的抗肿瘤效果。内质网压力诱导剂和UPR抑制药物的联合使用可能是最有前途的抗癌方法之一[29]。
1.3.2 内质网功能紊乱与自身免疫疾病的关系炎症信号可以导致内质网压力进而触发内质网压力应答,通过上调相关分子的表达而引发自身免疫性疾病[34-35]。此外,炎症信号在自身免疫性疾病中,参与抗原识别过程、MHC Ⅰ/Ⅱ类及免疫球蛋白链的折叠和装配以及导致MHC肽加载的质量控制蛋白表达发生改变或耐受性丧失[34-37]。
1.3.3 内质网功能紊乱与病原微生物感染的关系大多数已知病原体的感染都能激活UPR。由于内质网压力与自噬或凋亡相关,病原体对内质网功能的调节可以导致病原体的存活、复制或清除。虽然关于UPR在病毒和细菌感染发病机制中的作用知之甚少,但内质网压力的调控在难治性传染病中十分重要[38]。
1.3.4 内质网功能紊乱与神经退行性疾病的关系阿尔兹海默病是一种典型的神经退行性疾病。阿尔兹海默病的内质网压力水平异常,导致突触功能障碍和神经退行性疾病。此外,UPR与阿尔兹海默病的主要特征紧密相关,例如异常蛋白聚集、细胞压力和突触功能下降等[39-41]。
2 内质网靶向纳米药物的设计原理鉴于内质网功能紊乱与诸多疾病的发生发展存在紧密联系,内质网靶向药物的开发将为内质网相关疾病的精准治疗奠定重要基础。随着纳米技术的不断发展,内质网靶向纳米药物应运而生。该类药物是通过纳米技术,将内质网功能调节药物制备成内质网靶向的纳米颗粒或其他纳米形态,进而通过药物与内质网的相互作用,实现治疗内质网相关疾病的目的。
2.1 内质网靶向纳米药物的制备方法纳米药物载体负载与生物活性分子自组装是制备内质网靶向纳米药物的两种主要方法(图 2)。纳米药物载体负载是将具有内质网功能调节作用的药物通过非共价相互作用或者通过共价修饰作用负载于纳米药物载体,从而实现药物的纳米化,以及药物的高效靶向递送与释放。常用的纳米药物载体包括无机纳米材料(如介孔硅、氧化铝纳米棒等)、脂质体、纳米胶束、高分子聚合物、超分子组装体等。例如,介孔硅用于负载引起内质网压力的阿霉素[42];氧化铝纳米棒用于负载内质网钙泵抑制剂毒胡萝卜素(Thapsigargin) 及自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)[43];聚乙丙交酯[Poly (DL-lactide-co-glycolide) polymer,PLGA]、γ-聚谷氨酸[Poly(γ-glutamic acid),PGA] 用于负载多肽抗原[44-45]。
 |
| 图 2 内质网靶向纳米药物制备的示意图 Fig. 2 Illustration of preparation of ER-targeting nanodrug. (A) Nanocarrier-based preparation of the nanodrugs. (B) Molecular assembly-based preparation of the nanodrugs. |
| 图选项 |
生物活性分子自组装是内质网功能调节药物不通过纳米药物载体的负载作用,而通过非共价或共价作用力自组装形成特定的纳米形态。例如,由两亲性喹喔啉衍生物与Fmoc修饰的RACR多肽共价连接的Quino-1-Fmoc-RACR自组装形成具有内质网靶向及内质网成像能力的纳米粒子[46];聚乙二醇化磷脂酰乙醇胺[Poly(ethylene glycol)-phosphoethanolamine,PEG-PE] 自组装形成具有内质网靶向和内质网压力诱导能力的胶束[47];三取代三嗪与5-氟尿嘧啶通过氢键自组装形成内质网靶向性的纳米粒子[48];四对甲苯磺酰胺乙胺酰苯基卟啉与磷脂酰聚乙二醇共组装形成具有内质网靶向性的纳米粒子[49]。
2.2 内质网靶向纳米药物的内质网靶向原理纳米药物由全身给药(如静脉注射) 后,需要历经体内系统性运输、靶向细胞膜、细胞内吞、内吞体逃逸、内质网靶向等步骤(图 3),才能在靶细胞内质网中发生积累并发挥作用[26, 50]。
 |
| 图 3 内质网靶向纳米药物特异性靶向肿瘤内质网的过程示意图[26, 50] Fig. 3 Illustration of specific targeting of ER-targeting nanodrug to the tumor ER[26, 50]. |
| 图选项 |
2.2.1 体内系统性运输当纳米颗粒以静脉注射方式进入机体后,需要经历血液循环到达目标组织与细胞。然而,纳米颗粒很容易被免疫系统视为入侵者,并且被肝脏、脾脏或网状内皮系统(Reticuloendothelial system,RES) 排除,从而迅速丧失功能[26, 50]。
纳米颗粒可通过增强通透性与滞留(Enhanced permeability and retention,EPR) 效应被动积聚在肿瘤部位[51]。肿瘤血管内皮的穿孔允许大分子或纳米颗粒进入肿瘤组织,导致增强通透性效应;此外,肿瘤组织中淋巴系统的缺陷降低了肿瘤间质中高分子化合物、纳米颗粒的清除,从而产生滞留效应[50, 52]。在临床前研究中,EPR效应已被广泛接受并被证明是一种有效的将纳米颗粒送到肿瘤部位的策略[51],但其递送作用一直存在重大争议[53]。
2.2.2 靶向细胞膜纳米药物通过非特异性或特异性作用与细胞膜结合。在纳米药物与细胞的非特异性作用中,范德华力引起的分子电偶极矩,以及大分子周围细胞的密度梯度产生渗透压诱导的细胞聚合,均可促进或降低其相互结合。促进纳米药物与细胞结合的作用包括疏水力、氢键、非极性聚集或水合作用等。
纳米药物与细胞膜的特异性结合是通过与膜受体或抗原结合的配体来实现的。最常见的配体是多肽、叶酸、内皮生长因子、转铁蛋白、透明质酸以及针对肿瘤细胞抗原的单克隆抗体或Fab片段。设计主动靶向纳米药物主要考虑粒子表面配体的密度、细胞的选择性及稳定性等[50]。
2.2.3 细胞内吞纳米药物通常以内吞作用进入细胞。在该过程中,与纳米颗粒接触或结合的膜区域内陷或折叠,在胞质侧形成囊袋,后者进而脱离质膜形成囊泡。内吞作用分为吞噬作用和胞饮作用[50, 54]。吞噬作用特异性发生于单核吞噬细胞系统中,即巨噬细胞、组织细胞、破骨细胞、库普弗细胞、中性粒细胞等。在吞噬过程中,含货物的囊泡以吞噬体的形式从细胞质膜萌发并进入胞质,随后直径大于500 nm的囊泡逐渐酸化并与溶酶体融合,由此将货物释放到溶酶体进行降解[54]。胞饮作用是肿瘤细胞及大多数体细胞内化纳米颗粒的主要方式。根据参与蛋白种类的不同,胞饮作用分为网格蛋白介导的内吞作用、小凹蛋白介导的内吞作用等[54]。
网格蛋白介导的内吞作用是纳米颗粒内吞的主要机制。参与这一过程的蛋白招募货物形成网格蛋白包被的凹陷,然后形成网格蛋白包被的囊泡[54]。网格蛋白聚合(与其他蛋白质的作用相结合) 有助于囊泡颈的形成和收缩,帮助将环绕颈部的膜带靠近。膜分离蛋白动力蛋白是一种大型的GTPase,它在收缩的颈部周围形成螺旋状聚合物,在GTP水解后介导质膜囊的裂变,不可逆地将网格蛋白包被的囊泡释放到细胞内部[54]。随后内吞体介导货物从质膜转移到溶酶体进行降解。内吞体膜质子泵V-ATPase介导质子从胞质向内吞体腔的逆浓度梯度转运,导致内吞体中pH值下降。随着内吞体成熟,早期内吞体(pH 6.2–6.3) 逐渐转变为后期内吞体(pH 5.0–5.5)。晚期内吞体最终与含有降解酶的溶酶体融合(pH 4.8–5.4)。纳米药物如果无法从内吞体中逃逸,最终将在富含酶的溶酶体中被降解[50]。因此,对于经网格蛋白介导的内吞作用进入细胞的内质网靶向纳米药物来说,从内吞体逃逸是关键的一步。
小凹蛋白介导的内吞作用起始于小凹蛋白引发质膜的亚结构域形成小泡,即瓶状质膜内陷。质膜内陷直径约为50–80 nm,富含胆固醇、鞘脂和完整的膜蛋白[54]。对于内吞体以外的胞内靶向转运途径而言,小凹蛋白介导的内吞作用对纳米药物的摄取被认为是最有前途的。这是由于以吞噬作用和网格蛋白介导的内吞作用均经历从内吞体到溶酶体的胞内过程,货物将有可能被最终降解,而经小凹蛋白介导的内吞作用进入胞内的货物则逃脱了内吞体途径的命运[26, 54-58]。研究发现,小凹蛋白介导的内吞作用参与叶酸、碱性磷酸酶、血清白蛋白、霍乱毒素和病毒(HIV、猿类病毒、多瘤病毒、埃可病毒1) 等的内化[26]。
2.2.4 内吞体逃逸经吞噬作用或网格蛋白介导的内吞作用进入细胞的纳米药物一般不能直接穿过内吞体膜,需要在纳米药物表面引入膜穿透肽、阳离子两亲性肽、融合肽、pH缓冲聚合物和融合性脂质等破坏内吞体膜,才能促进纳米药物从内吞体向胞质释放,进而靶向内质网。这些过程也促进了微管驱动的通路,使纳米药物能够从早期内吞体逃逸,或者通过COPI囊泡诱导的逆向转运途径,经高尔基体转运到内质网,从而使纳米药物得以绕过溶酶体降解途径[26, 50, 57-58]。
2.2.5 内质网靶向纳米药物的内质网靶向机制分为主动靶向和被动靶向两种。在主动内质网靶向过程中,经吞噬作用或网格蛋白介导的内吞作用进入细胞的纳米药物从内吞体或溶酶体释放后,通过特定的内质网靶向分子或基团主动靶向内质网。在被动内质网靶向过程中,经选择性内吞途径(如小凹蛋白介导的内吞作用) 进入细胞的纳米药物通过胞内转运过程直接被动的靶向内质网。
目前已开发出的介导主动内质网靶向的分子或基团有:KKXX信号肽(如KKAA)[44]、内质网插入信号序列Eriss (MRYMILGLLALAAVCSA)[45]、RACR多肽[46]、脂酰乙醇胺(Phosphoethanolamine,PE)[47]、对甲苯磺酰胺(N-tosylethylenediamine)[48]等(图 4)。例如,Shi等将Fmoc修饰的Fmoc-RACR多肽与喹喔啉衍生物通过共价连接形成两亲性化合物Quino-1-Fmoc-RACR,该化合物能够形成聚集诱导发光的组装体,特异性靶向内质网并进行内质网成像[46]。
 |
| 图 4 介导主动内质网靶向过程的分子或基团 Fig. 4 Molecules and groups mediating active ER targeting. |
| 图选项 |
被动内质网靶向能够实现将特定形态(如纳米棒) 的纳米药物载体直接运送到内质网[42-43],或者将内质网脂质体递送到内质网或内质网相关膜[55]。例如:Pollock等报道了靶向内质网和内质网相关膜的脂质体,这也是第一类靶向于除溶酶体外的特定细胞亚结构域的脂质体。内质网脂质体能够将亲脂性药物/标记直接插入内质网膜,避免了内吞体途径的降解和内吞体逃逸过程,特别适合脂质和亲脂性药物进入人类细胞内质网的长时间递送。抗病毒药物亚氨基糖的递送即可通过内质网脂质体而实现[55]。
3 内质网靶向纳米药物的应用3.1 内质网靶向纳米药物在癌症靶向治疗中的应用由于内质网功能及内质网压力应答与癌症的发生发展存在紧密联系,研究者们通过设计各种类型的内质网靶向纳米药物,以载体/药物自身或光响应原理诱导肿瘤细胞产生严重的内质网压力,或者阻断其内质网压力应答过程,从而实现癌症靶向治疗的目的。
通过内质网靶向纳米载体或其负载的药物引发内质网压力,是内质网靶向纳米药物杀死肿瘤细胞的重要机制。通过药物负载及分子自组装方法,人们构建出一系列具有高效抗肿瘤效应的内质网靶向纳米药物,如:聚乙二醇化磷脂酰乙醇胺(PEG-PE) 胶束[47],负载2-脱氧葡萄糖、光敏剂和化疗药物的葡聚糖载体[59],基于三取代三嗪和5-氟尿嘧啶的超分子自组装纳米粒子[48],含有pH敏感肽及DM1毒素的维生素脂质纳米囊泡[60],肿瘤细胞膜包覆并负载阿霉素的介孔硅纳米棒[42],负载自噬抑制剂3-甲基腺嘌呤和内质网压力诱导剂毒胡萝卜素的氧化铝纳米棒[43],内质网膜修饰负载siRNA的阳离子载体(Cv/siRNA)[58]等。
光响应内质网靶向纳米药物是近年来该领域的研究热点。例如,四对甲苯磺酰胺乙胺酰苯基卟啉与磷脂酰聚乙二醇进行共组装,构建出近红外光响应的纳米组装体,实现内质网区域的活性氧(Reactive oxygen species,ROS) 富集,从而诱导肿瘤细胞死亡[49]。Bao等制备出具有良好光热转化及内质网靶向性能的金属掺杂碳纳米棒,适用于荧光/光声/热三模态成像引导的光热治疗[61]。
3.2 内质网靶向纳米药物在免疫调节中的应用内质网靶向纳米药物可以作为疫苗的递送体系,增强免疫细胞对多肽抗原的加工与递呈能力,提高疫苗的作用效果。在免疫细胞中,内质网靶向纳米药物对内质网功能的调节主要体现在抗原递呈及免疫因子释放[62]。为了产生有效的抗原递呈作用,多肽抗原需要到达发生抗原交叉表达过程的细胞器。内质网是MHC Ⅰ类递呈途径主要的多肽抗原装载位点,因此将多肽抗原高效传递到内质网可以显著提高其交叉递呈效率[44]。纳米载体作为一种新型的疫苗载体,能够促进表位MHC Ⅰ复合体的形成[63]。例如:Sneh-Edri等在聚乙丙交酯纳米颗粒中封装多肽抗原抗源性肽,同时在表面修饰内质网靶向肽KKXX,使纳米颗粒得以高效靶向树突状细胞的内质网,从而延长了多肽抗原的交叉递呈时间[44]。Matsuo等基于内质网插入信号序列和融合源脂质体,将封装的抗肿瘤细胞毒性T淋巴细胞(Cytotoxic T lymphocytes,CTLs) 表位肽引入抗原呈递细胞的MHC Ⅰ类通路,提高了抗原呈递效率,增强了体内肿瘤免疫的诱导作用[45]。此外,内质网靶向的γ-聚谷氨酸纳米颗粒可作为优良疫苗载体,诱导高效的交叉表达,从而在体内产生强大的抗肿瘤免疫特性[64-65]。Zitzmann等开发出具有内质网靶向性的多不饱和内质网脂质体(Polyunsaturated ER-targeting liposomes,PERLs),通过降低细胞胆固醇而发挥抗病毒及免疫调节活性[66-67]。
4 总结与展望鉴于内质网功能紊乱与人类诸多疾病的发生发展紧密相关,内质网靶向纳米药物的开发日益成为纳米靶向药物开发的研究热点。通过纳米药物载体负载或生物活性分子自组装的方法,同时引入内质网靶向分子或基团,实现内质网功能调节药物的纳米化及高效靶向递送,成为内质网靶向纳米药物设计的基本策略。这些纳米药物在癌症靶向治疗、免疫调节、疫苗开发等方面具有广泛的应用前景。
然而,迄今对内质网靶向药物的研究尚处于起始阶段,有许多科学问题亟待解决。一方面,目前开发出的内质网主动靶向分子种类和数量非常有限。这些主动靶向分子难以满足构建多功能内质网靶向纳米药物的需要。不仅如此,这些分子介导的内质网靶向机制尚未明确,从而阻碍了靶向分子的理性设计与优化进程。因此,后续需要在新型内质网主动靶向分子的开发及作用机制探究方面开展深入研究。另一方面,尽管科学家们开始尝试将内质网靶向纳米药物应用于肿瘤靶向治疗、免疫调节等领域,但开展的工作十分有限,相关成果与临床应用之间仍存在很大距离。在后续研究中,人们将进一步拓展内质网靶向药物在肿瘤免疫治疗、多功能疫苗研发、肥胖及糖尿病治疗等方面的应用,尤其是在内质网靶向纳米药物的生物安全性与稳定性评价、靶向效果优化以及给药方式探索等方面开展深入研究。随着后续工作的开展,内质网靶向纳米药物势必将与线粒体靶向纳米药物、细胞核靶向纳米药物一起,成为亚细胞器靶向纳米药物研发与应用的主要方向。
参考文献
| [1] | 王娟, 徐文娟, 王信文, 等. 内质网在纳米材料毒性效应形成中的作用及机制. 生物化学与生物物理进展, 2019, 46(1): 20-31. Wang J, Xu WJ, Wang XW, et al. The role of endoplasmic reticulum in introducing nano-toxicology and the mechanism involved. Prog Biochem Biophys, 2019, 46(1): 20-31 (in Chinese). |
| [2] | 刘百里. 细胞的起源和进化(二). 生物学通报, 1998, 33(7): 18-19. Liu BL. The origin and evolution of cell (Ⅱ). Bull Biol, 1998, 33(7): 18-19 (in Chinese). |
| [3] | Lee JE, Cathey PI, Wu HX, et al. Endoplasmic reticulum contact sites regulate the dynamics of membraneless organelles. Science, 2020, 367(6477): eaay7108. DOI:10.1126/science.aay7108 |
| [4] | Saheki Y, de Camilli P. Endoplasmic reticulum-plasma membrane contact sites. Ann Rev Biochem, 2017, 86: 659-684. DOI:10.1146/annurev-biochem-061516-044932 |
| [5] | Almeida C, Amaral MD. A central role of the endoplasmic reticulum in the cell emerges from its functional contact sites with multiple organelles. Cell Mol Life Sci, 2020. DOI:10.1007/s00018-020-03523-w |
| [6] | Wang M, Kaufman RJ. Protein misfolding in the endoplasmic reticulum as a conduit to human disease. Nature, 2016, 529(7586): 326-335. DOI:10.1038/nature17041 |
| [7] | Marciniak SJ. Endoplasmic reticulum stress: a key player in human disease. FEBS J, 2019, 286(2): 228-231. DOI:10.1111/febs.14740 |
| [8] | Xiang CC, Wang YJ, Zhang H, et al. The role of endoplasmic reticulum stress in neurodegenerative disease. Apoptosis, 2017, 22(1): 1-26. DOI:10.1007/s10495-016-1296-4 |
| [9] | D'Mello SR, Cruz CN, Chen ML, et al. The evolving landscape of drug products containing nanomaterials in the United States. Nat Nanotechnol, 2017, 12(6): 523-529. DOI:10.1038/nnano.2017.67 |
| [10] | Byrappa K, Ohara S, Adschiri T. Nanoparticles synthesis using supercritical fluid technology- towards biomedical applications. Adv Drug Deliver Rev, 2008, 60(3): 299-327. DOI:10.1016/j.addr.2007.09.001 |
| [11] | 刘君, 许银银, 李萌, 等. 纳米药物的研究进展. 药学与临床研究, 2020(1): 51-55. Liu J, Xu YY, Li M, et al. Research Progress of nanomedicine. Pharmaceut Clin Res, 2020(1): 51-55 (in Chinese). |
| [12] | Mitragotri S, Anderson DG, Chen XY, et al. Accelerating the translation of nanomaterials in biomedicine. ACS Nano, 2015, 9(7): 6644-6654. DOI:10.1021/acsnano.5b03569 |
| [13] | Farnoud1 AM. Nano-bio interactions in drug delivery. Phys Biol, 2020, 17(5): 050201. DOI:10.1088/1478-3975/aba63b |
| [14] | Hassan S, Prakash G, Bal Ozturk A, et al. Evolution and clinical translation of drug delivery nanomaterials. Nano Today, 2017, 15: 91-106. DOI:10.1016/j.nantod.2017.06.008 |
| [15] | Oladimeji O, Akinyelu J, Singh M. Nanomedicines for subcellular targeting: the mitochondrial perspective. Curr Med Chem, 2019, 27(33): 5480-5509. |
| [16] | Malhi SS, Murthy RSR. Delivery to mitochondria: a narrower approach for broader therapeutics. Expert Opin Drug Deliv, 2012, 9(8): 909-935. DOI:10.1517/17425247.2012.694864 |
| [17] | Zhang XY, Zhang PY. Mitochondria targeting nano agents in cancer therapeutics. Oncol Lett, 2016, 12(6): 4887-4890. DOI:10.3892/ol.2016.5302 |
| [18] | 王娟, 王妹梅, 王晶晶, 等. 线粒体在纳米毒性效应中的作用及其机制研究进展. 应用与环境生物学报, 2015, 21(4): 579-589. Wang J, Wang MM, Wang JJ, et al. Review on the role of mitochondria in nano-toxicology. Chin J Appl Environ Biol, 2015, 21(4): 579-589 (in Chinese). |
| [19] | Hammond PT. Nano tools pave the way to new solutions in infectious disease. ACS Infect Dis, 2017, 3(8): 554-558. DOI:10.1021/acsinfecdis.7b00104 |
| [20] | Yu QL, Zhang YM, Liu YH, et al. Magnetism and photo dual-controlled supramolecular assembly for suppression of tumor invasion and metastasis. Sci Adv, 2018, 4(9): eaat2297. DOI:10.1126/sciadv.aat2297 |
| [21] | Ghosh C, Nandi A, Basu S. Lipid nanoparticle-mediated induction of endoplasmic reticulum stress in cancer cells. ACS Appl Bio Mater, 2019, 2(9): 3992-4001. DOI:10.1021/acsabm.9b00532 |
| [22] | Gao P, Pan W, Li N, et al. Boosting cancer therapy with organelle-targeted nanomaterials. ACS Appl Mater Interfaces, 2019, 11(30): 26529-26558. DOI:10.1021/acsami.9b01370 |
| [23] | Liu MY, Lu Y, Yu QL, et al. In situ assembly of magnetic nanocrystals/graphene oxide nanosheets on tumor cells enables efficient cancer therapy. Nano Res, 2020, 13(4): 1133-1140. DOI:10.1007/s12274-020-2759-z |
| [24] | Song J, Lin CC, Yang X, et al. Mitochondrial targeting nanodrugs self-assembled from 9-O-octadecyl substituted berberine derivative for cancer treatment by inducing mitochondrial apoptosis pathways. J Control Release, 2019, 294: 27-42. DOI:10.1016/j.jconrel.2018.11.014 |
| [25] | Zhang B, Yu QL, Zhang YM, et al. Two-dimensional supramolecular assemblies based on β-cyclodextrin-grafted graphene oxide for mitochondrial dysfunction and photothermal therapy. Chem Commun, 2019, 55(81): 12200-12203. DOI:10.1039/C9CC05727G |
| [26] | Ma XW, Gong NQ, Zhong L, et al. Future of nanotherapeutics: Targeting the cellular sub-organelles. Biomaterials, 2016, 97: 10-21. DOI:10.1016/j.biomaterials.2016.04.026 |
| [27] | Depaoli MR, Hay JC, Graier WF, et al. The enigmatic ATP supply of the endoplasmic reticulum. Biol Rev, 2019, 94(2): 610-628. DOI:10.1111/brv.12469 |
| [28] | Almanza A, Carlesso A, Chintha C, et al. Endoplasmic reticulum stress signalling-from basic mechanisms to clinical applications. FEBS J, 2019, 286(2): 241-278. DOI:10.1111/febs.14608 |
| [29] | Wang M, Kaufman RJ. The impact of the endoplasmic reticulum protein-folding environment on cancer development. Nat Rev Cancer, 2014, 14(9): 581-597. DOI:10.1038/nrc3800 |
| [30] | Kudo T, Katayama T, Imaizumi K, et al. The unfolded protein response is involved in the pathology of Alzheimer's disease. Ann N Y Acad Sci, 2002, 977(1): 349-355. DOI:10.1111/j.1749-6632.2002.tb04837.x |
| [31] | Lin WS, Stone S. Unfolded protein response in myelin disorders. Neural Regen Res, 2020, 15(04): 636-645. DOI:10.4103/1673-5374.266903 |
| [32] | Hughes D, Mallucci GR. The unfolded protein response in neurodegenerative disorders-therapeutic modulation of the PERK pathway. FEBS J, 2019, 286(2): 342-355. DOI:10.1111/febs.14422 |
| [33] | Kadowaki H, Nishitoh H. Endoplasmic reticulum quality control by garbage disposal. FEBS J, 2019, 286(2): 232-240. DOI:10.1111/febs.14589 |
| [34] | 牛春雪, 马蕾, 薛海波, 等. Notch1信号通路参与自身免疫性疾病发病机制的研究进展. 现代免疫学, 2020, 40(1): 67-71. Niu CX, Ma L, Xue HB, et al. Research progress on the involvement of Notch1 signaling pathway in the pathogenesis of autoimmune disease. Curr Immunol, 2020, 40(1): 67-71 (in Chinese). |
| [35] | Liu Q, K?rner H, Wu HX, et al. Endoplasmic reticulum stress in autoimmune diseases. Immunobiology, 2020, 225(2): 151881. DOI:10.1016/j.imbio.2019.11.016 |
| [36] | Woodward AM, Di Zazzo A, Bonini S, et al. Endoplasmic reticulum stress promotes inflammation-mediated proteolytic activity at the ocular surface. Sci Rep, 2020, 10: 2216. DOI:10.1038/s41598-020-59237-3 |
| [37] | Barrera MJ, Aguilera S, Castro I, et al. Endoplasmic reticulum stress in autoimmune diseases: Can altered protein quality control and/or unfolded protein response contribute to autoimmunity? A critical review on Sj?gren's syndrome. Autoimmun Rev, 2018, 17(8): 796-808. DOI:10.1016/j.autrev.2018.02.009 |
| [38] | Choi JA, Song CH. Insights into the role of endoplasmic reticulum stress in infectious diseases. Front Immunol, 2019, 10: 3147. |
| [39] | 薛小燕, 郭小华, 李敏, 等. 神经退行性疾病发病机制研究进展. 中国老年学杂志, 2015, 10(11): 3149-3151, 3152. Xue XY, Guo XH, Li M, et al. Progression in the pathogenesis of neurodegenerative diseases. Chin J Gerontol, 2015, 10: 3149-3151, 3152 (in Chinese). DOI:10.3969/j.issn.1005-9202.2015.11.133 |
| [40] | Duggan M, Torkzaban B, Ahooyi TM, et al. Age-related neurodegenerative diseases. Neural Regen Res, 2020, 235(4): 3131-3141. |
| [41] | Gerakis Y, Hetz C. Emerging roles of ER stress in the etiology and pathogenesis of Alzheimer's disease. FEBS J, 2018, 285(6): 995-1011. DOI:10.1111/febs.14332 |
| [42] | Zhang W, Yu MR, Xi ZY, et al. Cancer cell membrane-camouflaged nanorods with endoplasmic reticulum targeting for improved antitumor therapy. ACS Appl Mater Interfaces, 2019, 11(50): 46614-46625. DOI:10.1021/acsami.9b18388 |
| [43] | Wang Y, Kaur G, Chen YT, et al. Bioinert anodic alumina nanotubes for targeting of endoplasmic reticulum stress and autophagic signaling: a combinatorial nanotube-based drug delivery system for enhancing cancer therapy. ACS Appl Mater Interfaces, 2015, 7(49): 27140-27151. DOI:10.1021/acsami.5b07557 |
| [44] | Sneh-Edri H, Likhtenshtein D, Stepensky D. Intracellular targeting of PLGA nanoparticles encapsulating antigenic peptide to the endoplasmic reticulum of dendritic cells and its effect on antigen cross-presentation in vitro. Mol Pharmaceutics, 2011, 8(4): 1266-1275. DOI:10.1021/mp200198c |
| [45] | Matsuo K, Yoshikawa T, Oda A, et al. Efficient generation of antigen-specific cellular immunity by vaccination with poly (γ-glutamic acid) nanoparticles entrapping endoplasmic reticulum-targeted peptides. Biochem Biophys Res Commun, 2007, 362(4): 1069-1072. DOI:10.1016/j.bbrc.2007.08.112 |
| [46] | Shi LL, Gao XH, Yuan WZ, et al. Endoplasmic reticulum-targeted fluorescent nanodot with large stokes shift for vesicular transport monitoring and long-term bioimaging. Small, 2018, 14(25): 1800223. DOI:10.1002/smll.201800223 |
| [47] | Wang J, Fang XC, Liang W. Pegylated phospholipid micelles induce endoplasmic reticulum-dependent apoptosis of cancer cells but not normal cells. ACS Nano, 2012, 6(6): 5018-5030. DOI:10.1021/nn300571c |
| [48] | Ghosh C, Nandi A, Basu S. Supramolecular self-assembly of triazin-based small molecules: targeting the endoplasmic reticulum in cancer cells. Nanoscale, 2019, 11(7): 3326-3335. DOI:10.1039/C8NR08682F |
| [49] | Deng HZ, Zhou ZJ, Yang WJ, et al. Endoplasmic reticulum targeting to amplify immunogenic cell death for cancer immunotherapy. Nano Lett, 2020, 20(3): 1928-1933. DOI:10.1021/acs.nanolett.9b05210 |
| [50] | Li YH, Wang J, Wientjes MG, et al. Delivery of nanomedicines to extracellular and intracellular compartments of a solid tumor. Adv Drug Deliv Rev, 2012, 64(1): 29-39. DOI:10.1016/j.addr.2011.04.006 |
| [51] | Goos JACM, Cho A, Carter LM, et al. Delivery of polymeric nanostars for molecular imaging and endoradiotherapy through the enhanced permeability and retention (EPR) effect. Theranostics, 2020, 10(2): 567-584. DOI:10.7150/thno.36777 |
| [52] | Liu YJ, Sun DD, Fan Q, et al. The enhanced permeability and retention effect based nanomedicine at the site of injury. Nano Res, 2020, 13(2): 564-569. DOI:10.1007/s12274-020-2655-6 |
| [53] | Nel A, Ruoslahti E, Meng H. New insights into "Permeability" as in the enhanced permeability and retention effect of cancer nanotherapeutics. ACS Nano, 2017, 11(10): 9567-9569. DOI:10.1021/acsnano.7b07214 |
| [54] | Doherty GJ, McMahon HT. Mechanisms of endocytosis. Annu Rev Biochem, 2009, 78: 857-902. DOI:10.1146/annurev.biochem.78.081307.110540 |
| [55] | Pollock S, Antrobus R, Newton L, et al. Uptake and trafficking of liposomes to the endoplasmic reticulum. FASEB J, 2010, 24(6): 1866-1878. DOI:10.1096/fj.09-145755 |
| [56] | Patel S, Kim J, Herrera M, et al. Brief update on endocytosis of nanomedicines. Adv Drug Deliver Rev, 2019, 144: 90-111. |
| [57] | 孙晓译, 魏丽丽, 陈海靓, 等. 纳米载体细胞器靶向的研究进展. 药学学报, 2009, 44(8): 838-844. Sun XY, Wei LL, Chen HL, et al. Advances in the study of organelles targeting nanocarriers. Acta Pharm Sin, 2009, 44(8): 838-844 (in Chinese). |
| [58] | Qiu C, Han HH, Sun J, et al. Regulating intracellular fate of siRNA by endoplasmic reticulum membrane-decorated hybrid nanoplexes. Nat Commun, 2019, 10: 2702. |
| [59] | Dong M, Xiao XZ, Su ZG, et al. Light-induced ROS Generation and 2-DG-activated endoplasmic reticulum stress by antitumor nanosystems: an effective combination therapy by regulating the tumor microenvironment. Small, 2019, 15(17): 1900212. |
| [60] | Wang YQ, Ji MY, Wang C. Endoplasmic reticulum-targeted glutathione and pH dual responsive vitamin lipid nanovesicles for tocopheryl DM1 delivery and cancer therapy. Int J Pharm, 2020, 582: 119331. |
| [61] | Bao YW, Hua XW, Li YH, et al. Endoplasmic reticulum-targeted phototherapy using one-step synthesized trace metal-doped carbon-dominated nanoparticles: laser-triggered nucleolar delivery and increased tumor accumulation. Acta Biomater, 2019, 88: 462-476. |
| [62] | Amigorena S, Savina A. Intracellular mechanisms of antigen cross presentation in dendritic cells. Curr Opin Immunol, 2010, 22(1): 109-117. |
| [63] | Lynn GM, Sedlik C, Baharom F, et al. Peptide-TLR-7/8a conjugate vaccines chemically programmed for nanoparticle self-assembly enhance CD8 T-cell immunity to tumor antigens. Nat Biotechnol, 2020, 38(3): 320-332. |
| [64] | Mukai Y, Yoshinaga T, Yoshikawa M, et al. Induction of endoplasmic reticulum-endosome fusion for antigen cross-presentation induced by poly (γ-glutamic acid) nanoparticles. J Immunol, 2011, 187(12): 6249-6255. |
| [65] | Nieto-Orellana A, Li H, Rosière R, et al. Targeted PEG-poly (glutamic acid) complexes for inhalation protein delivery to the lung. J Control Release, 2019, 316: 250-262. |
| [66] | Pollock S, Nichita NB, B?hmer A, et al. Polyunsaturated liposomes are antiviral against hepatitis B and C viruses and HIV by decreasing cholesterol levels in infected cells. Proc Natl Acad Sci USA, 2010, 107(40): 17176-17181. |
| [67] | Miller JL, Lachica R, Sayce AC, et al. Liposome-mediated delivery of iminosugars enhances efficacy against dengue virus in vivo. Antimicrob Agents Chemother, 2012, 56(12): 6379-6386. |
