

1. 西南大学 园艺园林学院 南方山地园艺学教育部重点实验室,重庆 400715;
2. 重庆市蔬菜学重点实验室,重庆 400715
收稿日期:2020-04-28;接收日期:2020-06-15;网络出版时间:2020-06-23
基金项目:重庆市自然科学基金(Nos. cstc2019jcyj-zdxmX0022, cstc2019jcyj-msxmX0335),重庆市技术创新与应用发展专项(Nos.cstc2019jscx-gksbX0114, cstc2018jscx-mszdX0010)资助
摘要:WRKY转录因子是高等植物中最大的转录因子家族之一,参与植物多个生长发育进程,其调控网络复杂。WRKY12是具有典型代表性的WRKY家族成员。文中对WRKY12在多个生长发育过程中的最新调控机制进行了综述,并且比较了WRKY12与WRKY13之间的功能差异。这为深入研究WRKY12调控植物发育机制提供参考,也为探索WRKY家族其他成员自我调控以及WRKY家族因子之间的协同机制提供较为清晰的研究思路和借鉴策略。
关键词:WRKY12WRKY13生长发育分子机制
Molecular mechanism of WRKY12 in regulating plant development
Yue Dong1,2, Yuanda Wang1,2, Zhimin Wang1,2, Dayong Wei1,2, Qinglin Tang1,2


1. Key Laboratory of Horticulture Science for Southern Mountainous Regions, Ministry of Education, College of Horticulture and Landscape Architecture, Southwest University, Chongqing 400715, China;
2. Chongqing Key Laboratory of Olericulture, Chongqing 400715, China
Received: April 28, 2020; Accepted: June 15, 2020; Published: June 23, 2020
Supported by: Natural Science Foundation of Chongqing, China (Nos. cstc2019jcyj-zdxmX0022, cstc2019jcyj-msxmX0335), Technology Innovation and Application Development Project of CQ CSTC, China (Nos. cstc2019jscx-gksbX0114, cstc2018jscx-mszdX0010)
Corresponding author: Qinglin Tang. Tel: +86-23-68251274; E-mail: swutql@163.com.
Abstract: WRKY transcription factors are one of the largest families of transcription factors in higher plants and involved in regulating multiple and complex growth and development processes in plants. WRKY12 is a typical member of WRKY family. This article summarizes recent research progresses on the regulatory mechanism of WRKY12 in multiple growth and development processes, and analyzes the functional differences between WRKY12 and WRKY13. It provides a useful reference for further studying the molecular mechanism of WRKY12 in plant complex developments. It also provides clearer research ideas and reference strategies for exploring the self-regulation of other WRKY member and the mutual regulatory relationships between different WRKY family genes.
Keywords: WRKY12WRKY13developmentmolecular mechanism
WRKY转录因子是高等植物中最大的转录因子家族之一,在植物的种子萌发与休眠、开花、结果、抗逆和信号传导等过程中发挥着重要的作用。目前,WRKY转录因子通过其保守结构域与目的基因启动子区域的W-box特异性结合,从而激活或抑制目的基因的表达,进而参与植物的各个生命活动。WRKY12的N端具有保守的WRKYGQK功能域,C端含有1个C2H2结构域,是典型的WRKY家族Ⅱc亚族的成员,其调控植物多个生命活动的功能机制较为复杂。因此,本文主要针对WRKY12在植物多个生长发育过程中的最新调控机制进行较为系统地综述,同时对比分析WRKY13在相应过程中的反馈调节机制。希望能为WRKY12在发育调控中的精细作用机制研究提供参考,特别是为WRKY家族其他成员作用机制的深入探索提供一套较为全面的研究思路和借鉴策略。
1 WRKY12的蛋白结构、基因表达模式、亚细胞定位WRKY家族具有非常显著的结构特点,其蛋白结构基本含有1–2个WRKY结构域(为DNA结合域),该结构域约由60个高度保守的氨基酸残基组成,包括位于N端的WRKYGQK七肽序列和位于C端的锌指结构。位于N末端的WRKYGQK是保守的核心序列,位于C端的序列由C2H2或C2HC型锌指结构组成[1]。WRKY氨基酸残基也可能以WRRY、WSKY、WKRY、WVKY或WKKY等形式出现。根据WRKY结构域的数量和C末端锌指结构域的类型,WRKY大家族可以分成3类:Ⅰ类通常含有2个WRKY结构域,其锌指结构为C2H2型;Ⅱ类含有1个WRKY结构域,锌指结构也为C2H2型;Ⅲ类含有1个WRKY结构域和C2HC (与Ⅰ类和Ⅱ类的C2H2不同)型锌指结构。另外,依据氨基酸序列特点,Ⅱ类WRKY又可进一步分为Ⅱa、Ⅱb、Ⅱc、Ⅱd和Ⅱe共5个亚类[2]。研究表明:受WRKY调控的靶基因启动子区大都含有W-box (TTGACC/T)。其中TGAC是W-box的核心序列,且高度保守,一旦当中任一核苷酸发生改变都会影响WRKY蛋白与之结合的能力[2]。
研究表明,WRKY12蛋白N端含有1个WRKYGQK结构域,C端为C2H2型锌指结构,是典型的WRKY家族Ⅱ类中Ⅱc亚类的成员[3]。它的亚细胞定位于细胞核内,为核内蛋白,特异性表达于植物的根、茎及叶脉等组织中,基因的表达量在整个营养生长阶段呈上升趋势。一定程度上,其特定的基因表达模式表明它主要调控植物营养生长后期及生殖生长过程[3-5]。
2 WRKY12调控开花WRKY12参与植物生长发育的各个过程,其中,Li等的研究结果表明,其参与拟南芥的开花调控,可以在短日照条件下促进开花[3]。植物的开花调节主要有光周期途径、春化途径、自主途径、温度途径、年龄途径以及赤霉素途径等六大途径。在赤霉素途径中,当植株体内的赤霉素受体蛋白感知到内源或外源的赤霉素存在时,则会招募GA INSENSITIVE (GAI)、REPRESSOR of ga1-3 (RGA)、RGA-LIKE1 (RGL1)、RGA-LIKE2 (RGL2)和RGA-LIKE3 (RGL3)这5个DELLA蛋白,使其发生泛素化降解,从而导致各种转录因子的释放和激活。这些转录因子随后会调节下游信号转导级联并调节对赤霉素的反应。研究发现,AtWRKY12可与拟南芥DELLA蛋白家族中的GAI和RGL1相互作用,并能直接结合到开花整合子FRUITFULL (FUL)启动子区域的W-box并诱导FUL表达,从而促进开花[3]。最近Ma等的研究也表明,AtWRKY12还可以与SQUAMOSA PROMOTER BINDING–LIKE10 (SPL10)相互作用,通过年龄途径调控开花[4]。SPL10是年龄途径关键作用因子miR156的靶基因,SPL10可以结合到WRKY12启动子区域并诱导其转录;同时,SPL10还可以与WRKY12发生互作,协同激活miR172b的转录从而促进开花[4]。
Yu等发现,芒属植物南荻Miscanthus lutarioriparius的MlWRKY12基因可以调控植株开花[5]。在atwrky12拟南芥突变体中过表达MlWRKY12,植株表现为早花表型。通过分析测量转基因植株中开花相关基因的转录本丰度,发现拟南芥中MlWRKY12的过表达对CONSTANS的表达水平有重大影响。此外,FLOWERING LOCUS T (FT)、LEAFY (LFY)、APETALA1 (AP1)、CAULIFLOWER (CAL)和FRUITFULL (FUL)等开花相关基因的表达量均在转基因植株中上调。这些结果都表明了MlWRKY12可以对开花时间产生影响[5]。
同时,研究还发现,WRKY12的同一亚族成员WRKY13也能调控开花,但令人感兴趣的是其调控方向与WRKY12相反[3]。与WRKY12相似,WRKY13也能通过赤霉素途径和年龄途径参与开花调控。在赤霉素途径中,WRKY13与GAI和RGL1相互作用,并能直接结合到开花整合子FUL启动子区域的W-box抑制其开花;在年龄途径中,SPL10可以结合到WRKY13启动子区域并抑制其转录;同时,SPL10还可以与WRKY13发生互作,协同抑制miR172b的转录从而延迟开花[4]。Li等为了探讨二者作用相反的原因,在进一步测定了两个基因的表达时间谱后发现:WRKY13的基因表达量随着苗龄的增长逐渐下降,这与WRKY12正好相反。另外,二者启动子区域都存在着W-box,彼此都可以结合到对方的启动子上;交换二者的启动子区域时,其表达方式与原来正好相反,这表明二者之间存在着相互拮抗的调节关系[3]。
当然,在WRKY家族中还有其他成员也能参与开花调节,如WRKY25、WRKY71、WRKY75等皆被证明与开花相关,且都是通过赤霉素途径调控开花,但具体的作用机制并不完全相同[6-8]。
3 WRKY12参与次生细胞壁形态建成植物次生细胞壁是木质纤维素的来源,可用于生产第二代生物燃料,其组成和结构的遗传改良可以减少细胞壁的顽固性,增加生物量产量,从而提高燃料作物的生物燃料生产。其发育受到多种转录因子的调控,例如NAM、NAC、MYB和WRKY等[9-11]。南荻被认为是一种产生木质纤维素材料的天然作物,在北美、亚洲和欧洲被广泛研究,是最有前途的生物能源作物之一。Yu等从南荻中分离出MlWRKY12基因,鉴定了其分子特性,并研究其对拟南芥次生细胞壁形成的潜在影响[5]。首先,Yu等通过原位杂交分析发现MlWRKY12在南荻的维管束鞘、厚壁组织和薄壁组织中均有表达;然后,他们将MlWRKY12基因导入次生细胞壁增厚的atwrky12突变株,构建了atwrky12+35S::MlWRKY12株系。最后通过免疫组织化学法和甲苯胺南染色法检测野生型、atwrky12和atwrky12+35S::MlWRKY12株系的茎干切片中髓薄壁组织细胞的纤维素和木聚糖含量。结果显示,在atwrky12+35S::MlWRKY12株系与野生型株系中均未检测到纤维素和木聚糖,而atwrky12株系中检测出了纤维素和木聚糖,即MlWRKY12的外源表达成功挽救了AtWRKY12突变引起的次生细胞壁增厚表型。由此可知,MlWRKY12在拟南芥中起作用,并对拟南芥次生细胞壁的形成具有负调控作用。
有意思的是,Li等的研究表明AtWRKY13能够正向调控拟南芥次生细胞壁的建成[12];他们发现WRKY13突变后导致拟南芥的茎秆较为纤弱,atwkry13突变体的茎直径和维管束数量明显减少,且WRKY13能上调木质素途径基因转录水平和茎中木质素含量[11]。此外,次生细胞壁合成基因NAC SECONDARY WALL THICKENING PROMOTING FACTOR2 (NST2)是WRKY13的直接下游靶点。
4 WRKY12增强细胞性软腐病等病害的抗性据研究报道,植物WRKY家族中许多成员都与植物的抗病性有关,例如水稻OsWRKY45是水稻抗稻瘟病的正调控因子,而AtWRKY8和AtWRKY48在对假单胞杆菌Pseudomonas syringae抗性调节中都起着负调控作用[13]。据Kim报道,大白菜Brassica rapa L. ssp. pekinensisBrWRKY12基因可以增强其对软腐病菌Pectobacterium carotovorum ssp. carotovorum (Pcc)的抗性,过表达BrWRKY12可以减少大白菜软腐病的发生[14];他们从大白菜中分离并鉴定了BrWRKY12基因,发现在Pcc感染大白菜后BrWRKY12的表达上调。然后将BrWRKY12在拟南芥中进行了异源表达,当Pcc感染转基因植株后,BrWRKY12的表达上调,且转基因植株对Pcc的抗性增强。值得注意的是,其同源基因AtWRKY12的表达下调。为了进一步阐明AtWRKY12在病原体防御中的作用,他们用Pcc去感染atwrky12突变体植株,结果表明atwrky12突变体与野生型相比,对Pcc的抗性没有明显的差异,这就表明AtWRKY12不影响植株的抗病性,也说明WRKY12在大白菜与拟南芥中存在功能差异[14]。同时发现,在过表达BrWRKY12的拟南芥转基因株系中,茉莉酸(Jasmonic acid,JA)信号传导途径中防御相关基因PLANT DEFENSIN1.2 (PDF1.2)和POLYGALACTURONASE-INHIBITING PROTEIN2 (PGIP2)的表达量增加[14]。由此说明,BrWRKY12通过转录激活防御相关基因,增强了对Pcc的抗性。
此外,Wen等的研究也发现,WRKY12可参与挪威云杉Picea abies对小孢子菌Heterobasidion parviporum的防御过程,在病菌侵染挪威云杉幼苗的早期,WRKY12转录因子被大量诱导[15]。
据Cheng等研究发现,WRKY13也可以增强植物的抗病性[16]。水稻OsWRKY13是拟南芥AtWRKY70的同源基因。水稻OsWRKY13超量表达能增强转基因植株对白叶枯病的抗性,它可以通过激活水杨酸(Salicylic acid,SA)信号传导途径和抑制茉莉酸信号传导途径参与水稻抗病反应。而且,John等研究表明OsWRKY13基因在水稻植株发育和抗病性相关的生理通路中起着重要的调控作用[17];他们对水稻进行真菌侵染试验后分析OsWRKY13表达情况,发现抗病品种中OsWRKY13的表达量均高于未感染的对照和易感病品种;同时他们还发现:受WRKY13调控的3个基因TIFY DOMAIN PROTEIN9 (TIFY9)、WRKY12和PATHOGEN-RELATED2 (PR2)在病原菌侵染的抗纹枯病品种中均有诱导表达。其中在病原菌侵染的抗鞘腐病品种中WRKY12和PR2的表达较高[17]。他们还将OsWRKY13导入易感病品种的水稻植株中,构建了OsWRKY13过表达株系,检测分析发现,与野生型相比,转基因植株中OsWRKY13的表达水平和WRKY12、TIFY9、PR2的共表达水平均高于野生型[17]。这些转基因植株对病原菌的抗性都大大增强。
5 WRKY12负调重金属镉耐性镉是一种广泛存在的对植物有毒的污染物。谷胱甘肽(Glutathione,GSH)依赖的植物螯合蛋白(PHYTOCHELATIN,PC)合成途径在镉的解毒机制中起关键作用。Han等发现了AtWRKY12在调控镉耐受性方面的功能[18]。研究发现,镉胁迫会抑制AtWRKY12的表达,atwrky12功能缺失突变体对镉的耐受性增强,而过表达AtWRKY12的植株对镉的敏感性增加。AtWRKY12的过表达和功能缺失分别通过抑制或释放PC合成途径相关基因的表达,与镉积累的增加和减少相关。瞬时表达实验表明,AtWRKY12可抑制PC合成途径中γ-谷氨酰半胱氨酸合成酶(γ-glutamylcysteine synthetase,GSH1)、GSH synthetase (GSH2)、植物螯合肽合成本酶(Phytochelatin synthase1,PCS1)和Phytochelatin synthase2 (PCS2)基因的表达[18]。进一步分析表明,AtWRKY12蛋白在体内可以直接与GSH1启动子的W-box结合,而不能结合GSH2、PCS1和PCS2启动子的W-box[18]。由此表明,AtWRKY12蛋白直接作用于GSH1,间接抑制PC合成相关基因的表达,从而负调控拟南芥的镉的耐受性。
与AtWRKY12相反,AtWRKY13可以正向调节植株对镉的耐受性。Sheng等通过功能基因筛选鉴定了一个耐镉的显性突变体,对其进行镉胁迫时发现AtWRKY13被大量诱导表达[19]。而且,AtWRKY13的过表达降低了镉的累积,提高了植物对镉的耐受性,AtWRKY13功能的丧失则导致了镉的累积和敏感性的增加[19]。拟南芥AtWRKY13蛋白通过直接结合Arabidopsis pleiotropic drug resistance8 (PDR8,具有镉耐受性)的启动子来激活PDR8的转录[19]。遗传分析表明,AtWRKY13蛋白在PDR8上游起正向调节镉耐性的作用。说明WRKY13可以直接作用于PDR8,正向调节拟南芥对镉的耐受性[19]。此外,Zhang等发现WRKY13可与D-半胱氨酸脱硫酶基因(D-CYSTEINE DESULFHYDRASE,DCD)的启动子结合,诱导其转录,从而提高植株对镉的耐受性[20]。
6 总结与展望本文对WRKY12在开花调控、次生细胞壁建成、抗病性及对重金属镉的耐受性等方面的功能进行了分析(调控网络如图 1所示),同时对比了WRKY13在相关方面的调控机制。值得注意的是,两者在开花调控、次生细胞壁建成和对重金属镉的耐受性中的功能正好是相反的。虽然在同样的生长发育过程中分别起着促进和抑制的相反作用,但是它们却同属于WRKY家族的Ⅱc亚族,并且蛋白结构十分相似。以拟南芥AtWRKY12和AtWRKY13为例,二者在蛋白序列上相似性达到了43.6%,仅比对蛋白的C端时,发现它们拥有高达81.1%的相似性[3]。所以,它们在功能上的差异值得进一步的分析和探讨。
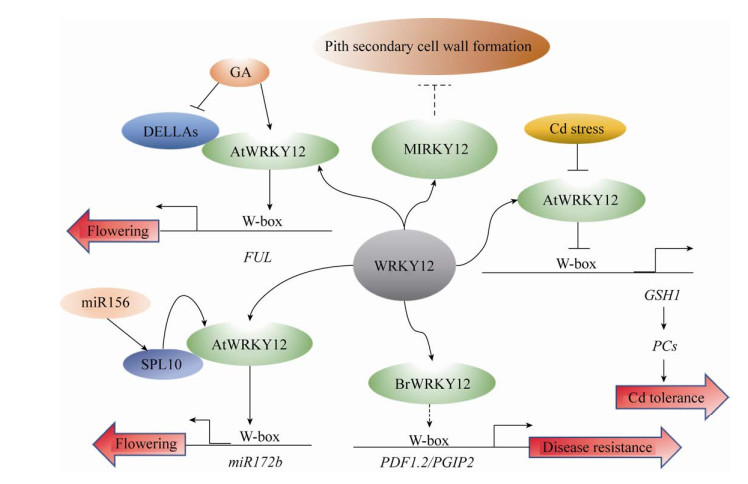 |
| 图 1 WRKY12调控网络图[3-5, 14, 18] Fig. 1 The regulation network of WRKY12[3-5, 14, 18]. |
| 图选项 |
Li等在研究中分析,拟南芥AtWRKY12和AtWRKY13在开花调控方面功能的差异性可能是由于两者的相互拮抗,构成了一个苗龄依赖性的平衡调节子[3]。在生殖生长阶段,AtWRKY13大量表达导致开花相关基因被抑制,确保植株不会提早开花。而随着植株的生长,内源性赤霉素的含量逐渐上升,诱导AtWRKY12的表达。此外,AtWRKY13也能通过一个反馈调节机制诱导AtWRKY12的表达。逐渐丰富的正向调节子又抑制AtWRKY13导致开花相关基因的含量上升,从而导致植株正常开花[3]。也就是说两者都可以通过结合到对方的启动子区域的W-box来调节彼此的表达。在Li等的研究基础上,Ma等进一步证实了AtWRKY12和AtWRKY13的功能差异确实与苗龄相关,二者可参与年龄途径调控开花。值得注意的是,近些年的研究也发现,在拟南芥74个WRKYs中,83%的基因启动子区域至少含有2个完整的W-box,58%有4个或更多,这表明WRKY蛋白之间可能存在复杂的相互调控网络[21]。
当然,目前对WRKY12功能的研究还不够全面,随着研究技术的发展,我们对其及其家族的研究也会越来越深入。近些年来,转录组测序等技术越来越多地应用于对WRKY家族的研究。例如,Wu等通过对转录组的分析发现WRKY转录因子可与异三聚体G蛋白偶联信号通路中的基因相互作用,调节植物对微量营养元素的反应[22]。Li等对两个甜度不同的梨Pyrus ussuriensis的品种进行转录组测序,找出了差异基因PuSWEET15,还发现PuWRKY31蛋白可以结合到其启动子区域并诱导其表达[23]。Yang等对进行冷胁迫处理的茄子进行转录组测序,筛选出了差异表达基因SmWRKY26和SmWRKY32,证实了其可参与茄子对冷胁迫的响应[24]。Ren等对毛白杨Populus tomentosa Carr.进行了转录组和代谢组分析,发现热激处理下PtWRKR13和PtWRKR50的表达量下调[25]。
这些例子也为我们提供了参考,未来我们或许可以参考同家族其他成员的研究思路,利用高通量转录组学、蛋白质组学、代谢组学等研究手段对WRKY12进行更深入地研究,继续探索WRKY12在植株中的调控网络,为分析其如何发挥信号协同和信号拮抗的作用奠定生物化学基础,从而帮助人们深入了解WRKY转录因子之间的自我调控和交叉调控机制。
参考文献
| [1] | Eulgem T, Rushton PJ, Robatzek S, et al. The WRKY superfamily of plant transcription factors. Trends Plant Sci, 2000, 5(5): 199-206. DOI:10.1016/S1360-1385(00)01600-9 |
| [2] | Rushton PJ, Somssich IE, Ringler P, et al. WRKY transcription factors. Trends Plant Sci, 2010, 15(5): 247-258. DOI:10.1016/j.tplants.2010.02.006 |
| [3] | Li W, Wang HP, Yu DQ. Arabidopsis WRKY transcription factors WRKY12 and WRKY13 oppositely regulate flowering under short-day conditions. Mol Plant, 2016, 9(11): 1492-1503. DOI:10.1016/j.molp.2016.08.003 |
| [4] | Ma ZB, Li W, Wang HP, et al. WRKY transcription factors WRKY12 and WRKY13 interact with SPL10 to modulate age-mediated flowering. J Integr Plant Biol, 2020. |
| [5] | Yu YC, Hu RB, Wang HM, et al. MlWRKY12, a novel Miscanthus transcription factor, participates in pith secondary cell wall formation and promotes flowering. Plant Sci, 2013, 212: 1-9. DOI:10.1016/j.plantsci.2013.07.010 |
| [6] | Wang FX, Li SJ, Yu DQ. Overexpression of WRKY25 causes early flowering in Arabidopsis under long-day conditions. Plant Divers Resour, 2011, 33(6): 653-659 (in Chinese). 王芳秀, 黎舒佳, 余迪求. WRKY25过量表达导致拟南芥在长光照下开花提前. 植物分类与资源学报, 2011, 33(6): 653-659. |
| [7] | Yu YC, Liu ZH, Wang L, et al. WRKY 71 accelerates flowering via the direct activation of FLOWERING LOCUS T and LEAFY in Arabidopsis thaliana. Plant J, 2016, 85(1): 96-106. DOI:10.1111/tpj.13092 |
| [8] | Zhang LP, Chen LG, Yu DQ. Transcription factor WRKY75 interacts with DELLA proteins to affect flowering. Plant Physiol, 2018, 176(1): 790-803. DOI:10.1104/pp.17.00657 |
| [9] | Wang HZ, Avci U, Nakashima J, et al. Mutation of WRKY transcription factors initiates pith secondary wall formation and increases stem biomass in dicotyledonous plants. Proc Natl Acad Sci USA, 2010, 107(51): 22338-22343. DOI:10.1073/pnas.1016436107 |
| [10] | Wang HZ, Dixon RA. On-off switches for secondary cell wall biosynthesis. Mol Plant, 2012, 5(2): 297-303. DOI:10.1093/mp/ssr098 |
| [11] | Nakata MT, Takahara M, Sakamoto S, et al. High-throughput analysis of Arabidopsis stem vibrations to identify mutants with altered mechanical properties. Front Plant Sci, 2018, 9: 780. DOI:10.3389/fpls.2018.00780 |
| [12] | Li W, Tian ZX, Yu DQ. WRKY13 acts in stem development in Arabidopsis thaliana. Plant Sci, 2015, 236: 205-213. DOI:10.1016/j.plantsci.2015.04.004 |
| [13] | Qiu YP, Yu DQ. Over-expression of the stress-induced OsWRKY45 enhances disease resistance and drought tolerance in Arabidopsis. Environ Exp Bot, 2009, 65(1): 35-47. DOI:10.1016/j.envexpbot.2008.07.002 |
| [14] | Kim HS, Park YH, Nam H, et al. Overexpression of the Brassica rapa transcription factor WRKY 12 results in reduced soft rot symptoms caused by Pectobacterium carotovorum in Arabidopsis and Chinese cabbage. Plant Biol (Stuttg), 2014, 16(5): 973-981. DOI:10.1111/plb.12149 |
| [15] | Wen Z, Raffaello T, Zeng Z, et al. Chlorophyll fluorescence imaging for monitoring effects of Heterobasidion parviporum small secreted protein induced cell death and in planta defense gene expression. Fungal Genet Biol, 2019, 126: 37-49. DOI:10.1016/j.fgb.2019.02.003 |
| [16] | Cheng HT, Liu HB, Deng Y, et al. The WRKY45-2 WRKY13 WRKY42 transcriptional regulatory cascade is required for rice resistance to fungal pathogen. Plant Physiol, 2015, 167(3): 1087-1099. DOI:10.1104/pp.114.256016 |
| [17] | Jimmy JL, Babu S. Gene network mediated by WRKY13 to regulate resistance against sheath infecting fungi in rice (Oryza sativa L.). Plant Sci,, 2019, 280: 269-282. DOI:10.1016/j.plantsci.2018.12.017 |
| [18] | Han YY, Fan TT, Zhu XY, et al. WRKY12 represses GSH1 expression to negatively regulate cadmium tolerance in Arabidopsis. Plant Mol Biol, 2019, 99(1/2): 149-159. DOI:10.1007/s11103-018-0809-7 |
| [19] | Sheng YB, Yan XX, Huang Y, et al. The WRKY transcription factor, WRKY13, activates PDR8 expression to positively regulate cadmium tolerance in Arabidopsis. Plant Cell Environ, 2019, 42(3): 891-903. DOI:10.1111/pce.13457 |
| [20] | Zhang Q, Cai W, Ji TT, et al. WRKY13 enhances cadmium tolerance by promoting D-CYSTEINE DESULFHYDRASE and hydrogen sulfide production. Plant Physiol, 2020, 183(1): 345-357. DOI:10.1104/pp.19.01504 |
| [21] | Zhang M, Chen Y, Nie L, et al. Transcriptome-wide identification and screening of WRKY factors involved in the regulation of taxol biosynthesis in Taxus chinensis. Sci Rep, 2019, 8(1): 5197. |
| [22] | Wu TY, Krishnamoorthi S, Goh H, et al. Crosstalk between heterotrimeric G protein-coupled signaling pathways and WRKY transcription factors modulating plant responses to suboptimal micronutrient conditions. J Exp Bot, 2020, eraa108. |
| [23] | Li XY, Guo W, Li JC, et al. Histone acetylation at the promoter for the transcription factor PuWRKY31 affects sucrose accumulation in pear fruit. Plant Physiol, 2020, 182(4): 2035-2046. DOI:10.1104/pp.20.00002 |
| [24] | Yang Y, Liu J, Zhou XH, et al. Identification of WRKY gene family and characterization of cold stress-responsive WRKY genes in eggplant. Peer J, 2020, 8(6): e8777. |
| [25] | Ren SX, Ma KB, Lu ZG, et al. Transcriptomic and metabolomic analysis of the heat-stress response of Populus tomentosa Carr. Forests, 2019, 10(5): 383. DOI:10.3390/f10050383 |
